3.1.1 氯气的发现与制备 课件(共41张PPT) 2023-2024学年高一化学苏教版(2029)必修第一册
文档属性
| 名称 | 3.1.1 氯气的发现与制备 课件(共41张PPT) 2023-2024学年高一化学苏教版(2029)必修第一册 |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-21 00:00:00 | ||
图片预览








文档简介
(共41张PPT)
必 修 一
学
化
J
S
第一单元 氯气及氯的化合物
1 氯气的发现与制备
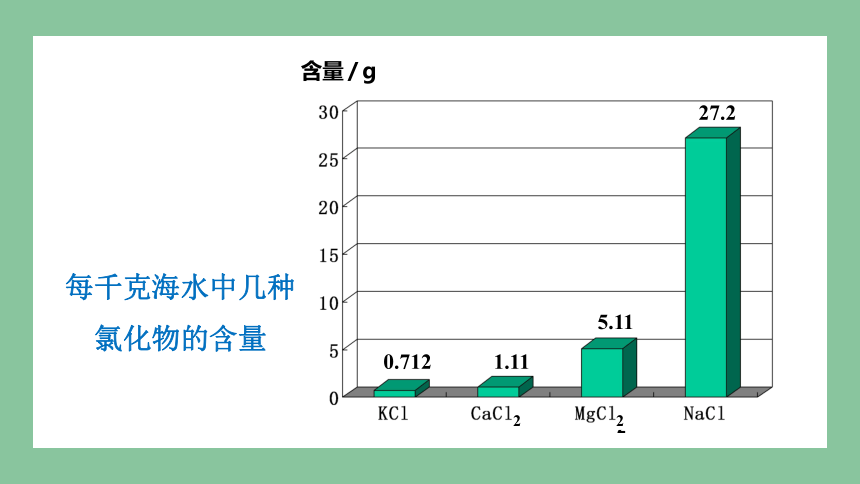
每千克海水中几种氯化物的含量
含量 / g
0.712
1.11
5.11
27.2
2
2
2
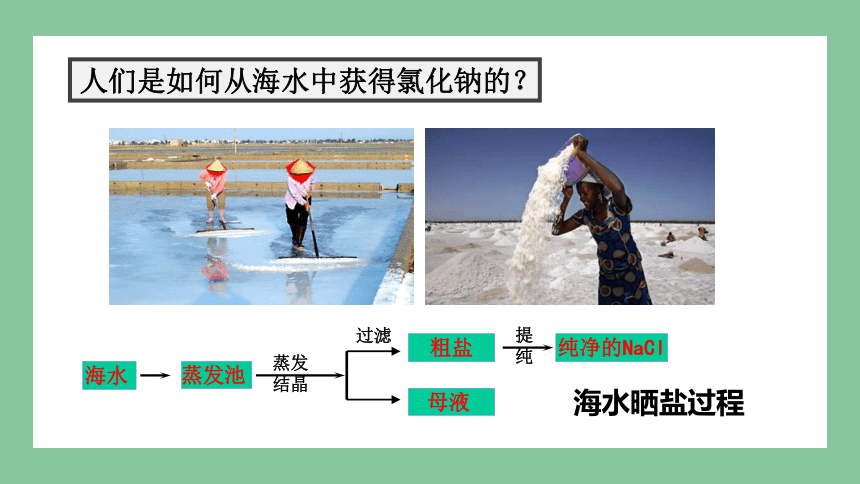
人们是如何从海水中获得氯化钠的?
海水晒盐过程
海水
蒸发池
粗盐
母液
纯净的NaCl
过滤
提纯
蒸发 结晶
NaCl俗名“食盐”,它有哪些用途呢?
医学:配成浓度为 0.9%的“生理盐水”。
生活:我们餐桌上的必需调味品。
工业:电解饱和食盐水制取氯气。
1774年,瑞典化学家舍勒把浓盐酸与软锰矿混在一起加热发现了氯气。
舍勒 瑞典化学家
1810年,英国化学家戴维研究后得出这种气体仅由一种元素组成。我国早年译文将其译成“绿气”,后改为氯气。
戴维 英国化学家
(一)氯气的工业制法
(二)氯气的实验室制法
1、电解熔融氯化钠制取氯气和金属钠。
2、电解饱和食盐水制取氯气。
工业上是如何由氯化钠获得氯气的?
???
2NaCl 2Na + Cl2↑
电解
两条途径
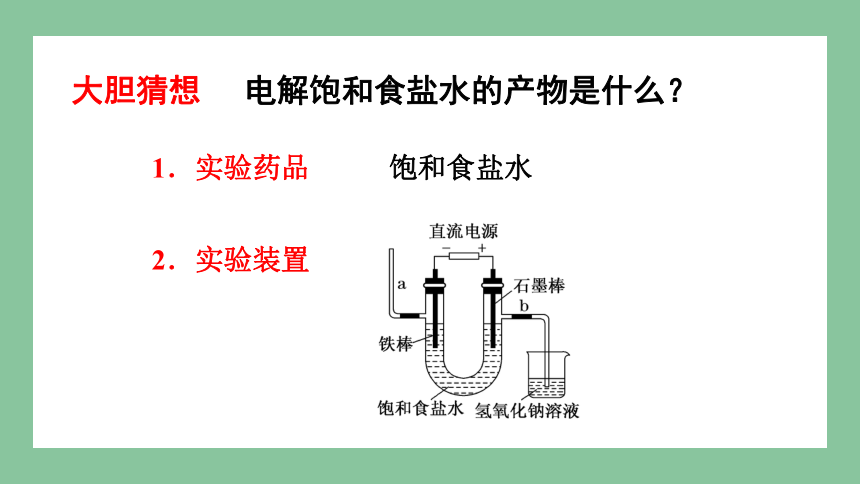
电解饱和食盐水的产物是什么?
1.实验药品 饱和食盐水
2.实验装置
大胆猜想
实验探究——电解饱和食盐水
提示:氯气的检验方法
使湿润的淀粉碘化钾试纸变蓝
- +
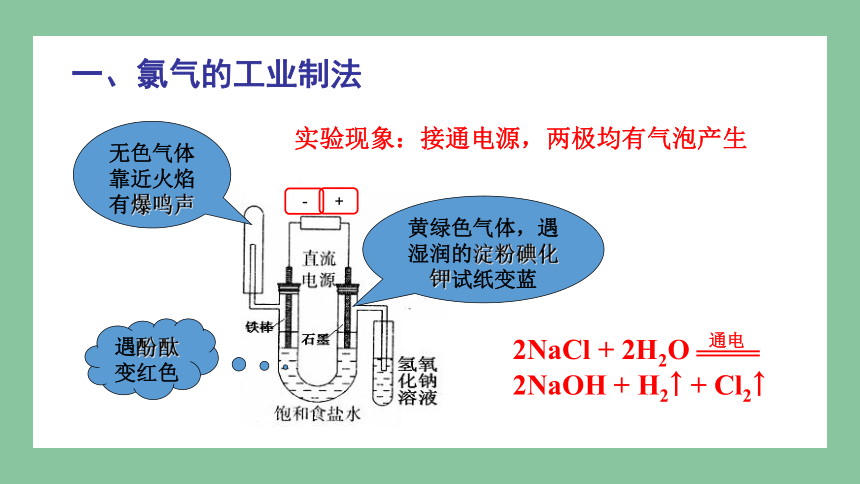
一、氯气的工业制法
黄绿色气体,遇湿润的淀粉碘化钾试纸变蓝
遇酚酞变红色
无色气体靠近火焰有爆鸣声
2NaCl + 2H2O 2NaOH + H2↑ + Cl2↑
通电
接通电源,两极均有气泡产生
实验现象:
1、以电解食盐水为基础制取氯气等产品的工业称为 ,电解饱和食盐水的化学方程式为 。
2、与电源正极相连的电极上产生 ,与电源负极相连的电极上产生 。
2NaCl + 2H2O 2NaOH + H2↑ + Cl2↑
通电
氯碱工业
氯气
氢气
知识小结
D
C
阅读下面资料,你能了解氯气的哪些性质?
1915年04月22日,在第一次世界大战的比利时战场上,德军正与英法联军对峙。忽然,从处于上风口的德军阵地上升起一股股黄绿色的云团,有强烈的刺激性气味,一直飘向处于下风口的英法阵地。毫无准备的英法士兵猝不及防,眼看着黄绿色的气体涌来,两万余名士兵先是咳嗽继而喘息,大多数士兵因中毒导致死亡。经统计,最终活下来的士兵
大部分都是在黄绿色云团飘来时跑到了较高的山丘上才幸免于难,还有一些人是用湿手绢捂住了嘴才保住了性命,而这种使上万人丧命的气体就是氯气,而这场战争也作为战争史上第一次化学战记入了史册。
氯气的物理性质
1. 黄绿色的气体
2. 有刺激性气味
3. 有毒
4. 密度比空气大
5. 易液化
6. 能溶于水(常温下1体积的水中大约能溶解2体积的氯气)
3.反应原理:
二、氯气的实验室制法
1.实验药品:二氧化锰 (固体)、浓盐酸 (液体)
2.实验装置:
MnO2 + 4HCl (浓) MnCl2 + 2H2O + Cl2↑
△
MnO2 + 4HCl (浓) MnCl2 + 2H2O + Cl2↑
△
反应原理:
1. 根据制取氯气原料的状态和反应条件,制取装置有什么特点?
气体发生装置
A
B
C
制O2
固-固加热型
制CO2
固-液不加热型
发生装置
气体发生装置的选择是根据反应物的状态和反应条件来确定的。
制Cl2
固-液加热型
饱和食盐水
2. 根据氯气密度比空气大,能溶于水而难溶于饱和食盐水,收集装置有什么特点?
气体收集装置
A
B
C
MnO2 + 4HCl (浓) MnCl2 + 2H2O + Cl2↑
△
反应原理:
尾气处理装置
NaOH溶液
3. 氯气收集满了能任意排放吗?用什么试剂来吸收多余氯气?
MnO2 + 4HCl (浓) MnCl2 + 2H2O + Cl2↑
△
反应原理:
发生装置
收集装置
尾气吸收装置
这样收集到的氯气纯净吗?
4. 此法制得的氯气纯净吗 可能存在哪些杂质气体 用哪些试剂来除杂,有没有先后顺序?
气体净化装置
除HCl气体
饱和食盐水
除水蒸气
(无水CaCl2)
浓硫酸
MnO2 + 4HCl (浓) MnCl2 + 2H2O + Cl2↑
△
反应原理:
发生
净化
收集
尾气处理
一套完整的制取气体的实验装置
知识小结
1.为什么用分液漏斗装盐酸?为什么让盐酸缓慢地注入,而不是一次将浓盐酸注入烧瓶里?
答:用分液漏斗可以控制液体的用量,避免生成的氯气过多。
问题解决
2、能否用其它试剂代替二氧化锰或浓盐酸来制取氯气?
答:可以用KMnO4、KClO3等氧化剂代替MnO2,与浓盐酸反应(不需加热)
2KMnO4+16HCl(浓) === 2KCl+2MnCl2+5Cl2↑+8H2O
KClO3+6HCl(浓) === KCl+3Cl2↑+3H2O
也可用固体NaCl和浓H2SO4代替浓盐酸与MnO2反应
2NaCl + 2H2SO4(浓)+ MnO2 === Na2SO4 + MnSO4 + Cl2↑+ 2H2O
△
3、为什么用浓盐酸和二氧化锰制取氯气时,要缓缓加热,不能强热 ?
答:浓盐酸有很强的挥发性,强热时能挥发出大量的氯化氢气体和水蒸气,而使制得的氯气中含有大量杂质;另一方面,又降低了HCl的利用率。
4、如何检验氯气的生成?
答:1. 黄绿色、有刺激性气味的气体 (色、态、味);
2. 湿润的淀粉KI试纸 (变蓝);
3. 湿润的品红试纸 (褪色);
4. 浓氨水 (白烟)。
先验密,后实验;先固体,后液体;先撤管,后撤灯;先除HCl,后除H2O;先除杂,后收集。
验密: 向吸收尾气的烧杯中加水浸没长玻璃导管约 2cm,关闭分液漏斗活塞,点燃酒精灯,微热圆底烧瓶。若烧杯中有气泡产生,且停止加热后,导管中形成一段稳定的水柱,说明装置的气密性良好。
5、几项操作的先后顺序
同一种装置采用不同的操作方法,有不同的用途
请思考图示的装置都有哪些用途?
知识拓展
1. 从A口进气,从B口排出瓶内的空气,可收集O2、Cl2等比空气重的气体 —— 向上排空气法
2. 从B口进气,从A口排出瓶内的空气,可收集H2、NH3等比空气轻的气体 —— 向下排空气法
3.在瓶内充满水,从B口进气,将瓶内水从A口压出,可作为排水取气装置。
集气瓶
在瓶内加入适量液体净化剂,从A口进气,B口出气,可作为气体净化装置。
洗气瓶
量气瓶
若要测定实验制得的少量O2的体积,应在瓶内先装满水,再将O2从B端通入,A端用长导管接入量筒中。
D
C
(1)装置中有六处错误,请指出:
①______________________________________________;
②______________________________________________;
③______________________________________________;
④______________________________________________;
⑤______________________________________________;
⑥______________________________________________。
长颈漏斗应改成分液漏斗
稀盐酸应改为浓盐酸
烧瓶下应垫石棉网
应该用酒精灯加热
盛浓硫酸的洗气瓶和盛饱和食盐水的洗气瓶位置颠倒了
洗气瓶 D 中的进气导管应插入液面,出气导管不应插入液面
(2)在更正后的装置图中,仪器中的饱和食盐水、浓硫酸、氢氧化钠溶液的作用分别是:
①饱和食盐水的作用:___________________________;
②浓硫酸的作用:_________________________________;
③氢氧化钠溶液的作用:___________________________。
除去混在氯气中的HCl
除去混在氯气中的水蒸气
吸收多余的Cl2,防止污染环境
看
观
谢
谢
必 修 一
学
化
J
S
第一单元 氯气及氯的化合物
1 氯气的发现与制备
每千克海水中几种氯化物的含量
含量 / g
0.712
1.11
5.11
27.2
2
2
2
人们是如何从海水中获得氯化钠的?
海水晒盐过程
海水
蒸发池
粗盐
母液
纯净的NaCl
过滤
提纯
蒸发 结晶
NaCl俗名“食盐”,它有哪些用途呢?
医学:配成浓度为 0.9%的“生理盐水”。
生活:我们餐桌上的必需调味品。
工业:电解饱和食盐水制取氯气。
1774年,瑞典化学家舍勒把浓盐酸与软锰矿混在一起加热发现了氯气。
舍勒 瑞典化学家
1810年,英国化学家戴维研究后得出这种气体仅由一种元素组成。我国早年译文将其译成“绿气”,后改为氯气。
戴维 英国化学家
(一)氯气的工业制法
(二)氯气的实验室制法
1、电解熔融氯化钠制取氯气和金属钠。
2、电解饱和食盐水制取氯气。
工业上是如何由氯化钠获得氯气的?
???
2NaCl 2Na + Cl2↑
电解
两条途径
电解饱和食盐水的产物是什么?
1.实验药品 饱和食盐水
2.实验装置
大胆猜想
实验探究——电解饱和食盐水
提示:氯气的检验方法
使湿润的淀粉碘化钾试纸变蓝
- +
一、氯气的工业制法
黄绿色气体,遇湿润的淀粉碘化钾试纸变蓝
遇酚酞变红色
无色气体靠近火焰有爆鸣声
2NaCl + 2H2O 2NaOH + H2↑ + Cl2↑
通电
接通电源,两极均有气泡产生
实验现象:
1、以电解食盐水为基础制取氯气等产品的工业称为 ,电解饱和食盐水的化学方程式为 。
2、与电源正极相连的电极上产生 ,与电源负极相连的电极上产生 。
2NaCl + 2H2O 2NaOH + H2↑ + Cl2↑
通电
氯碱工业
氯气
氢气
知识小结
D
C
阅读下面资料,你能了解氯气的哪些性质?
1915年04月22日,在第一次世界大战的比利时战场上,德军正与英法联军对峙。忽然,从处于上风口的德军阵地上升起一股股黄绿色的云团,有强烈的刺激性气味,一直飘向处于下风口的英法阵地。毫无准备的英法士兵猝不及防,眼看着黄绿色的气体涌来,两万余名士兵先是咳嗽继而喘息,大多数士兵因中毒导致死亡。经统计,最终活下来的士兵
大部分都是在黄绿色云团飘来时跑到了较高的山丘上才幸免于难,还有一些人是用湿手绢捂住了嘴才保住了性命,而这种使上万人丧命的气体就是氯气,而这场战争也作为战争史上第一次化学战记入了史册。
氯气的物理性质
1. 黄绿色的气体
2. 有刺激性气味
3. 有毒
4. 密度比空气大
5. 易液化
6. 能溶于水(常温下1体积的水中大约能溶解2体积的氯气)
3.反应原理:
二、氯气的实验室制法
1.实验药品:二氧化锰 (固体)、浓盐酸 (液体)
2.实验装置:
MnO2 + 4HCl (浓) MnCl2 + 2H2O + Cl2↑
△
MnO2 + 4HCl (浓) MnCl2 + 2H2O + Cl2↑
△
反应原理:
1. 根据制取氯气原料的状态和反应条件,制取装置有什么特点?
气体发生装置
A
B
C
制O2
固-固加热型
制CO2
固-液不加热型
发生装置
气体发生装置的选择是根据反应物的状态和反应条件来确定的。
制Cl2
固-液加热型
饱和食盐水
2. 根据氯气密度比空气大,能溶于水而难溶于饱和食盐水,收集装置有什么特点?
气体收集装置
A
B
C
MnO2 + 4HCl (浓) MnCl2 + 2H2O + Cl2↑
△
反应原理:
尾气处理装置
NaOH溶液
3. 氯气收集满了能任意排放吗?用什么试剂来吸收多余氯气?
MnO2 + 4HCl (浓) MnCl2 + 2H2O + Cl2↑
△
反应原理:
发生装置
收集装置
尾气吸收装置
这样收集到的氯气纯净吗?
4. 此法制得的氯气纯净吗 可能存在哪些杂质气体 用哪些试剂来除杂,有没有先后顺序?
气体净化装置
除HCl气体
饱和食盐水
除水蒸气
(无水CaCl2)
浓硫酸
MnO2 + 4HCl (浓) MnCl2 + 2H2O + Cl2↑
△
反应原理:
发生
净化
收集
尾气处理
一套完整的制取气体的实验装置
知识小结
1.为什么用分液漏斗装盐酸?为什么让盐酸缓慢地注入,而不是一次将浓盐酸注入烧瓶里?
答:用分液漏斗可以控制液体的用量,避免生成的氯气过多。
问题解决
2、能否用其它试剂代替二氧化锰或浓盐酸来制取氯气?
答:可以用KMnO4、KClO3等氧化剂代替MnO2,与浓盐酸反应(不需加热)
2KMnO4+16HCl(浓) === 2KCl+2MnCl2+5Cl2↑+8H2O
KClO3+6HCl(浓) === KCl+3Cl2↑+3H2O
也可用固体NaCl和浓H2SO4代替浓盐酸与MnO2反应
2NaCl + 2H2SO4(浓)+ MnO2 === Na2SO4 + MnSO4 + Cl2↑+ 2H2O
△
3、为什么用浓盐酸和二氧化锰制取氯气时,要缓缓加热,不能强热 ?
答:浓盐酸有很强的挥发性,强热时能挥发出大量的氯化氢气体和水蒸气,而使制得的氯气中含有大量杂质;另一方面,又降低了HCl的利用率。
4、如何检验氯气的生成?
答:1. 黄绿色、有刺激性气味的气体 (色、态、味);
2. 湿润的淀粉KI试纸 (变蓝);
3. 湿润的品红试纸 (褪色);
4. 浓氨水 (白烟)。
先验密,后实验;先固体,后液体;先撤管,后撤灯;先除HCl,后除H2O;先除杂,后收集。
验密: 向吸收尾气的烧杯中加水浸没长玻璃导管约 2cm,关闭分液漏斗活塞,点燃酒精灯,微热圆底烧瓶。若烧杯中有气泡产生,且停止加热后,导管中形成一段稳定的水柱,说明装置的气密性良好。
5、几项操作的先后顺序
同一种装置采用不同的操作方法,有不同的用途
请思考图示的装置都有哪些用途?
知识拓展
1. 从A口进气,从B口排出瓶内的空气,可收集O2、Cl2等比空气重的气体 —— 向上排空气法
2. 从B口进气,从A口排出瓶内的空气,可收集H2、NH3等比空气轻的气体 —— 向下排空气法
3.在瓶内充满水,从B口进气,将瓶内水从A口压出,可作为排水取气装置。
集气瓶
在瓶内加入适量液体净化剂,从A口进气,B口出气,可作为气体净化装置。
洗气瓶
量气瓶
若要测定实验制得的少量O2的体积,应在瓶内先装满水,再将O2从B端通入,A端用长导管接入量筒中。
D
C
(1)装置中有六处错误,请指出:
①______________________________________________;
②______________________________________________;
③______________________________________________;
④______________________________________________;
⑤______________________________________________;
⑥______________________________________________。
长颈漏斗应改成分液漏斗
稀盐酸应改为浓盐酸
烧瓶下应垫石棉网
应该用酒精灯加热
盛浓硫酸的洗气瓶和盛饱和食盐水的洗气瓶位置颠倒了
洗气瓶 D 中的进气导管应插入液面,出气导管不应插入液面
(2)在更正后的装置图中,仪器中的饱和食盐水、浓硫酸、氢氧化钠溶液的作用分别是:
①饱和食盐水的作用:___________________________;
②浓硫酸的作用:_________________________________;
③氢氧化钠溶液的作用:___________________________。
除去混在氯气中的HCl
除去混在氯气中的水蒸气
吸收多余的Cl2,防止污染环境
看
观
谢
谢
