3.1.3 氧化还原反应 课件(共87张PPT) 2023-2024学年高一化学苏教版(2029)必修第一册
文档属性
| 名称 | 3.1.3 氧化还原反应 课件(共87张PPT) 2023-2024学年高一化学苏教版(2029)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-21 15:53:22 | ||
图片预览










文档简介
(共87张PPT)
必 修 一
学
化
J
S
专题3 从海水中获得的化学物质
第一单元 氯气及氯的化合物
3 氧化还原反应 第1课时
感受氧化还原反应的存在
刚削好的苹果
放置30分钟后的苹果
刚泡好的绿茶
放置2小时后的绿茶
感受氧化还原反应的存在
好吃的月饼
幕后的“英雄”
感受氧化还原反应的存在
金属生锈
感受氧化还原反应的存在
如何判断一个反应是否属于氧化还原反应
反应中有元素化合价的改变
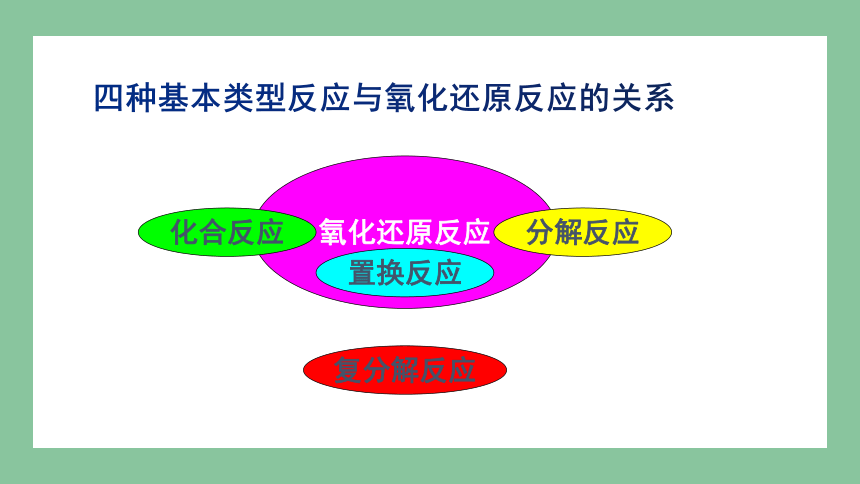
四种基本类型反应与氧化还原反应的关系
氧化还原反应
分解反应
化合反应
置换反应
复分解反应
元素化合价确定的一般规律
1、由金属和非金属组成的化合物中,金属元素一般显 价,非金属元素一般显 价;
2、化合物中,氧通常显 价,氢通常显 价;
3、化合物中各元素化合价的代数和为 ;
4、单质中元素的化合价为 。
负
正
-2
+1
0
0
CaCO3 = CaO + CO2 ↑
2Fe + 3Cl2 2FeCl3
Na2O + H2O = 2NaOH
非氧化还原反应
氧化还原反应
非氧化还原反应
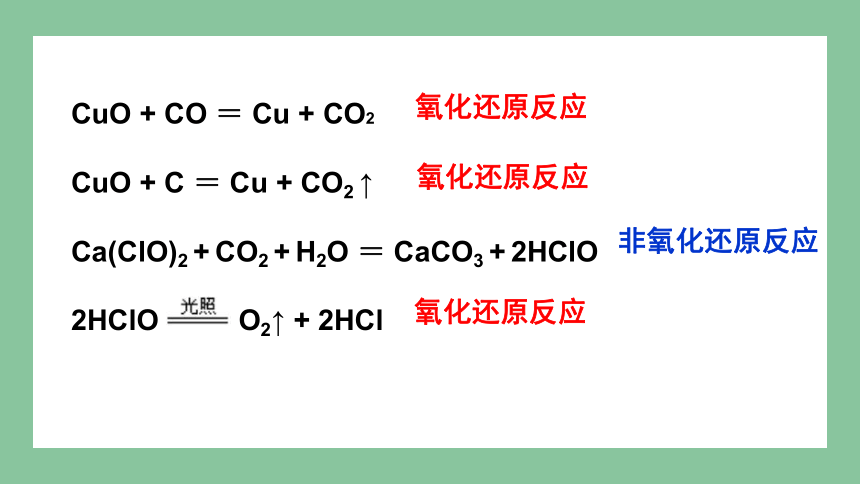
判断下列反应是否属于氧化还原反应?
CuO + CO = Cu + CO2
CuO + C = Cu + CO2 ↑
Ca(ClO)2 + CO2 + H2O = CaCO3 + 2HClO
2HClO O2↑ + 2HCl
氧化还原反应
非氧化还原反应
氧化还原反应
氧化还原反应
对于氧化还原反应,元素的化合价在反应过程中为什么有升有降?
分析 NaCl 的形成过程
2Na + Cl2 2NaCl
问题探究
2Na + Cl2 = 2NaCl
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
该化学反应中化合价升降的原因 。
0
0
+1
-1
电子的得失
生成 NaCl 时是“电子得失”,生成 HCl 时是“电子对偏移”。
即“电子得失”和“电子对偏移”统称为“电子的转移”。
说 明
一.氧化还原反应
1.定义:
凡是有电子转移的化学反应,称为氧化还原反应
2.特征:
反应前后化合价发生变化 (判断依据)
3.实质:
电子发生转移 (得失或偏移)
有电子转移的化学反应都是氧化还原反应。
氧化剂
还原剂
n个e-
失去电子
,被氧化
得到电子
,被还原
反应物中失去电子(元素化合价升高)的物质—被氧化
二.氧化剂和还原剂
1.定义:
反应物中得到电子(元素化合价降低)的物质—被还原
氧化剂:
还原剂:
0
0
+1
-1
化合价降低
被还原
化合价升高
被氧化
失去2e-
得到2e-
还原剂
氧化剂
①氧化剂和还原剂均是指反应物质,是一种化学试剂,不是某一种元素。
②氧化剂本身被还原,发生还原反应,得到的产物是还原产物。
③还原剂本身被氧化,发生氧化反应,得到的产物是氧化产物。
说 明
-4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7
失去e-,
化合价升高,
被氧化,
作还原剂
得到e-,
作氧化剂
化合价降低,
被还原,
2.化合价升降与得失电子的关系
二.氧化剂和还原剂
2HCl + Fe = FeCl2 + H2↑
氧化剂, 还原剂;
元素被氧化, 元素被还原.
+1 0 +2 0
HCl
Fe
Fe
H
三.氧化产物和还原产物
氧化产物:还原剂失去电子生成的产物—(元素
化合价升高)生成物。
还原产物:氧化剂得到电子生成的物质—(元素
化合价降低)生成物。
2HCl + Fe = FeCl2 + H2↑
还原剂
氧化产物
氧化剂
还原产物
MnO2 + 4HCl(浓)= MnCl2 + Cl2 + 2H2O↑
氧化剂 还原剂
被氧化 被还原
氧化产物 还原产物
0
-1
-1
+4
+2
MnO2
HCl
HCl
MnO2
Cl2
MnCl2
氧化剂 + 还原剂 = 氧化产物 + 还原产物
得到电子,化合价降低,被还原,发生还原反应
失去电子,化合价升高,被氧化,发生氧化反应
三.氧化产物和还原产物
指出下列反应中的氧化剂、还原剂、氧化产物、还原产物。
① CuO + CO Cu + CO2
② 2KClO3 2KCl + 3O2↑
③ Cl2 + H2O = HCl + HClO
④ MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O
⑤ Cu + 2H2SO4(浓) = CuSO4 + SO2↑+ 2H2O
MnO2
歧化反应
小窍门:提供氧的一般是氧化剂
Cl2 + H2O = HCl + HClO
SO2 + 2H2S = 3S↓ + H2O
歧化反应
0
-1
+1
归中反应
0
-2
+4
知识拓展
四.氧化还原反应得失电子的表示方法——双线桥法
例如:2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
1.正确判断各反应物、生成物各元素的化合价
及其变化。
0 +1 +3 0
步骤:
2.两个线桥一个在上、一个在下,线桥的方向
是从反应物一方指向生成物一方,首尾都必
须对应与发生化合价发生变化的同种元素。
步骤:
例如:2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
0 +1 +3 0
3.标出得失电子数,电子符号用“e-”来表示。
4.得失电子总数 = 原子个数 × 每个原子得失电子数
失去 2×3e-
得到 3×2e-
注意:反应中失去电子的总数等于得到电子的总数
步骤:
例如:2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
0 +1 +3 0
失去 2×e-
Cl2 + H2O = HCl + HClO
失去 e-
得到 e-
得到 2e-
+4
+2
-1
0
0
+1
-1
MnO2 + 4 HCl(浓) = MnCl2 + Cl2 + 2H2O
1.
2.
箭头必须由还原剂中失电子的元素指向氧化剂中得电子的元素。
箭头方向表示 电子转移的方向 。
在“桥”上标明转移的 电子总数 。
知识拓展
五.氧化还原反应方程式的配平
(1)配平原则:电子守恒、原子守恒、电荷守恒
(2)配平步骤 (以高锰酸钾和浓盐酸反应制氯气为例):
① 标出化合价变化了的元素的化合价。
KMnO4 + HCl KCl + MnCl2 + Cl2↑+ H2O
+7
-1
+2
0
② 根据元素存在的实际形式调整发生了氧化还原反应的物质的系数,使之成 1︰1 的关系,然后使化合价升降总数相等。
KMnO4 + 2HCl KCl + MnCl2 + Cl2↑+ H2O
+7
-1
+2
0
化合价 ↓ 5×2
化合价 ↑ 2×5
③ 根据化合价升降总数相等确定发生氧化还原反应的物质的化学计量数。
2KMnO4+10HCl KCl+2MnCl2+5Cl2↑+H2O
④ 利用元素守恒,用观察法配平没有参加氧化还原反应的其他物质的系数。
2KMnO4+16HCl 2KCl+2MnCl2+5Cl2↑+8H2O
⑤ 检查方程式两边各原子的个数是否相等,离子方程式还要检查方程式两边的离子所带的电荷数是否相等。
2KMnO4+16HCl = 2KCl+2MnCl2+5Cl2↑+8H2O
例:24mL浓度为0.05mol/L的Na2SO3溶液,恰好与20mL浓度为0.02mol/L的K2X2O7溶液完全反应,则元素X在被还原产物中的化合价是 ( )
A. +6 B. +3 C. +2 D. 0
B
六.氧化还原反应的计算
A
1. 还原性:失去电子的性质 (实质)
化合价升高 (特征)
2. 氧化性:得到电子的性质 (实质)
化合价降低 (特征)
七.氧化性与还原性
下列由左边物质生成右边物质有无氧化还原变化?左边物质表现什么性质?
(1) KI → I2
(2) SO2 → SO3
(3) HgCl2 → Hg2Cl2
(4) SO2 → S
(5) N2O5 → N2O3
(6) KMnO4 → K2MnO4
还原性
还原性
氧化性
氧化性
氧化性
氧化性
-1 0 +1 +3 +5 +7
Cl -- Cl -- Cl -- Cl -- Cl -- Cl
HCl Cl2 HClO HClO2 HClO3 HClO4
只能做还原剂
只能做氧化剂
既能做氧化剂,又能做还原剂
小结:判断微粒(分子、原子、离子)是否具有氧化性或还原性。
(1)元素处于最高价态--只能得电子
--只有氧化性
(2)元素处于最低价态--只能失电子
--只有还原性
(3)元素处于中间价态--
即能得电子 既有氧化性
又能失电子 又有还原性
下列微粒中只有氧化性的是 ________;
只有还原性的是 ___________
既有氧化性又有还原性的是 _______________。
(1) Cl2 (2) Cl- (3) Fe (4) Fe2+
(5) Fe3+ (6) O2 (7) S2- (8) S
(9) SO2 (10) HCl
5、6
2、3、7
1、4、
8、9、10
专题3 从海水中获得的化学物质
第一单元 氯气及氯的化合物
3 氧化还原反应 第2课时
一.氧化还原反应:
凡是有电子转移的化学反应,称为氧化还原反应
二.氧化剂:
还原剂:
反应物中得到电子(元素化合价降低)的物质—被还原
反应物中失去电子(元素化合价升高)的物质—被氧化
知识回顾
四.氧化还原反应得失电子的表示方法——双线桥法、单线桥法
三.氧化产物:
还原剂失去电子生成的产物—(元素化合价升高)
还原产物:
氧化剂得到电子生成的产物—(元素化合价降低)
五.氧化还原反应方程式的配平——标、等、定、平、查
六.氧化还原反应的计算——利用化合价的升降相等
七.氧化性:
失去电子的性质(实质);化合价升高(特征)
氧化性:
得到电子的性质(实质);化合价降低(特征)
活泼非金属单质:Cl2 、Br2 、I2 、O2等
高价金属离子或不活泼金属离子:Fe3+ 、Cu2+ 、Ag+等
高价含氧化合物:H2SO4 、HNO3 、 KMnO4 、MnO2等
常见的强氧化剂
八.常见重要的氧化剂和还原剂
活泼金属单质:Na、Mg、Al、Zn、Fe 等
某些非金属单质:C、H2等
非金属阴离子:S2- 、I- 、Br- 等
低价金属离子:Fe2+ 等
低价化合物:H2S、HI、NH3、CO等
常见的还原剂
下列各组物质中,通常均可用作还原剂的是( )
A. H2S、SO2、H2SO4
B. Cl2、FeCl2、FeCl3
C. H2、NO、CO
D. Br2、KBr、KCl
C
原子或离子的得电子能力越强,物质氧化性越强。
原子或离子的失电子能力越强,物质还原性越强。
九. 氧化性、还原性强弱判断
强调:物质氧化性或还原性的强弱由
得失电子难易决定,与得失电子多少无关
1、以化学方程式判断
氧化剂 + 还原剂 = 还原产物 + 氧化产物。
则:氧化性:氧化剂 > 氧化产物,
还原性:还原剂 > 还原产物。
十. 氧化性、还原性强弱判断方法
K2CrO4 + 14HCI(浓) = 2KCI + CrCI3 + CI2↑+ 7H2O
判断在酸条件下,
氧化性:K2CrO4 CI2 ,
还原性:HCI CrCI3 。
>
>
2、根据元素的化合价
同种元素化合价高氧化性强,化合价低还原性强。
如:氧化性:HClO3 > HClO2 > HClO,
还原性:FeCl2 > FeCl3。
3.根据金属活动顺序表判断
失电子能力逐渐减弱,还原性逐渐减弱
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+ (H+) Cu2+ Hg2+ Ag+ Pt2+ Au3+
得电子能力逐渐增强,氧化性逐渐增强
4.根据反应的难易程度判断 如:
2KMnO4 + 16HCl(浓)== 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O
MnO2 + 4HCl(浓)== MnCl2 + Cl2↑+ 2H2O
O2 + 4HCl(浓)==== 2H2O + 2Cl2↑
△
△
催化剂
则: 氧化性:KMnO4 > MnO2 > O2
与含有变价元素的还原剂在相似条件下反应,可根据氧化产物的价态的高低来判断氧化剂氧化性的强弱。
则: 氧化性:Cl2 > S
5.根据被氧化或还原的程度
△
△
2Fe + 3Cl2 = 2FeCl3
Fe + S = FeS
1.电子守恒规律:失电子总数 = 得电子总数
即:升价总数 = 降价总数
2.反应先后规律:
一种氧化(还原)剂面对多种还原(氧化)剂时,优先与还原(氧化)性强的反应。
十一.氧化还原反应的规律
3.价态变化规律:
归中规律:同种元素的高、低两种不同价态相互反应,化合价只靠拢不交叉。
歧化规律:同种元素中间价可同时变为高价和低价。
推论:同种元素的相邻价态不发生氧化还原反应,如H2S与S、S与SO2、SO2与H2SO4等。
【典例1】对于反应 IBr + H2O = HBr + HIO 的说法正确的是 ( )
A.IBr只作氧化剂
B.IBr只作还原剂
C.IBr既是氧化剂又是还原剂
D.IBr既不是氧化剂又不是还原剂
D
【解析】这一题的关键是正确判断共价化合物IBr和HIO中I、Br元素的化合价。分析可知,该反应不属于氧化还原反应,故D正确。
【点拨】氧化还原反应中的重要概念理解要深刻,不能混淆。抓住两条线:氧化剂被还原,化合价降低,得到还原产物;还原剂被氧化,化合价升高,得到氧化产物。在反应中,氧化剂是得到电子(或电子对偏向)的物质,反应时所含元素的化合价降低,还原剂是失去电子(或电子对偏离)的物质,所含元素的化合价升高。电子转移数可以只看化合价升高的数目或者只看化合价降低的数目,不能将得失电子数相加。
【迁移训练1】 (2010·南通模拟)制备氰氨基化钙的化学方程式为CaCO3 + 2HCN = CaCN2 + CO↑+ H2↑+ CO2↑,在反应中 ( )
A.氢元素被氧化,碳元素被还原
B.HCN既是氧化剂又是还原剂
C.CaCN2是氧化产物,H2为还原产物
D.CO是氧化产物,H2为还原产物
B C
【解析】根据化合价不交叉规律,该反应的电子转移情况为:
【典例2】常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O ①
2Fe3+ + H2O2 = 2Fe2+ + O2↑ + 2H+ ②
下列说法正确的是 ( )
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中,Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+
C D
【解析】由氧化还原反应的强弱规律知,氧化性是氧化剂大于氧化产物,还原性是还原剂大于还原产物,由方程①知,氧化剂H2O2氧化性比氧化产物Fe3+强,由方程②知,还原剂H2O2还原性比还原产物Fe2+强,A错误;方程①和方程②相加,即H2O2分解生成H2O和O2,H2O2呈弱酸性,故随着反应进行,pH升高,B错误;H2O2分解时Fe3+或Fe2+作催化剂,所以总量不变,C正确;因Fe2+可导致H2O2分解,所以H2O2生产过程要避免混入Fe2+,D正确。
【点拨】氧化性、还原性强弱比较的方法有很多,最基本的即为氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,对于一个自发的氧化还原反应,一般是强氧化性和强还原性物质生成弱氧化性和弱还原性物质。
【迁移训练2】(2010·海安中学)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是______。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为______。
AsH3
Br2
【解析】(1)在反应中KBrO3得到电子,化合价降低是氧化剂,而还原剂是化合价升高的物质,所以只能是AsH3。
(2)0.2 mol KBrO3在反应中得到1 mol电子生成X,说明溴元素化合价变化为5,即产物为0价的Br2。
(3)根据上述反应可推知______。
A.氧化性:KBrO3>H3AsO4
B.氧化性:H3AsO4>KBrO3
C.还原性:AsH3>X
D.还原性:X>AsH3
A C
【解析】 (3)氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物。
(4)将氧化剂和还原剂的化学式及其配
平后的化学计量数填入下列方框中,
并标出电子转移的方向和数目:_________________
(4)电子转移的方向和数目,要注意电子转移是由还原剂指向氧化剂。
【典例3】向NaBr、NaI、Na2SO3混合液中通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是 ( )
A.NaCl、Na2SO4 B.NaBr、Na2SO4
C.NaCl、Na2SO4、I2 D.NaCl、
A
【解析】 向NaBr、NaI、Na2SO3混合液中,通入一定量氯气后,发生反应的次序分别为:
Na2SO3 + Cl2 + H2O = Na2SO4 + 2HCl、
2NaI + Cl2 = 2NaCl + I2、
2NaBr + Cl2 = 2NaCl + Br2。
将溶液蒸干则HCl、Br2、Cl2挥发,灼烧I2升华,若通入的氯气是过量的,得到固体剩余物质的组成是NaCl、Na2SO4;若通入的氯气是不足量的,则还有可能留下NaBr。
【点拨】要注意优先原理的应用。越易失电子的物质,失去后就越难得到电子,越易得到电子的物质,得到后就越难失去电子;当一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应。同理,一种还原剂遇多种氧化剂时,氧化性最强的优先发生反应。
【迁移训练3】已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是 ( )
A.3Cl2+6FeI2 = 2FeCl3+4FeI3
B.Cl2+FeI2 = FeCl2+I2
C.Co2O3+6HCl = 2CoCl2+Cl2↑+3H2O
D.2Fe3++2I- = 2Fe2++I2
A
【解析】由于还原性I->Fe2+,故A不可能发生,B、D可能发生。又因为氧化性Co2O3>Cl2,故C也可能发生。
【典例4】(2010·金陵中学)“神七”登天标志着我国的航天事业进入了新的篇章。
(1)火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭温度过高,在火箭一面涂上一种特殊的涂料,该涂料的性质最可能的是________。
A.在高温下不融化 B.在高温下可分解气化
C.在常温下就分解气化 D.该涂料不可能发生分解
B
【解析】防止火箭温度过高,即应该在温度较高的情况下能气化降温。
(2)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,其反应的方程式是 N2O4+N2H4 → N2+H2O。
请配平该反应方程式:
____N2O4+____N2H4 → ____N2+____H2O
该反应中被氧化的原子与被还原的原子的物质的量之比是_______。这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是____________。
1
2
3
4
2:1
产物无污染
【解析】(2)配平的关键是将化合价的升降标注清楚,N2O4中N为+4价,N2H4中N为-2价,反应后均生成N2,所以N2H4的化学计量数应为N2O4的2倍。
【迁移训练4】将NO+Zn+OH-+H2O → NH3+Zn(OH)配平后,离子方程式中H2O的化学计量数是( )
A.2 B.3 C.6 D.8
【解析】用化合价升降法配平得方程式:
NO+4Zn+7OH-+6H2O = NH3↑+4Zn(OH)
C
看
观
谢
谢
必 修 一
学
化
J
S
专题3 从海水中获得的化学物质
第一单元 氯气及氯的化合物
3 氧化还原反应 第1课时
感受氧化还原反应的存在
刚削好的苹果
放置30分钟后的苹果
刚泡好的绿茶
放置2小时后的绿茶
感受氧化还原反应的存在
好吃的月饼
幕后的“英雄”
感受氧化还原反应的存在
金属生锈
感受氧化还原反应的存在
如何判断一个反应是否属于氧化还原反应
反应中有元素化合价的改变
四种基本类型反应与氧化还原反应的关系
氧化还原反应
分解反应
化合反应
置换反应
复分解反应
元素化合价确定的一般规律
1、由金属和非金属组成的化合物中,金属元素一般显 价,非金属元素一般显 价;
2、化合物中,氧通常显 价,氢通常显 价;
3、化合物中各元素化合价的代数和为 ;
4、单质中元素的化合价为 。
负
正
-2
+1
0
0
CaCO3 = CaO + CO2 ↑
2Fe + 3Cl2 2FeCl3
Na2O + H2O = 2NaOH
非氧化还原反应
氧化还原反应
非氧化还原反应
判断下列反应是否属于氧化还原反应?
CuO + CO = Cu + CO2
CuO + C = Cu + CO2 ↑
Ca(ClO)2 + CO2 + H2O = CaCO3 + 2HClO
2HClO O2↑ + 2HCl
氧化还原反应
非氧化还原反应
氧化还原反应
氧化还原反应
对于氧化还原反应,元素的化合价在反应过程中为什么有升有降?
分析 NaCl 的形成过程
2Na + Cl2 2NaCl
问题探究
2Na + Cl2 = 2NaCl
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
该化学反应中化合价升降的原因 。
0
0
+1
-1
电子的得失
生成 NaCl 时是“电子得失”,生成 HCl 时是“电子对偏移”。
即“电子得失”和“电子对偏移”统称为“电子的转移”。
说 明
一.氧化还原反应
1.定义:
凡是有电子转移的化学反应,称为氧化还原反应
2.特征:
反应前后化合价发生变化 (判断依据)
3.实质:
电子发生转移 (得失或偏移)
有电子转移的化学反应都是氧化还原反应。
氧化剂
还原剂
n个e-
失去电子
,被氧化
得到电子
,被还原
反应物中失去电子(元素化合价升高)的物质—被氧化
二.氧化剂和还原剂
1.定义:
反应物中得到电子(元素化合价降低)的物质—被还原
氧化剂:
还原剂:
0
0
+1
-1
化合价降低
被还原
化合价升高
被氧化
失去2e-
得到2e-
还原剂
氧化剂
①氧化剂和还原剂均是指反应物质,是一种化学试剂,不是某一种元素。
②氧化剂本身被还原,发生还原反应,得到的产物是还原产物。
③还原剂本身被氧化,发生氧化反应,得到的产物是氧化产物。
说 明
-4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7
失去e-,
化合价升高,
被氧化,
作还原剂
得到e-,
作氧化剂
化合价降低,
被还原,
2.化合价升降与得失电子的关系
二.氧化剂和还原剂
2HCl + Fe = FeCl2 + H2↑
氧化剂, 还原剂;
元素被氧化, 元素被还原.
+1 0 +2 0
HCl
Fe
Fe
H
三.氧化产物和还原产物
氧化产物:还原剂失去电子生成的产物—(元素
化合价升高)生成物。
还原产物:氧化剂得到电子生成的物质—(元素
化合价降低)生成物。
2HCl + Fe = FeCl2 + H2↑
还原剂
氧化产物
氧化剂
还原产物
MnO2 + 4HCl(浓)= MnCl2 + Cl2 + 2H2O↑
氧化剂 还原剂
被氧化 被还原
氧化产物 还原产物
0
-1
-1
+4
+2
MnO2
HCl
HCl
MnO2
Cl2
MnCl2
氧化剂 + 还原剂 = 氧化产物 + 还原产物
得到电子,化合价降低,被还原,发生还原反应
失去电子,化合价升高,被氧化,发生氧化反应
三.氧化产物和还原产物
指出下列反应中的氧化剂、还原剂、氧化产物、还原产物。
① CuO + CO Cu + CO2
② 2KClO3 2KCl + 3O2↑
③ Cl2 + H2O = HCl + HClO
④ MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O
⑤ Cu + 2H2SO4(浓) = CuSO4 + SO2↑+ 2H2O
MnO2
歧化反应
小窍门:提供氧的一般是氧化剂
Cl2 + H2O = HCl + HClO
SO2 + 2H2S = 3S↓ + H2O
歧化反应
0
-1
+1
归中反应
0
-2
+4
知识拓展
四.氧化还原反应得失电子的表示方法——双线桥法
例如:2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
1.正确判断各反应物、生成物各元素的化合价
及其变化。
0 +1 +3 0
步骤:
2.两个线桥一个在上、一个在下,线桥的方向
是从反应物一方指向生成物一方,首尾都必
须对应与发生化合价发生变化的同种元素。
步骤:
例如:2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
0 +1 +3 0
3.标出得失电子数,电子符号用“e-”来表示。
4.得失电子总数 = 原子个数 × 每个原子得失电子数
失去 2×3e-
得到 3×2e-
注意:反应中失去电子的总数等于得到电子的总数
步骤:
例如:2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
0 +1 +3 0
失去 2×e-
Cl2 + H2O = HCl + HClO
失去 e-
得到 e-
得到 2e-
+4
+2
-1
0
0
+1
-1
MnO2 + 4 HCl(浓) = MnCl2 + Cl2 + 2H2O
1.
2.
箭头必须由还原剂中失电子的元素指向氧化剂中得电子的元素。
箭头方向表示 电子转移的方向 。
在“桥”上标明转移的 电子总数 。
知识拓展
五.氧化还原反应方程式的配平
(1)配平原则:电子守恒、原子守恒、电荷守恒
(2)配平步骤 (以高锰酸钾和浓盐酸反应制氯气为例):
① 标出化合价变化了的元素的化合价。
KMnO4 + HCl KCl + MnCl2 + Cl2↑+ H2O
+7
-1
+2
0
② 根据元素存在的实际形式调整发生了氧化还原反应的物质的系数,使之成 1︰1 的关系,然后使化合价升降总数相等。
KMnO4 + 2HCl KCl + MnCl2 + Cl2↑+ H2O
+7
-1
+2
0
化合价 ↓ 5×2
化合价 ↑ 2×5
③ 根据化合价升降总数相等确定发生氧化还原反应的物质的化学计量数。
2KMnO4+10HCl KCl+2MnCl2+5Cl2↑+H2O
④ 利用元素守恒,用观察法配平没有参加氧化还原反应的其他物质的系数。
2KMnO4+16HCl 2KCl+2MnCl2+5Cl2↑+8H2O
⑤ 检查方程式两边各原子的个数是否相等,离子方程式还要检查方程式两边的离子所带的电荷数是否相等。
2KMnO4+16HCl = 2KCl+2MnCl2+5Cl2↑+8H2O
例:24mL浓度为0.05mol/L的Na2SO3溶液,恰好与20mL浓度为0.02mol/L的K2X2O7溶液完全反应,则元素X在被还原产物中的化合价是 ( )
A. +6 B. +3 C. +2 D. 0
B
六.氧化还原反应的计算
A
1. 还原性:失去电子的性质 (实质)
化合价升高 (特征)
2. 氧化性:得到电子的性质 (实质)
化合价降低 (特征)
七.氧化性与还原性
下列由左边物质生成右边物质有无氧化还原变化?左边物质表现什么性质?
(1) KI → I2
(2) SO2 → SO3
(3) HgCl2 → Hg2Cl2
(4) SO2 → S
(5) N2O5 → N2O3
(6) KMnO4 → K2MnO4
还原性
还原性
氧化性
氧化性
氧化性
氧化性
-1 0 +1 +3 +5 +7
Cl -- Cl -- Cl -- Cl -- Cl -- Cl
HCl Cl2 HClO HClO2 HClO3 HClO4
只能做还原剂
只能做氧化剂
既能做氧化剂,又能做还原剂
小结:判断微粒(分子、原子、离子)是否具有氧化性或还原性。
(1)元素处于最高价态--只能得电子
--只有氧化性
(2)元素处于最低价态--只能失电子
--只有还原性
(3)元素处于中间价态--
即能得电子 既有氧化性
又能失电子 又有还原性
下列微粒中只有氧化性的是 ________;
只有还原性的是 ___________
既有氧化性又有还原性的是 _______________。
(1) Cl2 (2) Cl- (3) Fe (4) Fe2+
(5) Fe3+ (6) O2 (7) S2- (8) S
(9) SO2 (10) HCl
5、6
2、3、7
1、4、
8、9、10
专题3 从海水中获得的化学物质
第一单元 氯气及氯的化合物
3 氧化还原反应 第2课时
一.氧化还原反应:
凡是有电子转移的化学反应,称为氧化还原反应
二.氧化剂:
还原剂:
反应物中得到电子(元素化合价降低)的物质—被还原
反应物中失去电子(元素化合价升高)的物质—被氧化
知识回顾
四.氧化还原反应得失电子的表示方法——双线桥法、单线桥法
三.氧化产物:
还原剂失去电子生成的产物—(元素化合价升高)
还原产物:
氧化剂得到电子生成的产物—(元素化合价降低)
五.氧化还原反应方程式的配平——标、等、定、平、查
六.氧化还原反应的计算——利用化合价的升降相等
七.氧化性:
失去电子的性质(实质);化合价升高(特征)
氧化性:
得到电子的性质(实质);化合价降低(特征)
活泼非金属单质:Cl2 、Br2 、I2 、O2等
高价金属离子或不活泼金属离子:Fe3+ 、Cu2+ 、Ag+等
高价含氧化合物:H2SO4 、HNO3 、 KMnO4 、MnO2等
常见的强氧化剂
八.常见重要的氧化剂和还原剂
活泼金属单质:Na、Mg、Al、Zn、Fe 等
某些非金属单质:C、H2等
非金属阴离子:S2- 、I- 、Br- 等
低价金属离子:Fe2+ 等
低价化合物:H2S、HI、NH3、CO等
常见的还原剂
下列各组物质中,通常均可用作还原剂的是( )
A. H2S、SO2、H2SO4
B. Cl2、FeCl2、FeCl3
C. H2、NO、CO
D. Br2、KBr、KCl
C
原子或离子的得电子能力越强,物质氧化性越强。
原子或离子的失电子能力越强,物质还原性越强。
九. 氧化性、还原性强弱判断
强调:物质氧化性或还原性的强弱由
得失电子难易决定,与得失电子多少无关
1、以化学方程式判断
氧化剂 + 还原剂 = 还原产物 + 氧化产物。
则:氧化性:氧化剂 > 氧化产物,
还原性:还原剂 > 还原产物。
十. 氧化性、还原性强弱判断方法
K2CrO4 + 14HCI(浓) = 2KCI + CrCI3 + CI2↑+ 7H2O
判断在酸条件下,
氧化性:K2CrO4 CI2 ,
还原性:HCI CrCI3 。
>
>
2、根据元素的化合价
同种元素化合价高氧化性强,化合价低还原性强。
如:氧化性:HClO3 > HClO2 > HClO,
还原性:FeCl2 > FeCl3。
3.根据金属活动顺序表判断
失电子能力逐渐减弱,还原性逐渐减弱
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+ (H+) Cu2+ Hg2+ Ag+ Pt2+ Au3+
得电子能力逐渐增强,氧化性逐渐增强
4.根据反应的难易程度判断 如:
2KMnO4 + 16HCl(浓)== 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O
MnO2 + 4HCl(浓)== MnCl2 + Cl2↑+ 2H2O
O2 + 4HCl(浓)==== 2H2O + 2Cl2↑
△
△
催化剂
则: 氧化性:KMnO4 > MnO2 > O2
与含有变价元素的还原剂在相似条件下反应,可根据氧化产物的价态的高低来判断氧化剂氧化性的强弱。
则: 氧化性:Cl2 > S
5.根据被氧化或还原的程度
△
△
2Fe + 3Cl2 = 2FeCl3
Fe + S = FeS
1.电子守恒规律:失电子总数 = 得电子总数
即:升价总数 = 降价总数
2.反应先后规律:
一种氧化(还原)剂面对多种还原(氧化)剂时,优先与还原(氧化)性强的反应。
十一.氧化还原反应的规律
3.价态变化规律:
归中规律:同种元素的高、低两种不同价态相互反应,化合价只靠拢不交叉。
歧化规律:同种元素中间价可同时变为高价和低价。
推论:同种元素的相邻价态不发生氧化还原反应,如H2S与S、S与SO2、SO2与H2SO4等。
【典例1】对于反应 IBr + H2O = HBr + HIO 的说法正确的是 ( )
A.IBr只作氧化剂
B.IBr只作还原剂
C.IBr既是氧化剂又是还原剂
D.IBr既不是氧化剂又不是还原剂
D
【解析】这一题的关键是正确判断共价化合物IBr和HIO中I、Br元素的化合价。分析可知,该反应不属于氧化还原反应,故D正确。
【点拨】氧化还原反应中的重要概念理解要深刻,不能混淆。抓住两条线:氧化剂被还原,化合价降低,得到还原产物;还原剂被氧化,化合价升高,得到氧化产物。在反应中,氧化剂是得到电子(或电子对偏向)的物质,反应时所含元素的化合价降低,还原剂是失去电子(或电子对偏离)的物质,所含元素的化合价升高。电子转移数可以只看化合价升高的数目或者只看化合价降低的数目,不能将得失电子数相加。
【迁移训练1】 (2010·南通模拟)制备氰氨基化钙的化学方程式为CaCO3 + 2HCN = CaCN2 + CO↑+ H2↑+ CO2↑,在反应中 ( )
A.氢元素被氧化,碳元素被还原
B.HCN既是氧化剂又是还原剂
C.CaCN2是氧化产物,H2为还原产物
D.CO是氧化产物,H2为还原产物
B C
【解析】根据化合价不交叉规律,该反应的电子转移情况为:
【典例2】常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O ①
2Fe3+ + H2O2 = 2Fe2+ + O2↑ + 2H+ ②
下列说法正确的是 ( )
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中,Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+
C D
【解析】由氧化还原反应的强弱规律知,氧化性是氧化剂大于氧化产物,还原性是还原剂大于还原产物,由方程①知,氧化剂H2O2氧化性比氧化产物Fe3+强,由方程②知,还原剂H2O2还原性比还原产物Fe2+强,A错误;方程①和方程②相加,即H2O2分解生成H2O和O2,H2O2呈弱酸性,故随着反应进行,pH升高,B错误;H2O2分解时Fe3+或Fe2+作催化剂,所以总量不变,C正确;因Fe2+可导致H2O2分解,所以H2O2生产过程要避免混入Fe2+,D正确。
【点拨】氧化性、还原性强弱比较的方法有很多,最基本的即为氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,对于一个自发的氧化还原反应,一般是强氧化性和强还原性物质生成弱氧化性和弱还原性物质。
【迁移训练2】(2010·海安中学)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是______。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为______。
AsH3
Br2
【解析】(1)在反应中KBrO3得到电子,化合价降低是氧化剂,而还原剂是化合价升高的物质,所以只能是AsH3。
(2)0.2 mol KBrO3在反应中得到1 mol电子生成X,说明溴元素化合价变化为5,即产物为0价的Br2。
(3)根据上述反应可推知______。
A.氧化性:KBrO3>H3AsO4
B.氧化性:H3AsO4>KBrO3
C.还原性:AsH3>X
D.还原性:X>AsH3
A C
【解析】 (3)氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物。
(4)将氧化剂和还原剂的化学式及其配
平后的化学计量数填入下列方框中,
并标出电子转移的方向和数目:_________________
(4)电子转移的方向和数目,要注意电子转移是由还原剂指向氧化剂。
【典例3】向NaBr、NaI、Na2SO3混合液中通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是 ( )
A.NaCl、Na2SO4 B.NaBr、Na2SO4
C.NaCl、Na2SO4、I2 D.NaCl、
A
【解析】 向NaBr、NaI、Na2SO3混合液中,通入一定量氯气后,发生反应的次序分别为:
Na2SO3 + Cl2 + H2O = Na2SO4 + 2HCl、
2NaI + Cl2 = 2NaCl + I2、
2NaBr + Cl2 = 2NaCl + Br2。
将溶液蒸干则HCl、Br2、Cl2挥发,灼烧I2升华,若通入的氯气是过量的,得到固体剩余物质的组成是NaCl、Na2SO4;若通入的氯气是不足量的,则还有可能留下NaBr。
【点拨】要注意优先原理的应用。越易失电子的物质,失去后就越难得到电子,越易得到电子的物质,得到后就越难失去电子;当一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应。同理,一种还原剂遇多种氧化剂时,氧化性最强的优先发生反应。
【迁移训练3】已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是 ( )
A.3Cl2+6FeI2 = 2FeCl3+4FeI3
B.Cl2+FeI2 = FeCl2+I2
C.Co2O3+6HCl = 2CoCl2+Cl2↑+3H2O
D.2Fe3++2I- = 2Fe2++I2
A
【解析】由于还原性I->Fe2+,故A不可能发生,B、D可能发生。又因为氧化性Co2O3>Cl2,故C也可能发生。
【典例4】(2010·金陵中学)“神七”登天标志着我国的航天事业进入了新的篇章。
(1)火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭温度过高,在火箭一面涂上一种特殊的涂料,该涂料的性质最可能的是________。
A.在高温下不融化 B.在高温下可分解气化
C.在常温下就分解气化 D.该涂料不可能发生分解
B
【解析】防止火箭温度过高,即应该在温度较高的情况下能气化降温。
(2)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,其反应的方程式是 N2O4+N2H4 → N2+H2O。
请配平该反应方程式:
____N2O4+____N2H4 → ____N2+____H2O
该反应中被氧化的原子与被还原的原子的物质的量之比是_______。这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是____________。
1
2
3
4
2:1
产物无污染
【解析】(2)配平的关键是将化合价的升降标注清楚,N2O4中N为+4价,N2H4中N为-2价,反应后均生成N2,所以N2H4的化学计量数应为N2O4的2倍。
【迁移训练4】将NO+Zn+OH-+H2O → NH3+Zn(OH)配平后,离子方程式中H2O的化学计量数是( )
A.2 B.3 C.6 D.8
【解析】用化合价升降法配平得方程式:
NO+4Zn+7OH-+6H2O = NH3↑+4Zn(OH)
C
看
观
谢
谢
