3.2.1 钠的性质与制备 课件(共32张PPT) 2023-2024学年高一化学苏教版(2029)必修第一册
文档属性
| 名称 | 3.2.1 钠的性质与制备 课件(共32张PPT) 2023-2024学年高一化学苏教版(2029)必修第一册 |  | |
| 格式 | ppt | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-21 15:57:50 | ||
图片预览








文档简介
(共32张PPT)
必 修 一
学
化
J
S
专题2 从海水中获得化学物质
新闻链接
中国科学院刘静研究员所带领的科研小组,利用金属钠、钾实现高温消融治疗肿瘤的新方法。该小组成员通过系列离体及在体动物试验,证实了新方法的可行性。
《国际热疗学报》(International Journal of Hyperthermia,7月版)
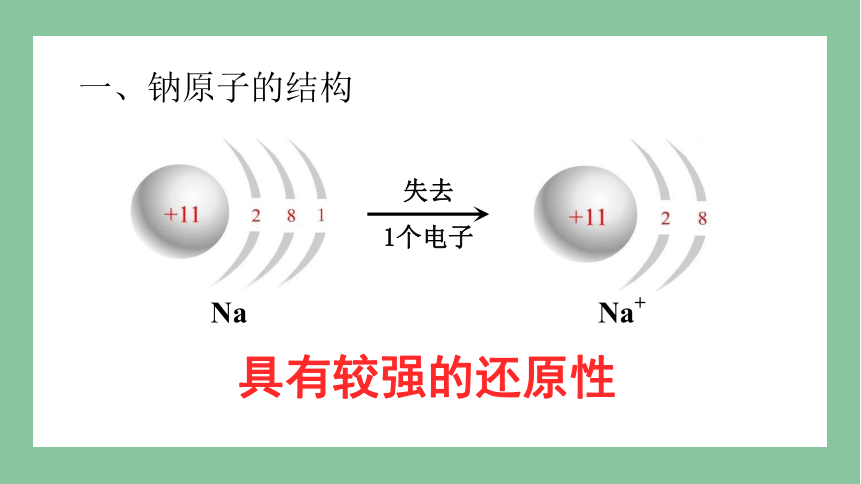
失去
1个电子
Na
Na+
具有较强的还原性
一、钠原子的结构
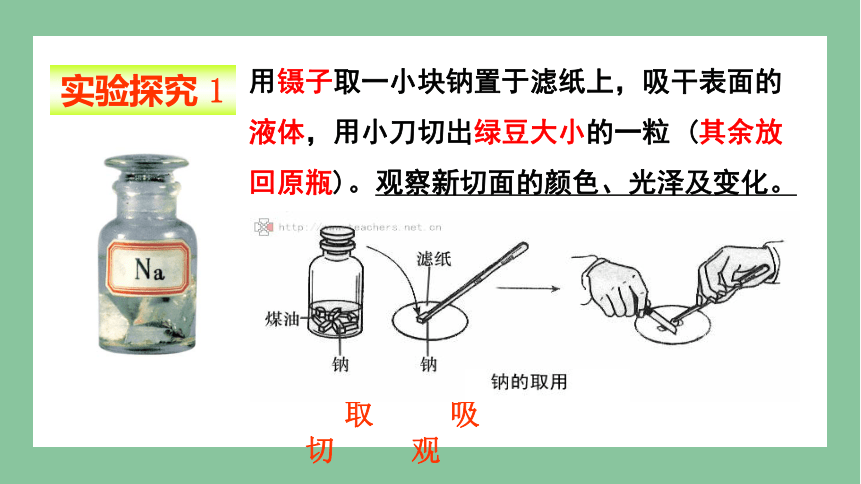
用镊子取一小块钠置于滤纸上,吸干表面的液体,用小刀切出绿豆大小的一粒 (其余放回原瓶)。观察新切面的颜色、光泽及变化。
取 吸 切 观
实验探究 1
实验目的 探究金属钠常温下和氧气反应
实验用品 金属钠、镊子、滤纸、小刀
实验步骤 取、吸、切、观
切割
切面
放置一会儿
金属钠银白色
金属钠在空气中表面变暗,生成氧化膜
实验探究 2
将一小块金属钠放在蒸发皿上,用酒精灯对其加热,观察现象。
实验现象:钠在空气中受热后,先熔化成闪亮的小球后剧烈燃烧产生黄色火焰,生成淡黄色固体。
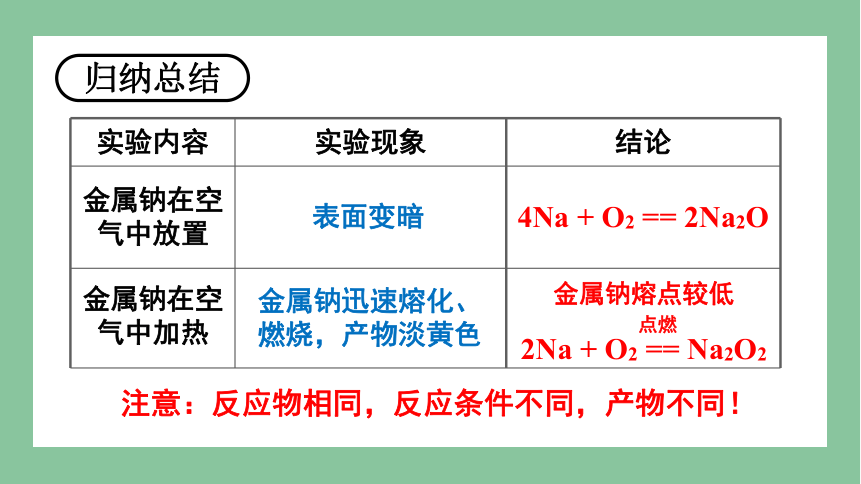
实验内容 实验现象 结论
金属钠在空气中放置
表面变暗
金属钠迅速熔化、燃烧,产物淡黄色
金属钠熔点较低
2Na + O2 == Na2O2
点燃
4Na + O2 == 2Na2O
金属钠在空气中加热
注意:反应物相同,反应条件不同,产物不同!
归纳总结
资料卡片
过氧化钠
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
钠在空气中燃烧时生成过氧化钠。过氧化钠是一种淡黄色固体,与水反应生成氢氧化钠和氧气,与二氧化碳反应生成碳酸钠和氧气。过氧化钠可用于漂白剂和呼吸面具中的供氧剂。
思 考
除了氧气,钠还能与哪些单质反应?
在氯气中燃烧:(剧烈燃烧、产生白色的烟)
2Na + Cl2 2NaCl
点燃
与硫粉混合研磨:(火星四射、发生爆炸)
2Na + S Na2S
研磨
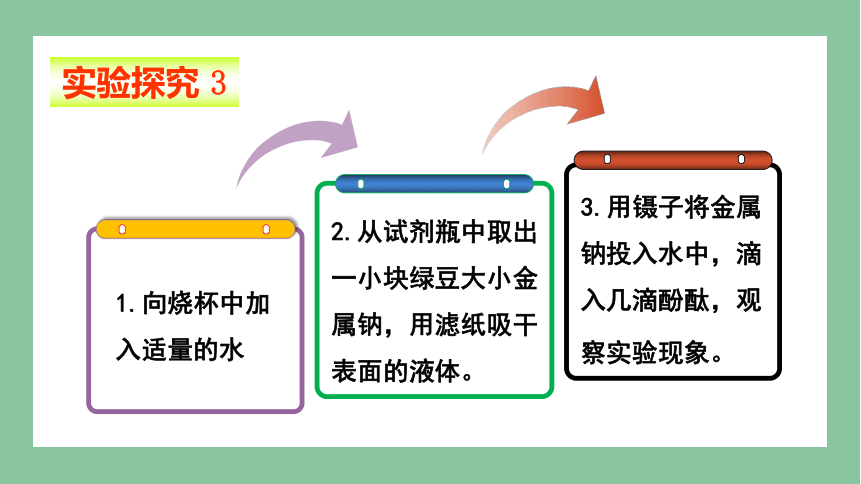
实验探究 3
3.用镊子将金属钠投入水中,滴入几滴酚酞,观察实验现象。
2.从试剂瓶中取出一小块绿豆大小金属钠,用滤纸吸干表面的液体。
1.向烧杯中加入适量的水
实验现象:金属钠浮在水面上,迅速熔成一个闪亮的小球,小球在水面上四处游动并且发出嘶嘶的响声,滴入酚酞的溶液变红。
现象
解释
浮
熔
游
红
你看到了什么?
你听到了什么?
响
密度 (钠) < 密度 (水)
反应放热,钠的熔点较低
产生气体,推动小球迅速移动
溶液呈碱性
反应剧烈
Na如果与酸的反应?
归纳总结
实验内容 实验现象 结论
金属钠与水反应
金属钠与酸反应
浮、熔、游、响、红
比水更剧烈
2Na + 2H2O == 2NaOH + H2↑
2Na + 2HCl == 2NaCl + H2↑
问题探究
西汉时期的湿法炼铜技术,实质就是活泼的铁将铜从它的盐溶液中置换出来。请思考Na能不能置换出CuSO4溶液中的Cu?
有气体和蓝色沉淀生成
钠与硫酸铜溶液反应:
(1)2Na + 2H2O = 2NaOH + H2↑
(2)2NaOH + CuSO4 = Cu(OH)2↓+ Na2SO4
化学方程式:
总式:2Na + 2H2O + CuSO4 = Cu(OH)2↓+ Na2SO4 + H2↑
结论:钠与盐溶液不会置换出金属单质,而是钠先与水发生反应
思 考
什么条件下才能利用钠置换出盐当中的金属单质?
熔融状态
——置换反应
TiCl4 + 4Na ==== Ti + 4NaCl
700~800℃
熔融
钛
——冶炼金属
二、钠的化学性质
2Na + O2 == Na2O2
点燃
4Na + O2 == 2Na2O
1、与氧气反应
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
2、与水反应
2Na + 2H2O == 2NaOH + H2↑
实验现象:浮、熔、游、响、红
2Na + 2HCl == 2NaCl + H2↑
问题探究
1.钠为什么要保存在煤油中?
2.若金属钠着火能不能用水?如何灭火?
为了隔绝空气和水。
金属钠着火不能用水灭,因为水与钠反应放热且生成易燃物H2火烧得更旺。
金属钠着火一般用砂土盖灭。
三、钠在自然界的存在
钠元素在自然界中分布很广,但只以化合态形式存在。
NaCl
Na2CO3
Na2SO4·10H2O
NaNO3
化合态
纯碱
芒硝
食盐
化学史话
汉弗莱·戴维(1778-1829)
1807年由英国年轻的化学家汉弗莱·戴维最早用电解法,首次在实验室人工成功制取金属钠。
2NaCl === 2Na + Cl2↑
通电
四、钠的应用
制备重要化合物
钠强还原性
核反应堆热交换剂
Na、K合金为液体且导热性能好
制作高压钠灯
黄光射程远,透雾力强
冶炼某些金属
钠活动性强
Na2O2
Ti
课堂反馈
1、金属钠应保存在( )
A. 空气中 B. 水中
C. 煤油中 D. 密闭容器中
C
2、取一小块钠放在玻璃燃烧匙里加热,下列实验现象
正确的是( )
① 金属钠先熔化 ② 在空气中燃烧火焰呈黄色
③ 燃烧时火星四射 ④ 燃烧后生成淡黄色固体
⑤ 燃烧后生成白色固体
A. ①②③ B. ①②④ C. ①②⑤ D. ①③⑤
B
3、钠与水反应时产生的现象是( )
① 钠浮在水面上; ② 钠沉在水底;
③ 钠熔化成小球;
④ 钠迅速游动逐渐减小,最后消失;
⑤ 发出嘶嘶的声音; ⑥ 滴入酚酞后溶液显红色。
A. ②③④⑤ B. ①②③④⑤⑥
C. ①③④⑤ D. ①③④⑤⑥
D
4、下列叙述中,错误的是( )
A. 钠燃烧时发出黄色的火焰
B. 钠在空气中燃烧生成过氧化钠
C. 钠与硫化合时可以发生爆炸
D. 可以直接用手拿钠
D
点评:人的皮肤上有水分,易与Na反应生成具有强烈腐蚀性的强碱NaOH。
5、将一小块钠投入到盛有煤油和水的烧杯中(煤油和水均足够多),可以观察到的现象是( )
A. 钠浮在煤油层上,不反应
B. 钠沉在煤油层下,不反应
C. 钠沉在煤油层下,浮在水层上,
在交界处剧烈反应
D. 钠沉在水层下剧烈反应
C
6、钠可以制成高压钠灯,是由于( )
A. 钠是活泼金属
B. 钠是电的良导体
C. 焰色反应呈黄色
D. 钠光射程远且透射能力强
D
课堂小结
一、钠原子的结构
还原性
二、钠的化学性质
2Na + O2 == Na2O2
点燃
4Na + O2 == 2Na2O
1、与氧气反应
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
2、与水反应
2Na + 2H2O == 2NaOH + H2↑
浮、熔、游、响、红
2Na + 2HCl == 2NaCl + H2↑
三、钠在自然界的存在
四、钠的应用
看
观
谢
谢
必 修 一
学
化
J
S
专题2 从海水中获得化学物质
新闻链接
中国科学院刘静研究员所带领的科研小组,利用金属钠、钾实现高温消融治疗肿瘤的新方法。该小组成员通过系列离体及在体动物试验,证实了新方法的可行性。
《国际热疗学报》(International Journal of Hyperthermia,7月版)
失去
1个电子
Na
Na+
具有较强的还原性
一、钠原子的结构
用镊子取一小块钠置于滤纸上,吸干表面的液体,用小刀切出绿豆大小的一粒 (其余放回原瓶)。观察新切面的颜色、光泽及变化。
取 吸 切 观
实验探究 1
实验目的 探究金属钠常温下和氧气反应
实验用品 金属钠、镊子、滤纸、小刀
实验步骤 取、吸、切、观
切割
切面
放置一会儿
金属钠银白色
金属钠在空气中表面变暗,生成氧化膜
实验探究 2
将一小块金属钠放在蒸发皿上,用酒精灯对其加热,观察现象。
实验现象:钠在空气中受热后,先熔化成闪亮的小球后剧烈燃烧产生黄色火焰,生成淡黄色固体。
实验内容 实验现象 结论
金属钠在空气中放置
表面变暗
金属钠迅速熔化、燃烧,产物淡黄色
金属钠熔点较低
2Na + O2 == Na2O2
点燃
4Na + O2 == 2Na2O
金属钠在空气中加热
注意:反应物相同,反应条件不同,产物不同!
归纳总结
资料卡片
过氧化钠
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
钠在空气中燃烧时生成过氧化钠。过氧化钠是一种淡黄色固体,与水反应生成氢氧化钠和氧气,与二氧化碳反应生成碳酸钠和氧气。过氧化钠可用于漂白剂和呼吸面具中的供氧剂。
思 考
除了氧气,钠还能与哪些单质反应?
在氯气中燃烧:(剧烈燃烧、产生白色的烟)
2Na + Cl2 2NaCl
点燃
与硫粉混合研磨:(火星四射、发生爆炸)
2Na + S Na2S
研磨
实验探究 3
3.用镊子将金属钠投入水中,滴入几滴酚酞,观察实验现象。
2.从试剂瓶中取出一小块绿豆大小金属钠,用滤纸吸干表面的液体。
1.向烧杯中加入适量的水
实验现象:金属钠浮在水面上,迅速熔成一个闪亮的小球,小球在水面上四处游动并且发出嘶嘶的响声,滴入酚酞的溶液变红。
现象
解释
浮
熔
游
红
你看到了什么?
你听到了什么?
响
密度 (钠) < 密度 (水)
反应放热,钠的熔点较低
产生气体,推动小球迅速移动
溶液呈碱性
反应剧烈
Na如果与酸的反应?
归纳总结
实验内容 实验现象 结论
金属钠与水反应
金属钠与酸反应
浮、熔、游、响、红
比水更剧烈
2Na + 2H2O == 2NaOH + H2↑
2Na + 2HCl == 2NaCl + H2↑
问题探究
西汉时期的湿法炼铜技术,实质就是活泼的铁将铜从它的盐溶液中置换出来。请思考Na能不能置换出CuSO4溶液中的Cu?
有气体和蓝色沉淀生成
钠与硫酸铜溶液反应:
(1)2Na + 2H2O = 2NaOH + H2↑
(2)2NaOH + CuSO4 = Cu(OH)2↓+ Na2SO4
化学方程式:
总式:2Na + 2H2O + CuSO4 = Cu(OH)2↓+ Na2SO4 + H2↑
结论:钠与盐溶液不会置换出金属单质,而是钠先与水发生反应
思 考
什么条件下才能利用钠置换出盐当中的金属单质?
熔融状态
——置换反应
TiCl4 + 4Na ==== Ti + 4NaCl
700~800℃
熔融
钛
——冶炼金属
二、钠的化学性质
2Na + O2 == Na2O2
点燃
4Na + O2 == 2Na2O
1、与氧气反应
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
2、与水反应
2Na + 2H2O == 2NaOH + H2↑
实验现象:浮、熔、游、响、红
2Na + 2HCl == 2NaCl + H2↑
问题探究
1.钠为什么要保存在煤油中?
2.若金属钠着火能不能用水?如何灭火?
为了隔绝空气和水。
金属钠着火不能用水灭,因为水与钠反应放热且生成易燃物H2火烧得更旺。
金属钠着火一般用砂土盖灭。
三、钠在自然界的存在
钠元素在自然界中分布很广,但只以化合态形式存在。
NaCl
Na2CO3
Na2SO4·10H2O
NaNO3
化合态
纯碱
芒硝
食盐
化学史话
汉弗莱·戴维(1778-1829)
1807年由英国年轻的化学家汉弗莱·戴维最早用电解法,首次在实验室人工成功制取金属钠。
2NaCl === 2Na + Cl2↑
通电
四、钠的应用
制备重要化合物
钠强还原性
核反应堆热交换剂
Na、K合金为液体且导热性能好
制作高压钠灯
黄光射程远,透雾力强
冶炼某些金属
钠活动性强
Na2O2
Ti
课堂反馈
1、金属钠应保存在( )
A. 空气中 B. 水中
C. 煤油中 D. 密闭容器中
C
2、取一小块钠放在玻璃燃烧匙里加热,下列实验现象
正确的是( )
① 金属钠先熔化 ② 在空气中燃烧火焰呈黄色
③ 燃烧时火星四射 ④ 燃烧后生成淡黄色固体
⑤ 燃烧后生成白色固体
A. ①②③ B. ①②④ C. ①②⑤ D. ①③⑤
B
3、钠与水反应时产生的现象是( )
① 钠浮在水面上; ② 钠沉在水底;
③ 钠熔化成小球;
④ 钠迅速游动逐渐减小,最后消失;
⑤ 发出嘶嘶的声音; ⑥ 滴入酚酞后溶液显红色。
A. ②③④⑤ B. ①②③④⑤⑥
C. ①③④⑤ D. ①③④⑤⑥
D
4、下列叙述中,错误的是( )
A. 钠燃烧时发出黄色的火焰
B. 钠在空气中燃烧生成过氧化钠
C. 钠与硫化合时可以发生爆炸
D. 可以直接用手拿钠
D
点评:人的皮肤上有水分,易与Na反应生成具有强烈腐蚀性的强碱NaOH。
5、将一小块钠投入到盛有煤油和水的烧杯中(煤油和水均足够多),可以观察到的现象是( )
A. 钠浮在煤油层上,不反应
B. 钠沉在煤油层下,不反应
C. 钠沉在煤油层下,浮在水层上,
在交界处剧烈反应
D. 钠沉在水层下剧烈反应
C
6、钠可以制成高压钠灯,是由于( )
A. 钠是活泼金属
B. 钠是电的良导体
C. 焰色反应呈黄色
D. 钠光射程远且透射能力强
D
课堂小结
一、钠原子的结构
还原性
二、钠的化学性质
2Na + O2 == Na2O2
点燃
4Na + O2 == 2Na2O
1、与氧气反应
2Na2O2 + 2H2O = 4NaOH + O2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
2、与水反应
2Na + 2H2O == 2NaOH + H2↑
浮、熔、游、响、红
2Na + 2HCl == 2NaCl + H2↑
三、钠在自然界的存在
四、钠的应用
看
观
谢
谢
