1.2.2 气体摩尔体积 课件(共42张PPT) 2023-2024学年高一化学苏教版(2029)必修第一册
文档属性
| 名称 | 1.2.2 气体摩尔体积 课件(共42张PPT) 2023-2024学年高一化学苏教版(2029)必修第一册 |

|
|
| 格式 | ppt | ||
| 文件大小 | 6.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-21 15:58:18 | ||
图片预览





文档简介
(共42张PPT)
必 修 一
学
化
J
S
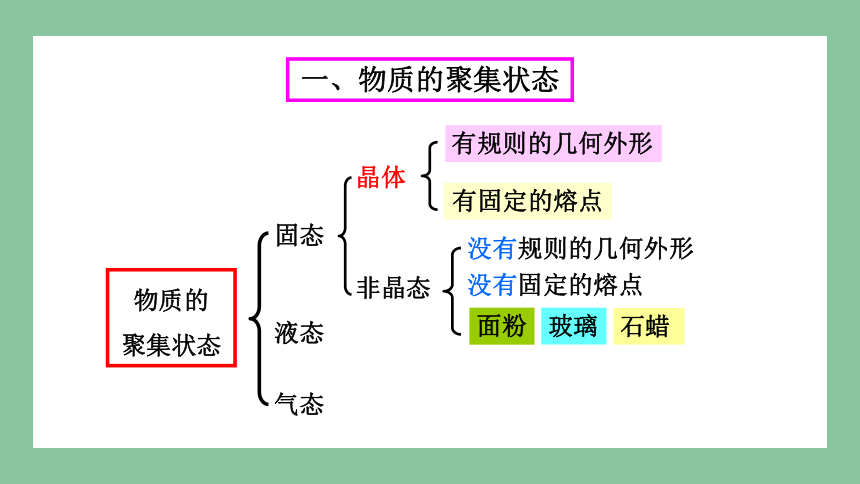
固态
物质的
聚集状态
液态
气态
晶体
非晶态
有规则的几何外形
有固定的熔点
没有规则的几何外形
没有固定的熔点
面粉
玻璃
石蜡
一、物质的聚集状态
霞石
电气石
重晶石
菱铁矿
菱锰矿
辉铋矿
硼砂
石膏
玛瑙
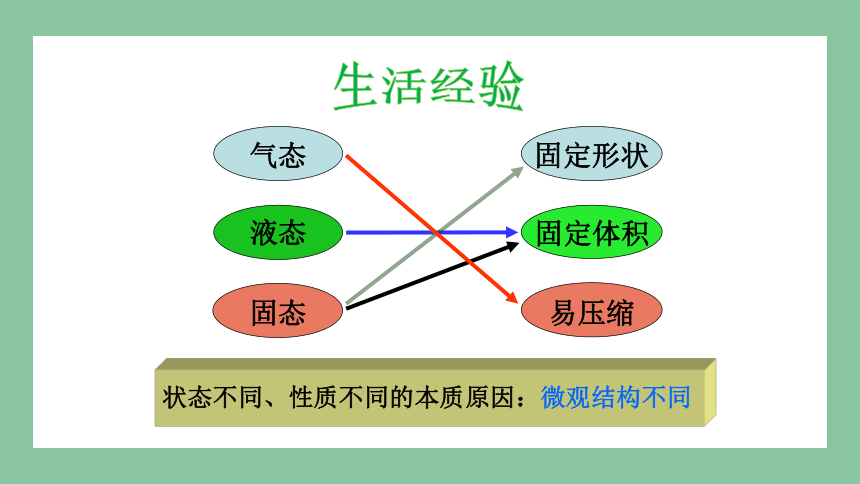
气态
液态
固态
易压缩
固定体积
固定形状
状态不同、性质不同的本质原因:微观结构不同
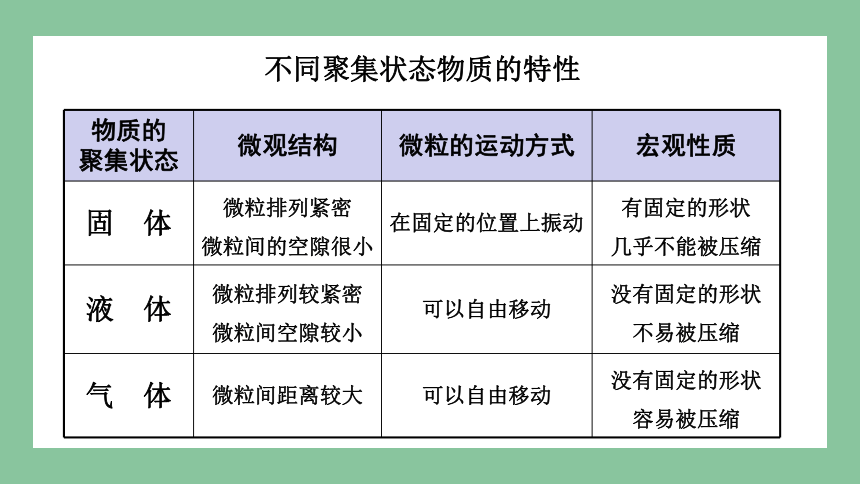
物质的
聚集状态 微观结构 微粒的运动方式 宏观性质
固 体 微粒排列紧密
微粒间的空隙很小 在固定的位置上振动 有固定的形状
几乎不能被压缩
液 体 微粒排列较紧密
微粒间空隙较小 可以自由移动 没有固定的形状
不易被压缩
气 体 微粒间距离较大 可以自由移动 没有固定的形状
容易被压缩
不同聚集状态物质的特性
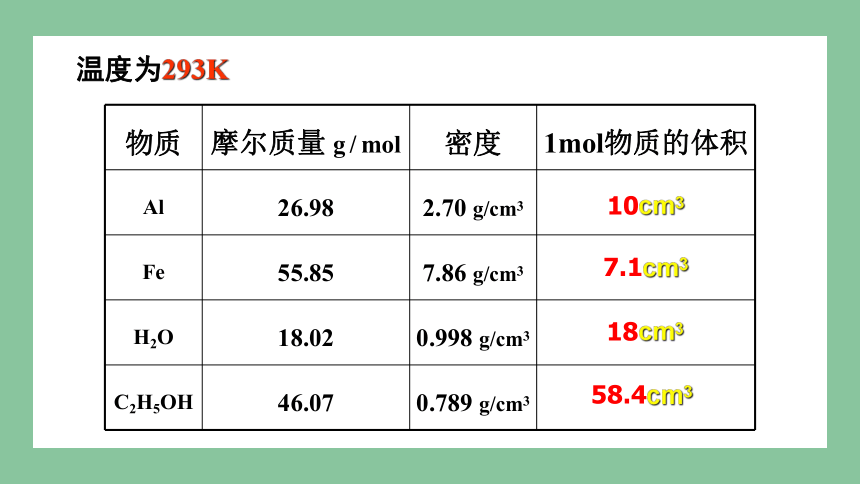
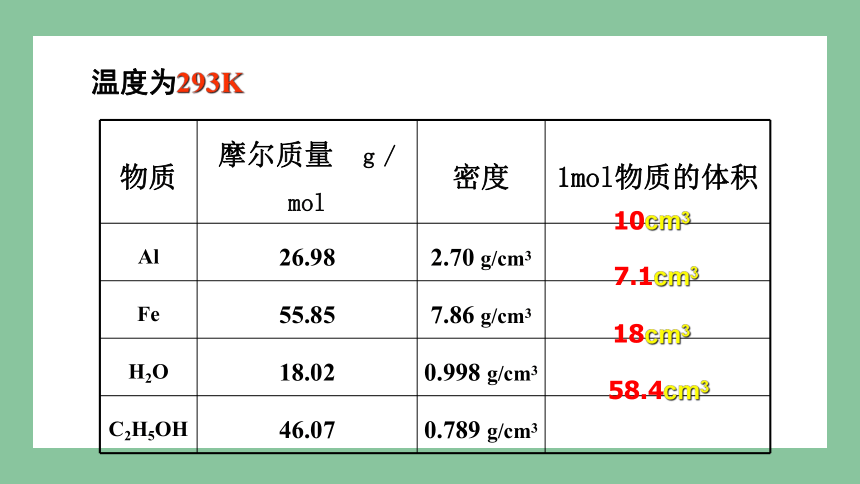
物质 摩尔质量 g / mol 密度 1mol物质的体积
Al 26.98 2.70 g/cm3
Fe 55.85 7.86 g/cm3
H2O 18.02 0.998 g/cm3
C2H5OH 46.07 0.789 g/cm3
18cm3
58.4cm3
温度为293K
10cm3
7.1cm3
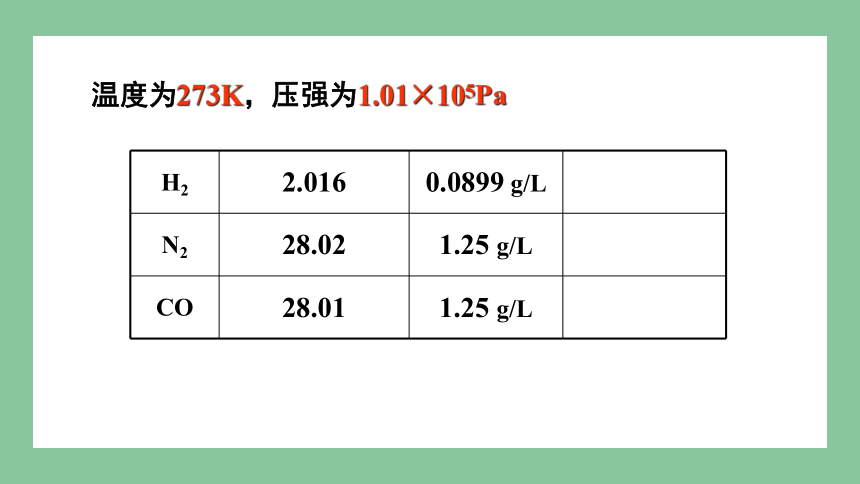
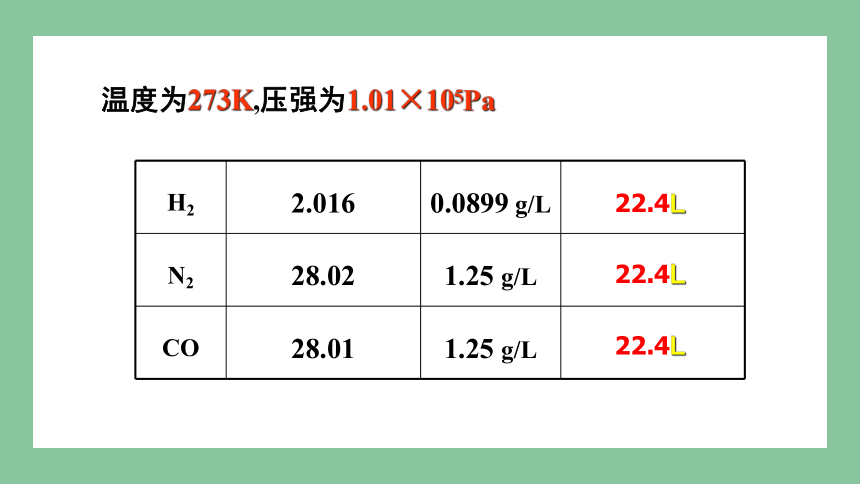
H2 2.016 0.0899 g/L
N2 28.02 1.25 g/L
CO 28.01 1.25 g/L
温度为273K,压强为1.01×105Pa
●
1mol 不同的固态、液态物质体积不同
T相同
1、1mol不同物质的体积:
二、影响物质体积的因素
物质 摩尔质量 g / mol 密度 1mol物质的体积
Al 26.98 2.70 g/cm3
Fe 55.85 7.86 g/cm3
H2O 18.02 0.998 g/cm3
C2H5OH 46.07 0.789 g/cm3
18cm3
58.4cm3
温度为293K
10cm3
7.1cm3
H2 2.016 0.0899 g/L
N2 28.02 1.25 g/L
CO 28.01 1.25 g/L
22.4L
22.4L
22.4L
温度为273K,压强为1.01×105Pa
二、影响物质体积的因素
●
1mol 不同的固态、液态物质体积不同
T相同
●
1mol不同的气态物质,体积大约相同
T、P相同
1、1mol不同物质的体积:
22.4 L
仔细对比物质的体积微观模型,你能说出决定物质体积的因素吗?
V1
V4
V2
V3
2、影响物质体积大小的因素:
②微粒的数目
①微粒的大小
③微粒之间的距离
固、液
气体
温度
压强
p不变
T升高
V增大
T不变
p增大
V减小
1、1mol固体、液体的体积主要决定于组成它们的微粒大小。
2、相同条件下,1mol气体的体积主要决定于分子间的距离。
分子间距大约是分子直径的10倍
科学证明:在温度和压强一定时,任何气体分子间的平均距离是相等!叙述气体体积时一定要指明温度和压强!
三、气体摩尔体积
V
Vm
n = ——
1.定义:单位物质的量的气体所占的体积。
2.符号:Vm
3.单位:L/mol 或 L·mol-1、m3/mol等
4.对象:任何气体(纯净或混合气体)
5.公式:
★标准状况 ( 温度0℃(273K)、压强 1.01×105 Pa )下 1mol任何气体体积约:22.4L
答案:气体的体积在分子个数、温度、压强一定时,决定于气体的分子间平均距离,而与分子种类无关。
为什么说气体摩尔体积也适用于混合气体?
想一想
1. 标准状况下,1mol任何物质的体积都约是22.4L。
(错,物质应是气体)
2. 1mol气体的体积约为22.4L。
(错,应标明条件-标准状况)
3. 标准状况下,1molO2和N2混合气体的体积约为22.4L。
(对,气体体积与分子种类无关)
4. 22.4L气体所含分子数一定大于11.2L气体所含的分子数。
(错,未指明气体体积是否在相同条件下测定)
5. 标准状况下,气体的摩尔体积都是22.4L。
(错,“约为”;单位应为L/mol)
6. 只有在标准状况下,气体的摩尔体积才可能约为22.4L/mol。
(错,不一定)
条件:标准状况
对象:任何气体
物质的量:1mol
结论
体积约占 22.4L
标准状况下的气体摩尔体积的要点:
1mol任何气体,可以是单一纯净的气体,也可以是混合气体,气体体积与分子种类无关。
特别提示
5. 5克氨在标准状况时体积是多少
解: 氨的式量是17,
氨的摩尔质量是 17g/mol。
5. 5g
17g/mol
= 0. 32 mol
答:5. 5氨在标准状况时的体积是7. 2L。
V(NH3) = Vm×n (NH3) = 22. 4L/mol ×0. 32mol = 7. 2L
n (NH3) =
m(NH3)
M (NH3)
=
例题1
m
n
N
÷M
×M
×NA
÷NA
×22.4L/mol
÷22.4L/mol
(标准状况)
v
课堂小结
1、下列叙述正确的是( )
A.1 mol任何气体的体积都约为22.4 L
B.1 mol任何物质在标准状况下所占的体积都约为22.4 L
C.标准状况下,1 mol水所占的体积是22.4 L
D.标准状况下,22.4 L任何气体的物质的量都约为1 mol
D
课堂练习
气体的体积和物质的量的关系:
1. 标准状况下,1mol的CO2的体积为:_____
2. 标准状况下,0.5mol的H2S的体积为:_____
3. 标准状况下,44.8L的CH4的物质的量为:______
含H的个数为:_________
4. 标准状况下,6.72L的NH3的物质的量为:______
质量为:_____
22.4L
11.2L
1mol
2.408×1024
0.3mol
5.1g
课后思考
我们初中学过,50 mL的水 50 mL的酒精混合在一起的体积小于100 mL,那么在标准状况下的11.2 L的 O2和11.2 L H2混合在一起的体积是否等于22.4 L?如果混合气体被点燃后剩余气体在标准状况下体积是多少?
2、规律:阿伏加德罗定律中有“四同”:
同温、同压、同体积、同微粒数。
只要有任何“三同”,就可以定出另一同。
1、定义:同温同压下,相同体积的任何气体含有
相同数目的分子。
一、阿伏加德罗定律
3、在同温下,两种气体同体积又同分子数,则必然同压。
“四同”:同温、同压、同体积、同微粒数
1、同温同压下,同体积的两种气体必含有相同数目的分子。
2、同温同压下,同分子数目的两种气体必同体积。
理想气体状态方程
pV = nRT
p为压强 V为体积
n为物质的量 R为常数
T为温度
认识本质
阿伏加德罗定律的推论
pV = nRT
知识拓展
1、下列说法中不正确的是:
A、同温同压下,含有相同分子数的两种气体占有相同的体积。
B、同温同压下,相同质量的两种气体含有相同分子数。
C、同温同压下,2L O2和N2的混合气体与 2LCO2和CO的混合
气体含有相同分子数。
D、同温同压下,相同物质的量的两种气体占有相同的体积。
√
√
√
课堂练习
2、同温同压下,同体积的氨和硫化氢气体的质量比是 ;同质量的氨和硫化氢气体的体积比是 ;同质量的氨和硫化氢气体中所含氢原子个数比是 ;若两者所含氢原子个数相等,它们的物质的量之比是 。
3、同温同压下,两种气体A和B的体积之比为 2 : 1,质量之比为 8 : 5,则A与B的密度之比为 ,摩尔质量之比为 。
1 : 2
2 : 1
3 : 1
2 : 3
4 : 5
4 : 5
学习“物质的量”之后,化学方程式表示的意义更为广泛,以锌和稀硫酸反应为例:
Zn + H2SO4 === ZnSO4 + H2↑
微粒数 1 1 1 1
物质的量 1 mol 1 mol 1 mol 1 mol
质量 65 g 98 g 161 g 2 g
二、有关化学方程式的计算
Zn + H2SO4 === ZnSO4 + H2↑
物质的量与质量 1 mol 1 mol 1 mol 2 g
物质的量与气体
体积(标准状况) 1 mol 1 mol 1 mol 22.4 L
质量与气体体积
(标准状况) 65 g 98 g 161 g 22.4 L
1. 写出相关的化学方程式或由化学方程式找出关系式
2.在方程式下面标明有关的量(标明的量应为纯净物
的量,单位上下要相同。)
3. 列出比例式
计算步骤:
5. 写出答案
4. 计算出结果
14 g Fe 与足量稀盐酸充分混合后,消耗 HCl 的物质的量为多少?生成标准状况下的H2多少升?
答:消耗 HCl 为 0.5 mol,生成的 H2 为 5.6 L。
例题2
写
标
列
算
答
Zn + 2HCl == ZnCl2 + H2
65g
22.4L
V (H2)
6.5g
V(H2) =
2.24 L
=
6.5g× 22.4 L
65g
65g
6.5g
=
22.4L
V (H2)
4、实验室用6.5g Zn与足量盐酸完全反应。求生成H2的体积(标况下)。
解:
答:生成 H2 的体积为 2.24 L。
课堂练习
一、阿伏加德罗定律
二、有关化学方程式的计算
定义:同温同压下,相同体积的任何气体含有相同数目的分子。
规律:三同定一同
pV = nRT
步骤:写、标、列、算、答
课堂小结
课后思考
在标准状况 ( 温度 273 K、压强 1.01×105 Pa )下 1mol 任何气体体积约为22.4 L,你能计算出理想气体状态方程中常数 R 大概的数值吗?(R的单位Pa·m3·mol-1·K-1)
看
观
谢
谢
必 修 一
学
化
J
S
固态
物质的
聚集状态
液态
气态
晶体
非晶态
有规则的几何外形
有固定的熔点
没有规则的几何外形
没有固定的熔点
面粉
玻璃
石蜡
一、物质的聚集状态
霞石
电气石
重晶石
菱铁矿
菱锰矿
辉铋矿
硼砂
石膏
玛瑙
气态
液态
固态
易压缩
固定体积
固定形状
状态不同、性质不同的本质原因:微观结构不同
物质的
聚集状态 微观结构 微粒的运动方式 宏观性质
固 体 微粒排列紧密
微粒间的空隙很小 在固定的位置上振动 有固定的形状
几乎不能被压缩
液 体 微粒排列较紧密
微粒间空隙较小 可以自由移动 没有固定的形状
不易被压缩
气 体 微粒间距离较大 可以自由移动 没有固定的形状
容易被压缩
不同聚集状态物质的特性
物质 摩尔质量 g / mol 密度 1mol物质的体积
Al 26.98 2.70 g/cm3
Fe 55.85 7.86 g/cm3
H2O 18.02 0.998 g/cm3
C2H5OH 46.07 0.789 g/cm3
18cm3
58.4cm3
温度为293K
10cm3
7.1cm3
H2 2.016 0.0899 g/L
N2 28.02 1.25 g/L
CO 28.01 1.25 g/L
温度为273K,压强为1.01×105Pa
●
1mol 不同的固态、液态物质体积不同
T相同
1、1mol不同物质的体积:
二、影响物质体积的因素
物质 摩尔质量 g / mol 密度 1mol物质的体积
Al 26.98 2.70 g/cm3
Fe 55.85 7.86 g/cm3
H2O 18.02 0.998 g/cm3
C2H5OH 46.07 0.789 g/cm3
18cm3
58.4cm3
温度为293K
10cm3
7.1cm3
H2 2.016 0.0899 g/L
N2 28.02 1.25 g/L
CO 28.01 1.25 g/L
22.4L
22.4L
22.4L
温度为273K,压强为1.01×105Pa
二、影响物质体积的因素
●
1mol 不同的固态、液态物质体积不同
T相同
●
1mol不同的气态物质,体积大约相同
T、P相同
1、1mol不同物质的体积:
22.4 L
仔细对比物质的体积微观模型,你能说出决定物质体积的因素吗?
V1
V4
V2
V3
2、影响物质体积大小的因素:
②微粒的数目
①微粒的大小
③微粒之间的距离
固、液
气体
温度
压强
p不变
T升高
V增大
T不变
p增大
V减小
1、1mol固体、液体的体积主要决定于组成它们的微粒大小。
2、相同条件下,1mol气体的体积主要决定于分子间的距离。
分子间距大约是分子直径的10倍
科学证明:在温度和压强一定时,任何气体分子间的平均距离是相等!叙述气体体积时一定要指明温度和压强!
三、气体摩尔体积
V
Vm
n = ——
1.定义:单位物质的量的气体所占的体积。
2.符号:Vm
3.单位:L/mol 或 L·mol-1、m3/mol等
4.对象:任何气体(纯净或混合气体)
5.公式:
★标准状况 ( 温度0℃(273K)、压强 1.01×105 Pa )下 1mol任何气体体积约:22.4L
答案:气体的体积在分子个数、温度、压强一定时,决定于气体的分子间平均距离,而与分子种类无关。
为什么说气体摩尔体积也适用于混合气体?
想一想
1. 标准状况下,1mol任何物质的体积都约是22.4L。
(错,物质应是气体)
2. 1mol气体的体积约为22.4L。
(错,应标明条件-标准状况)
3. 标准状况下,1molO2和N2混合气体的体积约为22.4L。
(对,气体体积与分子种类无关)
4. 22.4L气体所含分子数一定大于11.2L气体所含的分子数。
(错,未指明气体体积是否在相同条件下测定)
5. 标准状况下,气体的摩尔体积都是22.4L。
(错,“约为”;单位应为L/mol)
6. 只有在标准状况下,气体的摩尔体积才可能约为22.4L/mol。
(错,不一定)
条件:标准状况
对象:任何气体
物质的量:1mol
结论
体积约占 22.4L
标准状况下的气体摩尔体积的要点:
1mol任何气体,可以是单一纯净的气体,也可以是混合气体,气体体积与分子种类无关。
特别提示
5. 5克氨在标准状况时体积是多少
解: 氨的式量是17,
氨的摩尔质量是 17g/mol。
5. 5g
17g/mol
= 0. 32 mol
答:5. 5氨在标准状况时的体积是7. 2L。
V(NH3) = Vm×n (NH3) = 22. 4L/mol ×0. 32mol = 7. 2L
n (NH3) =
m(NH3)
M (NH3)
=
例题1
m
n
N
÷M
×M
×NA
÷NA
×22.4L/mol
÷22.4L/mol
(标准状况)
v
课堂小结
1、下列叙述正确的是( )
A.1 mol任何气体的体积都约为22.4 L
B.1 mol任何物质在标准状况下所占的体积都约为22.4 L
C.标准状况下,1 mol水所占的体积是22.4 L
D.标准状况下,22.4 L任何气体的物质的量都约为1 mol
D
课堂练习
气体的体积和物质的量的关系:
1. 标准状况下,1mol的CO2的体积为:_____
2. 标准状况下,0.5mol的H2S的体积为:_____
3. 标准状况下,44.8L的CH4的物质的量为:______
含H的个数为:_________
4. 标准状况下,6.72L的NH3的物质的量为:______
质量为:_____
22.4L
11.2L
1mol
2.408×1024
0.3mol
5.1g
课后思考
我们初中学过,50 mL的水 50 mL的酒精混合在一起的体积小于100 mL,那么在标准状况下的11.2 L的 O2和11.2 L H2混合在一起的体积是否等于22.4 L?如果混合气体被点燃后剩余气体在标准状况下体积是多少?
2、规律:阿伏加德罗定律中有“四同”:
同温、同压、同体积、同微粒数。
只要有任何“三同”,就可以定出另一同。
1、定义:同温同压下,相同体积的任何气体含有
相同数目的分子。
一、阿伏加德罗定律
3、在同温下,两种气体同体积又同分子数,则必然同压。
“四同”:同温、同压、同体积、同微粒数
1、同温同压下,同体积的两种气体必含有相同数目的分子。
2、同温同压下,同分子数目的两种气体必同体积。
理想气体状态方程
pV = nRT
p为压强 V为体积
n为物质的量 R为常数
T为温度
认识本质
阿伏加德罗定律的推论
pV = nRT
知识拓展
1、下列说法中不正确的是:
A、同温同压下,含有相同分子数的两种气体占有相同的体积。
B、同温同压下,相同质量的两种气体含有相同分子数。
C、同温同压下,2L O2和N2的混合气体与 2LCO2和CO的混合
气体含有相同分子数。
D、同温同压下,相同物质的量的两种气体占有相同的体积。
√
√
√
课堂练习
2、同温同压下,同体积的氨和硫化氢气体的质量比是 ;同质量的氨和硫化氢气体的体积比是 ;同质量的氨和硫化氢气体中所含氢原子个数比是 ;若两者所含氢原子个数相等,它们的物质的量之比是 。
3、同温同压下,两种气体A和B的体积之比为 2 : 1,质量之比为 8 : 5,则A与B的密度之比为 ,摩尔质量之比为 。
1 : 2
2 : 1
3 : 1
2 : 3
4 : 5
4 : 5
学习“物质的量”之后,化学方程式表示的意义更为广泛,以锌和稀硫酸反应为例:
Zn + H2SO4 === ZnSO4 + H2↑
微粒数 1 1 1 1
物质的量 1 mol 1 mol 1 mol 1 mol
质量 65 g 98 g 161 g 2 g
二、有关化学方程式的计算
Zn + H2SO4 === ZnSO4 + H2↑
物质的量与质量 1 mol 1 mol 1 mol 2 g
物质的量与气体
体积(标准状况) 1 mol 1 mol 1 mol 22.4 L
质量与气体体积
(标准状况) 65 g 98 g 161 g 22.4 L
1. 写出相关的化学方程式或由化学方程式找出关系式
2.在方程式下面标明有关的量(标明的量应为纯净物
的量,单位上下要相同。)
3. 列出比例式
计算步骤:
5. 写出答案
4. 计算出结果
14 g Fe 与足量稀盐酸充分混合后,消耗 HCl 的物质的量为多少?生成标准状况下的H2多少升?
答:消耗 HCl 为 0.5 mol,生成的 H2 为 5.6 L。
例题2
写
标
列
算
答
Zn + 2HCl == ZnCl2 + H2
65g
22.4L
V (H2)
6.5g
V(H2) =
2.24 L
=
6.5g× 22.4 L
65g
65g
6.5g
=
22.4L
V (H2)
4、实验室用6.5g Zn与足量盐酸完全反应。求生成H2的体积(标况下)。
解:
答:生成 H2 的体积为 2.24 L。
课堂练习
一、阿伏加德罗定律
二、有关化学方程式的计算
定义:同温同压下,相同体积的任何气体含有相同数目的分子。
规律:三同定一同
pV = nRT
步骤:写、标、列、算、答
课堂小结
课后思考
在标准状况 ( 温度 273 K、压强 1.01×105 Pa )下 1mol 任何气体体积约为22.4 L,你能计算出理想气体状态方程中常数 R 大概的数值吗?(R的单位Pa·m3·mol-1·K-1)
看
观
谢
谢
