4.2.1 含硫物质之间的转化 课件(共27张PPT) 2023-2024学年高一化学苏教版(2029)必修第一册
文档属性
| 名称 | 4.2.1 含硫物质之间的转化 课件(共27张PPT) 2023-2024学年高一化学苏教版(2029)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1005.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-21 15:37:32 | ||
图片预览






文档简介
(共27张PPT)
必 修 一
学
化
J
S
专题4 硫与环境保护
第二单元 硫及其化合物的相互转化
第1课时 含硫物质之间的转化
朱砂
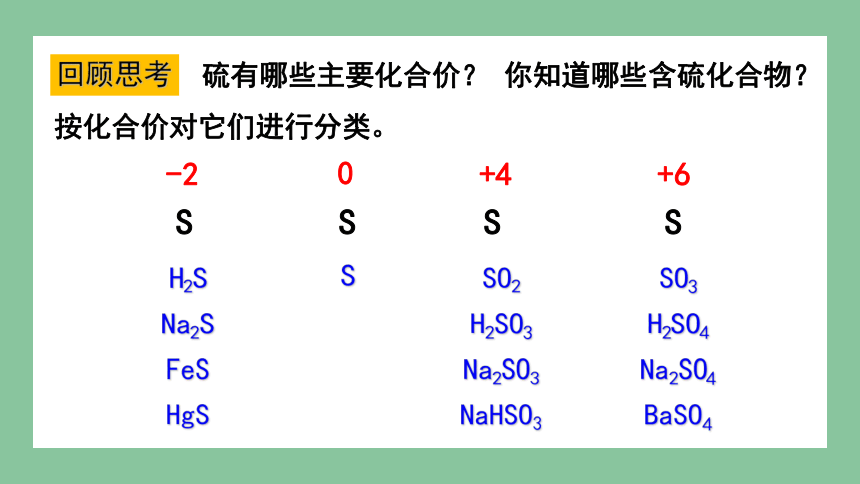
硫有哪些主要化合价? 你知道哪些含硫化合物?按化合价对它们进行分类。
S S S S
-2
0
+4
+6
H2S
Na2S
FeS
HgS
SO3
H2SO4
Na2SO4
BaSO4
S
SO2
H2SO3
Na2SO3
NaHSO3
回顾思考
我们知道氯元素的化合价有0、-1、+1等,不同化合价的含氯物质间可以相互转化。那么,含硫物质之间是否也可互相转化?如何转化?
温故知新
不同价态的含硫物质间通过氧化还原反应转化,
相同价态的含硫物质间通过非氧化还原反应转化。
硫单质的性质
一、物理性质
淡黄色固体,不溶于水,微溶于酒精,易溶于CS2 。
二、化学性质
S 中间价态(0) 既具有氧化性、又具有还原性。
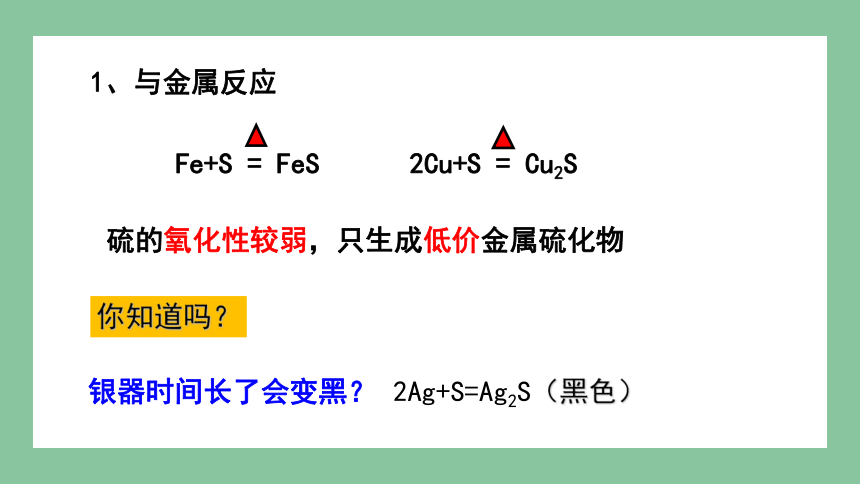
1、与金属反应
Fe+S = FeS
2Cu+S = Cu2S
硫的氧化性较弱,只生成低价金属硫化物
2Ag+S=Ag2S(黑色)
银器时间长了会变黑?
你知道吗?
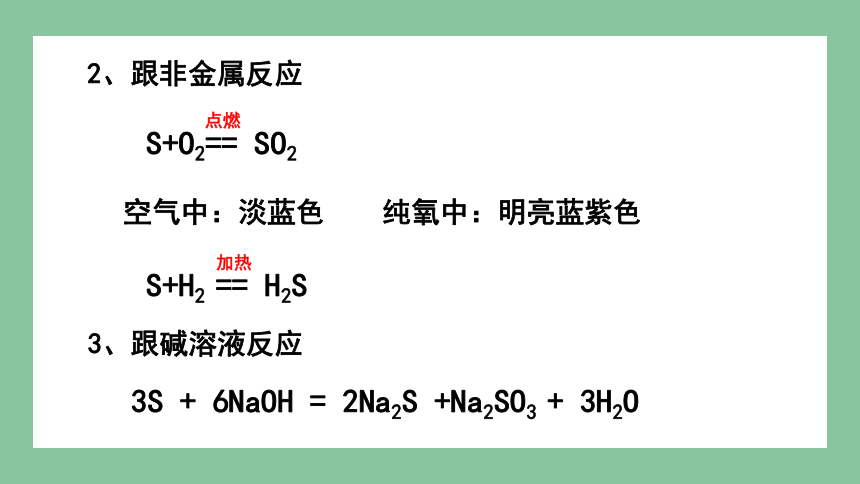
2、跟非金属反应
空气中:淡蓝色 纯氧中:明亮蓝紫色
S+O2== SO2
点燃
S+H2 == H2S
加热
3、跟碱溶液反应
3S + 6NaOH = 2Na2S +Na2SO3 + 3H2O
无色有臭鸡蛋气味的气体,能溶于水(1:2.6)。有毒。其水溶液叫氢硫酸。
臭名远扬的硫化氢
H2S的性质
思考:从化合价角度考虑H2S有什么化学性质?
从酸、碱、盐的角度考虑H2S有什么化学性质?
1、弱酸性
2、还原性
点燃
2H2S + O2 == 2S + 2H2O 氧气不足
2H2S + 3O2 == 2SO2 + 2H2O 氧气充足
点燃
低价只有还原性:-2 → 0
3.制备H2S:
H2S+2NaOH=Na2S+2H2O
H2S的性质
FeS+H2SO4=FeSO4+H2S↑
一.物理性质 无色固体,熔点(16.8℃),沸点(44.8℃)
标准状况呢?
SO3+ H2O=H2SO4 (放出大量热)
SO3 + CaO = CaSO4
SO3 + Ca(OH)2 = CaSO4+ H2O
二.化学性质——酸性氧化物
SO3的性质
1、与水反应
2、与氧化物反应
3、与碱反应
固体
S
S
S
S
0
+4
+6
–2
氧化 氧化 氧化
还原 还原 还原
不相同价态的硫元素转化规律
小结
1、不相同价态的含硫化合物间,通过氧化还原反应规律来转化。
2、S在发生价态变化时,一般都变化到相邻价态。
(1) Hg+S=HgS
(用硫处理散落在地上的汞,以防止汞中毒)
(2)2Na2SO3+O2=2Na2SO4 ,Na2SO3应密封保存。
(3)2NaOH+SO2=Na2SO3+H2O
[思考]请同学们判断以上三个反应哪些是氧化还原反应,哪些是非氧化还原反应。
亚硫酸盐易被氧化
SO32-+2H+= SO2↑+H2O
学以致用
整理与归纳
硫及其化合物之间相互转化
Na2SO4
H2SO4
BaSO4
SO3
SO2
S
H2S
H2SO3
H2S
Na2SO3
①
②
③
⑤
④
⑥
⑦
⑧
⑨
[思考]请同学们完成上述涉及到的方程式:
参考答案
相同价态含硫化合物间--非氧化还原反应转化
不同价态含硫化合物间--氧化还原反应转化
① S + Hg = HgS ② S + O2 = SO2
③ 2SO2+O2 2SO3 ④ SO3 + H2O = H2SO4
点燃
催化剂
加热
⑤ 2NaOH+SO2=Na2SO3+H2O
⑥ H2O+SO2 H2SO3
⑦2Na2SO3+O2=2Na2SO4
⑧2NaOH+H2SO4 = Na2SO4+H2O
⑨BaCl2+H2SO4 = BaSO4↓+2HCl
1.判断正误(正确的打“√”,错误的打“×”)
(1)硫元素在自然界中的存在形态有游离态和化合态两种。( )
(2)1 mol SO2与足量O2充分反应可得到1 mol SO3。( )
(3)硫单质和SO2都既有氧化性又有还原性。( )
课堂练习
√
×
√
(4)FeS、FeCl2都可由相应单质直接化合生成。( )
(5)SO2、SO3都可与水直接化合生成相应的含氧酸。( )
(6)SO2通入CaCl2溶液中可生成白色沉淀。( )
(7)硫酸生成氢气时,H+起氧化作用;硫酸生成二氧化硫时,+6价的硫起氧化作用。( )
×
√
×
√
2.硫在空气中燃烧生成气体A,把A溶于水得B的溶液,向B溶液中滴加溴水,溴水褪色,B变成C,在C里加Na2S产生气体D,把D通入B溶液得浅黄色沉淀E。A、B、C、D、E都含同一种元素。按A、B、C、D、E顺序排序的是( )
A.SO2、H2SO4、H2SO3、H2S、S
B.SO2、H2SO3、H2SO4、H2S、S
C.SO2、H2SO3、H2SO4、SO3、Na2S2O3
D.SO3、H2SO4、H2SO3、SO2、Na2S2O3
B
解析:硫在空气中燃烧生成SO2,SO2溶于水得H2SO3,向H2SO3溶液滴加溴水生成H2SO4和HBr,在H2SO4溶液中加Na2S产生气体H2S,H2S与H2SO3反应产生浅黄色沉淀S,故B项正确。
3.重金属离子有毒,实验室有甲、乙两种废液,均有一定毒性。甲废液经检验呈碱性,主要有毒离子为Ba2+,将甲、乙两种废液按一定比例混合,毒性明显降低。乙废液中可能含有的离子是( )
A
解析: 能沉淀Ba2+,OH-能沉淀Cu2+,而C项中离子皆没有毒性。故选A。
4.下列有关硫及其化合物的说法正确的是( )
A.SO2、H2SO3均具有还原性,故浓硫酸均能氧化SO2和H2SO3
B.H2S与浓硫酸在不同的条件下反应的氧化产物只能是SO2
C
解析:A项,SO2、H2SO3虽然有还原性,但均不能与浓硫酸发生氧化还原反应,因为+4价硫与+6价硫之间无中间价;B项,氧化产物可能是S或SO2;D项,S与O2反应生成SO2,不能生成SO3。
5.鉴别稀硫酸和浓硫酸最简单的方法是( )
A.加酚酞试液
B.与铜片反应
C.加BaCl2溶液和硝酸
D.用玻璃棒各蘸一点滴在纸上
D
看
观
谢
谢
必 修 一
学
化
J
S
专题4 硫与环境保护
第二单元 硫及其化合物的相互转化
第1课时 含硫物质之间的转化
朱砂
硫有哪些主要化合价? 你知道哪些含硫化合物?按化合价对它们进行分类。
S S S S
-2
0
+4
+6
H2S
Na2S
FeS
HgS
SO3
H2SO4
Na2SO4
BaSO4
S
SO2
H2SO3
Na2SO3
NaHSO3
回顾思考
我们知道氯元素的化合价有0、-1、+1等,不同化合价的含氯物质间可以相互转化。那么,含硫物质之间是否也可互相转化?如何转化?
温故知新
不同价态的含硫物质间通过氧化还原反应转化,
相同价态的含硫物质间通过非氧化还原反应转化。
硫单质的性质
一、物理性质
淡黄色固体,不溶于水,微溶于酒精,易溶于CS2 。
二、化学性质
S 中间价态(0) 既具有氧化性、又具有还原性。
1、与金属反应
Fe+S = FeS
2Cu+S = Cu2S
硫的氧化性较弱,只生成低价金属硫化物
2Ag+S=Ag2S(黑色)
银器时间长了会变黑?
你知道吗?
2、跟非金属反应
空气中:淡蓝色 纯氧中:明亮蓝紫色
S+O2== SO2
点燃
S+H2 == H2S
加热
3、跟碱溶液反应
3S + 6NaOH = 2Na2S +Na2SO3 + 3H2O
无色有臭鸡蛋气味的气体,能溶于水(1:2.6)。有毒。其水溶液叫氢硫酸。
臭名远扬的硫化氢
H2S的性质
思考:从化合价角度考虑H2S有什么化学性质?
从酸、碱、盐的角度考虑H2S有什么化学性质?
1、弱酸性
2、还原性
点燃
2H2S + O2 == 2S + 2H2O 氧气不足
2H2S + 3O2 == 2SO2 + 2H2O 氧气充足
点燃
低价只有还原性:-2 → 0
3.制备H2S:
H2S+2NaOH=Na2S+2H2O
H2S的性质
FeS+H2SO4=FeSO4+H2S↑
一.物理性质 无色固体,熔点(16.8℃),沸点(44.8℃)
标准状况呢?
SO3+ H2O=H2SO4 (放出大量热)
SO3 + CaO = CaSO4
SO3 + Ca(OH)2 = CaSO4+ H2O
二.化学性质——酸性氧化物
SO3的性质
1、与水反应
2、与氧化物反应
3、与碱反应
固体
S
S
S
S
0
+4
+6
–2
氧化 氧化 氧化
还原 还原 还原
不相同价态的硫元素转化规律
小结
1、不相同价态的含硫化合物间,通过氧化还原反应规律来转化。
2、S在发生价态变化时,一般都变化到相邻价态。
(1) Hg+S=HgS
(用硫处理散落在地上的汞,以防止汞中毒)
(2)2Na2SO3+O2=2Na2SO4 ,Na2SO3应密封保存。
(3)2NaOH+SO2=Na2SO3+H2O
[思考]请同学们判断以上三个反应哪些是氧化还原反应,哪些是非氧化还原反应。
亚硫酸盐易被氧化
SO32-+2H+= SO2↑+H2O
学以致用
整理与归纳
硫及其化合物之间相互转化
Na2SO4
H2SO4
BaSO4
SO3
SO2
S
H2S
H2SO3
H2S
Na2SO3
①
②
③
⑤
④
⑥
⑦
⑧
⑨
[思考]请同学们完成上述涉及到的方程式:
参考答案
相同价态含硫化合物间--非氧化还原反应转化
不同价态含硫化合物间--氧化还原反应转化
① S + Hg = HgS ② S + O2 = SO2
③ 2SO2+O2 2SO3 ④ SO3 + H2O = H2SO4
点燃
催化剂
加热
⑤ 2NaOH+SO2=Na2SO3+H2O
⑥ H2O+SO2 H2SO3
⑦2Na2SO3+O2=2Na2SO4
⑧2NaOH+H2SO4 = Na2SO4+H2O
⑨BaCl2+H2SO4 = BaSO4↓+2HCl
1.判断正误(正确的打“√”,错误的打“×”)
(1)硫元素在自然界中的存在形态有游离态和化合态两种。( )
(2)1 mol SO2与足量O2充分反应可得到1 mol SO3。( )
(3)硫单质和SO2都既有氧化性又有还原性。( )
课堂练习
√
×
√
(4)FeS、FeCl2都可由相应单质直接化合生成。( )
(5)SO2、SO3都可与水直接化合生成相应的含氧酸。( )
(6)SO2通入CaCl2溶液中可生成白色沉淀。( )
(7)硫酸生成氢气时,H+起氧化作用;硫酸生成二氧化硫时,+6价的硫起氧化作用。( )
×
√
×
√
2.硫在空气中燃烧生成气体A,把A溶于水得B的溶液,向B溶液中滴加溴水,溴水褪色,B变成C,在C里加Na2S产生气体D,把D通入B溶液得浅黄色沉淀E。A、B、C、D、E都含同一种元素。按A、B、C、D、E顺序排序的是( )
A.SO2、H2SO4、H2SO3、H2S、S
B.SO2、H2SO3、H2SO4、H2S、S
C.SO2、H2SO3、H2SO4、SO3、Na2S2O3
D.SO3、H2SO4、H2SO3、SO2、Na2S2O3
B
解析:硫在空气中燃烧生成SO2,SO2溶于水得H2SO3,向H2SO3溶液滴加溴水生成H2SO4和HBr,在H2SO4溶液中加Na2S产生气体H2S,H2S与H2SO3反应产生浅黄色沉淀S,故B项正确。
3.重金属离子有毒,实验室有甲、乙两种废液,均有一定毒性。甲废液经检验呈碱性,主要有毒离子为Ba2+,将甲、乙两种废液按一定比例混合,毒性明显降低。乙废液中可能含有的离子是( )
A
解析: 能沉淀Ba2+,OH-能沉淀Cu2+,而C项中离子皆没有毒性。故选A。
4.下列有关硫及其化合物的说法正确的是( )
A.SO2、H2SO3均具有还原性,故浓硫酸均能氧化SO2和H2SO3
B.H2S与浓硫酸在不同的条件下反应的氧化产物只能是SO2
C
解析:A项,SO2、H2SO3虽然有还原性,但均不能与浓硫酸发生氧化还原反应,因为+4价硫与+6价硫之间无中间价;B项,氧化产物可能是S或SO2;D项,S与O2反应生成SO2,不能生成SO3。
5.鉴别稀硫酸和浓硫酸最简单的方法是( )
A.加酚酞试液
B.与铜片反应
C.加BaCl2溶液和硝酸
D.用玻璃棒各蘸一点滴在纸上
D
看
观
谢
谢
