4.2.2 氧化还原方程式的配平 课件(共26张PPT) 2023-2024学年高一化学苏教版(2029)必修第一册
文档属性
| 名称 | 4.2.2 氧化还原方程式的配平 课件(共26张PPT) 2023-2024学年高一化学苏教版(2029)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 551.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-21 15:37:59 | ||
图片预览








文档简介
(共26张PPT)
必 修 一
学
化
J
S
专题4 硫与环境保护
第二单元 硫及其化合物的相互转化
第2课时 氧化还原方程式的配平
一.氧化还原反应方程式的配平方法
1.基本原则
(1)得失电子守恒
特征:氧化还原反应中,化合价有升必有降,升降总值相等。
本质:氧化还原反应中,氧化剂得电子总数等于还原剂失电子总数。
(2)质量守恒
反应前后原子的种类和数目不变。
(3)电荷守恒
对于离子反应,方程式两端阴、阳离子所带电荷总数相等。
2.一般步骤
(1)标变价,标明反应前后变价元素的化合价;
(2)列变化,列出化合价的变化值;
(3)求总数,求最小公倍数使化合价升降总数相等;
(4)配系数,确定氧化剂、还原剂或氧化产物、还原产物的化学计量系数,观察法配平其它物质系数;
(5)查守恒,检查质量、电荷、得失电子是否守恒。
【例题1】配平下列化学方程式:
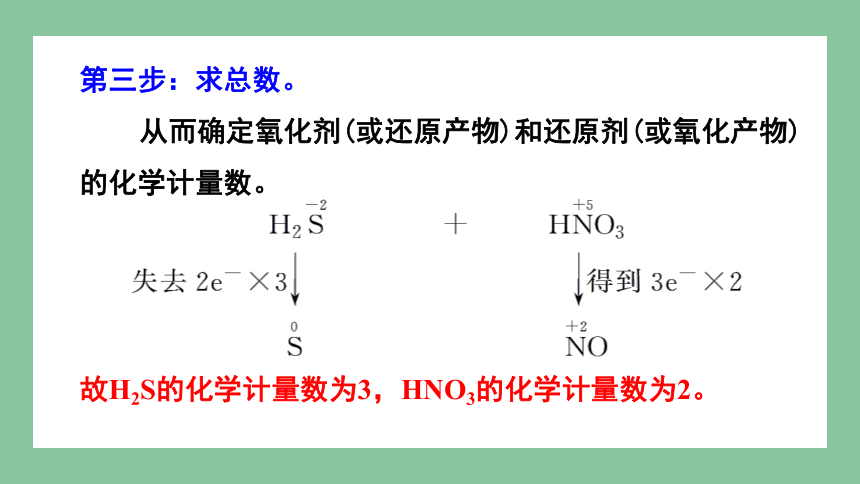
H2S+HNO3―→S↓+NO↑+H2O
【解析】第一步:标变价。
-2 +5 0 +2
H2S+HNO3―→S↓+NO↑+H2O
第二步:列变化。
第三步:求总数。
从而确定氧化剂(或还原产物)和还原剂(或氧化产物)
的化学计量数。
故H2S的化学计量数为3,HNO3的化学计量数为2。
第四步:配系数。
先配平变价元素,再利用原子守恒配平其他元素。
3H2S+2HNO3===3S↓+2NO↑+4H2O
第五步:查守恒。
检查质量、得失电子是否守恒,若为离子反应,还应检查电荷是否守恒。
练习:NH3 + O2 — NO + H2O
4 5 — 4 6
二.常见氧化还原反应方程式配平的类型
1.正向配平类
氧化剂和还原剂是不同的物质,从方程式左端,确定氧化剂、还原剂的系数。
【例题2】
__KI+__KIO3+__H2SO4==__I2+__K2SO4+_H2O
【答案】5 1 3 3 3 3
2.逆向配平类
氧化产物和还原产物是不同的物质,可从方程式右端,确定氧化产物、还原产物的系数。
【例题3】
__S+__NaOH==__Na2S+__Na2SO3+__H2O
【答案】3 6 2 1 3
练习 I2 + KOH — KI + KIO3 + H2O
3 6 — 5 1 3
【答案】3 6 2 1 3
【解析】S既是氧化剂又是还原剂,化合价有升高到+4,也有降低到-2,因此从方程式左端产物开始分析,为了保证得失电子守恒,Na2S和Na2SO3化学计量系数之比是2:1,确定S的系数是3,再根据观察法配平其它物质的系数。
3.缺项配平类
给出的方程式,缺少一种或几种反应物(生成物),一般是H+或OH-或H2O,需要溶液环境判断。
条件 补项原则
酸性条件下 缺H或多O补H+,少O补H2O
碱性条件下 缺H或多O补H2O,少O补OH-
【例题4】将NaBiO3固体(黄色,微溶)加入到MnSO4和H2SO4的混合溶液里,加热,溶液显紫色(Bi3+无色)。配平该反应的离子方程式:
_NaBiO3+__Mn2++__→__Na++__Bi3++__MnO4-+__
【答案】 5 2 14H+ 5 5 2 7H2O
【解析】
①先根据得失电子守恒,确定NaBiO3和Mn2+的系数为5、2;Bi3+和MnO4-的系数为5、2;
②原子守恒,确定Na+的系数为5、5、2;
③补项,根据酸性环境,以及方程式右端少氧,确定方程式左端是H+,右端是H2O,原子守恒配平系数。
4.整体配平类
一种物质中有两种或以上元素化合价发生变化。
【例题5】__FeS2+__O2===__Fe2O3+__SO2
高温
【答案】4 11 2 8
练习
Fe3C + HNO3 — Fe(NO3)3 + CO2↑+ NO2↑+ H2O
1 22 —3 1 13 11
【答案】4 11 2 8
【解析】
确定FeS2和O2的系数是4、11,观察法配平其它物质的系数。
三.信息型氧化还原反应方程式的书写
1.根据信息,判断氧化剂、还原剂、氧化产物和还原产物;
2.写方程,按照
氧化剂+还原剂→还原产物+氧化产物
的形式写出方程式,利用电子得失守恒配平它们的系数;
3.补缺项,根据原子守恒、电荷守恒和溶液酸碱性,
补充H+或OH-或H2O;
4.配平并检查,根据原子守恒、电荷守恒原则检查方程式。
三.信息型氧化还原反应方程式的书写
【例题6】KMnO4与热的稀硫酸酸化的Na2C2O4反应,
生成Mn2+和CO2,写出并配平该反应的离子方程式。
第一步:根据化合价变化判断,
KMnO4是氧化剂,Mn2+是还原产物;
Na2C2O4(碳元素化合价+3价)是还原剂,CO2是氧化产物。
第二步:按“氧化剂+还原剂→还原产物+氧化产物”
把离子方程式初步写成
MnO4-+C2O4-→Mn2++CO2↑
根据化合价升降守恒确定:
2MnO4-+5C2O4-→2Mn2++10CO2↑。
第三步:反应在硫酸中进行,故在左边补充H+,右边补充H2O,即
2MnO4-+5C2O4-+ H+===2Mn2++10CO2↑+ H2O
第四步:依据电荷守恒及H、O原子守恒配平并检查,即
2MnO4-+5C2O4-+16H+===2Mn2++10CO2↑+8H2O
1.__MnO4-+__H++__Cl-==__Mn2++__Cl2↑+__H2O
2.__Cl2+__Ca(OH)2==__CaCl2+__Ca(ClO)2+__H2O
3.__P4+__KOH+__H2O==__K3PO4+__PH3↑
2 16 10 2 5 8
2 2 1 1 2
2 9 3 3 5
课堂练习
4.__ClO-+__Fe(OH)3+__ =__Cl-+__FeO42-+__H2O
5.__MnO4-+__H2O2+__ ==__Mn2++__O2↑+__H2O
6._Cu2S+__HNO3==__Cu(NO3)2+__ NO↑+_H2SO4+_H2O
3 2 4OH- 3 2 5
2 5 6H+ 2 5 8
3 22 6 10 3 8
7.+6价铬的化合物毒性较大,常用NaHSO3将酸性废液中的Cr2O72-还原成Cr3+,该反应的离子方程式为 。
看
观
谢
谢
必 修 一
学
化
J
S
专题4 硫与环境保护
第二单元 硫及其化合物的相互转化
第2课时 氧化还原方程式的配平
一.氧化还原反应方程式的配平方法
1.基本原则
(1)得失电子守恒
特征:氧化还原反应中,化合价有升必有降,升降总值相等。
本质:氧化还原反应中,氧化剂得电子总数等于还原剂失电子总数。
(2)质量守恒
反应前后原子的种类和数目不变。
(3)电荷守恒
对于离子反应,方程式两端阴、阳离子所带电荷总数相等。
2.一般步骤
(1)标变价,标明反应前后变价元素的化合价;
(2)列变化,列出化合价的变化值;
(3)求总数,求最小公倍数使化合价升降总数相等;
(4)配系数,确定氧化剂、还原剂或氧化产物、还原产物的化学计量系数,观察法配平其它物质系数;
(5)查守恒,检查质量、电荷、得失电子是否守恒。
【例题1】配平下列化学方程式:
H2S+HNO3―→S↓+NO↑+H2O
【解析】第一步:标变价。
-2 +5 0 +2
H2S+HNO3―→S↓+NO↑+H2O
第二步:列变化。
第三步:求总数。
从而确定氧化剂(或还原产物)和还原剂(或氧化产物)
的化学计量数。
故H2S的化学计量数为3,HNO3的化学计量数为2。
第四步:配系数。
先配平变价元素,再利用原子守恒配平其他元素。
3H2S+2HNO3===3S↓+2NO↑+4H2O
第五步:查守恒。
检查质量、得失电子是否守恒,若为离子反应,还应检查电荷是否守恒。
练习:NH3 + O2 — NO + H2O
4 5 — 4 6
二.常见氧化还原反应方程式配平的类型
1.正向配平类
氧化剂和还原剂是不同的物质,从方程式左端,确定氧化剂、还原剂的系数。
【例题2】
__KI+__KIO3+__H2SO4==__I2+__K2SO4+_H2O
【答案】5 1 3 3 3 3
2.逆向配平类
氧化产物和还原产物是不同的物质,可从方程式右端,确定氧化产物、还原产物的系数。
【例题3】
__S+__NaOH==__Na2S+__Na2SO3+__H2O
【答案】3 6 2 1 3
练习 I2 + KOH — KI + KIO3 + H2O
3 6 — 5 1 3
【答案】3 6 2 1 3
【解析】S既是氧化剂又是还原剂,化合价有升高到+4,也有降低到-2,因此从方程式左端产物开始分析,为了保证得失电子守恒,Na2S和Na2SO3化学计量系数之比是2:1,确定S的系数是3,再根据观察法配平其它物质的系数。
3.缺项配平类
给出的方程式,缺少一种或几种反应物(生成物),一般是H+或OH-或H2O,需要溶液环境判断。
条件 补项原则
酸性条件下 缺H或多O补H+,少O补H2O
碱性条件下 缺H或多O补H2O,少O补OH-
【例题4】将NaBiO3固体(黄色,微溶)加入到MnSO4和H2SO4的混合溶液里,加热,溶液显紫色(Bi3+无色)。配平该反应的离子方程式:
_NaBiO3+__Mn2++__→__Na++__Bi3++__MnO4-+__
【答案】 5 2 14H+ 5 5 2 7H2O
【解析】
①先根据得失电子守恒,确定NaBiO3和Mn2+的系数为5、2;Bi3+和MnO4-的系数为5、2;
②原子守恒,确定Na+的系数为5、5、2;
③补项,根据酸性环境,以及方程式右端少氧,确定方程式左端是H+,右端是H2O,原子守恒配平系数。
4.整体配平类
一种物质中有两种或以上元素化合价发生变化。
【例题5】__FeS2+__O2===__Fe2O3+__SO2
高温
【答案】4 11 2 8
练习
Fe3C + HNO3 — Fe(NO3)3 + CO2↑+ NO2↑+ H2O
1 22 —3 1 13 11
【答案】4 11 2 8
【解析】
确定FeS2和O2的系数是4、11,观察法配平其它物质的系数。
三.信息型氧化还原反应方程式的书写
1.根据信息,判断氧化剂、还原剂、氧化产物和还原产物;
2.写方程,按照
氧化剂+还原剂→还原产物+氧化产物
的形式写出方程式,利用电子得失守恒配平它们的系数;
3.补缺项,根据原子守恒、电荷守恒和溶液酸碱性,
补充H+或OH-或H2O;
4.配平并检查,根据原子守恒、电荷守恒原则检查方程式。
三.信息型氧化还原反应方程式的书写
【例题6】KMnO4与热的稀硫酸酸化的Na2C2O4反应,
生成Mn2+和CO2,写出并配平该反应的离子方程式。
第一步:根据化合价变化判断,
KMnO4是氧化剂,Mn2+是还原产物;
Na2C2O4(碳元素化合价+3价)是还原剂,CO2是氧化产物。
第二步:按“氧化剂+还原剂→还原产物+氧化产物”
把离子方程式初步写成
MnO4-+C2O4-→Mn2++CO2↑
根据化合价升降守恒确定:
2MnO4-+5C2O4-→2Mn2++10CO2↑。
第三步:反应在硫酸中进行,故在左边补充H+,右边补充H2O,即
2MnO4-+5C2O4-+ H+===2Mn2++10CO2↑+ H2O
第四步:依据电荷守恒及H、O原子守恒配平并检查,即
2MnO4-+5C2O4-+16H+===2Mn2++10CO2↑+8H2O
1.__MnO4-+__H++__Cl-==__Mn2++__Cl2↑+__H2O
2.__Cl2+__Ca(OH)2==__CaCl2+__Ca(ClO)2+__H2O
3.__P4+__KOH+__H2O==__K3PO4+__PH3↑
2 16 10 2 5 8
2 2 1 1 2
2 9 3 3 5
课堂练习
4.__ClO-+__Fe(OH)3+__ =__Cl-+__FeO42-+__H2O
5.__MnO4-+__H2O2+__ ==__Mn2++__O2↑+__H2O
6._Cu2S+__HNO3==__Cu(NO3)2+__ NO↑+_H2SO4+_H2O
3 2 4OH- 3 2 5
2 5 6H+ 2 5 8
3 22 6 10 3 8
7.+6价铬的化合物毒性较大,常用NaHSO3将酸性废液中的Cr2O72-还原成Cr3+,该反应的离子方程式为 。
看
观
谢
谢
