5.1.2 元素周期表 元素周期表的应用 课件(共48张PPT) 2023-2024学年高一化学苏教版(2029)必修第一册
文档属性
| 名称 | 5.1.2 元素周期表 元素周期表的应用 课件(共48张PPT) 2023-2024学年高一化学苏教版(2029)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-21 15:41:09 | ||
图片预览





文档简介
(共48张PPT)
必 修 一
学
化
J
S
专题5 微观结构与物质的多样性
第一单元 元素周期律和元素周期表
第2课时 元素周期表 元素周期表的应用
1869年门捷列夫在继承和分析了前人工作的基础上,对大量实验事实进行了订正、分析和概括,成功地对元素进行了科学分类。将化学性质相似的元素放在一个纵行制出了第一张元素周期表,揭示了化学元素的内在联系,使其构成一个完整的体系成为化学发展史上重要的里程碑之一。
他还预言了一些未知元素的性质都得到了证实。但是由于时代的局限,门捷列夫揭示的元素内在联系的规律还是初步的,他未能认识到形成元素性质周期性变化的根本原因。
Ti=50
Zr=90
?=180
V=51
Nb=94
Ta=182
Cr=52
Mo=96
W=186
Mn=55
Rh=104.4
Pt=197.44
Fe=56
Ru=104.4
Ir=198
Ni=Co=59
Pd=106.6
Os=199
H=1
Cu=63.4
Ag=108
Hg=200
Be=9.4
Mg=24
Zn=65.2
Cd=112
B=11
Al=27.4
=68
Ur=116
Au=197
C=12
Si=28
=70
Sn=118
N=14
P=31
As=75
Sb=122
Bi=210
O=16
S=32
Se=79.4
Te=128
F=19
Cl=35.5
Br=80
I=127
Li=7
Na=23
K=39
Rb=85.4
Cs=133
Tl=204
Ca=40
Sr=87.6
Ba=137
Pb=207
=45
Ce=92
Er=56
La=94
Yt=66
Di=95
In=75
Th=118
门捷列夫的第一张周期表
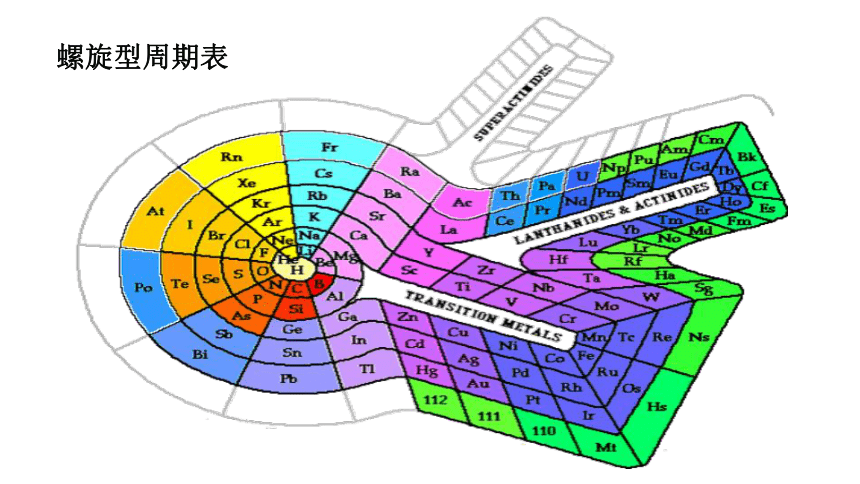
螺旋型周期表
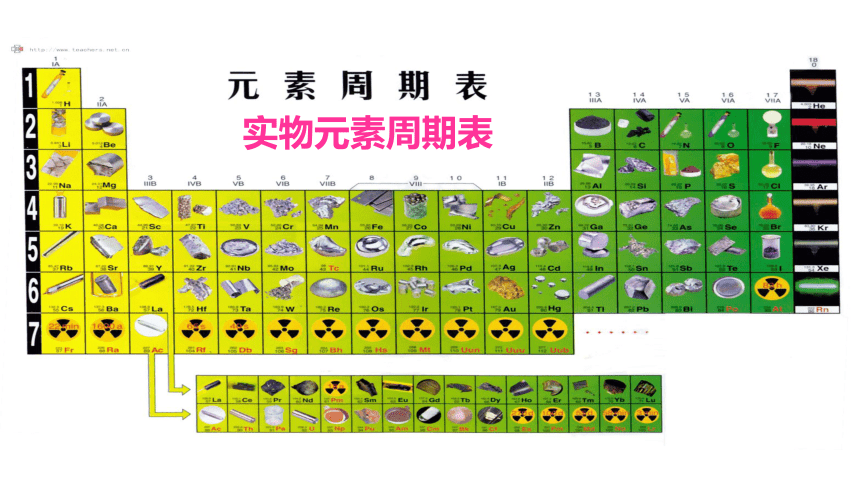
实物元素周期表
请同学们仔细观察元素周期表,思考:
1、最早的元素周期表是以什么原则编排?
2、什么是原子序数?原子序数与原子结构有何关系?
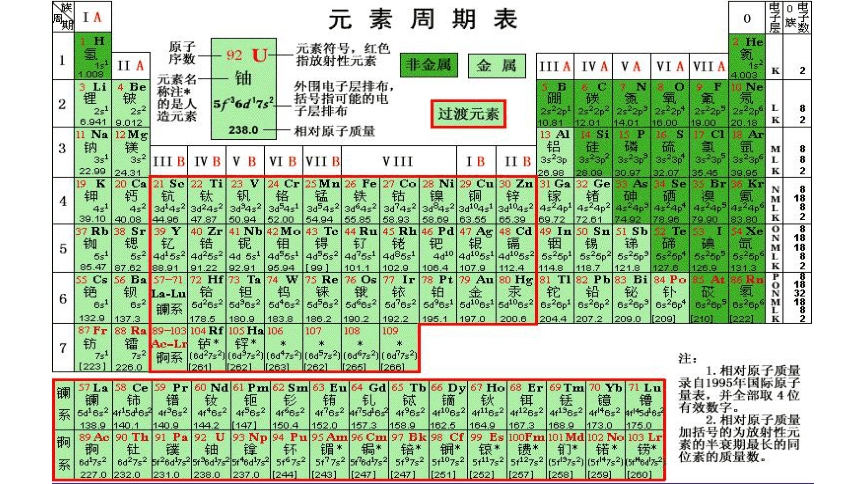
3、现在的周期表以什么原则编排?有多少横行?多少周期?每周期有多少元素?有多少纵行?有多少族?如何分布?
原子序数=核电荷数=质子数=核外电子数
1、编排原则:
① 按原子序数递增原则,从左到右排布
横行:
③ 纵行:
将电子层数相同的元素排成一个横行
把最外层电子数相同的元素按电子层数递增的顺序从上到下排成纵行
一、元素周期表
2、结构
(1)周期(横行)
具有相同的电子层数而又按原子序数递增的顺序排列的一系列元素,称为一个周期。
周期序数 = 电子层数
练习
短周期:
长周期:
周期
第一、二、三周期
第四、五、六、七周期
三短四长
(元素种数:分别为:2、8、8)
(元素种数:分别为:18、18、32、32)
(2)族(纵行)
①主族: 由短周期元素和长周期元素共同构成的族。
表示方法:在族序数后面标“A”字。ⅠA、ⅡA、 ⅢA、…
②副族: 完全由长周期元素构成的族。
表示方法:在族序数后标“B”字。如ⅠB、ⅡB、 ⅢB、…
③第VⅢ族:
④0族:
(“八、九、十” 三个纵行)
稀有气体元素
七主七副三八一零
周期:7个
短周期:3个(第1、2、3周期)
长周期:4个(第4、5、6、7周期)
族:16个
主族:7个
副族:7个
第Ⅷ 族:1个
0族:1个
周期表
(7个横行)
(18个纵行)
课堂小结
原子结构或原子序数
周期序数=电子层数
主族序数=最外层电子数
元素位置
1、研究合成特殊性质的新物质
(1)在金属和非金属的分界线附近寻找半导体材料;
(2)在过渡元素(副族和Ⅷ族元素)中寻找各种优良的催化剂和耐高温、耐腐蚀的材料;
(3)在元素周期表的右上角即F、Cl、S、P等元素附近选择用于生产低毒农药的元素。
二、元素周期表的应用
2、指导人们寻找新材料和稀有矿产
同族元素、相邻同周期元素性质相似,在自然界中以共生矿的形式存在。根据在周期表位置,寻找地壳含量较大或分布较集中的元素的矿床,如铂会存在于金矿。
3、推测元素的原子结构,预测元素的主要性质
素的原子结构决定元素周期表中位置,位置反映了元素的原子结构和元素性质的特点,如“铝”性质的预测。
综合拓展
一、原子结构与元素在周期表中的位置关系
1.核外电子层数=周期数。
2.主族元素的最外层电子数=价电子数=主族序数=最高正化合价。
3.质子数=原子序数=原子核外电子数=核电荷数。
4.最低负化合价绝对值=8-主族序数(ⅣA~ⅦA)。
5.原子半径越大,失电子越易,还原性越强,金属性越强,形成的最高价氧化物对应水化物的碱性越强,其离子的氧化性越弱。
6.原子半径越小,得电子越易,氧化性越强,非金属性越强,形成的气态氢化物越稳定,形成的最高价氧化物对应水化物的酸性越强,其离子的还原性越弱。
四、元素周期表中的“三角规律”和“对角线规律”
A、B、C、D四种元素在周期表中的相对位置如右图,则有:
对角线规律:A、D性质相似。在周期表中,Li—Mg,Be—Al,B—Si处于对角线位置,性质相似。如Be、Al是两性元素,Al2O3、BeO是两性氧化物,Be(OH)2、Al(OH)3都能与强碱(NaOH、KOH等)反应。
1、下列有关原子结构和元素周期律的表述正确的是( )
①原子序数为15的元素的最高化合价为+3
②第ⅦA族元素是同周期中非金属性最强的元素
③第2周期ⅣA族元素的原子核电荷数和中子数一定为6
④原子序数为12的元素位于元素周期表的第3周期ⅡA族
A.①② B.①③ C.②④ D.③④
C
课堂练习
2.镁、锂在元素周期表中具有特殊“对角线”关系,它们的性质相似。例如,它们的单质在过量氧气中燃烧时均只生成正常的氧化物等,下列关于锂的叙述不正确的是( )
A.Li2SO4能溶于水
B.LiOH是易溶于水、受热不分解的强碱
C.Li遇浓硫酸不产生“钝化”现象
D.Li2CO3受热分解,生成Li2O和CO2
B
3、若发现117号元素X,则下列关于它的叙述中正确的是 ( )
A.它处在第六周期
B.它的原子核外有七个电子层
C.它处在第ⅦA族
D.它的原子最外层有六个电子
连减法:117-2-8-8-18-18-32=31,31-14=17(纵行)
BC
4、某元素的最外层有2个电子, 该元素 ( )
A.一定是金属元素
B.一定是ⅡA 族元素
C.一定是He
D.无法确定属于哪类元素
D
5、下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
(A) (B)
(C) (D)
2 3 4
11
19
2
10 11
18 19
6
11 12 13
24
1
3 4
11 12
D
看
观
谢
谢
必 修 一
学
化
J
S
专题5 微观结构与物质的多样性
第一单元 元素周期律和元素周期表
第2课时 元素周期表 元素周期表的应用
1869年门捷列夫在继承和分析了前人工作的基础上,对大量实验事实进行了订正、分析和概括,成功地对元素进行了科学分类。将化学性质相似的元素放在一个纵行制出了第一张元素周期表,揭示了化学元素的内在联系,使其构成一个完整的体系成为化学发展史上重要的里程碑之一。
他还预言了一些未知元素的性质都得到了证实。但是由于时代的局限,门捷列夫揭示的元素内在联系的规律还是初步的,他未能认识到形成元素性质周期性变化的根本原因。
Ti=50
Zr=90
?=180
V=51
Nb=94
Ta=182
Cr=52
Mo=96
W=186
Mn=55
Rh=104.4
Pt=197.44
Fe=56
Ru=104.4
Ir=198
Ni=Co=59
Pd=106.6
Os=199
H=1
Cu=63.4
Ag=108
Hg=200
Be=9.4
Mg=24
Zn=65.2
Cd=112
B=11
Al=27.4
=68
Ur=116
Au=197
C=12
Si=28
=70
Sn=118
N=14
P=31
As=75
Sb=122
Bi=210
O=16
S=32
Se=79.4
Te=128
F=19
Cl=35.5
Br=80
I=127
Li=7
Na=23
K=39
Rb=85.4
Cs=133
Tl=204
Ca=40
Sr=87.6
Ba=137
Pb=207
=45
Ce=92
Er=56
La=94
Yt=66
Di=95
In=75
Th=118
门捷列夫的第一张周期表
螺旋型周期表
实物元素周期表
请同学们仔细观察元素周期表,思考:
1、最早的元素周期表是以什么原则编排?
2、什么是原子序数?原子序数与原子结构有何关系?
3、现在的周期表以什么原则编排?有多少横行?多少周期?每周期有多少元素?有多少纵行?有多少族?如何分布?
原子序数=核电荷数=质子数=核外电子数
1、编排原则:
① 按原子序数递增原则,从左到右排布
横行:
③ 纵行:
将电子层数相同的元素排成一个横行
把最外层电子数相同的元素按电子层数递增的顺序从上到下排成纵行
一、元素周期表
2、结构
(1)周期(横行)
具有相同的电子层数而又按原子序数递增的顺序排列的一系列元素,称为一个周期。
周期序数 = 电子层数
练习
短周期:
长周期:
周期
第一、二、三周期
第四、五、六、七周期
三短四长
(元素种数:分别为:2、8、8)
(元素种数:分别为:18、18、32、32)
(2)族(纵行)
①主族: 由短周期元素和长周期元素共同构成的族。
表示方法:在族序数后面标“A”字。ⅠA、ⅡA、 ⅢA、…
②副族: 完全由长周期元素构成的族。
表示方法:在族序数后标“B”字。如ⅠB、ⅡB、 ⅢB、…
③第VⅢ族:
④0族:
(“八、九、十” 三个纵行)
稀有气体元素
七主七副三八一零
周期:7个
短周期:3个(第1、2、3周期)
长周期:4个(第4、5、6、7周期)
族:16个
主族:7个
副族:7个
第Ⅷ 族:1个
0族:1个
周期表
(7个横行)
(18个纵行)
课堂小结
原子结构或原子序数
周期序数=电子层数
主族序数=最外层电子数
元素位置
1、研究合成特殊性质的新物质
(1)在金属和非金属的分界线附近寻找半导体材料;
(2)在过渡元素(副族和Ⅷ族元素)中寻找各种优良的催化剂和耐高温、耐腐蚀的材料;
(3)在元素周期表的右上角即F、Cl、S、P等元素附近选择用于生产低毒农药的元素。
二、元素周期表的应用
2、指导人们寻找新材料和稀有矿产
同族元素、相邻同周期元素性质相似,在自然界中以共生矿的形式存在。根据在周期表位置,寻找地壳含量较大或分布较集中的元素的矿床,如铂会存在于金矿。
3、推测元素的原子结构,预测元素的主要性质
素的原子结构决定元素周期表中位置,位置反映了元素的原子结构和元素性质的特点,如“铝”性质的预测。
综合拓展
一、原子结构与元素在周期表中的位置关系
1.核外电子层数=周期数。
2.主族元素的最外层电子数=价电子数=主族序数=最高正化合价。
3.质子数=原子序数=原子核外电子数=核电荷数。
4.最低负化合价绝对值=8-主族序数(ⅣA~ⅦA)。
5.原子半径越大,失电子越易,还原性越强,金属性越强,形成的最高价氧化物对应水化物的碱性越强,其离子的氧化性越弱。
6.原子半径越小,得电子越易,氧化性越强,非金属性越强,形成的气态氢化物越稳定,形成的最高价氧化物对应水化物的酸性越强,其离子的还原性越弱。
四、元素周期表中的“三角规律”和“对角线规律”
A、B、C、D四种元素在周期表中的相对位置如右图,则有:
对角线规律:A、D性质相似。在周期表中,Li—Mg,Be—Al,B—Si处于对角线位置,性质相似。如Be、Al是两性元素,Al2O3、BeO是两性氧化物,Be(OH)2、Al(OH)3都能与强碱(NaOH、KOH等)反应。
1、下列有关原子结构和元素周期律的表述正确的是( )
①原子序数为15的元素的最高化合价为+3
②第ⅦA族元素是同周期中非金属性最强的元素
③第2周期ⅣA族元素的原子核电荷数和中子数一定为6
④原子序数为12的元素位于元素周期表的第3周期ⅡA族
A.①② B.①③ C.②④ D.③④
C
课堂练习
2.镁、锂在元素周期表中具有特殊“对角线”关系,它们的性质相似。例如,它们的单质在过量氧气中燃烧时均只生成正常的氧化物等,下列关于锂的叙述不正确的是( )
A.Li2SO4能溶于水
B.LiOH是易溶于水、受热不分解的强碱
C.Li遇浓硫酸不产生“钝化”现象
D.Li2CO3受热分解,生成Li2O和CO2
B
3、若发现117号元素X,则下列关于它的叙述中正确的是 ( )
A.它处在第六周期
B.它的原子核外有七个电子层
C.它处在第ⅦA族
D.它的原子最外层有六个电子
连减法:117-2-8-8-18-18-32=31,31-14=17(纵行)
BC
4、某元素的最外层有2个电子, 该元素 ( )
A.一定是金属元素
B.一定是ⅡA 族元素
C.一定是He
D.无法确定属于哪类元素
D
5、下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
(A) (B)
(C) (D)
2 3 4
11
19
2
10 11
18 19
6
11 12 13
24
1
3 4
11 12
D
看
观
谢
谢
