5.2.1 离子键 课件(共33张PPT) 2023-2024学年高一化学苏教版(2029)必修第一册
文档属性
| 名称 | 5.2.1 离子键 课件(共33张PPT) 2023-2024学年高一化学苏教版(2029)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-21 15:47:06 | ||
图片预览











文档简介
(共33张PPT)
必 修 一
学
化
J
S
专题5 微观结构与物质的多样性
第二单元 微粒之间的相互作用力
第1课时 离子键
食盐
干冰
冰山
氧化镁
你曾否想过
元素的化学性质主要决定于元素的原子结构,而化学反应的实质又是原子的重新组合。那么是不是任意两个或多个原子相遇就都形成新物质的分子?
显然不是,原子与原子相遇有的能进行组合,有的不能。这节课我们就来研究一下原子组合时的强烈相互作用——化学键的相关知识。
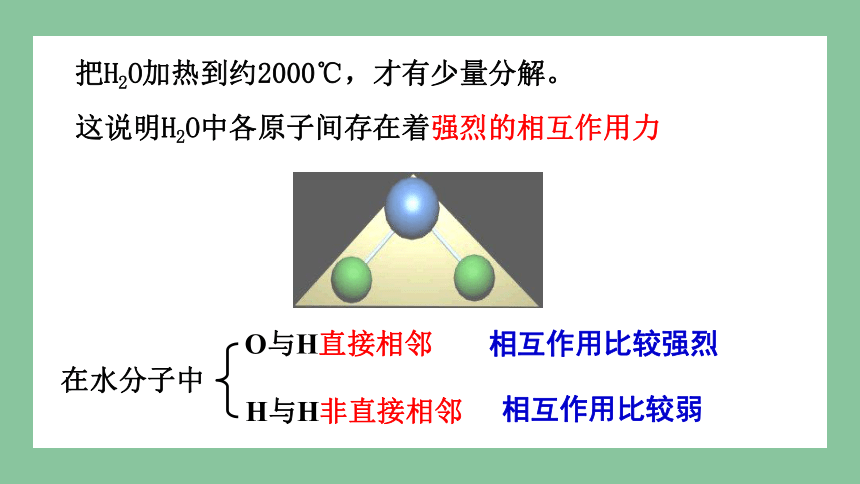
把H2O加热到约2000℃,才有少量分解。
这说明H2O中各原子间存在着强烈的相互作用力
在水分子中
O与H直接相邻
H与H非直接相邻
相互作用比较强烈
相互作用比较弱
物质中直接相邻的原子或离子之间存在的强烈的相互作用叫做化学键。
1.概念理解:
a. 直接相邻
b.原子或离子之间
c.强烈的相互作用
2.化学键主要类型:
a.离子键
b.共价键
一、化学键
c.金属键
首先让我们来回忆以前学过的一种离子化合物的制备,请看实验。
这节课我们学习化学键的一个分支——离子键。
钠在加热的情况融成一个小球,当把盛有钠的燃烧匙伸入盛有氯气的集气瓶中,钠剧烈燃烧,发出黄光,瓶中出现大量白烟,原来的黄绿色逐渐消失!
反应的化学方程式为:
实验现象
从宏观上看,钠和氯气发生了化学反应,生成了新物质氯化钠。如若从微观的角度,又应该怎样理解上述反应呢
思考
Na
+11
8
1
2
Cl
+17
8
7
2
+11
8
2
+17
8
8
2
Na+
Cl-
Na和Cl2的反应
1.在氯化钠晶体中,Na+和Cl- 间存在哪些作用力?
Na+离子和Cl-离子间的静电相互吸引作用
不可能!因阴阳离子接近到某一定距离时,吸引和排斥作用达到平衡,阴阳离子间形成稳定的离子键。
2.阴阳离子结合在一起,彼此电荷是否会相互抵消呢?
阴阳离子间电子与电子、原子核与原子核间的相互排斥作用
二、离子键
定义: 使阴、阳离子结合成化合物的静电作用叫做离子键。
成键微粒:阴、阳离子
键的性质:静电作用(静电引力和斥力)
成键条件:形成阴、阳离子。
含有离子键的化合物就是离子化合物。
思考
哪些物质能形成离子键?
1.活泼的金属元素(IA,IIA)和活泼的非金属元素(VIA,VIIA)之间的化合物。
2.活泼的金属元素和酸根离子形成的盐
3.铵根离子和酸根离子(或活泼非金属元素)形成的盐。
大部分的盐、碱、金属氧化物
4.活泼金属氧化物、活泼金属过氧化物(如Na2O、Na2O2)等属于离子化合物。
在元素符号周围用“ · ”或“×”来表示原子最外层电子的式子,叫电子式。
三、电子式
1、原子的电子式:常把其最外层电子数用小黑点“.”或小叉“×”来表示。
氯原子表示为
Cl
.
.
.
.
.
.
.
如:钠原子表示为
Na
×
写出下列元素原子的电子式:
H Be B C N O F Ne
2、阳离子电子式:简单阳离子的电子式就是用其离子符号表示。
H+
Na+
Mg2+
Ca2+
Al3+
3、阴离子的电子式:不但要画出最外层电子数,而且还应用于括号“[ ]”括起来,并在右上角标出“n-”电荷字样。
··
[ O ]2-
··
:
:
[ Cl ]-
··
··
:
:
写出下列微粒的电子式:
H-
S2-
F-
Br-
4、离子化合物的电子式:
NaCl
AB型:
AB2型:
A2B型:
Na2O
MgCl2
相同阴、阳离子的电子式不能合并写。
注
写出下列微粒的电子式:
KBr NaCl CaCl2 K2O
5、用电子式表示离子化合物的形成过程
例:
用电子式表示溴化钙的形成过程
Br ·
··
··
:
· Br
··
··
:
·Ca·
+
+
→
Ca2+
[ Br ]-
··
··
:
:
[ Br ]-
··
··
:
:
(1)不能把“→”写成“=”
(2)箭头左边写的是原子的电子式,右边是离子化合物的电子式
(3)左边相同的原子可以合并,而右边相同的离子要分开写。
(4)注意阴、阳离子电子式的写法
(5)用箭头标明电子转移方向(也可不标)
注
练习:用电子式表示下列形成过程。
Mg
2
Br
Br
S
K
K
Br
Mg
Br
(2)MgBr2
(1) K2S
6、离子键的强弱及意义
根据离子键的成因,离子键的强弱取决于成键离子的半径以及所带电荷数。离子键的强弱决定了离子化合物的熔、沸点的高低,一般情况下离子键越强,离子化合物的熔沸点越高。
离子键的强弱
请比较:NaCl和MgCl2 NaCl和NaBr
(1)阴阳离子半径越小,离子键越强。
(2)阴阳离子带电荷越多,离子键越强。
(3)离子键越强,物质熔、沸点越高,硬度越大。
1.初步掌握离子键的概念。
2.掌握形成离子键的微粒、条件、本质及键的强弱。
3.区分:用电子式表示物质用电子式表示离子化合物(离子键) 形成过程。
课堂小结
Cl
2
S
Br
[ ]-
2+
Ca
1.下列微粒电子式错误的是( )
A.氯原子
B.硫离子
C.溴离子
D.钙离子
B
课堂练习
2+
Ca
Cl
[ ]-
2
F
[ ]-
K+
2+
Mg
[ ]
O
[ ]
2
S
[ ]
2
Na+
Na+
2.下列化合物电子式书写正确的是( )
A.
B.
C.
D.
D
3.下列说法中正确的是 ( )
(A)两个原子或多个原子之间的相互作用叫做化学键
(B)阴阳离子间通过静电引力而形成的化学键叫做离子键
(C)只有金属元素和非金属元素化合时才能形成离子键
(D)大多数的盐、碱和低价金属氧化物中含有离子键
D
(A)两个原子或多个原子之间的相互作用叫做化学键
(B)阴阳离子间通过静电引力而形成的化学键叫做离子键
(C)只有金属元素和非金属元素化合时才能形成离子键
应指相邻的两个或多个原子,强烈的相互作用
静电引力应改为静电作用,它包括引力和斥力。
铵根离子和和酸根离子(或活泼非金属元素离子)也可形成离子键。
最外层电子
在化学反应中,一般是原子的最外层电子发生变化,所以电子式只标明最外层电子。
看
观
谢
谢
必 修 一
学
化
J
S
专题5 微观结构与物质的多样性
第二单元 微粒之间的相互作用力
第1课时 离子键
食盐
干冰
冰山
氧化镁
你曾否想过
元素的化学性质主要决定于元素的原子结构,而化学反应的实质又是原子的重新组合。那么是不是任意两个或多个原子相遇就都形成新物质的分子?
显然不是,原子与原子相遇有的能进行组合,有的不能。这节课我们就来研究一下原子组合时的强烈相互作用——化学键的相关知识。
把H2O加热到约2000℃,才有少量分解。
这说明H2O中各原子间存在着强烈的相互作用力
在水分子中
O与H直接相邻
H与H非直接相邻
相互作用比较强烈
相互作用比较弱
物质中直接相邻的原子或离子之间存在的强烈的相互作用叫做化学键。
1.概念理解:
a. 直接相邻
b.原子或离子之间
c.强烈的相互作用
2.化学键主要类型:
a.离子键
b.共价键
一、化学键
c.金属键
首先让我们来回忆以前学过的一种离子化合物的制备,请看实验。
这节课我们学习化学键的一个分支——离子键。
钠在加热的情况融成一个小球,当把盛有钠的燃烧匙伸入盛有氯气的集气瓶中,钠剧烈燃烧,发出黄光,瓶中出现大量白烟,原来的黄绿色逐渐消失!
反应的化学方程式为:
实验现象
从宏观上看,钠和氯气发生了化学反应,生成了新物质氯化钠。如若从微观的角度,又应该怎样理解上述反应呢
思考
Na
+11
8
1
2
Cl
+17
8
7
2
+11
8
2
+17
8
8
2
Na+
Cl-
Na和Cl2的反应
1.在氯化钠晶体中,Na+和Cl- 间存在哪些作用力?
Na+离子和Cl-离子间的静电相互吸引作用
不可能!因阴阳离子接近到某一定距离时,吸引和排斥作用达到平衡,阴阳离子间形成稳定的离子键。
2.阴阳离子结合在一起,彼此电荷是否会相互抵消呢?
阴阳离子间电子与电子、原子核与原子核间的相互排斥作用
二、离子键
定义: 使阴、阳离子结合成化合物的静电作用叫做离子键。
成键微粒:阴、阳离子
键的性质:静电作用(静电引力和斥力)
成键条件:形成阴、阳离子。
含有离子键的化合物就是离子化合物。
思考
哪些物质能形成离子键?
1.活泼的金属元素(IA,IIA)和活泼的非金属元素(VIA,VIIA)之间的化合物。
2.活泼的金属元素和酸根离子形成的盐
3.铵根离子和酸根离子(或活泼非金属元素)形成的盐。
大部分的盐、碱、金属氧化物
4.活泼金属氧化物、活泼金属过氧化物(如Na2O、Na2O2)等属于离子化合物。
在元素符号周围用“ · ”或“×”来表示原子最外层电子的式子,叫电子式。
三、电子式
1、原子的电子式:常把其最外层电子数用小黑点“.”或小叉“×”来表示。
氯原子表示为
Cl
.
.
.
.
.
.
.
如:钠原子表示为
Na
×
写出下列元素原子的电子式:
H Be B C N O F Ne
2、阳离子电子式:简单阳离子的电子式就是用其离子符号表示。
H+
Na+
Mg2+
Ca2+
Al3+
3、阴离子的电子式:不但要画出最外层电子数,而且还应用于括号“[ ]”括起来,并在右上角标出“n-”电荷字样。
··
[ O ]2-
··
:
:
[ Cl ]-
··
··
:
:
写出下列微粒的电子式:
H-
S2-
F-
Br-
4、离子化合物的电子式:
NaCl
AB型:
AB2型:
A2B型:
Na2O
MgCl2
相同阴、阳离子的电子式不能合并写。
注
写出下列微粒的电子式:
KBr NaCl CaCl2 K2O
5、用电子式表示离子化合物的形成过程
例:
用电子式表示溴化钙的形成过程
Br ·
··
··
:
· Br
··
··
:
·Ca·
+
+
→
Ca2+
[ Br ]-
··
··
:
:
[ Br ]-
··
··
:
:
(1)不能把“→”写成“=”
(2)箭头左边写的是原子的电子式,右边是离子化合物的电子式
(3)左边相同的原子可以合并,而右边相同的离子要分开写。
(4)注意阴、阳离子电子式的写法
(5)用箭头标明电子转移方向(也可不标)
注
练习:用电子式表示下列形成过程。
Mg
2
Br
Br
S
K
K
Br
Mg
Br
(2)MgBr2
(1) K2S
6、离子键的强弱及意义
根据离子键的成因,离子键的强弱取决于成键离子的半径以及所带电荷数。离子键的强弱决定了离子化合物的熔、沸点的高低,一般情况下离子键越强,离子化合物的熔沸点越高。
离子键的强弱
请比较:NaCl和MgCl2 NaCl和NaBr
(1)阴阳离子半径越小,离子键越强。
(2)阴阳离子带电荷越多,离子键越强。
(3)离子键越强,物质熔、沸点越高,硬度越大。
1.初步掌握离子键的概念。
2.掌握形成离子键的微粒、条件、本质及键的强弱。
3.区分:用电子式表示物质用电子式表示离子化合物(离子键) 形成过程。
课堂小结
Cl
2
S
Br
[ ]-
2+
Ca
1.下列微粒电子式错误的是( )
A.氯原子
B.硫离子
C.溴离子
D.钙离子
B
课堂练习
2+
Ca
Cl
[ ]-
2
F
[ ]-
K+
2+
Mg
[ ]
O
[ ]
2
S
[ ]
2
Na+
Na+
2.下列化合物电子式书写正确的是( )
A.
B.
C.
D.
D
3.下列说法中正确的是 ( )
(A)两个原子或多个原子之间的相互作用叫做化学键
(B)阴阳离子间通过静电引力而形成的化学键叫做离子键
(C)只有金属元素和非金属元素化合时才能形成离子键
(D)大多数的盐、碱和低价金属氧化物中含有离子键
D
(A)两个原子或多个原子之间的相互作用叫做化学键
(B)阴阳离子间通过静电引力而形成的化学键叫做离子键
(C)只有金属元素和非金属元素化合时才能形成离子键
应指相邻的两个或多个原子,强烈的相互作用
静电引力应改为静电作用,它包括引力和斥力。
铵根离子和和酸根离子(或活泼非金属元素离子)也可形成离子键。
最外层电子
在化学反应中,一般是原子的最外层电子发生变化,所以电子式只标明最外层电子。
看
观
谢
谢
