3.1.2 氯气的性质及应用 课件(共44张PPT) 2023-2024学年高一化学苏教版(2029)必修第一册
文档属性
| 名称 | 3.1.2 氯气的性质及应用 课件(共44张PPT) 2023-2024学年高一化学苏教版(2029)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 17.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-21 15:48:09 | ||
图片预览











文档简介
(共44张PPT)
必 修 一
学
化
J
S
专题3 从海水中获得的化学物质
第一单元 氯气及氯的化合物
2 氯气的性质及其应用
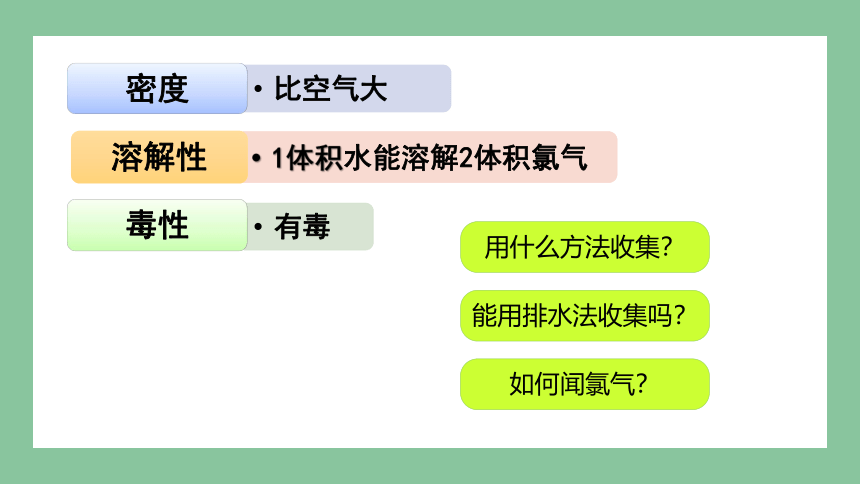
一、Cl2的物理性质
用什么方法收集?
能用排水法收集吗?
如何闻氯气?
如何闻气体?
用手在集气瓶口轻轻煽动,仅使极少量的气体飘进鼻孔。
1.下列有关氯气的叙述中不正确的是( )
A.氯气是一种黄绿色、有刺激性气味的气体
B.氯气、液氯和氯水是同一种物质
C.氯气能溶于水
D.氯气是一种有毒气体
B
课堂练习
氯气:气体。
液氯:液态氯,氯气在降温加压条件下液化。
氯水:氯气溶解于水,是混合物。
氯原子结构
最外层7个电子,易得电子,形成8电子稳定结构。
结构决定性质
1.与金属单质反应
(1)与 Cu(铜)反应
现象
红热的铜丝在氯气中剧烈燃烧,产生棕黄色的烟(氯化铜 CuCl2)
二、Cl2的化学性质
加少量水时(浓度大):溶液呈绿色
加多量水时(浓度小):溶液呈蓝色
Cu + Cl2 === CuCl2
点燃
化学方程式
(2)与 Fe(铁)反应
现象
红热的铁丝在氯气中剧烈燃烧,产生棕褐色的烟(氯化铁FeCl3)
加水时:溶液呈棕黄色
常温下,干燥的Cl2不与Fe反应,液氯可用钢瓶贮存。
注意
化学方程式
2Fe + 3Cl2 === 2FeCl3
点燃
(3)与 Na(钠)反应
现象
黄色火焰,生成大量白烟(氯化钠NaCl)
加水时:溶液呈无色
[小结] 氯气不但与铜、铁、钠反应,而且能与金属镁、铝等几乎所有的金属发生反应,并且生成化合价为最高价的金属氯化物。
化学方程式
2Na + Cl2 === 2NaCl
点燃
2.下列化合物中,不能通过单质间化合直接制取的是( )
A.FeCl3 B.CuCl2
C.HCl D.FeCl2
D
课堂练习
Cl2具有强氧化性,与变价金属反应生成高价金属氯化物,故Cl2与Fe反应得到的是FeCl3,而不是FeCl2。
① 点燃
二、Cl2的化学性质
2.与非金属反应
(1)与 H2(氢气)反应
纯净的氢气在氯气中安静的燃烧,发出苍白色的火焰,瓶口有白雾。
现象
工业上,采用在点燃条件制取氯化氢,然后溶于水制得盐酸。
化学方程式
H2 + Cl2 === 2HCl
点燃
② 光照
将氢气与氯气先混合后,经强光照射,发生爆炸,并在空气中跟水蒸气结合出现白雾。
现象
化学方程式
H2 + Cl2 === 2HCl
光照
为什么同样是氢气和氯气反应,表现出的现象却不同呢?
在点燃条件下,氢气从导管中导出,与氯气的接触面积很小。
在光照条件下,氢气和氯气充分混合,接触面积很大。
接触面积越大,反应越剧烈。
问题讨论
自来水用氯气消毒
游泳池用氯气消毒
氯气能溶解于水,在常温下,1体积的水能够溶解约2体积的氯气。
氯气的水溶液叫做氯水。
氯水成分探究:
【探究实验 1】观察氯水的颜色
现象:氯水呈浅黄绿色
结论一:氯水中有Cl2分子
问:氯水仅仅是氯气单纯地溶解于水(只存在氯分子和水分子)吗?
【探究实验 2】在试管中滴入几滴新制氯水,再滴入几滴硝酸银溶液和两滴稀硝酸,观察现象。
现象:产生不溶于稀硝酸的白色沉淀
结论二:氯水中有Cl-
AgCl
【探究实验 3】用玻璃棒蘸取新制氯水滴在PH试纸上。观察现象。
现象:PH试纸先变红,后褪色
结论三:氯水中有 H+ 和有漂白性的“?”
问:使PH试纸褪色的“?”是Cl2吗?
【探究实验 4】将干燥的氯气分别通入放有干燥有色布条和湿润的有色布条的广口瓶中,观察实验现象。
现象:干燥布条不褪色,湿润的布条褪色
结论四:Cl2无漂白性,Cl2遇水新生成一种有漂白性的物质
实验 结论
观察氯水颜色 氯水中有Cl2分子
氯水中加硝酸银、稀硝酸 氯水中有Cl -
氯水滴在PH试纸上 氯水中有H+及另一种新生成的具有漂白性物质
氯气通向干燥有色布条及湿润有色布条
探究实验小结:
结论:氯水成分复杂,说明氯气通入水中不是单纯的溶解,还发生了化学反应。
试写出氯气与水的反应方程式
3.与 H2O(水)反应
现象
溶液呈浅黄绿色
二、Cl2的化学性质
化学方程式
(次氯酸)
Cl2 + H2O HCl + HClO
Cl2 + H2O HCl + HClO
HClO H+ + ClO-
HCl = H+ + Cl-
Cl2、H2O、HClO、H+、Cl-、ClO-、HO-
新制氯水中存在哪些微粒?
问题讨论
a) 不稳定性:2 HClO HCl+O2↑
b) 强氧化性:漂白、 杀菌消毒
C) 弱酸性:酸性小于碳酸
光照
[思考] HClO有什么用途?
答:HClO用于杀菌消毒,漂白织物。
HClO的性质
次氯酸见光分解,氯水逐渐转化为盐酸,氧化性减弱。
[思考] 氯水能长久保存吗?
答:不能,现用现制。短时间保存:棕色细口瓶
自来水常用液氯消毒。为什么刚放出的自来水不能养金鱼,而将自来水在阳光下晒几小时就可以养金鱼了?
液氯、新制氯水、久置氯水的比较
液氯 新制氯水 久置氯水
分类
颜色
酸性
漂白性
纯净物
混合物
混合物
黄绿色
浅黄绿色
无色
无
有
无
无
有
有
4.与碱溶液反应
二、Cl2的化学性质
Cl2 + 2NaOH = NaCl + NaClO + H2O
——尾气吸收
(1)与 NaOH(氢氧化钠)溶液反应
(2)与石灰乳 Ca(OH)2 反应
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
——制取漂白粉
漂白粉
失效的原理:2HClO 2HCl+O2↑
有效成份: Ca(ClO)2
主要成份: CaCl2 和 Ca(ClO)2
制取原理:2Cl2 + 2Ca(OH)2 CaCl2 + Ca(ClO)2 + 2H2O
使用原理: Ca(ClO)2 + CO2 + H2O CaCO3↓+ 2HClO
光照
保存方法:密封保存,放在阴凉干燥处
是合成塑料、橡胶、人造纤维、
农药和药品的重要原料
制取漂白剂
制取盐酸
作消毒剂
氯气
三、氯气的用途
一. 氯气的物理性质
二. 氯气的化学性质
氯气是一种密度比空气大的、能溶于水的、有刺激性气味的黄绿色有毒气体。
1.与金属单质反应
Cu + Cl2 ==== CuCl2
点燃
2Fe + 3Cl2 ==== 2FeCl3
点燃
2Na + Cl2 ==== 2NaCl
点燃
课堂小结
3.与水反应
4.与碱反应
Cl2 + 2NaOH = NaCl + NaClO + H2O
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
Cl2 + H2O HCl + HClO
新制氯水中存在的微粒:Cl2、H2O、HClO、H+、Cl-、ClO-
2.与非金属单质反应
H2 + Cl2 ==== 2HCl
点燃
三. 氯气的用途
制取盐酸,制备漂白剂,制作消毒剂,合成塑料、橡胶、农药和药品等
漂白粉使用原理:
Ca(ClO)2 + CO2 + H2O = CaCO3↓+ 2HClO
3. 氯气泄露通常可采取的防御办法是( )
①人躲到低洼的地方去 ②人躲到较高的地方去
③多饮豆浆和牛奶 ④用沾有肥皂水的软布蒙面
⑤用尿液浸泡衣物蒙面
A. ① ③ B. ② ③ ④ C. ② ③ ⑤ D. ② ④ ⑤
D
4. 下列说法正确的是( )
A. 氯气以液态形式存在时可称作氯水或液氯
B. Cl2有毒,Cl-也有毒
C. Cl2和Cl-都是黄绿色
D. 红热的铜丝在氯气中燃烧,生成棕黄色的固体CuCl2
D
5. 下列关于氯气的叙述不正确的是( )
A. 钠在氯气中燃烧产生白色的烟
B. 红热的铜丝可以在氯气中燃烧,产生棕黄色的烟
C. 纯净的氢气可以在氯气中安静地燃烧,发出苍白色火焰
D. 氯气可用于漂白,这是氯气的漂白作用
D
看
观
谢
谢
必 修 一
学
化
J
S
专题3 从海水中获得的化学物质
第一单元 氯气及氯的化合物
2 氯气的性质及其应用
一、Cl2的物理性质
用什么方法收集?
能用排水法收集吗?
如何闻氯气?
如何闻气体?
用手在集气瓶口轻轻煽动,仅使极少量的气体飘进鼻孔。
1.下列有关氯气的叙述中不正确的是( )
A.氯气是一种黄绿色、有刺激性气味的气体
B.氯气、液氯和氯水是同一种物质
C.氯气能溶于水
D.氯气是一种有毒气体
B
课堂练习
氯气:气体。
液氯:液态氯,氯气在降温加压条件下液化。
氯水:氯气溶解于水,是混合物。
氯原子结构
最外层7个电子,易得电子,形成8电子稳定结构。
结构决定性质
1.与金属单质反应
(1)与 Cu(铜)反应
现象
红热的铜丝在氯气中剧烈燃烧,产生棕黄色的烟(氯化铜 CuCl2)
二、Cl2的化学性质
加少量水时(浓度大):溶液呈绿色
加多量水时(浓度小):溶液呈蓝色
Cu + Cl2 === CuCl2
点燃
化学方程式
(2)与 Fe(铁)反应
现象
红热的铁丝在氯气中剧烈燃烧,产生棕褐色的烟(氯化铁FeCl3)
加水时:溶液呈棕黄色
常温下,干燥的Cl2不与Fe反应,液氯可用钢瓶贮存。
注意
化学方程式
2Fe + 3Cl2 === 2FeCl3
点燃
(3)与 Na(钠)反应
现象
黄色火焰,生成大量白烟(氯化钠NaCl)
加水时:溶液呈无色
[小结] 氯气不但与铜、铁、钠反应,而且能与金属镁、铝等几乎所有的金属发生反应,并且生成化合价为最高价的金属氯化物。
化学方程式
2Na + Cl2 === 2NaCl
点燃
2.下列化合物中,不能通过单质间化合直接制取的是( )
A.FeCl3 B.CuCl2
C.HCl D.FeCl2
D
课堂练习
Cl2具有强氧化性,与变价金属反应生成高价金属氯化物,故Cl2与Fe反应得到的是FeCl3,而不是FeCl2。
① 点燃
二、Cl2的化学性质
2.与非金属反应
(1)与 H2(氢气)反应
纯净的氢气在氯气中安静的燃烧,发出苍白色的火焰,瓶口有白雾。
现象
工业上,采用在点燃条件制取氯化氢,然后溶于水制得盐酸。
化学方程式
H2 + Cl2 === 2HCl
点燃
② 光照
将氢气与氯气先混合后,经强光照射,发生爆炸,并在空气中跟水蒸气结合出现白雾。
现象
化学方程式
H2 + Cl2 === 2HCl
光照
为什么同样是氢气和氯气反应,表现出的现象却不同呢?
在点燃条件下,氢气从导管中导出,与氯气的接触面积很小。
在光照条件下,氢气和氯气充分混合,接触面积很大。
接触面积越大,反应越剧烈。
问题讨论
自来水用氯气消毒
游泳池用氯气消毒
氯气能溶解于水,在常温下,1体积的水能够溶解约2体积的氯气。
氯气的水溶液叫做氯水。
氯水成分探究:
【探究实验 1】观察氯水的颜色
现象:氯水呈浅黄绿色
结论一:氯水中有Cl2分子
问:氯水仅仅是氯气单纯地溶解于水(只存在氯分子和水分子)吗?
【探究实验 2】在试管中滴入几滴新制氯水,再滴入几滴硝酸银溶液和两滴稀硝酸,观察现象。
现象:产生不溶于稀硝酸的白色沉淀
结论二:氯水中有Cl-
AgCl
【探究实验 3】用玻璃棒蘸取新制氯水滴在PH试纸上。观察现象。
现象:PH试纸先变红,后褪色
结论三:氯水中有 H+ 和有漂白性的“?”
问:使PH试纸褪色的“?”是Cl2吗?
【探究实验 4】将干燥的氯气分别通入放有干燥有色布条和湿润的有色布条的广口瓶中,观察实验现象。
现象:干燥布条不褪色,湿润的布条褪色
结论四:Cl2无漂白性,Cl2遇水新生成一种有漂白性的物质
实验 结论
观察氯水颜色 氯水中有Cl2分子
氯水中加硝酸银、稀硝酸 氯水中有Cl -
氯水滴在PH试纸上 氯水中有H+及另一种新生成的具有漂白性物质
氯气通向干燥有色布条及湿润有色布条
探究实验小结:
结论:氯水成分复杂,说明氯气通入水中不是单纯的溶解,还发生了化学反应。
试写出氯气与水的反应方程式
3.与 H2O(水)反应
现象
溶液呈浅黄绿色
二、Cl2的化学性质
化学方程式
(次氯酸)
Cl2 + H2O HCl + HClO
Cl2 + H2O HCl + HClO
HClO H+ + ClO-
HCl = H+ + Cl-
Cl2、H2O、HClO、H+、Cl-、ClO-、HO-
新制氯水中存在哪些微粒?
问题讨论
a) 不稳定性:2 HClO HCl+O2↑
b) 强氧化性:漂白、 杀菌消毒
C) 弱酸性:酸性小于碳酸
光照
[思考] HClO有什么用途?
答:HClO用于杀菌消毒,漂白织物。
HClO的性质
次氯酸见光分解,氯水逐渐转化为盐酸,氧化性减弱。
[思考] 氯水能长久保存吗?
答:不能,现用现制。短时间保存:棕色细口瓶
自来水常用液氯消毒。为什么刚放出的自来水不能养金鱼,而将自来水在阳光下晒几小时就可以养金鱼了?
液氯、新制氯水、久置氯水的比较
液氯 新制氯水 久置氯水
分类
颜色
酸性
漂白性
纯净物
混合物
混合物
黄绿色
浅黄绿色
无色
无
有
无
无
有
有
4.与碱溶液反应
二、Cl2的化学性质
Cl2 + 2NaOH = NaCl + NaClO + H2O
——尾气吸收
(1)与 NaOH(氢氧化钠)溶液反应
(2)与石灰乳 Ca(OH)2 反应
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
——制取漂白粉
漂白粉
失效的原理:2HClO 2HCl+O2↑
有效成份: Ca(ClO)2
主要成份: CaCl2 和 Ca(ClO)2
制取原理:2Cl2 + 2Ca(OH)2 CaCl2 + Ca(ClO)2 + 2H2O
使用原理: Ca(ClO)2 + CO2 + H2O CaCO3↓+ 2HClO
光照
保存方法:密封保存,放在阴凉干燥处
是合成塑料、橡胶、人造纤维、
农药和药品的重要原料
制取漂白剂
制取盐酸
作消毒剂
氯气
三、氯气的用途
一. 氯气的物理性质
二. 氯气的化学性质
氯气是一种密度比空气大的、能溶于水的、有刺激性气味的黄绿色有毒气体。
1.与金属单质反应
Cu + Cl2 ==== CuCl2
点燃
2Fe + 3Cl2 ==== 2FeCl3
点燃
2Na + Cl2 ==== 2NaCl
点燃
课堂小结
3.与水反应
4.与碱反应
Cl2 + 2NaOH = NaCl + NaClO + H2O
2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
Cl2 + H2O HCl + HClO
新制氯水中存在的微粒:Cl2、H2O、HClO、H+、Cl-、ClO-
2.与非金属单质反应
H2 + Cl2 ==== 2HCl
点燃
三. 氯气的用途
制取盐酸,制备漂白剂,制作消毒剂,合成塑料、橡胶、农药和药品等
漂白粉使用原理:
Ca(ClO)2 + CO2 + H2O = CaCO3↓+ 2HClO
3. 氯气泄露通常可采取的防御办法是( )
①人躲到低洼的地方去 ②人躲到较高的地方去
③多饮豆浆和牛奶 ④用沾有肥皂水的软布蒙面
⑤用尿液浸泡衣物蒙面
A. ① ③ B. ② ③ ④ C. ② ③ ⑤ D. ② ④ ⑤
D
4. 下列说法正确的是( )
A. 氯气以液态形式存在时可称作氯水或液氯
B. Cl2有毒,Cl-也有毒
C. Cl2和Cl-都是黄绿色
D. 红热的铜丝在氯气中燃烧,生成棕黄色的固体CuCl2
D
5. 下列关于氯气的叙述不正确的是( )
A. 钠在氯气中燃烧产生白色的烟
B. 红热的铜丝可以在氯气中燃烧,产生棕黄色的烟
C. 纯净的氢气可以在氯气中安静地燃烧,发出苍白色火焰
D. 氯气可用于漂白,这是氯气的漂白作用
D
看
观
谢
谢
