5.3.2 晶体与非晶体 课件(共33张PPT) 2023-2024学年高一化学苏教版(2029)必修第一册
文档属性
| 名称 | 5.3.2 晶体与非晶体 课件(共33张PPT) 2023-2024学年高一化学苏教版(2029)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 7.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-21 00:00:00 | ||
图片预览










文档简介
(共33张PPT)
必 修 一
学
化
J
S
专题5 微观结构与物质的多样性
第三单元 从微粒结构看物质的多样性
第2课时 晶体与非晶体
常见的晶体
雪花
紫水晶
石英
食盐
干冰
钻石
常见的晶体
思考:根据你所知道的相关晶体的知识,观察这些晶体在外观上有什么特点?它们的物理性质(如硬度、熔点、沸点、导电性等)有什么特点?
这些晶体都有规则的几何外形,但性质有很大的差异。用X射线进行晶体的衍射实验时发现,在晶体内部,构成晶体的微粒在空间呈有规则的重复排列。晶体规则的几何外形是其内部构成微粒有规则排列的结果。晶体有固定的熔、沸点,构成微粒有原子、分子、离子。
晶体
1、定义:
具有规则几何外形的固体
2、构成微粒:
原子、分子、离子
根据晶体的组成微粒的不同,把晶体分成了离子晶体、分子晶体、原子晶体和金属晶体。
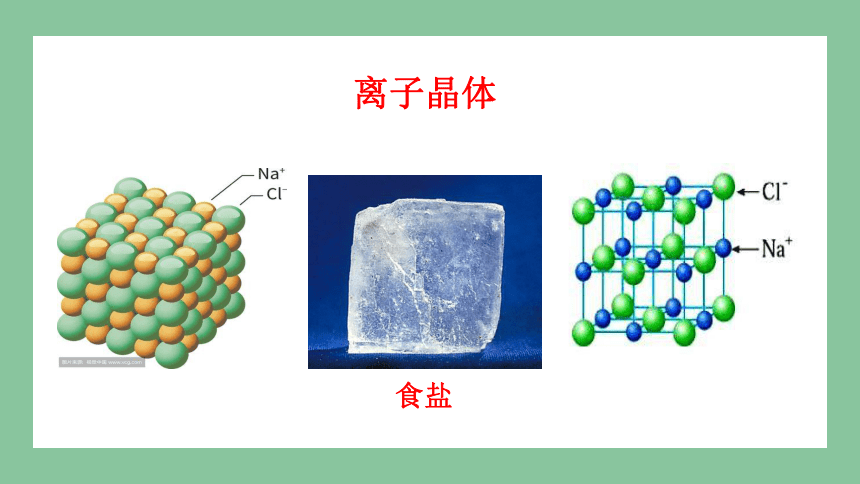
食盐
离子晶体
思考:
(1)氯化钠属于哪一类化合物,其晶体中有没有单个
氯化钠分子?
(2)组成微粒是什么,微粒间有什么作用力?
(3)离子晶体物理性质有什么特点
1、定义:
2、微粒:
3、微粒间作用力:
4、物理性质:
阴、阳离子按一定方式有规则地排列形成的晶体叫作离子晶体。
阴、阳离子
离子键
熔沸点较高,硬度较大。水溶液或者熔融状态下均导电。
离子晶体
思考:哪些类别的物质属于离子晶体呢?
强碱、部分金属氧化物、大部分盐类,即离子化合物
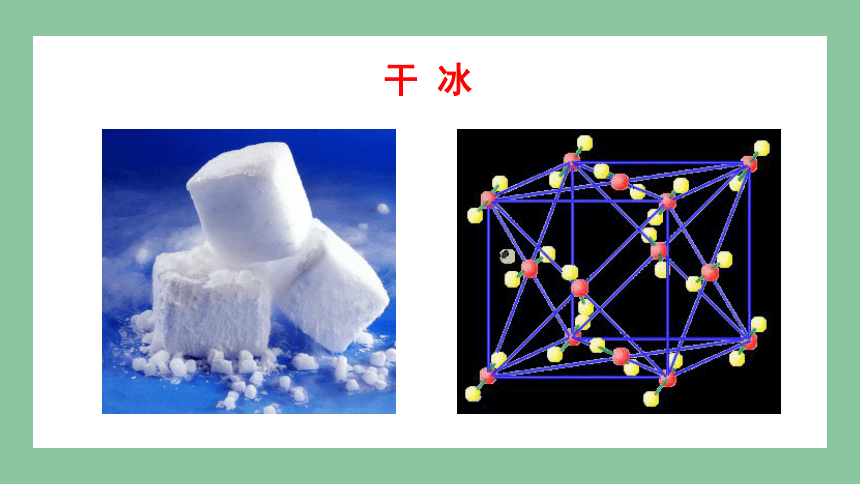
干 冰
干冰
思考:二氧化碳,在常温和压强为6079.8千帕压力下,冷凝成无色的液体,再在低压下迅速蒸发,便凝结成一块块冰雪状固体物质,其温度是零下78.5℃,即干冰.干冰也是一种晶体,那么组成微粒是什么,微粒间有什么样的作用力,有哪些性质呢
分子晶体
1、定义:
2、微粒:
3、作用力:
由分子构成的物质所形成的晶体属于分子晶体
分子
分子间作用力(或范德华力)
4、物理性质:
分子间的作用力很弱,分子晶体具有较低的熔点、沸点,硬度小、易挥发,许多物质在常温下呈气态或液态。
同类型分子的晶体,其熔、沸点随相对分子量的增加而升高。例如卤素单质的熔、沸点按F2、Cl2、Br2、I2顺序递增;但HF、H2O、NH3、CH3CH2OH等分子间,除存在范德华力外,还有氢键的作用力,它们的熔沸点较高。在固态和熔融状态时都不导电。
思考:水晶、紫水晶和钻石(金刚石)的主要成分都是二氧化硅,钻石(金刚石)的成分是碳,这些固体物质硬度都很大,熔、沸点很高,不同于离子晶体和分子晶体,那么,这些固体又属于哪一类晶体,组成微粒是什么,微粒间的作用力是怎么样的呢?
水晶
紫水晶
石英
钻石(金刚石)
水晶、石英的主要成分都是SiO2
水晶的结构
SiO2和金刚石的微观结构
钻石(金刚石)的结构
金刚石晶体中每个碳原子与相邻的四个碳原子以共价健结合,形成空间网状结构。
原子晶体
相邻原子之间只通过强烈的共价键结合而成的空间网状结构的晶体叫做原子晶体。
原子
共价键
1、定义:
2、微粒:
3、作用力:
高熔点、沸点和硬度,在通常情况下不导电,热的不良导体。原子晶体不导电、不易溶于任何溶剂,化学性质十分稳定。
4、物理性质:
金
银
铜
常见的几种金属晶体
铝
铁
水银(汞)
常见的几种金属晶体
金属晶体
1、定义:金属原子通过金属键形成的晶体
2、微粒:金属原子
3、作用力:金属键
4、物理性质:容易导电、导热、有延展性、有金属光泽;
熔沸点差距很大。
晶体 氯化钠 金刚石 二氧化硅 干冰
熔点/℃ 801 >3 550 1 723 -78
硬度 较硬 很硬 硬而脆 软
晶体类型 离子晶体 原子晶体 分子晶体
晶体特性 熔点较高硬度较大 熔点很高硬度很大 熔点较低硬度较小
课堂小结
1.晶体类型判断方法:
(1)分析微粒种类:离子、分子、原子。
(2)微粒间的相互作用力:离子键、分子间作用力、共价键 金属键。
2.物质类别与晶体类型
(1)离子化合物(强碱和大多数盐)都是离子晶体;
(2)共价分子(单质或化合物)是分子晶体;
(3)常见的原子晶体,如二氧化硅、碳化硅、金刚石、晶体硅等。
1、定义:内部原子或分子的排列呈现杂乱无章的分布状态的固体物质。
2、结构特点:没有一定规则的外形。
3、物理性质:没有固定的熔点
非晶体
4、举例:石蜡、玻璃、橡胶、松香、沥青等
玻璃
沥青
松香
1.下列说法中正确的是( )
A.SO2、SO3互为同分异构体
B.碘晶体、碘蒸气是同素异形体
C.168O与188O是同素异形体
D.同素异形体是同种元素形成的不同单质
D
课堂练习
2.下列说法中正确的是( )
A.氨化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物
B.碘晶体受热转变成碘蒸气,吸收的热量用于克服碘原子间的作用力
C.氧气和臭氧是同分异构体
D.有机化合物CH3—CH2—NO2,和H2N—CH2—COOH是同分异构体
D
看
观
谢
谢
必 修 一
学
化
J
S
专题5 微观结构与物质的多样性
第三单元 从微粒结构看物质的多样性
第2课时 晶体与非晶体
常见的晶体
雪花
紫水晶
石英
食盐
干冰
钻石
常见的晶体
思考:根据你所知道的相关晶体的知识,观察这些晶体在外观上有什么特点?它们的物理性质(如硬度、熔点、沸点、导电性等)有什么特点?
这些晶体都有规则的几何外形,但性质有很大的差异。用X射线进行晶体的衍射实验时发现,在晶体内部,构成晶体的微粒在空间呈有规则的重复排列。晶体规则的几何外形是其内部构成微粒有规则排列的结果。晶体有固定的熔、沸点,构成微粒有原子、分子、离子。
晶体
1、定义:
具有规则几何外形的固体
2、构成微粒:
原子、分子、离子
根据晶体的组成微粒的不同,把晶体分成了离子晶体、分子晶体、原子晶体和金属晶体。
食盐
离子晶体
思考:
(1)氯化钠属于哪一类化合物,其晶体中有没有单个
氯化钠分子?
(2)组成微粒是什么,微粒间有什么作用力?
(3)离子晶体物理性质有什么特点
1、定义:
2、微粒:
3、微粒间作用力:
4、物理性质:
阴、阳离子按一定方式有规则地排列形成的晶体叫作离子晶体。
阴、阳离子
离子键
熔沸点较高,硬度较大。水溶液或者熔融状态下均导电。
离子晶体
思考:哪些类别的物质属于离子晶体呢?
强碱、部分金属氧化物、大部分盐类,即离子化合物
干 冰
干冰
思考:二氧化碳,在常温和压强为6079.8千帕压力下,冷凝成无色的液体,再在低压下迅速蒸发,便凝结成一块块冰雪状固体物质,其温度是零下78.5℃,即干冰.干冰也是一种晶体,那么组成微粒是什么,微粒间有什么样的作用力,有哪些性质呢
分子晶体
1、定义:
2、微粒:
3、作用力:
由分子构成的物质所形成的晶体属于分子晶体
分子
分子间作用力(或范德华力)
4、物理性质:
分子间的作用力很弱,分子晶体具有较低的熔点、沸点,硬度小、易挥发,许多物质在常温下呈气态或液态。
同类型分子的晶体,其熔、沸点随相对分子量的增加而升高。例如卤素单质的熔、沸点按F2、Cl2、Br2、I2顺序递增;但HF、H2O、NH3、CH3CH2OH等分子间,除存在范德华力外,还有氢键的作用力,它们的熔沸点较高。在固态和熔融状态时都不导电。
思考:水晶、紫水晶和钻石(金刚石)的主要成分都是二氧化硅,钻石(金刚石)的成分是碳,这些固体物质硬度都很大,熔、沸点很高,不同于离子晶体和分子晶体,那么,这些固体又属于哪一类晶体,组成微粒是什么,微粒间的作用力是怎么样的呢?
水晶
紫水晶
石英
钻石(金刚石)
水晶、石英的主要成分都是SiO2
水晶的结构
SiO2和金刚石的微观结构
钻石(金刚石)的结构
金刚石晶体中每个碳原子与相邻的四个碳原子以共价健结合,形成空间网状结构。
原子晶体
相邻原子之间只通过强烈的共价键结合而成的空间网状结构的晶体叫做原子晶体。
原子
共价键
1、定义:
2、微粒:
3、作用力:
高熔点、沸点和硬度,在通常情况下不导电,热的不良导体。原子晶体不导电、不易溶于任何溶剂,化学性质十分稳定。
4、物理性质:
金
银
铜
常见的几种金属晶体
铝
铁
水银(汞)
常见的几种金属晶体
金属晶体
1、定义:金属原子通过金属键形成的晶体
2、微粒:金属原子
3、作用力:金属键
4、物理性质:容易导电、导热、有延展性、有金属光泽;
熔沸点差距很大。
晶体 氯化钠 金刚石 二氧化硅 干冰
熔点/℃ 801 >3 550 1 723 -78
硬度 较硬 很硬 硬而脆 软
晶体类型 离子晶体 原子晶体 分子晶体
晶体特性 熔点较高硬度较大 熔点很高硬度很大 熔点较低硬度较小
课堂小结
1.晶体类型判断方法:
(1)分析微粒种类:离子、分子、原子。
(2)微粒间的相互作用力:离子键、分子间作用力、共价键 金属键。
2.物质类别与晶体类型
(1)离子化合物(强碱和大多数盐)都是离子晶体;
(2)共价分子(单质或化合物)是分子晶体;
(3)常见的原子晶体,如二氧化硅、碳化硅、金刚石、晶体硅等。
1、定义:内部原子或分子的排列呈现杂乱无章的分布状态的固体物质。
2、结构特点:没有一定规则的外形。
3、物理性质:没有固定的熔点
非晶体
4、举例:石蜡、玻璃、橡胶、松香、沥青等
玻璃
沥青
松香
1.下列说法中正确的是( )
A.SO2、SO3互为同分异构体
B.碘晶体、碘蒸气是同素异形体
C.168O与188O是同素异形体
D.同素异形体是同种元素形成的不同单质
D
课堂练习
2.下列说法中正确的是( )
A.氨化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物
B.碘晶体受热转变成碘蒸气,吸收的热量用于克服碘原子间的作用力
C.氧气和臭氧是同分异构体
D.有机化合物CH3—CH2—NO2,和H2N—CH2—COOH是同分异构体
D
看
观
谢
谢
