人教版 高中化学 选择性必修2 2.1.1 共价键(共35张PPT)
文档属性
| 名称 | 人教版 高中化学 选择性必修2 2.1.1 共价键(共35张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 730.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 08:28:16 | ||
图片预览










文档简介
(共35张PPT)
汇报人:XXX
XX月XX日
第一课时 共价键的极性
人教版高中化学选择必修二
素养目标 1.掌握共价键可分为极性共价键和非极性共价键。
2.区分极性分子和非极性分子,了解分子极性与分子中键的极性及分子空间结构密切相关。
知识铺垫
必备知识
正误判断
1.根据成键元素的原子是否相同即共用电子对是否发生偏移,将共价键分为极性键和非极性键。
2.CO2分子中所含共价键是极性键(填“极性键”或“非极性键”),分子的空间结构是直线形;H2O分子中所含的共价键是极性键(填“极性键”或“非极性键”),分子空间结构是角形(或V形);H2O2分子中所含的共价键有极性键和非极性键。
知识铺垫
必备知识
正误判断
1.键的极性和分子的极性
(1)键的极性。
共价键 分类 极性共价键 非极性共价键
成键原子 不同元素的原子 同种元素的原子
共用电子对 发生偏移 不发生偏移
成键原子 的电性 电负性较小的原子呈正电性(δ+), 电负性较大的原子呈负电性(δ-) 电中性
知识铺垫
必备知识
正误判断
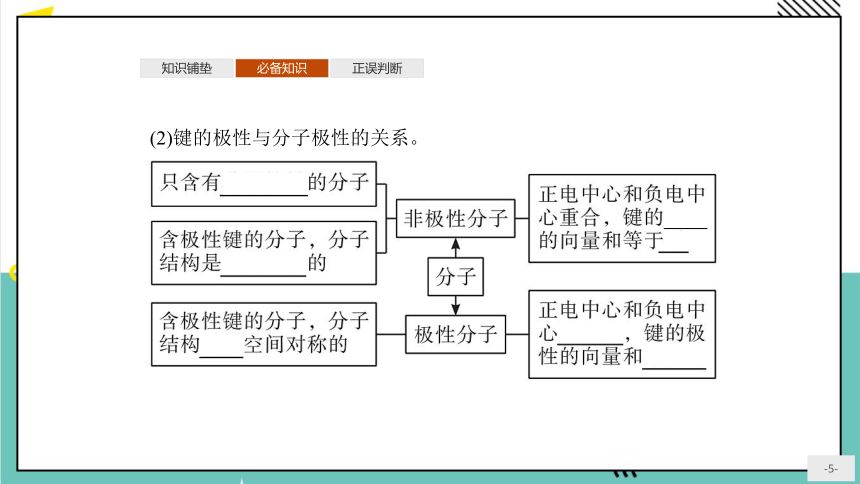
(2)键的极性与分子极性的关系。
知识铺垫
必备知识
正误判断
【微思考】含有极性键的分子一定是极性分子吗 含有非极性键的分子一定是非极性分子吗
提示:不一定。含有极性键的分子,若分子结构是空间对称的,则为非极性分子,否则是极性分子。H2O2分子中存在非极性键,但H2O2分子为极性分子。
知识铺垫
必备知识
正误判断
2.键的极性对化学性质的影响
羧酸是一类含羧基(—COOH)的有机酸,羧基可电离出H+而呈酸性。
三氟乙酸的酸性强于三氯乙酸,这是由于氟的电负性大于氯的电负性,C—F键的极性大于C—Cl键,导致羧基中的O—H键的极性更大,更易电离出氢离子。据此,酸性关系:CCl3COOH>CHCl2COOH>CH2ClCOOH(填“>”“=”或“<”)。
烃基(符号R—)是推电子基团,烃基越长推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。所以酸性:甲酸>乙酸>丙酸(填“>”“=”或“<”)。
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
知识铺垫
必备知识
正误判断
1.极性分子中不可能含有非极性键。 ( )
2.离子化合物中不可能含有非极性键。( )
3.非极性分子中不可能含有极性键。( )
4.极性分子中一定含有极性键。( )
5.H2O、CO2、CH4都是非极性分子。( )
答案:1.× 2.× 3.× 4.√ 5.×
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
键的极性与分子的极性
问题探究
1.已知H2O2分子的空间结构可在二面角中表示,如图所示:
(1)分析H2O2分子中共价键的种类有哪些
提示:H2O2分子中H—O键为极性共价键,O—O键为非极性共价键。
(2)H2O2分子中正电中心和负电中心是否重合 H2O2属于极性分子还是非极性分子
提示:不重合。H2O2属于极性分子。
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
2.从哪些方面可以判断键的极性
提示:可从组成元素、电子对偏移、成键原子电负性大小等方面进行判断。
3.如何根据多原子分子的组成及空间结构确定分子的极性
提示:多原子分子,如果为单质,则一般为非极性分子;如果为化合物,则看分子的空间结构,若空间结构对称则为非极性分子,若空间结构不对称则为极性分子。
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
深化拓展
1.键的极性的判断方法
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
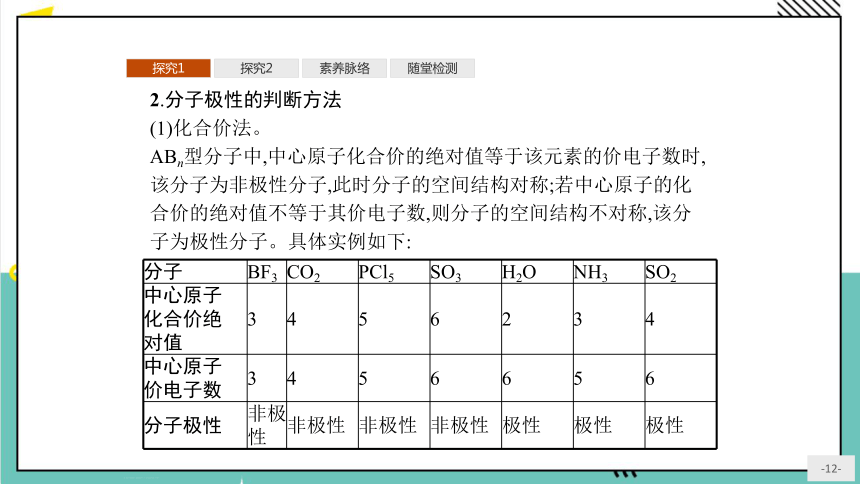
2.分子极性的判断方法
(1)化合价法。
ABn型分子中,中心原子化合价的绝对值等于该元素的价电子数时,该分子为非极性分子,此时分子的空间结构对称;若中心原子的化合价的绝对值不等于其价电子数,则分子的空间结构不对称,该分子为极性分子。具体实例如下:
分子 BF3 CO2 PCl5 SO3 H2O NH3 SO2
中心原子 化合价绝 对值 3 4 5 6 2 3 4
中心原子 价电子数 3 4 5 6 6 5 6
分子极性 非极性 非极性 非极性 非极性 极性 极性 极性
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
(2)根据所含共价键的类型及分子的空间结构判断。
分子类型 键的 极性 分子空间 结构 分子极性 代表物
双原子 分子 A2 非极性键 直线形(对称) 非极性 H2、O2、
Cl2、N2等
AB 极性键 直线形(不对称) 极性 HF、HCl、CO、NO等
三原子 分子 A2B(或 AB2) 极性键 直线形(对称) 非极性 CO2、CS2
等(键角180°)
极性键 V形(不对称) 极性 H2O(键角105°)等
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
分子类型 键的 极性 分子空间 结构 分子极性 代表物
四原子 分子 AB3 极性键 平面三角 形(对称) 非极性 BF3、BCl3等
极性键 三角锥形 (不对称) 极性 NH3(键角107°)等
五原子 分子 AB4 极性键 正四面体 形(对称) 非极性 CH4、CCl4(键角
109°28')等
ABnC4-n (n<4且为整数) 极性键 四面体形 (不对称) 极性 CHCl3、CH2Cl2等
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
(3)根据中心原子最外层电子是否全部成键判断。
中心原子即其他原子围绕它成键的原子。分子中的中心原子最外层电子若全部参与成键,不存在孤电子对,此分子一般为非极性分子;分子中的中心原子最外层电子若未全部参与成键,存在孤电子对,此分子一般为极性分子。如:CH4、BF3、CO2等分子中的中心原子的最外层电子均全部参与成键,它们都是非极性分子;H2O、NH3、NF3等分子中的中心原子的最外层电子均未全部参与成键,它们都是极性分子。
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
素能应用
典例1下列关于粒子结构的描述不正确的是( )
A.H2S和NH3均是价电子总数为8的极性分子
B.HS-和HCl均是含1个极性键的18电子粒子
C.CH2Cl2和CCl4均是空间结构为四面体形的非极性分子
D.SO2和SO3中心原子的杂化轨道类型均为sp2,空间构型分别为V形、平面三角形
答案:C
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
解析:H2S分子中氢、硫原子间形成极性键,且空间结构不对称,属于极性分子;NH3分子中含有极性键,空间结构为三角锥形,正负电荷中心不重合,属于极性分子,A项正确。HS-和HCl都只含一个极性键,都具有18个电子,B项正确。CH2Cl2正负电荷的中心不重合,是极性分子,C项错误。SO2中硫原子形成两个σ键,孤电子对数为 ×(6-2×2)=1,价层电子对数为3,为sp2杂化,分子空间结构为V形;SO3分子中,中心原子硫原子最外层有6个电子,外围有三个原子,所以不含孤电子对,价层电子对数为σ键个数+孤电子对数=3+ ×(6-3×2)=3,为sp2杂化,SO3分子为平面三角形结构,D项正确。
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
规律总结 从以下两方面判断分子的极性:
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
变式训练1-1下列物质:①BeCl2 ②Ar ③白磷 ④BF3 ⑤NH3 ⑥H2O2,其中含极性键的非极性分子是( )
A.①④⑥ B.②③⑥
C.①④ D.①③④⑤
答案:C
解析:①BeCl2空间结构是直线形,Cl—Be—Cl是含极性键的非极性分子;②Ar为稀有气体,分子中不含化学键;③白磷分子式为P4,不含极性键,含有的是非极性键;④BF3是平面三角形结构,是极性键构成的非极性分子;⑤过氧化氢是由极性键和非极性键构成的极性分子。故C项符合题目要求。
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
变式训练1-2下列各组物质的分子中,都属于含极性键的非极性分子的是( )
A.CO2、H2S B.C2H4、CH4
C.Cl2、C2H2 D.NH3、HCl
答案:B
解析:两种不同原子之间的共价键具有极性,C项Cl2分子中无极性键。根据分子的空间结构可以判断A项中H2S,D项中NH3、HCl分子中正负电荷中心不重合,属于极性分子。故正确答案为B。
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
键的极性对物质化学性质的影响——以物质的酸性为例
问题探究
无机含氧酸的化学式可以用(HO)mXOn来表示(X代表成酸元素,n代表非羟基氧原子数,m代表—OH数),则n值越大,m值越小,该酸的酸性就越强。其原因是非羟基氧原子的吸电子效应使O—H键极性增强,更容易电离出H+。
问题思考:
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
(1)硫酸、磷酸的结构式分别为 , ,它们的酸性强弱是怎样的
提示:硫酸可写为(HO)2SO2,磷酸可写为(HO)3PO,n值分别是2、1,m值分别是2、3,由n值越大、m值越小,该酸的酸性就越强,可知硫酸的酸性强于磷酸。
(2)HClO3、H2SeO3、H2BeO2、HMnO4四种含氧酸中酸性最强的是哪种酸
提示:HClO3可写成(HO)ClO2,n=2;H2SeO3可写成(HO)2SeO,n=1;H2BeO2可写成(HO)2Be,n=0;HMnO4可写成(HO)MnO3,n=3,因此酸性最强的为HMnO4。
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
深化拓展
判断物质酸性强弱的方法
(1)根据元素周期律判断。
①同一主族元素的非金属氢化物的酸性从上到下逐渐增强,如HF②同一周期元素的非金属氢化物的酸性从左向右逐渐增强,如H2S③同一主族元素最高价氧化物对应水化物的酸性从上到下逐渐减弱,如HClO4>HBrO4>HIO4;HNO3>H3PO4;H2CO3>H2SiO3。
④同一周期元素最高价氧化物对应水化物的酸性从左向右逐渐增强,如H3PO4探究1
探究2
素养脉络
随堂检测
(2)根据元素化合价判断。
同一元素的含氧酸,中心原子的化合价越高,酸性越强。如H2SO4>H2SO3;HClO4>HClO3>HClO2>HClO。
(3)根据非羟基氧原子数判断。
(4)根据电离常数来判断。
如K(H3PO4)>K(HClO),酸性H3PO4>HClO;或依据pKa(pKa=-lg Ka)大小判断:pKa越小,酸性越强。
探究1
探究2
素养脉络
随堂检测
(5)根据化学反应判断。
如H2SO4+Na2SO3 === Na2SO4+H2O+SO2↑,
酸性:H2SO4>H2SO3。
H2O+CO2+Ca(ClO)2 === CaCO3↓+2HClO,
酸性:H2CO3>HClO。
探究1
探究2
素养脉络
随堂检测
(6)羧酸酸性强弱的判断。
①与羧基相连的烷基含碳原子数越多,羧酸酸性越弱。
如酸性HCOOH>CH3COOH>C2H5COOH。
因为烷基是推电子基团,烷基含碳原子越多,推电子效应越大,使O—H键极性越弱,越难电离出H+。
②与羧基相连的碳原子上连接有电负性大的原子时,羧酸的酸性增强。
如酸性CF3COOH>CCl3COOH>CHCl2COOH>CH2ClCOOH>CH3COOH。
因为电负性大的原子的吸电子作用,使O—H键的极性增强,更易电离出H+。
探究1
探究2
素养脉络
随堂检测
素能应用
典例2下列各组酸中,酸性依次增强的是( )
A.H2CO3、H2SiO3、H3PO4
B.HNO3、H3PO4、H2SO4
C.HI、HCl、H2S
D.HClO、HClO3、HClO4
答案:D
解析:将含氧酸写成通式:(HO)mROn,R相同,n值越大,酸性越强;再根据元素非金属性强弱进行判断。A项中由于非金属性:C>Si,故酸性:H2CO3>H2SiO3;B项中由于非金属性:N>P,故酸性:HNO3>H3PO4;C项中HCl是强酸,H2S是弱酸;D项可根据通式(HO)mClOn判断出非羟基氧原子数n值依次为0、2、3,从而得出酸性强弱关系。
探究1
探究2
素养脉络
随堂检测
变式训练2-1下列各组物质中,酸性由强到弱排列顺序错误的是( )
A.HClO4>H2SO4>H3PO4
B.HClO4>HClO3>HClO2
C.HClO>HBrO4>HIO4
D.H2SO4>H2SO3>H2CO3
答案:C
解析:元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,A项正确;无机含氧酸酸性强弱的判断:同一元素的含氧酸,该元素价态越高,酸性越强,B项正确;HClO中的氯不是最高价,C项错误;酸性:H2SO4(强酸)>H2SO3(中强酸)>H2CO3(弱酸),D项正确。
探究1
探究2
素养脉络
随堂检测
变式训练2-2(双选)下列物质的酸性强弱比较正确的是( )
A.CH3COOH>HCOOH
B.HCOOH>CH3COOH>CH3CH2COOH
C.HClO3D.CH2FCOOH>CH2ClCOOH>CH3COOH
答案:BD
解析:CH3—的推电子作用使CH3COOH酸性弱于HCOOH,A项错误;含碳原子数越多的烷基推电子作用越强,使O—H键极性越弱,导致相应羧酸的酸性减弱,所以B项正确;同一元素不同价态的含氧酸中非羟基氧原子越多,酸性越强,C项错误;由于吸电子能力F>Cl>H,故D项正确。
探究1
探究2
素养脉络
随堂检测
探究1
探究2
素养脉络
随堂检测
1.在下列物质中,分子中电荷空间分布对称的是( )
①CO2 ②CCl4 ③NH3 ④H2O ⑤HBr
A.①②④ B.②④⑤ C.③⑤ D.①②
答案:D
解析:在由三个以上原子形成的化合物分子中,空间结构对称的分子,其电荷的空间分布对称,如直线形的CO2、正四面体形的CCl4。
2.下列物质中,由极性键形成的非极性分子是( )
A.CO2 B.Br2 C.CaCl2 D.SO2
答案:A
解析:不同种元素形成的化合物中才可能含有极性键;在由三个以上原子形成的化合物分子中,空间结构对称的分子,才是非极性分子,如直线形的CO2。
探究1
探究2
素养脉络
随堂检测
3.无机含氧酸酸性的强弱规律之一为:成酸元素的化合价越高,酸性越强。下列说法正确的是( )
A.根据这一规律高氯酸是强酸
B.H3PO4的酸性比盐酸的酸性强
C.碳酸比亚硫酸的酸性强
D.硝酸与磷酸的酸性强度一样
答案:A
解析:一般认为,成酸元素的化合价越高其酸性越强。盐酸为非含氧酸,不适用此规律,B项错误;碳酸与亚硫酸、硝酸与磷酸均不是同一元素的含氧酸,不能用题述规律进行比较,C、D两项错误。
探究1
探究2
素养脉络
随堂检测
4.含氧酸的酸性强弱与酸中的非羟基氧原子数n有关,n越大,酸性越强。一般n=0为弱酸,n=1为中强酸,n=2为强酸,n=3为很强酸。根据实验事实可知硼酸(H3BO3)是弱酸,而亚磷酸(H3PO3)是中强酸。
(1)这两种酸的结构简式分别为 、 。
(2)亚磷酸是 元酸,它与过量NaOH溶液反应的化学方程式为 。
(3)次磷酸是一种一元酸,化学式为H3PO2,它的结构简式为 。
探究1
探究2
素养脉络
随堂检测
探究1
探究2
素养脉络
随堂检测
汇报人:XXX
XX月XX日
第一课时 共价键的极性
人教版高中化学选择必修二
素养目标 1.掌握共价键可分为极性共价键和非极性共价键。
2.区分极性分子和非极性分子,了解分子极性与分子中键的极性及分子空间结构密切相关。
知识铺垫
必备知识
正误判断
1.根据成键元素的原子是否相同即共用电子对是否发生偏移,将共价键分为极性键和非极性键。
2.CO2分子中所含共价键是极性键(填“极性键”或“非极性键”),分子的空间结构是直线形;H2O分子中所含的共价键是极性键(填“极性键”或“非极性键”),分子空间结构是角形(或V形);H2O2分子中所含的共价键有极性键和非极性键。
知识铺垫
必备知识
正误判断
1.键的极性和分子的极性
(1)键的极性。
共价键 分类 极性共价键 非极性共价键
成键原子 不同元素的原子 同种元素的原子
共用电子对 发生偏移 不发生偏移
成键原子 的电性 电负性较小的原子呈正电性(δ+), 电负性较大的原子呈负电性(δ-) 电中性
知识铺垫
必备知识
正误判断
(2)键的极性与分子极性的关系。
知识铺垫
必备知识
正误判断
【微思考】含有极性键的分子一定是极性分子吗 含有非极性键的分子一定是非极性分子吗
提示:不一定。含有极性键的分子,若分子结构是空间对称的,则为非极性分子,否则是极性分子。H2O2分子中存在非极性键,但H2O2分子为极性分子。
知识铺垫
必备知识
正误判断
2.键的极性对化学性质的影响
羧酸是一类含羧基(—COOH)的有机酸,羧基可电离出H+而呈酸性。
三氟乙酸的酸性强于三氯乙酸,这是由于氟的电负性大于氯的电负性,C—F键的极性大于C—Cl键,导致羧基中的O—H键的极性更大,更易电离出氢离子。据此,酸性关系:CCl3COOH>CHCl2COOH>CH2ClCOOH(填“>”“=”或“<”)。
烃基(符号R—)是推电子基团,烃基越长推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。所以酸性:甲酸>乙酸>丙酸(填“>”“=”或“<”)。
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
知识铺垫
必备知识
正误判断
1.极性分子中不可能含有非极性键。 ( )
2.离子化合物中不可能含有非极性键。( )
3.非极性分子中不可能含有极性键。( )
4.极性分子中一定含有极性键。( )
5.H2O、CO2、CH4都是非极性分子。( )
答案:1.× 2.× 3.× 4.√ 5.×
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
键的极性与分子的极性
问题探究
1.已知H2O2分子的空间结构可在二面角中表示,如图所示:
(1)分析H2O2分子中共价键的种类有哪些
提示:H2O2分子中H—O键为极性共价键,O—O键为非极性共价键。
(2)H2O2分子中正电中心和负电中心是否重合 H2O2属于极性分子还是非极性分子
提示:不重合。H2O2属于极性分子。
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
2.从哪些方面可以判断键的极性
提示:可从组成元素、电子对偏移、成键原子电负性大小等方面进行判断。
3.如何根据多原子分子的组成及空间结构确定分子的极性
提示:多原子分子,如果为单质,则一般为非极性分子;如果为化合物,则看分子的空间结构,若空间结构对称则为非极性分子,若空间结构不对称则为极性分子。
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
深化拓展
1.键的极性的判断方法
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
2.分子极性的判断方法
(1)化合价法。
ABn型分子中,中心原子化合价的绝对值等于该元素的价电子数时,该分子为非极性分子,此时分子的空间结构对称;若中心原子的化合价的绝对值不等于其价电子数,则分子的空间结构不对称,该分子为极性分子。具体实例如下:
分子 BF3 CO2 PCl5 SO3 H2O NH3 SO2
中心原子 化合价绝 对值 3 4 5 6 2 3 4
中心原子 价电子数 3 4 5 6 6 5 6
分子极性 非极性 非极性 非极性 非极性 极性 极性 极性
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
(2)根据所含共价键的类型及分子的空间结构判断。
分子类型 键的 极性 分子空间 结构 分子极性 代表物
双原子 分子 A2 非极性键 直线形(对称) 非极性 H2、O2、
Cl2、N2等
AB 极性键 直线形(不对称) 极性 HF、HCl、CO、NO等
三原子 分子 A2B(或 AB2) 极性键 直线形(对称) 非极性 CO2、CS2
等(键角180°)
极性键 V形(不对称) 极性 H2O(键角105°)等
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
分子类型 键的 极性 分子空间 结构 分子极性 代表物
四原子 分子 AB3 极性键 平面三角 形(对称) 非极性 BF3、BCl3等
极性键 三角锥形 (不对称) 极性 NH3(键角107°)等
五原子 分子 AB4 极性键 正四面体 形(对称) 非极性 CH4、CCl4(键角
109°28')等
ABnC4-n (n<4且为整数) 极性键 四面体形 (不对称) 极性 CHCl3、CH2Cl2等
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
(3)根据中心原子最外层电子是否全部成键判断。
中心原子即其他原子围绕它成键的原子。分子中的中心原子最外层电子若全部参与成键,不存在孤电子对,此分子一般为非极性分子;分子中的中心原子最外层电子若未全部参与成键,存在孤电子对,此分子一般为极性分子。如:CH4、BF3、CO2等分子中的中心原子的最外层电子均全部参与成键,它们都是非极性分子;H2O、NH3、NF3等分子中的中心原子的最外层电子均未全部参与成键,它们都是极性分子。
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
素能应用
典例1下列关于粒子结构的描述不正确的是( )
A.H2S和NH3均是价电子总数为8的极性分子
B.HS-和HCl均是含1个极性键的18电子粒子
C.CH2Cl2和CCl4均是空间结构为四面体形的非极性分子
D.SO2和SO3中心原子的杂化轨道类型均为sp2,空间构型分别为V形、平面三角形
答案:C
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
解析:H2S分子中氢、硫原子间形成极性键,且空间结构不对称,属于极性分子;NH3分子中含有极性键,空间结构为三角锥形,正负电荷中心不重合,属于极性分子,A项正确。HS-和HCl都只含一个极性键,都具有18个电子,B项正确。CH2Cl2正负电荷的中心不重合,是极性分子,C项错误。SO2中硫原子形成两个σ键,孤电子对数为 ×(6-2×2)=1,价层电子对数为3,为sp2杂化,分子空间结构为V形;SO3分子中,中心原子硫原子最外层有6个电子,外围有三个原子,所以不含孤电子对,价层电子对数为σ键个数+孤电子对数=3+ ×(6-3×2)=3,为sp2杂化,SO3分子为平面三角形结构,D项正确。
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
规律总结 从以下两方面判断分子的极性:
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
变式训练1-1下列物质:①BeCl2 ②Ar ③白磷 ④BF3 ⑤NH3 ⑥H2O2,其中含极性键的非极性分子是( )
A.①④⑥ B.②③⑥
C.①④ D.①③④⑤
答案:C
解析:①BeCl2空间结构是直线形,Cl—Be—Cl是含极性键的非极性分子;②Ar为稀有气体,分子中不含化学键;③白磷分子式为P4,不含极性键,含有的是非极性键;④BF3是平面三角形结构,是极性键构成的非极性分子;⑤过氧化氢是由极性键和非极性键构成的极性分子。故C项符合题目要求。
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
变式训练1-2下列各组物质的分子中,都属于含极性键的非极性分子的是( )
A.CO2、H2S B.C2H4、CH4
C.Cl2、C2H2 D.NH3、HCl
答案:B
解析:两种不同原子之间的共价键具有极性,C项Cl2分子中无极性键。根据分子的空间结构可以判断A项中H2S,D项中NH3、HCl分子中正负电荷中心不重合,属于极性分子。故正确答案为B。
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
键的极性对物质化学性质的影响——以物质的酸性为例
问题探究
无机含氧酸的化学式可以用(HO)mXOn来表示(X代表成酸元素,n代表非羟基氧原子数,m代表—OH数),则n值越大,m值越小,该酸的酸性就越强。其原因是非羟基氧原子的吸电子效应使O—H键极性增强,更容易电离出H+。
问题思考:
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
(1)硫酸、磷酸的结构式分别为 , ,它们的酸性强弱是怎样的
提示:硫酸可写为(HO)2SO2,磷酸可写为(HO)3PO,n值分别是2、1,m值分别是2、3,由n值越大、m值越小,该酸的酸性就越强,可知硫酸的酸性强于磷酸。
(2)HClO3、H2SeO3、H2BeO2、HMnO4四种含氧酸中酸性最强的是哪种酸
提示:HClO3可写成(HO)ClO2,n=2;H2SeO3可写成(HO)2SeO,n=1;H2BeO2可写成(HO)2Be,n=0;HMnO4可写成(HO)MnO3,n=3,因此酸性最强的为HMnO4。
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
2.3第一课时共价键的极性课件-【新教材】人教版(2019)高中化学选择性必修2(共35张PPT)
探究1
探究2
素养脉络
随堂检测
深化拓展
判断物质酸性强弱的方法
(1)根据元素周期律判断。
①同一主族元素的非金属氢化物的酸性从上到下逐渐增强,如HF
④同一周期元素最高价氧化物对应水化物的酸性从左向右逐渐增强,如H3PO4
探究2
素养脉络
随堂检测
(2)根据元素化合价判断。
同一元素的含氧酸,中心原子的化合价越高,酸性越强。如H2SO4>H2SO3;HClO4>HClO3>HClO2>HClO。
(3)根据非羟基氧原子数判断。
(4)根据电离常数来判断。
如K(H3PO4)>K(HClO),酸性H3PO4>HClO;或依据pKa(pKa=-lg Ka)大小判断:pKa越小,酸性越强。
探究1
探究2
素养脉络
随堂检测
(5)根据化学反应判断。
如H2SO4+Na2SO3 === Na2SO4+H2O+SO2↑,
酸性:H2SO4>H2SO3。
H2O+CO2+Ca(ClO)2 === CaCO3↓+2HClO,
酸性:H2CO3>HClO。
探究1
探究2
素养脉络
随堂检测
(6)羧酸酸性强弱的判断。
①与羧基相连的烷基含碳原子数越多,羧酸酸性越弱。
如酸性HCOOH>CH3COOH>C2H5COOH。
因为烷基是推电子基团,烷基含碳原子越多,推电子效应越大,使O—H键极性越弱,越难电离出H+。
②与羧基相连的碳原子上连接有电负性大的原子时,羧酸的酸性增强。
如酸性CF3COOH>CCl3COOH>CHCl2COOH>CH2ClCOOH>CH3COOH。
因为电负性大的原子的吸电子作用,使O—H键的极性增强,更易电离出H+。
探究1
探究2
素养脉络
随堂检测
素能应用
典例2下列各组酸中,酸性依次增强的是( )
A.H2CO3、H2SiO3、H3PO4
B.HNO3、H3PO4、H2SO4
C.HI、HCl、H2S
D.HClO、HClO3、HClO4
答案:D
解析:将含氧酸写成通式:(HO)mROn,R相同,n值越大,酸性越强;再根据元素非金属性强弱进行判断。A项中由于非金属性:C>Si,故酸性:H2CO3>H2SiO3;B项中由于非金属性:N>P,故酸性:HNO3>H3PO4;C项中HCl是强酸,H2S是弱酸;D项可根据通式(HO)mClOn判断出非羟基氧原子数n值依次为0、2、3,从而得出酸性强弱关系。
探究1
探究2
素养脉络
随堂检测
变式训练2-1下列各组物质中,酸性由强到弱排列顺序错误的是( )
A.HClO4>H2SO4>H3PO4
B.HClO4>HClO3>HClO2
C.HClO>HBrO4>HIO4
D.H2SO4>H2SO3>H2CO3
答案:C
解析:元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,A项正确;无机含氧酸酸性强弱的判断:同一元素的含氧酸,该元素价态越高,酸性越强,B项正确;HClO中的氯不是最高价,C项错误;酸性:H2SO4(强酸)>H2SO3(中强酸)>H2CO3(弱酸),D项正确。
探究1
探究2
素养脉络
随堂检测
变式训练2-2(双选)下列物质的酸性强弱比较正确的是( )
A.CH3COOH>HCOOH
B.HCOOH>CH3COOH>CH3CH2COOH
C.HClO3
答案:BD
解析:CH3—的推电子作用使CH3COOH酸性弱于HCOOH,A项错误;含碳原子数越多的烷基推电子作用越强,使O—H键极性越弱,导致相应羧酸的酸性减弱,所以B项正确;同一元素不同价态的含氧酸中非羟基氧原子越多,酸性越强,C项错误;由于吸电子能力F>Cl>H,故D项正确。
探究1
探究2
素养脉络
随堂检测
探究1
探究2
素养脉络
随堂检测
1.在下列物质中,分子中电荷空间分布对称的是( )
①CO2 ②CCl4 ③NH3 ④H2O ⑤HBr
A.①②④ B.②④⑤ C.③⑤ D.①②
答案:D
解析:在由三个以上原子形成的化合物分子中,空间结构对称的分子,其电荷的空间分布对称,如直线形的CO2、正四面体形的CCl4。
2.下列物质中,由极性键形成的非极性分子是( )
A.CO2 B.Br2 C.CaCl2 D.SO2
答案:A
解析:不同种元素形成的化合物中才可能含有极性键;在由三个以上原子形成的化合物分子中,空间结构对称的分子,才是非极性分子,如直线形的CO2。
探究1
探究2
素养脉络
随堂检测
3.无机含氧酸酸性的强弱规律之一为:成酸元素的化合价越高,酸性越强。下列说法正确的是( )
A.根据这一规律高氯酸是强酸
B.H3PO4的酸性比盐酸的酸性强
C.碳酸比亚硫酸的酸性强
D.硝酸与磷酸的酸性强度一样
答案:A
解析:一般认为,成酸元素的化合价越高其酸性越强。盐酸为非含氧酸,不适用此规律,B项错误;碳酸与亚硫酸、硝酸与磷酸均不是同一元素的含氧酸,不能用题述规律进行比较,C、D两项错误。
探究1
探究2
素养脉络
随堂检测
4.含氧酸的酸性强弱与酸中的非羟基氧原子数n有关,n越大,酸性越强。一般n=0为弱酸,n=1为中强酸,n=2为强酸,n=3为很强酸。根据实验事实可知硼酸(H3BO3)是弱酸,而亚磷酸(H3PO3)是中强酸。
(1)这两种酸的结构简式分别为 、 。
(2)亚磷酸是 元酸,它与过量NaOH溶液反应的化学方程式为 。
(3)次磷酸是一种一元酸,化学式为H3PO2,它的结构简式为 。
探究1
探究2
素养脉络
随堂检测
探究1
探究2
素养脉络
随堂检测
