人教版 高中化学 选择性必修2 2.3.1 分子结构与物质的性质(共39张ppt)
文档属性
| 名称 | 人教版 高中化学 选择性必修2 2.3.1 分子结构与物质的性质(共39张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 11.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 00:00:00 | ||
图片预览









文档简介
汇报人:XXX
XX月XX日
分子结构与物质的性质
(第一课时)
人教版高中化学选择必修二
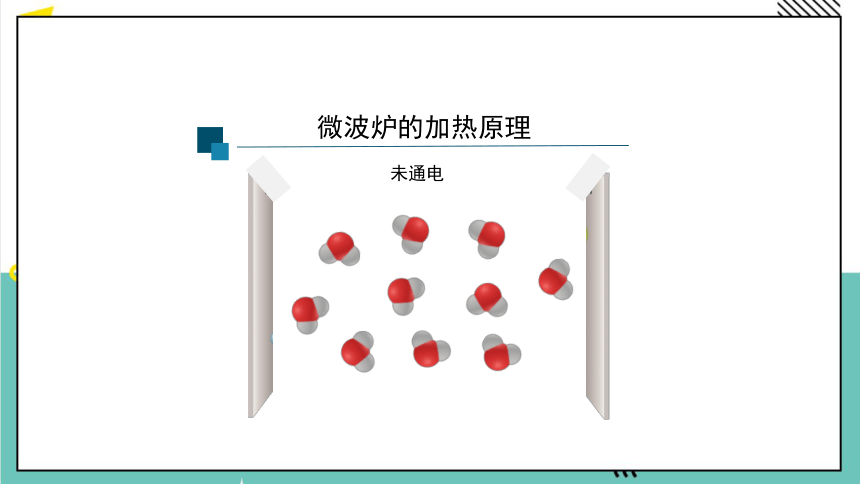
微波炉的加热原理
微波炉的加热原理
未通电
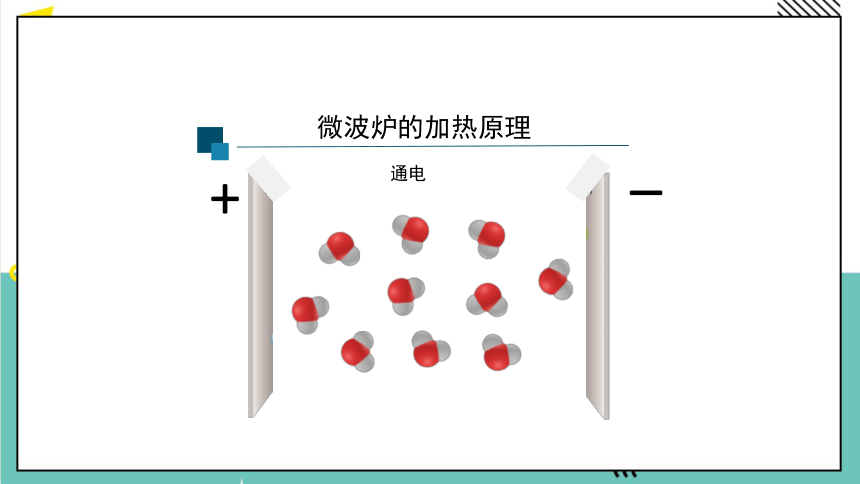
微波炉的加热原理
?
+
通电
众多的水分子随电磁场定向转动
因频繁相互间摩擦损耗,使电磁能转化为热能
电场
磁场
方向
偶极矩
微波炉的加热原理
水分子的表面静电势图
电子云
密度大
电子云
密度小
颜色表示静电势的数值
越接近红色,代表电子云密度越大
越接近蓝色,代表电子云密度越小
水分子的正电中心和负电中心不重合,在电场作用下可以定向转动。
极性分子
金
属
片
金
属
片
微波炉的加热原理
分子的极性
极性分子:分子内正电中心和负电中心不重合。
非极性分子:分子内正电中心和负电中心重合。
思考 为什么水分子内部正电中心和负电中心不重合?
H2
HF
电子式
结构式
认识分子的极性
活动1 写出H2、HF 的电子式、结构式
H2
HF
电子式
结构式
认识分子的极性
活动1 写出H2、HF 的电子式、结构式
H—H
H—F
H F
H H
:
:
:
:
:
δ-
δ+
由不同原子形成的共价键
非极性共价键
由同种原子形成的共价键
极性共价键
电子对发生偏移
电子对不发生偏移
H—H
H—F
认识分子的极性
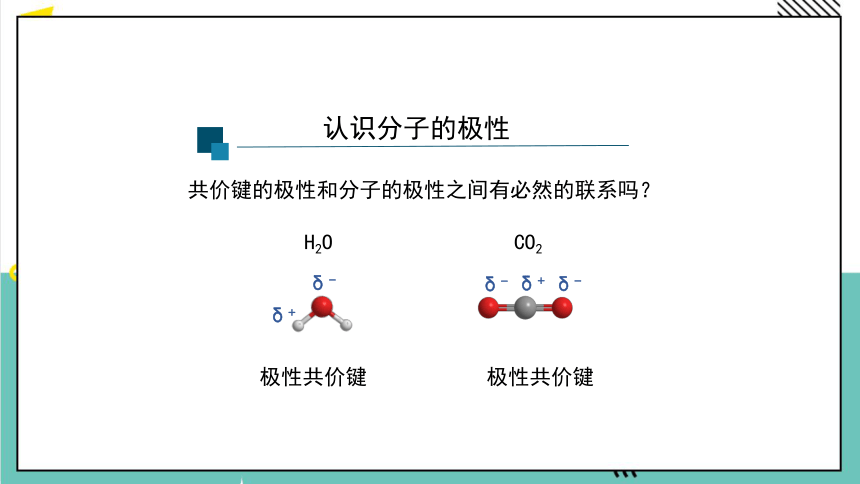
共价键的极性和分子的极性之间有必然的联系吗?
H2O
极性共价键
极性共价键
δ-
δ+
认识分子的极性
CO2
δ-
δ+
δ-
H2O
极性共价键
正电中心和负电中心不重合
极性分子
极性共价键
正电中心和负电中心重合
非极性分子
δ-
δ+
认识分子的极性
CO2
δ-
δ+
δ-
共价键的极性和分子的极性的关系
分子的极性
分子的空间结构
共价键的极性
正负电荷中心是否重合
决定
决定
判断分子的极性的方法
δ-
δ+
δ-
直线形
2个C=O的极性的向量和为零,是非极性分子
CO2
H2
Cl2
HF
HCl
判断分子的极性的方法
CCl4
NH3
CH4
BF3
H2
Cl2
HF
HCl
判断分子的极性的方法
CCl4
NH3
CH4
BF3
同种原子构成的双原子分子是非极性分子
H2
Cl2
HF
HCl
判断分子的极性的方法
CCl4
NH3
CH4
BF3
不同原子构成的双原子分子是极性分子
H2
Cl2
HF
HCl
判断分子的极性的方法
CCl4
NH3
CH4
BF3
相同原子构成的多原子分子大多是非极性分子
H2
Cl2
HF
HCl
判断分子的极性的方法
CCl4
NH3
CH4
BF3
NH3
3个N-H的极性的向量和不等于零,是极性分子
三角锥形
判断分子的极性的方法
BF3
平面三角形
3个B-F的极性的向量和等于零,是非极性分子
判断分子的极性的方法
CH4
正四面体形
4个C-H的极性的向量和等于零,是非极性分子
判断分子的极性的方法
CCl4
正四面体形
4个C-Cl的极性的向量和等于零,是非极性分子
判断分子的极性的方法
C
Cl
Cl
Cl
Cl
小结
分子
共价键的极性
分子中正电中心和负电中心
结论
举例
同种元素的
双原子分子
非极性键
重合
非极性分子
O2
不同种元素的双原子分子
极性键
不重合
极性分子
CO
多原子分子
分子中共价键的极性的向量和等于零
重合
非极性分子
CH4
分子中共价键的极性的向量和不等于零
不重合
极性分子
CH3Cl
键的极性对化学性质的影响
2Na+2H2O===2NaOH+H2↑
2Na+2CH3CH2OH 2CH3CH2ONa+H2↑
钠和水的反应
钠和乙醇的反应
为什么钠和水的反应比钠和乙醇的反应剧烈?
H
O
H
C2H5
O
H
δ+
δ-
δ+
δ-
乙醇分子中的C2H5—是推电子基团,使得乙醇分子中的电子云向着远离乙基的方向偏移,羟基的极性比水分子中的小,因而钠和乙醇
的反应不如钠和水的剧烈
键的极性对化学性质的影响
分子结构
化学键的极性
物质的化学性质
键的极性对化学性质的影响
CH3COOH
CH3COO- + H+
Ka =
c(CH3COO-)? c(H+ )
c(CH3COOH)
pKa = -lgKa
pKa 越小,酸性越强
键的极性对化学性质的影响
活动3 分析表格中pKa数据的变化规律及原因
酸
性
增
强
键的极性对化学性质的影响
CH3
O
H
δ+
δ-
O
C
C2H5
O
H
δ+
δ-
O
C
H
O
H
δ+
δ-
O
C
键的极性对化学性质的影响
活动3 分析表格中pKa数据的变化规律及原因
烃基是推电子基团,烃基越长,推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
酸
性
增
强
键的极性对化学性质的影响
活动3 分析表格中pKa数据的变化规律及原因
酸
性
增
强
键的极性对化学性质的影响
CH2
O
H
δ+
δ-
O
C
Cl
CH3
O
H
δ+
δ-
O
C
键的极性对化学性质的影响
CH3
O
H
δ+
δ-
O
C
CH
O
H
δ+
δ-
O
C
Cl
Cl
键的极性对化学性质的影响
CH3
O
H
δ+
δ-
O
C
C
O
H
δ+
δ-
O
C
Cl
Cl
Cl
键的极性对化学性质的影响
活动3 分析表格中pKa数据的变化规律及原因
酸
性
增
强
由于氯的电负性较大,极性:Cl3C— > Cl2CH— > ClCH2—
导致三氯乙酸中的羧基的极性最大,更易电离出氢离子
键的极性对化学性质的影响
活动3 预测三氟乙酸和三氯乙酸的酸性相对强弱
酸
性
增
强
由于氟的电负性大于氯的电负性,极性:F3C— > Cl3C—
导致三氟乙酸中的羧基的极性更大,更易电离出氢离子
键的极性对化学性质的影响
分子结构修饰
三氯蔗糖
不改变分子的主体骨架,保持分子的基本结构不变,仅改变分子结构中的某些基团而得到新的分子,分子被修饰后,其性质也可以发生显著的变化
XX月XX日
分子结构与物质的性质
(第一课时)
人教版高中化学选择必修二
微波炉的加热原理
微波炉的加热原理
未通电
微波炉的加热原理
?
+
通电
众多的水分子随电磁场定向转动
因频繁相互间摩擦损耗,使电磁能转化为热能
电场
磁场
方向
偶极矩
微波炉的加热原理
水分子的表面静电势图
电子云
密度大
电子云
密度小
颜色表示静电势的数值
越接近红色,代表电子云密度越大
越接近蓝色,代表电子云密度越小
水分子的正电中心和负电中心不重合,在电场作用下可以定向转动。
极性分子
金
属
片
金
属
片
微波炉的加热原理
分子的极性
极性分子:分子内正电中心和负电中心不重合。
非极性分子:分子内正电中心和负电中心重合。
思考 为什么水分子内部正电中心和负电中心不重合?
H2
HF
电子式
结构式
认识分子的极性
活动1 写出H2、HF 的电子式、结构式
H2
HF
电子式
结构式
认识分子的极性
活动1 写出H2、HF 的电子式、结构式
H—H
H—F
H F
H H
:
:
:
:
:
δ-
δ+
由不同原子形成的共价键
非极性共价键
由同种原子形成的共价键
极性共价键
电子对发生偏移
电子对不发生偏移
H—H
H—F
认识分子的极性
共价键的极性和分子的极性之间有必然的联系吗?
H2O
极性共价键
极性共价键
δ-
δ+
认识分子的极性
CO2
δ-
δ+
δ-
H2O
极性共价键
正电中心和负电中心不重合
极性分子
极性共价键
正电中心和负电中心重合
非极性分子
δ-
δ+
认识分子的极性
CO2
δ-
δ+
δ-
共价键的极性和分子的极性的关系
分子的极性
分子的空间结构
共价键的极性
正负电荷中心是否重合
决定
决定
判断分子的极性的方法
δ-
δ+
δ-
直线形
2个C=O的极性的向量和为零,是非极性分子
CO2
H2
Cl2
HF
HCl
判断分子的极性的方法
CCl4
NH3
CH4
BF3
H2
Cl2
HF
HCl
判断分子的极性的方法
CCl4
NH3
CH4
BF3
同种原子构成的双原子分子是非极性分子
H2
Cl2
HF
HCl
判断分子的极性的方法
CCl4
NH3
CH4
BF3
不同原子构成的双原子分子是极性分子
H2
Cl2
HF
HCl
判断分子的极性的方法
CCl4
NH3
CH4
BF3
相同原子构成的多原子分子大多是非极性分子
H2
Cl2
HF
HCl
判断分子的极性的方法
CCl4
NH3
CH4
BF3
NH3
3个N-H的极性的向量和不等于零,是极性分子
三角锥形
判断分子的极性的方法
BF3
平面三角形
3个B-F的极性的向量和等于零,是非极性分子
判断分子的极性的方法
CH4
正四面体形
4个C-H的极性的向量和等于零,是非极性分子
判断分子的极性的方法
CCl4
正四面体形
4个C-Cl的极性的向量和等于零,是非极性分子
判断分子的极性的方法
C
Cl
Cl
Cl
Cl
小结
分子
共价键的极性
分子中正电中心和负电中心
结论
举例
同种元素的
双原子分子
非极性键
重合
非极性分子
O2
不同种元素的双原子分子
极性键
不重合
极性分子
CO
多原子分子
分子中共价键的极性的向量和等于零
重合
非极性分子
CH4
分子中共价键的极性的向量和不等于零
不重合
极性分子
CH3Cl
键的极性对化学性质的影响
2Na+2H2O===2NaOH+H2↑
2Na+2CH3CH2OH 2CH3CH2ONa+H2↑
钠和水的反应
钠和乙醇的反应
为什么钠和水的反应比钠和乙醇的反应剧烈?
H
O
H
C2H5
O
H
δ+
δ-
δ+
δ-
乙醇分子中的C2H5—是推电子基团,使得乙醇分子中的电子云向着远离乙基的方向偏移,羟基的极性比水分子中的小,因而钠和乙醇
的反应不如钠和水的剧烈
键的极性对化学性质的影响
分子结构
化学键的极性
物质的化学性质
键的极性对化学性质的影响
CH3COOH
CH3COO- + H+
Ka =
c(CH3COO-)? c(H+ )
c(CH3COOH)
pKa = -lgKa
pKa 越小,酸性越强
键的极性对化学性质的影响
活动3 分析表格中pKa数据的变化规律及原因
酸
性
增
强
键的极性对化学性质的影响
CH3
O
H
δ+
δ-
O
C
C2H5
O
H
δ+
δ-
O
C
H
O
H
δ+
δ-
O
C
键的极性对化学性质的影响
活动3 分析表格中pKa数据的变化规律及原因
烃基是推电子基团,烃基越长,推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
酸
性
增
强
键的极性对化学性质的影响
活动3 分析表格中pKa数据的变化规律及原因
酸
性
增
强
键的极性对化学性质的影响
CH2
O
H
δ+
δ-
O
C
Cl
CH3
O
H
δ+
δ-
O
C
键的极性对化学性质的影响
CH3
O
H
δ+
δ-
O
C
CH
O
H
δ+
δ-
O
C
Cl
Cl
键的极性对化学性质的影响
CH3
O
H
δ+
δ-
O
C
C
O
H
δ+
δ-
O
C
Cl
Cl
Cl
键的极性对化学性质的影响
活动3 分析表格中pKa数据的变化规律及原因
酸
性
增
强
由于氯的电负性较大,极性:Cl3C— > Cl2CH— > ClCH2—
导致三氯乙酸中的羧基的极性最大,更易电离出氢离子
键的极性对化学性质的影响
活动3 预测三氟乙酸和三氯乙酸的酸性相对强弱
酸
性
增
强
由于氟的电负性大于氯的电负性,极性:F3C— > Cl3C—
导致三氟乙酸中的羧基的极性更大,更易电离出氢离子
键的极性对化学性质的影响
分子结构修饰
三氯蔗糖
不改变分子的主体骨架,保持分子的基本结构不变,仅改变分子结构中的某些基团而得到新的分子,分子被修饰后,其性质也可以发生显著的变化
