上海市长宁区重点中学2023-2024学年九年级上学期期中化学试题(含解析)
文档属性
| 名称 | 上海市长宁区重点中学2023-2024学年九年级上学期期中化学试题(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-21 00:00:00 | ||
图片预览




文档简介
2023学年第一学期期中考试
九年级化学学科试卷
(考试时间:40分钟 满分:50分)
相对原子质量:H-1 O-16 C-12 S-32
一、选择题(共20分)
1.属于化学变化的是
A.矿石粉碎 B.蔗糖溶解 C.燃气燃烧 D.酒精挥发
2.属于纯净物的是
A.汽水 B.河水 C.湖水 D.蒸馏水
3.空气中含量最多的气体是
A.氧气 B.氮气 C.氦气 D.水蒸气
4.SO3中S的化合价是
A.-6 B.-3 C.+3 D.+6
5.以下物质中,能引起酸雨的是
A.二氧化碳 B.二氧化硫 C.氮气 D.氧气
6.物质在氧气中燃烧的现象,描述正确的是
A.氢气:产生浓厚的白烟 B.镁带:生成氧化镁
C.硫:产生明亮的蓝紫色火焰 D.铁丝:发出红光,生成黑色固体
7.用打气筒可以将空气压入自行车胎内,这是由于
A.分子之间有间隔 B.分子可以分成原子
C.分子在不断运动 D.分子的体积变小
8.关于分子、原子的说法正确的是
A.分子、原子都可以直接构成物质 B.分子原子都很小,但分子比原子大
C.分子可分、原子不可分 D.分子是保持物质性质的一种微粒
9.下列化学用语与含义相符的是
A.2O一2个氧元素 B.P2O5一五氧化二磷
C.H2一2个氢原子 D.一+2价的钙原子
10.粗盐提纯的实验中,有关仪器的选择及目的均正确的是
A.药匙:取用粗盐 B.量筒:溶解粗盐
C.分液漏斗:制作过滤器 D.表面皿:蒸发滤液
11.关于氦气的说法正确的是
A.化学式:He2 B.元素存在形态:游离态
C.化学性质:密度小 D.用途:助燃
12.用“”和“”分别表示两种不同的原子,则根据分子模型“”,分析正确的是
A.该分子构成的物质由两种元素组成 B.“”是保持该物质性质的微粒
C.该物质的一个分子由两个原子构成 D.该物质的化学式可能是2HO
13.含氧元素的质量相同的SO2和SO3,含有相同的( )
A.硫元素质量 B.质量 C.氧原子个数 D.分子个数
14.硫在氧气中燃烧,描述正确的是
A.化学方程式:
B.反应前后氧元素的化合价发生变化
C.硫加氧气在点燃条件下生成二氧化硫
D.1.5克硫和1克氧气在点燃条件下生成2.5克二氧化硫
15~17题每题均有1~2个正确选项
15.下列说法正确的是
A.化合反应和分解反应都属于化学基本反应类型 B.同种分子构成的物质是纯净物
C.不同种元素组成的物质是化合物 D.单质、化合物按物质种类划分
16.某反应的化学方程式是,相关分析正确的是
A.SiO2可能是气体 B.X是一氧化碳
C.Y是非金属单质 D.反应前后元素的存在形态均改变
17.利用如图装置验证了空气中氧气的体积分数,起始量筒内水的体积是80mL。下列叙述错误的是
A.实验前需检查装置气密性 B.红磷熄灭、集气瓶冷却后再打开止水夹
C.用木炭粉代替红磷也可达到实验目的 D.最终量筒中液面约降至40mL刻度线处
二、简答题(共30分)
18.伴随主火炬的点燃,第19届亚洲运动会开幕。从1936年固体镁金属燃料到1972年首次使用液体燃料,再到1996年后采用丙烷等含碳燃料,火炬燃料发生了巨大的变化。
(1)镁是由 构成。
(2)写出金属镁和氧气发生燃烧反应的化学方程式 。
(3)丙烷(C3H8)是无色无味气体,微溶于水,化学性质稳定,常用作燃料。上述描述中,属于丙烷物理性质的是 。
(4)杭州亚运会开幕式是世界上首次在主火炬燃料方面,创新使用“零碳”甲醇燃料。甲醇(化学式为CH3OH)燃烧的微观示意图如下:
I.甲醇有 种元素组成;各元素质量比是 ;其摩尔质量是 ;0.1mol甲醇的质量是 ;2mol甲醇分子中约含 个氧原子(用科学计数法表示)。
Ⅱ.如图中的甲、乙、丙、丁四种物质,属于单质的是 (填化学式,下同),属于氧化物的是 。
Ⅲ.根据甲醇燃烧的微观示意图判断,说法正确的是 (填序号)。
A.反应前后分子种类不变 B.反应前后原子的种类不变
C.反应前后物质种类不变 D.甲醇由碳、氢、氧三个原子构成
Ⅳ.目前,我国科学家合成了一种新型催化剂,可将二氧化碳和氢气转化为清洁的液体燃料甲醇(化学式为CH3OH)和水,写出该反应的化学方程式为 。
19.气体制备与性质研究是初中化学重要实验,请回答下列问题:
实验一:氧气制取
(1)实验室用固体氯酸钾和二氧化锰共热制取氧气,反应的化学方程式为 ;可用装置D收集氧气,该收集气体方法的名称是 ;
(2)已知固体高锰酸钾加热会产生氧气,同时生成固体锰酸钾和二氧化锰。用高锰酸钾固体制取氧气可选用的发生装置是 (选填编号);
(3)分别加热等质量的a(混有少量高锰酸钾的氯酸钾)和b(纯净的氯酸钾),则产生氧气速率a b(选填“等于”“小于”或“大于”)。
(4)利用如图装置收集氧气,气体应从 (填“m”或“n”)端进入。
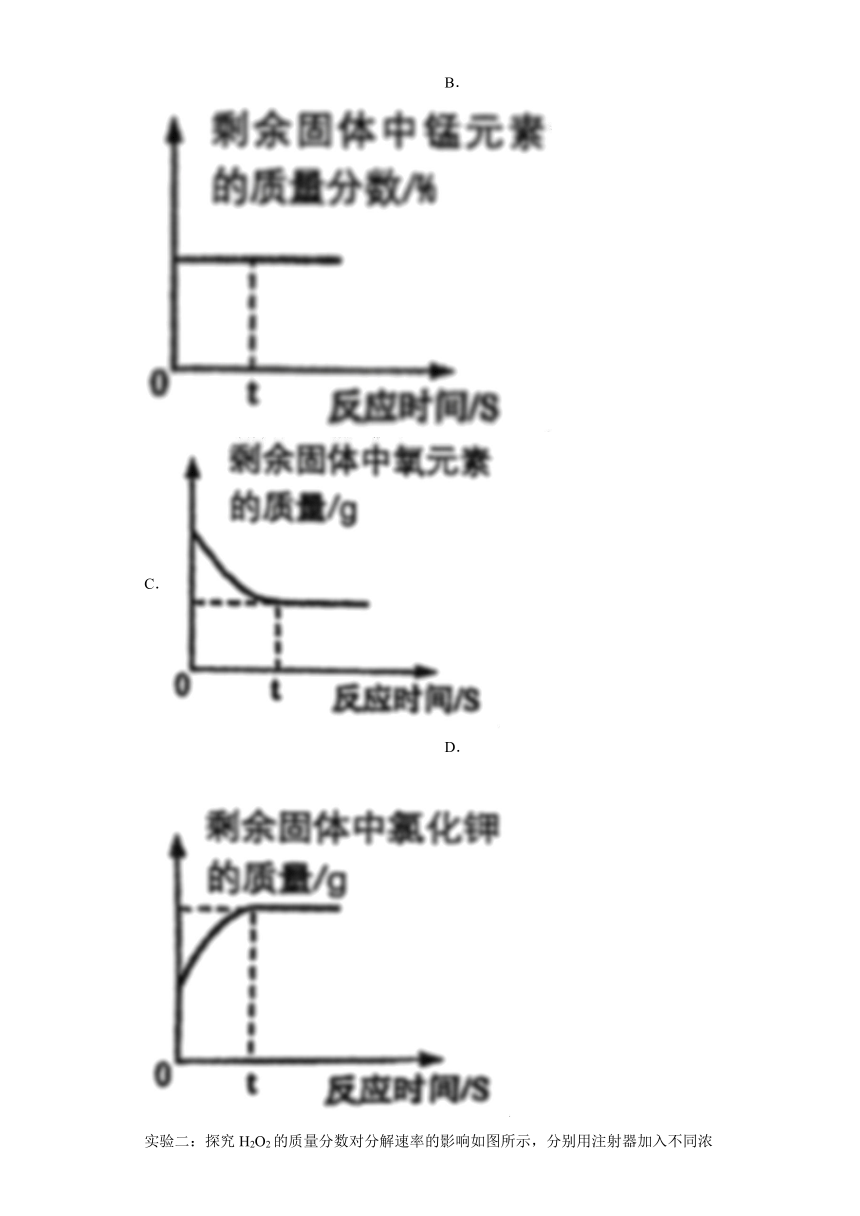
(5)加热氯酸钾和二氧化锰混合物制取氧气,反应过程中,能正确表示对应变化关系的图像是_____(填字母编号)。
A. B.
C. D.
实验二:探究H2O2的质量分数对分解速率的影响如图所示,分别用注射器加入不同浓度的H2O2溶液(见下表),使用传感器测烧瓶中O2的浓度(烧瓶内气压变化在安全范围),绘制氧气浓度随时间变化的曲线:
试验编号 H2O2的质量分数(%) H2O2溶液的体积(mL) 对应曲线
I 3.4 10.0 a
Ⅱ 2.4 ___________ b
Ⅲ 1.7 10.0 /
(6)填写表中数据 。
(7)从曲线a、b中,可得出的结论是 。
(8)计算3.4gH2O2完全分解所得氧气的物质的量 。(根据化学方程式列式计算)
实验三 研究催化剂对KClO3分解反应的影响
编号 KC1O3质量(g) 催化剂种类 催化剂质量(g) 收集50mLO2所需时间(s)
实验1 5 170
实验2 5 MnO2 0.5 49
实验3 5 Fe2O3 0.5 60
实验4 5 KCl 0.5 152
(9)设置实验1的目的是 。
(10)KC1的名称是 ;表中催化剂的催化效果最佳的是 (填化学式)。维持加热条件不变,用实验1继续收集50mLO2,所需时间明显少于170s,解释原因: 。要比较KC1O3分解反应中不同催化剂的催化效果,除了测量收集50mLO2所需时间外,还可以测量 。
实验四 气体性质研究
100mL气体X可能是O2、CO2中的一种或两种,用下图所示装置进行实验(忽略气体的溶解)。
(11)若观察到甲中石灰水变浑浊,乙中石灰水始终未变浑浊,最终有10mL液体进入丙中,则气体X的成分是 。若气体X中只含有O2,则观察到的现象是 。
试卷第2页,共7页
1.C
【详解】A、矿石粉碎是矿石形态的转变,没有新物质生成,不属于化学变化,选项A不符合题意;
B、蔗糖溶解是分子间距发生变化,没有新物质的生成,不属于化学变化,选项B不符合题意;
C、燃气燃烧后生成水和其他物质,有新物质的生成,属于化学变化,选项C符合题意;
D、酒精挥发是酒精由液体变为气体,没有新物质生成,不属于化学变化,选项D不符合题意。
故选C。
2.D
【详解】A、汽水中有碳酸、水等物质,是混合物,故不符合题意;
B、河水中有可溶性、不溶性杂质,是混合物,故不符合题意;
C、湖水中有可溶性、不溶性杂质,是混合物,故不符合题意;
D、蒸馏水中只有一种物质,是纯净物,故符合题意。
故选D
3.B
【详解】空气是由多种气体组成的混合物,主要成分是氮气和氧气,其中氮气约占78%,氧气约为21%,所以含量最多的为氮气;故选B。
4.D
【详解】设SO3中硫元素的化合价为x,化合物中,氧元素一般显-2价,根据化合物中各种元素化合价的代数和等于零,则:x+(-2)×3=0,得:x=+6。故选:D。
5.B
【详解】A、二氧化碳能溶于水,pH约为5.6,酸雨是指pH小于5.6的雨水,故错误;
B、二氧化硫与水反应生成亚硫酸,亚硫酸被氧化成硫酸,能形成酸雨,故正确;
C、氮气难溶于水,不会形成酸雨,故错误;
D、氧气不易溶于水,不会形成酸雨,故错误;
故选:B
6.C
【详解】A、氢气在氧气中燃烧产生蓝色火焰,错误;
B、镁在氧气中燃烧时,发出耀眼的白光,放出大量的热,生成一种白色固体,生成氧化镁是结论不是现象,错误;
C、硫在氧气中燃烧时,发出明亮的蓝紫色的火焰,正确;
D、铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体,错误;
故选C。
7.A
【详解】A. 正因为分子之间有间隔,所以才可以将空气压入车胎内,用打气筒将空气压入自行车胎内,分子之间的间隔减小。故A符合题意;
B. 分子是由原子构成的,在化学变化中分子可以破裂成为原子,而用打气筒将空气压入车胎内,发生的是物理变化,故B不符合题意;
C. 分子无时无刻不在做无规则运动,而用打气筒将空气压入自行车内,改变的是分子之间的间隔,与分子在不断运动无关,故C不符合题意;
D. 用打气筒将空气压入自行车胎内,分子之间的间隔变小,分子本身的体积没有变化,故D不符合题意。
故选A。
8.A
【详解】A、构成物质的粒子由分子、原子和离子,所以分子、原子都可以直接构成物质,故A项正确;
B、分子原子都很小,但分子不一定比原子大,比如:氢分子和铜原子,铜原子比氢分子大,故C项错误;
C、原子是化学变化中的最小粒子,分子是由原子构成的,在物理变化中,原子可以再分,故C项错误;
D、由分子构成的物质,分子是保持物质化学性质的最小粒子,故D项错误;
答案:A。
9.B
【详解】A、用元素符号来表示一个原子,由元素符号前面的数字表示原子的个数,表示多个该原子,2O表示2个氧原子,故A不符合题意;
B、化学式可以表示物质的名称,从右向左读,P2O5可表示五氧化二磷,故B符合题意;
C、化学式可以表示微观一个分子,H2表示1个氢分子,2H表示2个氢原子,故C不符合题意;
D、化合价标在元素符号的正上方,正负号在前,价数在后,表示钙元素的化合价为+2,故D不符合题意;
故选:B。
10.A
【详解】A. 粗盐提纯实验当中,用药匙来取用粗盐,故A符合题意;
B. 粗盐提纯实验当中不用量筒,粗盐是在烧杯中进行的,量筒不可以用来溶解药品,故B不符合题意;
C. 粗盐提纯实验当中,过滤器的制作用到的是普通漏斗,而不是分液漏斗,故C不符合题意;
D. 粗盐提纯实验中蒸发滤液用到的是蒸发皿,而不是表面皿,故D不符合题意。
故选A。
11.B
【详解】A、氦气为稀有气体,化学式为He,该选项说法不正确;
B、氦气在自然界中以单质形式存在,则存在形态为游离态,该选项说法正确;
C、密度不需要通过化学变化就能表现出来的性质,属于物理性质,该选项说法不正确;
D、氦气不具有助燃性,该选项说法不正确。
故选B。
12.A
【详解】A、由图可知,该物质是由分子构成,是由两种元素组成,该选项正确;
B、该物质是由分子构成,则保持该物质化学性质的最小微粒为分子,但一个分子并不能保持其物理性质,该选项不正确;
C、由图可知,该物质的一个分子由4个原子构成,该选项不正确;
D、元素符号右下角的数字表示分子中原子个数,则该物质的化学式可能为H2O2,该选项不正确。
故选A。
13.C
【分析】从分子原子角度进行分析解答。
【详解】因为每个氧原子质量都相同,故SO2与SO3含氧元素的质量相同则中氧原子个数就应该相等,C选项正确,符合题意。
故选C。
【点睛】本题为化学式的相关计算,此题难度不大,注意化学中的计算题不要当做数学题进行计算,应该从化学的角度即分子原子的角度分析问题。
14.B
【详解】A、硫和氧气在点燃条件下生成二氧化硫,反应物中有气体,生成物中气体不需要加气体符号,反应的化学方程式为:,故选项A不正确;
B、反应前氧元素的化合价为0价,反应后氧元素化合价为-2价,反应前后氧元素的化合价发生变化,故选项B正确;
C、在反应中“+”读作“和”,该反应从物质的角度可读作:硫和氧气在点燃的条件下生成二氧化硫,故选项C不正确;
D、根据化学方程式可知,硫和氧气参加反应的质量比为1:1,则1.5克硫和1克氧气在点燃条件下反应,硫只有1g参加反应,生成2克二氧化硫,故选项D不正确;
故选:B。
15.AB
【详解】A.化合反应和分解反应都属于化学基本反应类型,故A正确;
B.纯净物由一种物质组成,同种分子构成的物质是纯净物,故B正确;
C.不同种元素组成的物质不一定是化合物,如空气属于混合物,故C错误;
D.单质、化合物按物质组成元素种类划分,单质是由同种元素组成的纯净物,化合物是由不同种元素组成的纯净物,故D错误。
故选:AB。
16.BC
【详解】A、SiO2通常情况下是固体,故选项说法错误;
B、硅和碳在高温下反应生成单质硅和一氧化碳,根据质量守恒定律反应前后原子的种类和数目不变,反应前有1个硅原子、2个氧原子、2个碳原子,X是气体,因此X是一氧化碳,Y是硅,故选项说法正确;
C、硅和碳在高温下反应生成单质硅和一氧化碳,硅单质属于非金属单质,故选项说法正确;
D、根据选项B可知,反应前后碳元素由游离态变为化合态,硅元素由化合态变为游离态,但是氧元素反应前后都是化合态,故选项说法错误。
故选BC。
17.CD
【详解】A、实验前检查装置气密性是实验成功的前提条件,正确,不符合题意;
B、红磷熄灭、试管冷却后再打开止水夹,防止升温使得气体膨胀导致测得空气中氧气的体积分数偏低,正确,不符合题意;
C、用木炭粉代替红磷会导致测得空气中氧气的体积分数偏低,不能够达到实验目的,因为木炭燃烧会产生二氧化碳气体,影响实验中产生压强差的数值,故错误,符合题意;
D、空气中氧气的体积分数约为,因此进入试管中的水的体积为:,因此,最终量筒中液面约降至刻度线处,错误,符合题意;故选CD。
18.(1)镁原子
(2)
(3)无色无味气体,微溶于水
(4) 3##三 3:1:4 32g/mol 3.2g##3.2克 4.816×1024 O2 H2O B
【详解】(1)镁是金属,所以镁是由镁原子构成的;
(2)镁和氧气在点燃的条件下生成氧化镁,该反应的化学方程式为;
(3)物理性质是指不需要通过化学变化就表现的性质,根据题意可知,属于丙烷物理性质的是无色无味气体,微溶于水;
(4)由微观示意图可知,甲醇燃烧的化学方程式为,
Ⅰ、由甲醇的化学式CH3OH可知,甲醇是由碳氢氧三种元素组成的;
甲醇中碳氢氧元素的质量比为12:4:16=3:1:4;
甲醇的相对分子质量为12+4+16=32,所以甲醇的摩尔质量为32g/mol;
0.1mol甲醇的质量是0.1mol×32 g/mol=3.2g;
1mol甲醇分子中约含6.02×1023个分子,2mol甲醇分子中约含2×6.02×1023×4=4.816×1024个氧原子;
Ⅱ、由同种元素组成的纯净物为单质,由两种元素组成,其中一种是氧元素的化合物是氧化物,分析甲醇燃烧的化学方程式可知,甲、乙、丙、丁四种物质,属于单质的是乙,化学式为O2;属于氧化物的丁,化学式为H2O;
Ⅲ、A、在化学变化中分子分解成原子,原子重新组合成新的分子,所以化学反应前后分子的种类一定改变,故选项错误;
B、化学反应前后原子的种类、个数、质量不变,故选项正确;
C、化学变化是指有新物质生成的变化,故选项错误;
D、甲醇由甲醇分子构成的,甲醇分子是由碳、氢、氧三种原子构成,故选项错误;
故选B
Ⅳ、二氧化碳和氢气在催化剂的作用下生成甲醇和水,该反应的化学方程式为。
19.(1) ↑ 向上排空气法
(2)A
(3)大于
(4)m
(5)C
(6)10.0
(7)其它条件相同时,过氧化氢溶液质量分数越大,反应速率越快
(8)3.4g过氧化氢物质的量为:,
设生成氧气的物质的量为x,
,x=0.05mol;
答:理论上完全分解可以生成0.05mol氧气。
(9)对比实验
(10) 氯化钾 MnO2 氯酸钾分解产生氯化钾,起催化作用 相同时间内,收集气体体积的多少
(11) 10mL氧气和 90mL二氧化碳 甲乙中石灰水不变浑浊,且乙中石灰水流入丙中约100mL
【详解】(1)氯酸钾在二氧化锰催化作用下加热反应生成氯化钾和氧气,书写化学方程式注意配平及气体符号,所以化学方程式为↑;D为向上排空气法收集装置;
(2)反应物为固体,且需要加热,故选A为发生装置;
(3)高锰酸钾分解生成二氧化锰,可以加快氯酸钾分解,所以反应速度为a大于b;
(4)氧气的密度大于空气,若用如图装置收集氧气,气体应从m端通入;
(5)A、氯酸钾在二氧化锰的催化作用下加热生成氧气和氯化钾,氧气的质量逐渐增大,然后不变,不会出现减小的情况,故选项错误;
B、根据剩余固体逐渐减小,锰元素的质量不变,所以锰元素的质量分数逐渐增大,然后不变,故选项错误;
C、氯酸钾分解生成了氯化钾和氧气,二氧化锰中也含有氧元素,所以固体中氧元素的质量分数先减小,然后不变,故选项正确;
D、剩余固体中氯化钾的质量应该从零开始逐渐增大,故选项错误。
故选:C。
(6)为了进行对比,表中数据应该是10.0;
(7)从曲线a、b中,可得出的结论是其它条件相同时,过氧化氢溶液质量分数越大,反应速率越快;
(8)见答案
(9)通过对比才能知道实验2、3、4中加入药品后有无催化作用;
(10)KCl读作氯化钾;除了加入药品不同外,其他条件都相同,根据对比可知,收集相同体积的氧气,实验2所用时间最短,即二氧化锰的催化效果最好;维持加热条件不变,用实验1再继续收集收集50mLO2,所需时间明显少于170s,是因为氯酸钾分解产生氯化钾,起催化作用;要比较KClO3分解反应中不同催化剂的催化效果,除了测量收集50mLO2所需时间外,还可以测量相同时间内,收集气体体积的多少;
(11)若观察到甲中石灰水变浑浊,乙中石灰水始终未变浑浊,最终有10mL液体进入丙中,则气体 X 一定有二氧化碳,且不易溶于水的氧气进入乙瓶,被挤出的液体体积即为氧气的体积,则混合气体是10mL氧气和 90mL二氧化碳;若气体 X 中只含有O2,则观察到的现象是:甲乙中石灰水不变浑浊,且乙中石灰水流入丙中约100mL。
答案第8页,共8页
答案第7页,共7页
九年级化学学科试卷
(考试时间:40分钟 满分:50分)
相对原子质量:H-1 O-16 C-12 S-32
一、选择题(共20分)
1.属于化学变化的是
A.矿石粉碎 B.蔗糖溶解 C.燃气燃烧 D.酒精挥发
2.属于纯净物的是
A.汽水 B.河水 C.湖水 D.蒸馏水
3.空气中含量最多的气体是
A.氧气 B.氮气 C.氦气 D.水蒸气
4.SO3中S的化合价是
A.-6 B.-3 C.+3 D.+6
5.以下物质中,能引起酸雨的是
A.二氧化碳 B.二氧化硫 C.氮气 D.氧气
6.物质在氧气中燃烧的现象,描述正确的是
A.氢气:产生浓厚的白烟 B.镁带:生成氧化镁
C.硫:产生明亮的蓝紫色火焰 D.铁丝:发出红光,生成黑色固体
7.用打气筒可以将空气压入自行车胎内,这是由于
A.分子之间有间隔 B.分子可以分成原子
C.分子在不断运动 D.分子的体积变小
8.关于分子、原子的说法正确的是
A.分子、原子都可以直接构成物质 B.分子原子都很小,但分子比原子大
C.分子可分、原子不可分 D.分子是保持物质性质的一种微粒
9.下列化学用语与含义相符的是
A.2O一2个氧元素 B.P2O5一五氧化二磷
C.H2一2个氢原子 D.一+2价的钙原子
10.粗盐提纯的实验中,有关仪器的选择及目的均正确的是
A.药匙:取用粗盐 B.量筒:溶解粗盐
C.分液漏斗:制作过滤器 D.表面皿:蒸发滤液
11.关于氦气的说法正确的是
A.化学式:He2 B.元素存在形态:游离态
C.化学性质:密度小 D.用途:助燃
12.用“”和“”分别表示两种不同的原子,则根据分子模型“”,分析正确的是
A.该分子构成的物质由两种元素组成 B.“”是保持该物质性质的微粒
C.该物质的一个分子由两个原子构成 D.该物质的化学式可能是2HO
13.含氧元素的质量相同的SO2和SO3,含有相同的( )
A.硫元素质量 B.质量 C.氧原子个数 D.分子个数
14.硫在氧气中燃烧,描述正确的是
A.化学方程式:
B.反应前后氧元素的化合价发生变化
C.硫加氧气在点燃条件下生成二氧化硫
D.1.5克硫和1克氧气在点燃条件下生成2.5克二氧化硫
15~17题每题均有1~2个正确选项
15.下列说法正确的是
A.化合反应和分解反应都属于化学基本反应类型 B.同种分子构成的物质是纯净物
C.不同种元素组成的物质是化合物 D.单质、化合物按物质种类划分
16.某反应的化学方程式是,相关分析正确的是
A.SiO2可能是气体 B.X是一氧化碳
C.Y是非金属单质 D.反应前后元素的存在形态均改变
17.利用如图装置验证了空气中氧气的体积分数,起始量筒内水的体积是80mL。下列叙述错误的是
A.实验前需检查装置气密性 B.红磷熄灭、集气瓶冷却后再打开止水夹
C.用木炭粉代替红磷也可达到实验目的 D.最终量筒中液面约降至40mL刻度线处
二、简答题(共30分)
18.伴随主火炬的点燃,第19届亚洲运动会开幕。从1936年固体镁金属燃料到1972年首次使用液体燃料,再到1996年后采用丙烷等含碳燃料,火炬燃料发生了巨大的变化。
(1)镁是由 构成。
(2)写出金属镁和氧气发生燃烧反应的化学方程式 。
(3)丙烷(C3H8)是无色无味气体,微溶于水,化学性质稳定,常用作燃料。上述描述中,属于丙烷物理性质的是 。
(4)杭州亚运会开幕式是世界上首次在主火炬燃料方面,创新使用“零碳”甲醇燃料。甲醇(化学式为CH3OH)燃烧的微观示意图如下:
I.甲醇有 种元素组成;各元素质量比是 ;其摩尔质量是 ;0.1mol甲醇的质量是 ;2mol甲醇分子中约含 个氧原子(用科学计数法表示)。
Ⅱ.如图中的甲、乙、丙、丁四种物质,属于单质的是 (填化学式,下同),属于氧化物的是 。
Ⅲ.根据甲醇燃烧的微观示意图判断,说法正确的是 (填序号)。
A.反应前后分子种类不变 B.反应前后原子的种类不变
C.反应前后物质种类不变 D.甲醇由碳、氢、氧三个原子构成
Ⅳ.目前,我国科学家合成了一种新型催化剂,可将二氧化碳和氢气转化为清洁的液体燃料甲醇(化学式为CH3OH)和水,写出该反应的化学方程式为 。
19.气体制备与性质研究是初中化学重要实验,请回答下列问题:
实验一:氧气制取
(1)实验室用固体氯酸钾和二氧化锰共热制取氧气,反应的化学方程式为 ;可用装置D收集氧气,该收集气体方法的名称是 ;
(2)已知固体高锰酸钾加热会产生氧气,同时生成固体锰酸钾和二氧化锰。用高锰酸钾固体制取氧气可选用的发生装置是 (选填编号);
(3)分别加热等质量的a(混有少量高锰酸钾的氯酸钾)和b(纯净的氯酸钾),则产生氧气速率a b(选填“等于”“小于”或“大于”)。
(4)利用如图装置收集氧气,气体应从 (填“m”或“n”)端进入。
(5)加热氯酸钾和二氧化锰混合物制取氧气,反应过程中,能正确表示对应变化关系的图像是_____(填字母编号)。
A. B.
C. D.
实验二:探究H2O2的质量分数对分解速率的影响如图所示,分别用注射器加入不同浓度的H2O2溶液(见下表),使用传感器测烧瓶中O2的浓度(烧瓶内气压变化在安全范围),绘制氧气浓度随时间变化的曲线:
试验编号 H2O2的质量分数(%) H2O2溶液的体积(mL) 对应曲线
I 3.4 10.0 a
Ⅱ 2.4 ___________ b
Ⅲ 1.7 10.0 /
(6)填写表中数据 。
(7)从曲线a、b中,可得出的结论是 。
(8)计算3.4gH2O2完全分解所得氧气的物质的量 。(根据化学方程式列式计算)
实验三 研究催化剂对KClO3分解反应的影响
编号 KC1O3质量(g) 催化剂种类 催化剂质量(g) 收集50mLO2所需时间(s)
实验1 5 170
实验2 5 MnO2 0.5 49
实验3 5 Fe2O3 0.5 60
实验4 5 KCl 0.5 152
(9)设置实验1的目的是 。
(10)KC1的名称是 ;表中催化剂的催化效果最佳的是 (填化学式)。维持加热条件不变,用实验1继续收集50mLO2,所需时间明显少于170s,解释原因: 。要比较KC1O3分解反应中不同催化剂的催化效果,除了测量收集50mLO2所需时间外,还可以测量 。
实验四 气体性质研究
100mL气体X可能是O2、CO2中的一种或两种,用下图所示装置进行实验(忽略气体的溶解)。
(11)若观察到甲中石灰水变浑浊,乙中石灰水始终未变浑浊,最终有10mL液体进入丙中,则气体X的成分是 。若气体X中只含有O2,则观察到的现象是 。
试卷第2页,共7页
1.C
【详解】A、矿石粉碎是矿石形态的转变,没有新物质生成,不属于化学变化,选项A不符合题意;
B、蔗糖溶解是分子间距发生变化,没有新物质的生成,不属于化学变化,选项B不符合题意;
C、燃气燃烧后生成水和其他物质,有新物质的生成,属于化学变化,选项C符合题意;
D、酒精挥发是酒精由液体变为气体,没有新物质生成,不属于化学变化,选项D不符合题意。
故选C。
2.D
【详解】A、汽水中有碳酸、水等物质,是混合物,故不符合题意;
B、河水中有可溶性、不溶性杂质,是混合物,故不符合题意;
C、湖水中有可溶性、不溶性杂质,是混合物,故不符合题意;
D、蒸馏水中只有一种物质,是纯净物,故符合题意。
故选D
3.B
【详解】空气是由多种气体组成的混合物,主要成分是氮气和氧气,其中氮气约占78%,氧气约为21%,所以含量最多的为氮气;故选B。
4.D
【详解】设SO3中硫元素的化合价为x,化合物中,氧元素一般显-2价,根据化合物中各种元素化合价的代数和等于零,则:x+(-2)×3=0,得:x=+6。故选:D。
5.B
【详解】A、二氧化碳能溶于水,pH约为5.6,酸雨是指pH小于5.6的雨水,故错误;
B、二氧化硫与水反应生成亚硫酸,亚硫酸被氧化成硫酸,能形成酸雨,故正确;
C、氮气难溶于水,不会形成酸雨,故错误;
D、氧气不易溶于水,不会形成酸雨,故错误;
故选:B
6.C
【详解】A、氢气在氧气中燃烧产生蓝色火焰,错误;
B、镁在氧气中燃烧时,发出耀眼的白光,放出大量的热,生成一种白色固体,生成氧化镁是结论不是现象,错误;
C、硫在氧气中燃烧时,发出明亮的蓝紫色的火焰,正确;
D、铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体,错误;
故选C。
7.A
【详解】A. 正因为分子之间有间隔,所以才可以将空气压入车胎内,用打气筒将空气压入自行车胎内,分子之间的间隔减小。故A符合题意;
B. 分子是由原子构成的,在化学变化中分子可以破裂成为原子,而用打气筒将空气压入车胎内,发生的是物理变化,故B不符合题意;
C. 分子无时无刻不在做无规则运动,而用打气筒将空气压入自行车内,改变的是分子之间的间隔,与分子在不断运动无关,故C不符合题意;
D. 用打气筒将空气压入自行车胎内,分子之间的间隔变小,分子本身的体积没有变化,故D不符合题意。
故选A。
8.A
【详解】A、构成物质的粒子由分子、原子和离子,所以分子、原子都可以直接构成物质,故A项正确;
B、分子原子都很小,但分子不一定比原子大,比如:氢分子和铜原子,铜原子比氢分子大,故C项错误;
C、原子是化学变化中的最小粒子,分子是由原子构成的,在物理变化中,原子可以再分,故C项错误;
D、由分子构成的物质,分子是保持物质化学性质的最小粒子,故D项错误;
答案:A。
9.B
【详解】A、用元素符号来表示一个原子,由元素符号前面的数字表示原子的个数,表示多个该原子,2O表示2个氧原子,故A不符合题意;
B、化学式可以表示物质的名称,从右向左读,P2O5可表示五氧化二磷,故B符合题意;
C、化学式可以表示微观一个分子,H2表示1个氢分子,2H表示2个氢原子,故C不符合题意;
D、化合价标在元素符号的正上方,正负号在前,价数在后,表示钙元素的化合价为+2,故D不符合题意;
故选:B。
10.A
【详解】A. 粗盐提纯实验当中,用药匙来取用粗盐,故A符合题意;
B. 粗盐提纯实验当中不用量筒,粗盐是在烧杯中进行的,量筒不可以用来溶解药品,故B不符合题意;
C. 粗盐提纯实验当中,过滤器的制作用到的是普通漏斗,而不是分液漏斗,故C不符合题意;
D. 粗盐提纯实验中蒸发滤液用到的是蒸发皿,而不是表面皿,故D不符合题意。
故选A。
11.B
【详解】A、氦气为稀有气体,化学式为He,该选项说法不正确;
B、氦气在自然界中以单质形式存在,则存在形态为游离态,该选项说法正确;
C、密度不需要通过化学变化就能表现出来的性质,属于物理性质,该选项说法不正确;
D、氦气不具有助燃性,该选项说法不正确。
故选B。
12.A
【详解】A、由图可知,该物质是由分子构成,是由两种元素组成,该选项正确;
B、该物质是由分子构成,则保持该物质化学性质的最小微粒为分子,但一个分子并不能保持其物理性质,该选项不正确;
C、由图可知,该物质的一个分子由4个原子构成,该选项不正确;
D、元素符号右下角的数字表示分子中原子个数,则该物质的化学式可能为H2O2,该选项不正确。
故选A。
13.C
【分析】从分子原子角度进行分析解答。
【详解】因为每个氧原子质量都相同,故SO2与SO3含氧元素的质量相同则中氧原子个数就应该相等,C选项正确,符合题意。
故选C。
【点睛】本题为化学式的相关计算,此题难度不大,注意化学中的计算题不要当做数学题进行计算,应该从化学的角度即分子原子的角度分析问题。
14.B
【详解】A、硫和氧气在点燃条件下生成二氧化硫,反应物中有气体,生成物中气体不需要加气体符号,反应的化学方程式为:,故选项A不正确;
B、反应前氧元素的化合价为0价,反应后氧元素化合价为-2价,反应前后氧元素的化合价发生变化,故选项B正确;
C、在反应中“+”读作“和”,该反应从物质的角度可读作:硫和氧气在点燃的条件下生成二氧化硫,故选项C不正确;
D、根据化学方程式可知,硫和氧气参加反应的质量比为1:1,则1.5克硫和1克氧气在点燃条件下反应,硫只有1g参加反应,生成2克二氧化硫,故选项D不正确;
故选:B。
15.AB
【详解】A.化合反应和分解反应都属于化学基本反应类型,故A正确;
B.纯净物由一种物质组成,同种分子构成的物质是纯净物,故B正确;
C.不同种元素组成的物质不一定是化合物,如空气属于混合物,故C错误;
D.单质、化合物按物质组成元素种类划分,单质是由同种元素组成的纯净物,化合物是由不同种元素组成的纯净物,故D错误。
故选:AB。
16.BC
【详解】A、SiO2通常情况下是固体,故选项说法错误;
B、硅和碳在高温下反应生成单质硅和一氧化碳,根据质量守恒定律反应前后原子的种类和数目不变,反应前有1个硅原子、2个氧原子、2个碳原子,X是气体,因此X是一氧化碳,Y是硅,故选项说法正确;
C、硅和碳在高温下反应生成单质硅和一氧化碳,硅单质属于非金属单质,故选项说法正确;
D、根据选项B可知,反应前后碳元素由游离态变为化合态,硅元素由化合态变为游离态,但是氧元素反应前后都是化合态,故选项说法错误。
故选BC。
17.CD
【详解】A、实验前检查装置气密性是实验成功的前提条件,正确,不符合题意;
B、红磷熄灭、试管冷却后再打开止水夹,防止升温使得气体膨胀导致测得空气中氧气的体积分数偏低,正确,不符合题意;
C、用木炭粉代替红磷会导致测得空气中氧气的体积分数偏低,不能够达到实验目的,因为木炭燃烧会产生二氧化碳气体,影响实验中产生压强差的数值,故错误,符合题意;
D、空气中氧气的体积分数约为,因此进入试管中的水的体积为:,因此,最终量筒中液面约降至刻度线处,错误,符合题意;故选CD。
18.(1)镁原子
(2)
(3)无色无味气体,微溶于水
(4) 3##三 3:1:4 32g/mol 3.2g##3.2克 4.816×1024 O2 H2O B
【详解】(1)镁是金属,所以镁是由镁原子构成的;
(2)镁和氧气在点燃的条件下生成氧化镁,该反应的化学方程式为;
(3)物理性质是指不需要通过化学变化就表现的性质,根据题意可知,属于丙烷物理性质的是无色无味气体,微溶于水;
(4)由微观示意图可知,甲醇燃烧的化学方程式为,
Ⅰ、由甲醇的化学式CH3OH可知,甲醇是由碳氢氧三种元素组成的;
甲醇中碳氢氧元素的质量比为12:4:16=3:1:4;
甲醇的相对分子质量为12+4+16=32,所以甲醇的摩尔质量为32g/mol;
0.1mol甲醇的质量是0.1mol×32 g/mol=3.2g;
1mol甲醇分子中约含6.02×1023个分子,2mol甲醇分子中约含2×6.02×1023×4=4.816×1024个氧原子;
Ⅱ、由同种元素组成的纯净物为单质,由两种元素组成,其中一种是氧元素的化合物是氧化物,分析甲醇燃烧的化学方程式可知,甲、乙、丙、丁四种物质,属于单质的是乙,化学式为O2;属于氧化物的丁,化学式为H2O;
Ⅲ、A、在化学变化中分子分解成原子,原子重新组合成新的分子,所以化学反应前后分子的种类一定改变,故选项错误;
B、化学反应前后原子的种类、个数、质量不变,故选项正确;
C、化学变化是指有新物质生成的变化,故选项错误;
D、甲醇由甲醇分子构成的,甲醇分子是由碳、氢、氧三种原子构成,故选项错误;
故选B
Ⅳ、二氧化碳和氢气在催化剂的作用下生成甲醇和水,该反应的化学方程式为。
19.(1) ↑ 向上排空气法
(2)A
(3)大于
(4)m
(5)C
(6)10.0
(7)其它条件相同时,过氧化氢溶液质量分数越大,反应速率越快
(8)3.4g过氧化氢物质的量为:,
设生成氧气的物质的量为x,
,x=0.05mol;
答:理论上完全分解可以生成0.05mol氧气。
(9)对比实验
(10) 氯化钾 MnO2 氯酸钾分解产生氯化钾,起催化作用 相同时间内,收集气体体积的多少
(11) 10mL氧气和 90mL二氧化碳 甲乙中石灰水不变浑浊,且乙中石灰水流入丙中约100mL
【详解】(1)氯酸钾在二氧化锰催化作用下加热反应生成氯化钾和氧气,书写化学方程式注意配平及气体符号,所以化学方程式为↑;D为向上排空气法收集装置;
(2)反应物为固体,且需要加热,故选A为发生装置;
(3)高锰酸钾分解生成二氧化锰,可以加快氯酸钾分解,所以反应速度为a大于b;
(4)氧气的密度大于空气,若用如图装置收集氧气,气体应从m端通入;
(5)A、氯酸钾在二氧化锰的催化作用下加热生成氧气和氯化钾,氧气的质量逐渐增大,然后不变,不会出现减小的情况,故选项错误;
B、根据剩余固体逐渐减小,锰元素的质量不变,所以锰元素的质量分数逐渐增大,然后不变,故选项错误;
C、氯酸钾分解生成了氯化钾和氧气,二氧化锰中也含有氧元素,所以固体中氧元素的质量分数先减小,然后不变,故选项正确;
D、剩余固体中氯化钾的质量应该从零开始逐渐增大,故选项错误。
故选:C。
(6)为了进行对比,表中数据应该是10.0;
(7)从曲线a、b中,可得出的结论是其它条件相同时,过氧化氢溶液质量分数越大,反应速率越快;
(8)见答案
(9)通过对比才能知道实验2、3、4中加入药品后有无催化作用;
(10)KCl读作氯化钾;除了加入药品不同外,其他条件都相同,根据对比可知,收集相同体积的氧气,实验2所用时间最短,即二氧化锰的催化效果最好;维持加热条件不变,用实验1再继续收集收集50mLO2,所需时间明显少于170s,是因为氯酸钾分解产生氯化钾,起催化作用;要比较KClO3分解反应中不同催化剂的催化效果,除了测量收集50mLO2所需时间外,还可以测量相同时间内,收集气体体积的多少;
(11)若观察到甲中石灰水变浑浊,乙中石灰水始终未变浑浊,最终有10mL液体进入丙中,则气体 X 一定有二氧化碳,且不易溶于水的氧气进入乙瓶,被挤出的液体体积即为氧气的体积,则混合气体是10mL氧气和 90mL二氧化碳;若气体 X 中只含有O2,则观察到的现象是:甲乙中石灰水不变浑浊,且乙中石灰水流入丙中约100mL。
答案第8页,共8页
答案第7页,共7页
同课章节目录
