3.1铁及其化合物 第三课时课件(共25页)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 3.1铁及其化合物 第三课时课件(共25页)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 7.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 08:07:58 | ||
图片预览


文档简介
(共25张PPT)
人教版 高中化学必修1 第三章 第一节
Fe2+和Fe3+的性质及其检验
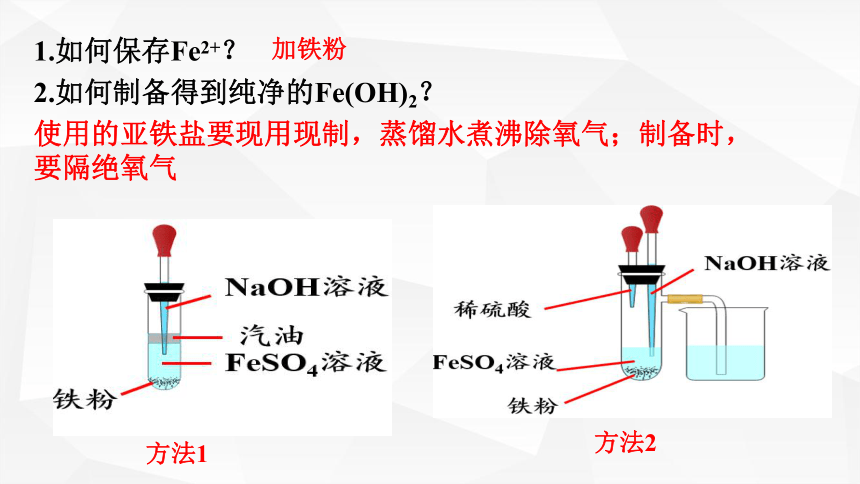
1.如何保存Fe2+?
2.如何制备得到纯净的Fe(OH)2?
使用的亚铁盐要现用现制,蒸馏水煮沸除氧气;制备时,要隔绝氧气
加铁粉
方法1
方法2
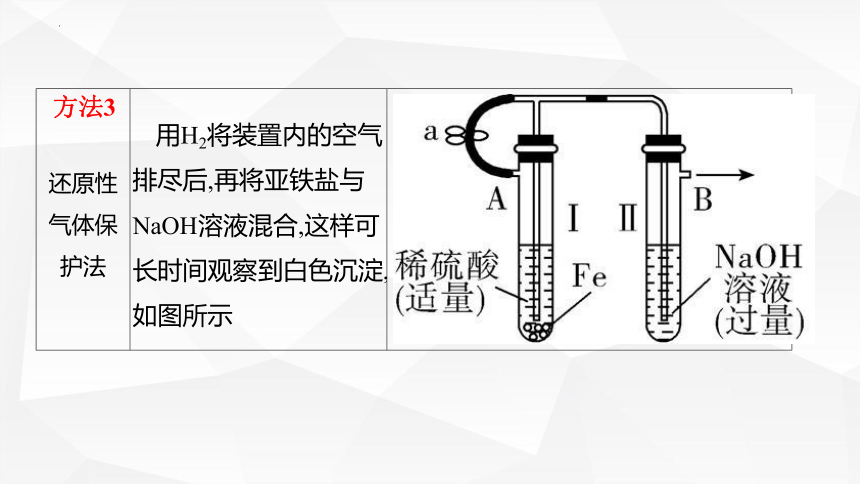
还原性 气体保 护法 用H2将装置内的空气排尽后,再将亚铁盐与NaOH溶液混合,这样可长时间观察到白色沉淀,如图所示
方法3
【问题1】有哪些方法可以鉴别FeCl2溶液和FeCl3溶液?
【拓展】除杂:
(1)FeCl2溶液中含有FeCl3杂质
(1)FeCl3溶液中含有FeCl2杂质
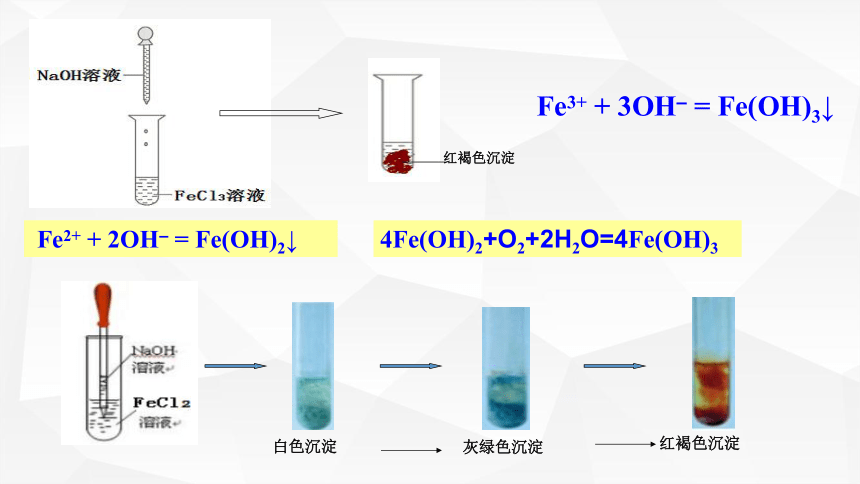
白色沉淀
灰绿色沉淀
红褐色沉淀
红褐色沉淀
Fe3+ + 3OH– = Fe(OH)3↓
Fe2+ + 2OH– = Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
KSCN溶液
Fe3+
(硫氰化钾溶液)
KSCN溶液
(硫氰化钾溶液)
Fe2+
血红色溶液
无明显现象
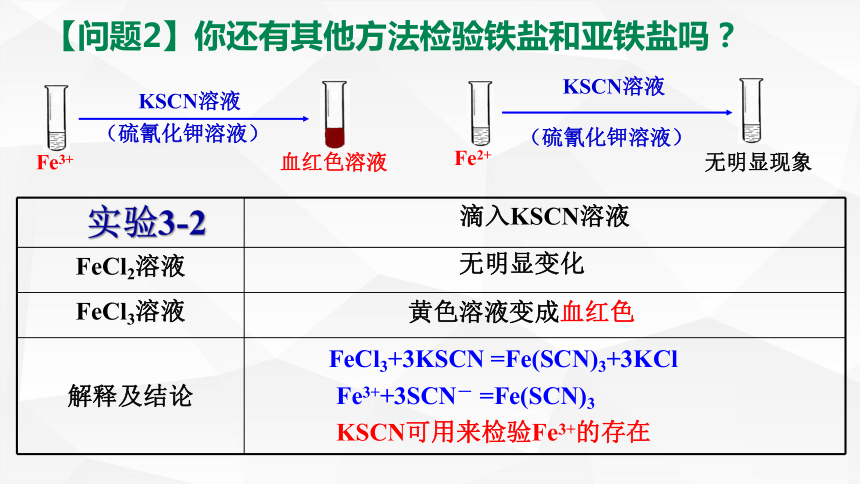
【问题2】你还有其他方法检验铁盐和亚铁盐吗?
实验3-2 滴入KSCN溶液
FeCl2溶液
FeCl3溶液
解释及结论
无明显变化
黄色溶液变成血红色
FeCl3+3KSCN =Fe(SCN)3+3KCl
Fe3++3SCN- =Fe(SCN)3
KSCN可用来检验Fe3+的存在
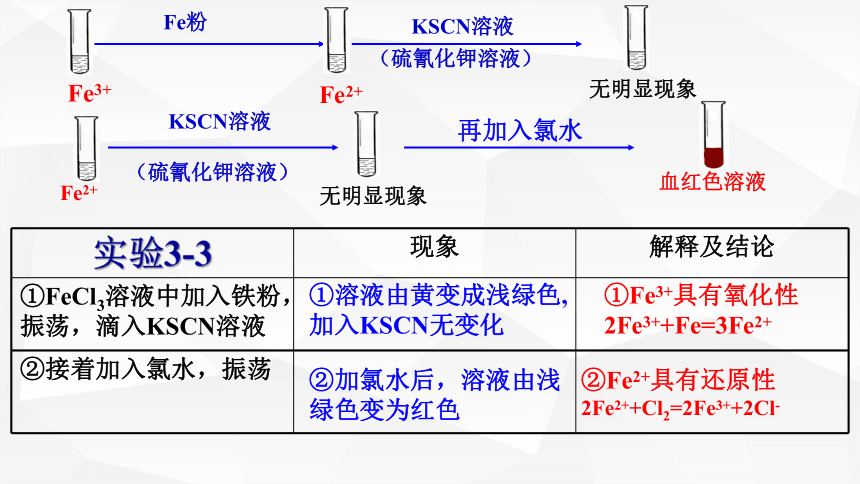
实验3-3 现象 解释及结论
①FeCl3溶液中加入铁粉,振荡,滴入KSCN溶液
②接着加入氯水,振荡
①溶液由黄变成浅绿色,加入KSCN无变化
②加氯水后,溶液由浅绿色变为红色
①Fe3+具有氧化性
2Fe3++Fe=3Fe2+
②Fe2+具有还原性
2Fe2++Cl2=2Fe3++2Cl-
Fe粉
Fe3+
无明显现象
KSCN溶液
(硫氰化钾溶液)
Fe2+
KSCN溶液
(硫氰化钾溶液)
Fe2+
再加入氯水
血红色溶液
无明显现象
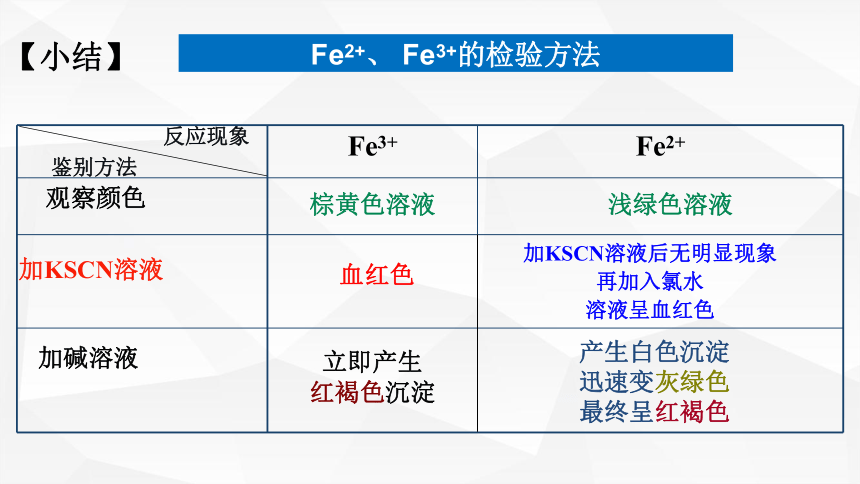
鉴别方法
反应现象
Fe3+ Fe2+
Fe2+、 Fe3+的检验方法
浅绿色溶液
棕黄色溶液
立即产生
红褐色沉淀
加KSCN溶液后无明显现象
再加入氯水
溶液呈血红色
血红色
加KSCN溶液
加碱溶液
观察颜色
【小结】
产生白色沉淀
迅速变灰绿色
最终呈红褐色
Fe2+、 Fe3+相互转化的条件
问题3:Fe2+
Fe3+
请同学们讨论探究Fe2+转化为Fe3+实验方案。
可选试剂:FeCl2溶液、FeCl3溶液、KSCN溶液、新制氯水、H2O2溶液、铁粉、铜粉。
1、将讨论好的实验方案记载下来
氧化剂
还原剂
还原性
氧化性
2、写下相应的离子方程式
还原剂:金属单质,如铁、铜、S2-、I- 等
氧化剂:Cl2、H2O2、 O2 、 HNO3、浓H2SO4 、 KMnO4 、 KClO3
Fe2+ Fe3+
氧化剂
还原剂
2Fe3+ + Cu === 3Fe2+
2Fe2+ + H2O2 + 2H+ === 2Fe3+ + 2H2O
2Fe2+ + Cl2 === 2Fe3+ + 2Cl—
还原性 氧化性
2Fe3+ + Fe === 3Fe2+
【思考】
(1)储存很久的FeSO4溶液,如何证明是否变质?
加KSCN溶液,变红,则证明变质
(2)为了检验某浅黄色FeCl3溶液中是否含有Fe2+,下列实验方案正确的是( )
A.滴入KSCN溶液,观察溶液是否变为血红色
B.滴入KMnO4溶液,观察紫红色是否褪去
C.滴入NaOH溶液,观察是否出现白色沉淀
D.加入铁钉,观察溶液是否变为浅绿色
B
学以致用1——印刷电路板
制作过程:
先在塑料板上镀上一层铜,然后在设计好的铜线路上涂上一层石蜡,把板浸到氯化铁溶液中,没有被石蜡覆盖住的铜就被反应掉。
2Fe3++Cu = 2Fe2+ +Cu2+
补Fe2+
学以致用2——亚铁补血剂
本品为薄膜衣片,除去薄膜衣后显暗黄色
维生素C与本品同服,有利于本品吸收
防止二价铁被氧化
防止二价铁被氧化
说明书解析
探究实验:取1mlFeCl3溶液,加入一片Vc片,充分振荡,待Vc片部分溶解后再滴加1~2滴KSCN溶液,观察现象,思考Vc片的作用。
浅绿
Zn+Fe2+ == Fe+Zn2+
2Fe2++Cl2 == 2Fe3++2Cl-
1.亚铁盐和铁盐
(1)亚铁盐
含有Fe2+的溶液,呈 色,既有氧化性,又有还原性。
①氧化性
Fe2+与Zn反应的离子方程式为 。
②还原性
Fe2+与Cl2反应的离子方程式为 。
(2)铁盐
①氧化性
含Fe3+的溶液,呈黄色,Fe3+具有较强的氧化性。Fe3+与Cu、I-反应的离子方程式为 、 。
②特性
含有Fe3+的盐溶液遇到 时变成红色。
③FeCl3易水解
将其饱和溶液滴入沸水中制备胶体的化学方程式 。
KSCN
2Fe3++Cu=Cu2++2Fe2+
2Fe3++2I-=2Fe2++I2
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
Cl2、 H2O2等
Fe
Fe2+
Fe3+
Cu2+
等
Cl2
等
弱氧化剂
强氧化剂
H+
还原剂
Fe、Cu等
强氧化剂
还原性、氧化性
还原性
氧化性
【课堂总结】“铁三角”关系
Fe
FeCl2
Fe3O4
H2O(g)或O2
FeCl3
Fe(OH)2
Fe(OH)3
Fe2O3
Cl2
HCl
NaOH
NaOH
FeO
HCl
HCl
HCl
O2+H2O
氯水
Fe
△
HCl
Fe(SCN)3
KSCN
白色沉淀
红褐色沉淀
血红色
灰绿色
判断下列描述的正误(正确的打“√”,错误的打“×”)
(1)金属阳离子只有氧化性,不可能有还原性( )
(2)氢氧化铁与HI溶液仅能发生中和反应( )
×
×
[解析]还会发生2Fe3++2I-=2Fe2++I2。
对点自测
(3)1 mol FeI2与足量氯气反应时转移的电子数为2NA( )
[解析]1 mol FeI2与足量氯气反应时转移的电子数为3NA。
[解析] Fe2+既有氧化性,又有还原性。
×
(4)检验Fe(NO3)2晶体是否变质:将样品溶于稀H2SO4后滴加KSCN溶液,观察溶液是否变红( )
(5)FeCl3溶液与KSCN溶液反应的离子方程式为Fe3++3SCN-=Fe(SCN)3↓( )
×
×
(6)向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含有Fe2+( )
√
[解析] Fe(SCN)3不是沉淀。
1、要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时最佳顺序为 ( )
①加入足量氯水 ②加入足量KMnO4 ③加入少量KSCN溶液
A. ①③ B. ③②
C. ③① D. ①②③
C
跟踪训练
2、下列离子方程式书写正确的是: ( )
A. 氯化亚铁溶液中通入氯气:
2Fe2+ + Cl2 = 2Fe3++2Cl-
B. 铜粉加入到氯化铁溶液中:
Cu+ Fe3+ = Fe2++Cu2+
C. 铁片加入到稀盐酸溶中:
Fe + 2H+ = Fe3+ + H2↑
D. 铁棒伸入到硫酸铜溶液中 :
2Fe + 3Cu2+ = 2Fe3+ + 3Cu
A
3.[2019·安徽合肥模拟] 选择合适试剂完成甲、乙两组实验。
甲组:检验含Fe3+的溶液中是否含有Fe2+ 乙组:检验含Fe2+的溶液中是否含有Fe3+
下列试剂选取正确的一项是( )
甲组 乙组
A 新制氯水、KSCN溶液 NaOH溶液
B 酸性KMnO4溶液 KSCN溶液
C NaOH溶液 溴水
D 溴水 酸性KMnO4溶液
B
[解析] 甲组:检验含Fe3+的溶液中是否含有Fe2+,由于Fe2+具有还原性,能使酸性高锰酸钾溶液褪色,Fe3+不能使酸性高锰酸钾溶液褪色,所以检验是否含有Fe2+可以选用酸性高锰酸
谢谢!
人教版 高中化学必修1 第三章 第一节
Fe2+和Fe3+的性质及其检验
1.如何保存Fe2+?
2.如何制备得到纯净的Fe(OH)2?
使用的亚铁盐要现用现制,蒸馏水煮沸除氧气;制备时,要隔绝氧气
加铁粉
方法1
方法2
还原性 气体保 护法 用H2将装置内的空气排尽后,再将亚铁盐与NaOH溶液混合,这样可长时间观察到白色沉淀,如图所示
方法3
【问题1】有哪些方法可以鉴别FeCl2溶液和FeCl3溶液?
【拓展】除杂:
(1)FeCl2溶液中含有FeCl3杂质
(1)FeCl3溶液中含有FeCl2杂质
白色沉淀
灰绿色沉淀
红褐色沉淀
红褐色沉淀
Fe3+ + 3OH– = Fe(OH)3↓
Fe2+ + 2OH– = Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
KSCN溶液
Fe3+
(硫氰化钾溶液)
KSCN溶液
(硫氰化钾溶液)
Fe2+
血红色溶液
无明显现象
【问题2】你还有其他方法检验铁盐和亚铁盐吗?
实验3-2 滴入KSCN溶液
FeCl2溶液
FeCl3溶液
解释及结论
无明显变化
黄色溶液变成血红色
FeCl3+3KSCN =Fe(SCN)3+3KCl
Fe3++3SCN- =Fe(SCN)3
KSCN可用来检验Fe3+的存在
实验3-3 现象 解释及结论
①FeCl3溶液中加入铁粉,振荡,滴入KSCN溶液
②接着加入氯水,振荡
①溶液由黄变成浅绿色,加入KSCN无变化
②加氯水后,溶液由浅绿色变为红色
①Fe3+具有氧化性
2Fe3++Fe=3Fe2+
②Fe2+具有还原性
2Fe2++Cl2=2Fe3++2Cl-
Fe粉
Fe3+
无明显现象
KSCN溶液
(硫氰化钾溶液)
Fe2+
KSCN溶液
(硫氰化钾溶液)
Fe2+
再加入氯水
血红色溶液
无明显现象
鉴别方法
反应现象
Fe3+ Fe2+
Fe2+、 Fe3+的检验方法
浅绿色溶液
棕黄色溶液
立即产生
红褐色沉淀
加KSCN溶液后无明显现象
再加入氯水
溶液呈血红色
血红色
加KSCN溶液
加碱溶液
观察颜色
【小结】
产生白色沉淀
迅速变灰绿色
最终呈红褐色
Fe2+、 Fe3+相互转化的条件
问题3:Fe2+
Fe3+
请同学们讨论探究Fe2+转化为Fe3+实验方案。
可选试剂:FeCl2溶液、FeCl3溶液、KSCN溶液、新制氯水、H2O2溶液、铁粉、铜粉。
1、将讨论好的实验方案记载下来
氧化剂
还原剂
还原性
氧化性
2、写下相应的离子方程式
还原剂:金属单质,如铁、铜、S2-、I- 等
氧化剂:Cl2、H2O2、 O2 、 HNO3、浓H2SO4 、 KMnO4 、 KClO3
Fe2+ Fe3+
氧化剂
还原剂
2Fe3+ + Cu === 3Fe2+
2Fe2+ + H2O2 + 2H+ === 2Fe3+ + 2H2O
2Fe2+ + Cl2 === 2Fe3+ + 2Cl—
还原性 氧化性
2Fe3+ + Fe === 3Fe2+
【思考】
(1)储存很久的FeSO4溶液,如何证明是否变质?
加KSCN溶液,变红,则证明变质
(2)为了检验某浅黄色FeCl3溶液中是否含有Fe2+,下列实验方案正确的是( )
A.滴入KSCN溶液,观察溶液是否变为血红色
B.滴入KMnO4溶液,观察紫红色是否褪去
C.滴入NaOH溶液,观察是否出现白色沉淀
D.加入铁钉,观察溶液是否变为浅绿色
B
学以致用1——印刷电路板
制作过程:
先在塑料板上镀上一层铜,然后在设计好的铜线路上涂上一层石蜡,把板浸到氯化铁溶液中,没有被石蜡覆盖住的铜就被反应掉。
2Fe3++Cu = 2Fe2+ +Cu2+
补Fe2+
学以致用2——亚铁补血剂
本品为薄膜衣片,除去薄膜衣后显暗黄色
维生素C与本品同服,有利于本品吸收
防止二价铁被氧化
防止二价铁被氧化
说明书解析
探究实验:取1mlFeCl3溶液,加入一片Vc片,充分振荡,待Vc片部分溶解后再滴加1~2滴KSCN溶液,观察现象,思考Vc片的作用。
浅绿
Zn+Fe2+ == Fe+Zn2+
2Fe2++Cl2 == 2Fe3++2Cl-
1.亚铁盐和铁盐
(1)亚铁盐
含有Fe2+的溶液,呈 色,既有氧化性,又有还原性。
①氧化性
Fe2+与Zn反应的离子方程式为 。
②还原性
Fe2+与Cl2反应的离子方程式为 。
(2)铁盐
①氧化性
含Fe3+的溶液,呈黄色,Fe3+具有较强的氧化性。Fe3+与Cu、I-反应的离子方程式为 、 。
②特性
含有Fe3+的盐溶液遇到 时变成红色。
③FeCl3易水解
将其饱和溶液滴入沸水中制备胶体的化学方程式 。
KSCN
2Fe3++Cu=Cu2++2Fe2+
2Fe3++2I-=2Fe2++I2
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
Cl2、 H2O2等
Fe
Fe2+
Fe3+
Cu2+
等
Cl2
等
弱氧化剂
强氧化剂
H+
还原剂
Fe、Cu等
强氧化剂
还原性、氧化性
还原性
氧化性
【课堂总结】“铁三角”关系
Fe
FeCl2
Fe3O4
H2O(g)或O2
FeCl3
Fe(OH)2
Fe(OH)3
Fe2O3
Cl2
HCl
NaOH
NaOH
FeO
HCl
HCl
HCl
O2+H2O
氯水
Fe
△
HCl
Fe(SCN)3
KSCN
白色沉淀
红褐色沉淀
血红色
灰绿色
判断下列描述的正误(正确的打“√”,错误的打“×”)
(1)金属阳离子只有氧化性,不可能有还原性( )
(2)氢氧化铁与HI溶液仅能发生中和反应( )
×
×
[解析]还会发生2Fe3++2I-=2Fe2++I2。
对点自测
(3)1 mol FeI2与足量氯气反应时转移的电子数为2NA( )
[解析]1 mol FeI2与足量氯气反应时转移的电子数为3NA。
[解析] Fe2+既有氧化性,又有还原性。
×
(4)检验Fe(NO3)2晶体是否变质:将样品溶于稀H2SO4后滴加KSCN溶液,观察溶液是否变红( )
(5)FeCl3溶液与KSCN溶液反应的离子方程式为Fe3++3SCN-=Fe(SCN)3↓( )
×
×
(6)向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含有Fe2+( )
√
[解析] Fe(SCN)3不是沉淀。
1、要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时最佳顺序为 ( )
①加入足量氯水 ②加入足量KMnO4 ③加入少量KSCN溶液
A. ①③ B. ③②
C. ③① D. ①②③
C
跟踪训练
2、下列离子方程式书写正确的是: ( )
A. 氯化亚铁溶液中通入氯气:
2Fe2+ + Cl2 = 2Fe3++2Cl-
B. 铜粉加入到氯化铁溶液中:
Cu+ Fe3+ = Fe2++Cu2+
C. 铁片加入到稀盐酸溶中:
Fe + 2H+ = Fe3+ + H2↑
D. 铁棒伸入到硫酸铜溶液中 :
2Fe + 3Cu2+ = 2Fe3+ + 3Cu
A
3.[2019·安徽合肥模拟] 选择合适试剂完成甲、乙两组实验。
甲组:检验含Fe3+的溶液中是否含有Fe2+ 乙组:检验含Fe2+的溶液中是否含有Fe3+
下列试剂选取正确的一项是( )
甲组 乙组
A 新制氯水、KSCN溶液 NaOH溶液
B 酸性KMnO4溶液 KSCN溶液
C NaOH溶液 溴水
D 溴水 酸性KMnO4溶液
B
[解析] 甲组:检验含Fe3+的溶液中是否含有Fe2+,由于Fe2+具有还原性,能使酸性高锰酸钾溶液褪色,Fe3+不能使酸性高锰酸钾溶液褪色,所以检验是否含有Fe2+可以选用酸性高锰酸
谢谢!
