3.1.1铁的单质课件(共25页)2023-2024学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 3.1.1铁的单质课件(共25页)2023-2024学年上学期高一化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 08:09:53 | ||
图片预览








文档简介
(共25张PPT)
第
三
章
铁
金
属
材
料
第一 节 铁 及 其 化 合 物
铁 的 单 质
化学1 必修 人民教育出版社
化学2 必修 人民教育出版社
教 学 目 标
核 心 素 养
1.了解铁的物理性质,掌握铁与不同氧化剂反应的产物的判断。
2.掌握铁与水反应的实质,熟悉反应现象,能写出化学方程式。
1.了解铁的发现及生活中铁的应用,培养学生树立化学为人类服务的思想。
2.通过铁与水蒸气的反应培养学生设计实验方案探究物质的转化的能力。
问题思考
陨石即是坠星的另一种,是来自地球之外的"客人"。含石量大的陨星称为陨石,含铁量大的陨星称为陨铁。陨星的形状各异,最大的陨石是重1770千克的吉林1 号陨石,最重的陨铁是纳米比亚的戈巴陨铁 ,重约60吨。
戈巴陨铁一角
资料卡片
缺铁性贫血
缺铁性贫血主要是由于铁摄入不足或丢失过多致使血清铁明显减少、贮存铁极度减少所引起的一种贫血。
人体内的含铁化合物主要分为两类:即功能性铁和储存铁。功能性铁参与氧的运输,其余的铁与一些酶结合,分布于身体各器官。体内缺铁将会导致人的记忆能力、免疫能力和对温度的适应能力等生理功能下降。如果体内的铁不足以供给生命活动的需要,就会发生贫血。
以药物治疗为主,辅以纠正偏食,给予高蛋白、富含维生素、富含铁的食物。
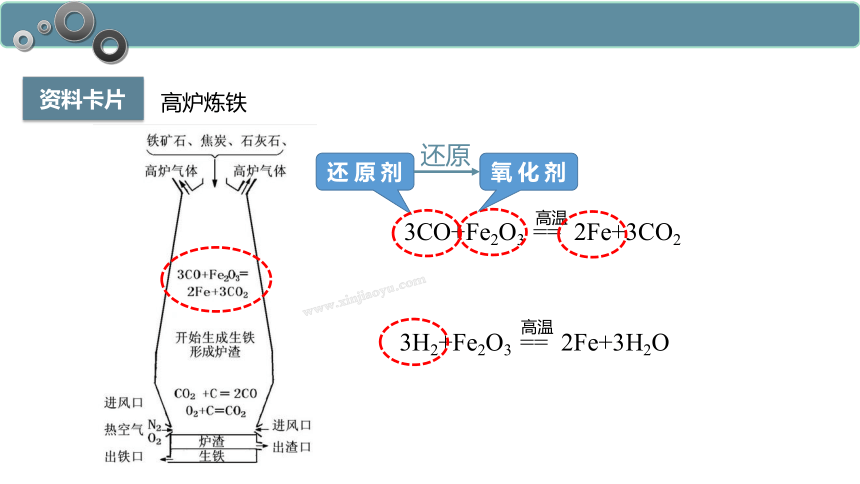
资料卡片
高炉炼铁
3CO+Fe2O3 == 2Fe+3CO2
高温
还 原 剂
还原
3H2+Fe2O3 == 2Fe+3H2O
高温
氧 化 剂
思考交流
利用了铁的哪些性质?铁还有哪些性质?
知识点一
延展性和导热性、导电性、能被磁体吸引
一、铁的单质
1. 物理性质
思考交流
一、铁的单质
1. 物理性质
2. 化学性质
写出:铁与氧气、氯气的反应、铁与盐酸的反应、铁与硫酸铜溶液的反应的化学方程式。
思考:铁的化合价的变化有什么异同?
为什么会有这样的异同?
知识点二
强氧化剂:氯气、硝酸、氧气等
弱氧化剂:盐酸、硫酸铜、硫等
氧化反应:Fe - 2e- = Fe2+
氧化反应:Fe -3e- = Fe3+
一、铁的单质
2. 化学性质
1. 物理性质
知识点二
一、铁的单质
2. 化学性质
1. 物理性质
(1)与非金属单质的反应
(2)与酸的反应
(3)与某些盐的反应
2Fe +3Cl2 == 2FeCl3
点燃
3Fe +2O2 == Fe3O4
点燃
Fe +S == FeS
Fe + 2H+ == Fe2++ H2
Fe + Cu2+ == Fe2++ Cu
问题思考
炽热的铁水注入模具之前,模具必须进行充分的干燥处理,不得留有水。
?
实验探究
2. 预测铁与水反应的产物是什么?从物质的类别和元素的价态的变化完成对反应的预测。
1. 铁和水在常温下能反应吗?如何提供水蒸气?如何提供反应所需的高温?
3. 如何验证铁与水反应生成的气体产物?
4. 如何组装并完成实验?
问题探究
1. 人们常用金属器皿(如铁壶、铝壶)来盛水,但铁与水可以反应,这一问题应怎样认识?
3. 铁制品如何保存?
2. 金属铁与水反应与金属钠与水反应有何异同?
知识点二
一、铁的单质
2. 化学性质
1. 物理性质
(1)与非金属单质的反应
(2)与酸的反应
(3)与某些盐的反应
(4)与水的反应
3Fe+4H2O(g) == Fe3O4+4H2
高温
知识运用
1. 将0.3 mol钠、0.1 mol铁分别加入到各盛有500 mL 0.2 mol·L-1稀硫酸的两个烧杯中,下列说法正确的是( )
A. 两个烧杯中金属沉在液面下
B. 两个烧杯中都没有金属剩余
C. 两个烧杯中都有金属剩余
D. 两个烧杯中产生氢气的质量相同
B
知识运用
2. 向500 mL 2 mol·L-1的CuSO4溶液中插入一铁片,反应片刻后取出铁片,洗涤、烘干,称其质量比原来增加2.0 g。下列说法错误的是(设反应后溶液的体积不变)( )
A. 参加反应的铁的质量是14 g
B. 析出的铜的物质的量是0.25 mol
C. 反应后溶液中c(CuSO4)=1.5 mol·L-1
D. 反应后溶液中c(FeSO4)=1.5 mol·L-1
D
知识运用
3. 某同学欲在实验室中完成铁与水蒸气反应的实验,装置如图甲、乙。
已知B中放入的是铁粉与石棉绒的混合物,C中放的是干燥剂,E为酒精喷灯,G为带有铁丝网罩的酒精灯。
(1)如何检查乙装置的气密性?
____________________________________________
_________________________________________________________________________________________。
(2)乙装置中湿沙子的作用是___________。
(3)B处发生反应的化学方程式为:
______________________________________。
知识运用
向H中加入水没过导管口,连接好装置,微热K,若H中导管口出现气泡,停止加热后导管中出现水柱,证明气密性良好(其他合理答案也可)
提供水蒸气
3Fe+4H2O(g) == Fe3O4+4H2
高温
知识运用
(4)该同学认为在乙装置的导管口处点燃反应产生的气体,装置H必不可少,H的作用是:__________________________________。
(5) 甲、乙两装置的B和K,B的优点是_____________________________________________
________________________。
干燥氢气,降低氢气中水蒸气的含量
石棉绒的使用增大了水蒸气与铁粉的接触面积,
使反应充分进行
1.下列说法正确的是
A.我国在战国中期就开始使用铁制品
B.自然界中的铁元素只存在于化合物中
C.铁能与所有金属的盐溶液反应生成亚铁盐和金属
D.高炉炼铁是用还原剂将铁从它的化合物中还原出来
√
1
2
3
自我测试
我国目前发现最早的人工冶铁制品是春秋初年秦国的铜柄铁剑,A项错误;
陨铁中的Fe以单质形态存在,B项错误;
Fe只能将金属活动性比它弱的金属从其盐溶液中置换出来,C项错误;
高炉炼铁是用CO等还原剂把Fe从铁矿石中还原出来,D项正确。
1
2
3
自我测试
2.用如图所示装置进行Fe与水蒸气反应的实验,下列有关说法不正确的是
A.装置A的作用是为实验提供持续不断的水
蒸气
B.装置B中反应的化学方程式是2Fe+3H2O(g)
Fe2O3+3H2
C.装置C中加入的固体干燥剂可能是碱石灰
D.点燃装置D处的气体前必须检验气体的纯度
√
自我测试
1
2
3
装置A将液态H2O转化为水蒸气,与装置B中的铁粉在高温下发生反应,A项正确;
铁粉与H2O(g)在高温下发生反应,生成Fe3O4和H2,B项错误;
自我测试
1
2
3
因生成的H2中含有较多的水蒸气,故需要用碱石灰等不与H2反应的干燥剂进行干燥,C项正确;
不纯的H2在点燃时可能会发生爆炸,故在点燃H2前必须检验其纯度,D项正确。
3.如图所示装置可用来制取Fe(OH)2并观察其在空气中被氧化的颜色变化。实验时必须使用铁屑、稀硫酸和NaOH溶液。
(1)在试管Ⅰ中加入的试剂是_____________。
(2)在试管Ⅱ中加入的试剂是___________。
稀硫酸、铁屑
自我测试
1
2
3
NaOH溶液
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和试管Ⅱ中加入试剂,塞紧塞子后的实验步骤是_________________________________________________________
______________。
打开止水夹a,待试管Ⅰ中反应生成的氢气排尽装置中的空气后,再关闭止水夹a
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是_____________________________________________
____________________。
(5)实验完毕,拔去试管Ⅱ中的橡胶塞,放入一部分空气,此时试管Ⅱ中发生反应的化学方程式为_______________
_________________。
自我测试
1
2
3
试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入
4Fe(OH)2+2H2O
第
三
章
铁
金
属
材
料
第一 节 铁 及 其 化 合 物
铁 的 单 质
化学1 必修 人民教育出版社
化学2 必修 人民教育出版社
教 学 目 标
核 心 素 养
1.了解铁的物理性质,掌握铁与不同氧化剂反应的产物的判断。
2.掌握铁与水反应的实质,熟悉反应现象,能写出化学方程式。
1.了解铁的发现及生活中铁的应用,培养学生树立化学为人类服务的思想。
2.通过铁与水蒸气的反应培养学生设计实验方案探究物质的转化的能力。
问题思考
陨石即是坠星的另一种,是来自地球之外的"客人"。含石量大的陨星称为陨石,含铁量大的陨星称为陨铁。陨星的形状各异,最大的陨石是重1770千克的吉林1 号陨石,最重的陨铁是纳米比亚的戈巴陨铁 ,重约60吨。
戈巴陨铁一角
资料卡片
缺铁性贫血
缺铁性贫血主要是由于铁摄入不足或丢失过多致使血清铁明显减少、贮存铁极度减少所引起的一种贫血。
人体内的含铁化合物主要分为两类:即功能性铁和储存铁。功能性铁参与氧的运输,其余的铁与一些酶结合,分布于身体各器官。体内缺铁将会导致人的记忆能力、免疫能力和对温度的适应能力等生理功能下降。如果体内的铁不足以供给生命活动的需要,就会发生贫血。
以药物治疗为主,辅以纠正偏食,给予高蛋白、富含维生素、富含铁的食物。
资料卡片
高炉炼铁
3CO+Fe2O3 == 2Fe+3CO2
高温
还 原 剂
还原
3H2+Fe2O3 == 2Fe+3H2O
高温
氧 化 剂
思考交流
利用了铁的哪些性质?铁还有哪些性质?
知识点一
延展性和导热性、导电性、能被磁体吸引
一、铁的单质
1. 物理性质
思考交流
一、铁的单质
1. 物理性质
2. 化学性质
写出:铁与氧气、氯气的反应、铁与盐酸的反应、铁与硫酸铜溶液的反应的化学方程式。
思考:铁的化合价的变化有什么异同?
为什么会有这样的异同?
知识点二
强氧化剂:氯气、硝酸、氧气等
弱氧化剂:盐酸、硫酸铜、硫等
氧化反应:Fe - 2e- = Fe2+
氧化反应:Fe -3e- = Fe3+
一、铁的单质
2. 化学性质
1. 物理性质
知识点二
一、铁的单质
2. 化学性质
1. 物理性质
(1)与非金属单质的反应
(2)与酸的反应
(3)与某些盐的反应
2Fe +3Cl2 == 2FeCl3
点燃
3Fe +2O2 == Fe3O4
点燃
Fe +S == FeS
Fe + 2H+ == Fe2++ H2
Fe + Cu2+ == Fe2++ Cu
问题思考
炽热的铁水注入模具之前,模具必须进行充分的干燥处理,不得留有水。
?
实验探究
2. 预测铁与水反应的产物是什么?从物质的类别和元素的价态的变化完成对反应的预测。
1. 铁和水在常温下能反应吗?如何提供水蒸气?如何提供反应所需的高温?
3. 如何验证铁与水反应生成的气体产物?
4. 如何组装并完成实验?
问题探究
1. 人们常用金属器皿(如铁壶、铝壶)来盛水,但铁与水可以反应,这一问题应怎样认识?
3. 铁制品如何保存?
2. 金属铁与水反应与金属钠与水反应有何异同?
知识点二
一、铁的单质
2. 化学性质
1. 物理性质
(1)与非金属单质的反应
(2)与酸的反应
(3)与某些盐的反应
(4)与水的反应
3Fe+4H2O(g) == Fe3O4+4H2
高温
知识运用
1. 将0.3 mol钠、0.1 mol铁分别加入到各盛有500 mL 0.2 mol·L-1稀硫酸的两个烧杯中,下列说法正确的是( )
A. 两个烧杯中金属沉在液面下
B. 两个烧杯中都没有金属剩余
C. 两个烧杯中都有金属剩余
D. 两个烧杯中产生氢气的质量相同
B
知识运用
2. 向500 mL 2 mol·L-1的CuSO4溶液中插入一铁片,反应片刻后取出铁片,洗涤、烘干,称其质量比原来增加2.0 g。下列说法错误的是(设反应后溶液的体积不变)( )
A. 参加反应的铁的质量是14 g
B. 析出的铜的物质的量是0.25 mol
C. 反应后溶液中c(CuSO4)=1.5 mol·L-1
D. 反应后溶液中c(FeSO4)=1.5 mol·L-1
D
知识运用
3. 某同学欲在实验室中完成铁与水蒸气反应的实验,装置如图甲、乙。
已知B中放入的是铁粉与石棉绒的混合物,C中放的是干燥剂,E为酒精喷灯,G为带有铁丝网罩的酒精灯。
(1)如何检查乙装置的气密性?
____________________________________________
_________________________________________________________________________________________。
(2)乙装置中湿沙子的作用是___________。
(3)B处发生反应的化学方程式为:
______________________________________。
知识运用
向H中加入水没过导管口,连接好装置,微热K,若H中导管口出现气泡,停止加热后导管中出现水柱,证明气密性良好(其他合理答案也可)
提供水蒸气
3Fe+4H2O(g) == Fe3O4+4H2
高温
知识运用
(4)该同学认为在乙装置的导管口处点燃反应产生的气体,装置H必不可少,H的作用是:__________________________________。
(5) 甲、乙两装置的B和K,B的优点是_____________________________________________
________________________。
干燥氢气,降低氢气中水蒸气的含量
石棉绒的使用增大了水蒸气与铁粉的接触面积,
使反应充分进行
1.下列说法正确的是
A.我国在战国中期就开始使用铁制品
B.自然界中的铁元素只存在于化合物中
C.铁能与所有金属的盐溶液反应生成亚铁盐和金属
D.高炉炼铁是用还原剂将铁从它的化合物中还原出来
√
1
2
3
自我测试
我国目前发现最早的人工冶铁制品是春秋初年秦国的铜柄铁剑,A项错误;
陨铁中的Fe以单质形态存在,B项错误;
Fe只能将金属活动性比它弱的金属从其盐溶液中置换出来,C项错误;
高炉炼铁是用CO等还原剂把Fe从铁矿石中还原出来,D项正确。
1
2
3
自我测试
2.用如图所示装置进行Fe与水蒸气反应的实验,下列有关说法不正确的是
A.装置A的作用是为实验提供持续不断的水
蒸气
B.装置B中反应的化学方程式是2Fe+3H2O(g)
Fe2O3+3H2
C.装置C中加入的固体干燥剂可能是碱石灰
D.点燃装置D处的气体前必须检验气体的纯度
√
自我测试
1
2
3
装置A将液态H2O转化为水蒸气,与装置B中的铁粉在高温下发生反应,A项正确;
铁粉与H2O(g)在高温下发生反应,生成Fe3O4和H2,B项错误;
自我测试
1
2
3
因生成的H2中含有较多的水蒸气,故需要用碱石灰等不与H2反应的干燥剂进行干燥,C项正确;
不纯的H2在点燃时可能会发生爆炸,故在点燃H2前必须检验其纯度,D项正确。
3.如图所示装置可用来制取Fe(OH)2并观察其在空气中被氧化的颜色变化。实验时必须使用铁屑、稀硫酸和NaOH溶液。
(1)在试管Ⅰ中加入的试剂是_____________。
(2)在试管Ⅱ中加入的试剂是___________。
稀硫酸、铁屑
自我测试
1
2
3
NaOH溶液
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和试管Ⅱ中加入试剂,塞紧塞子后的实验步骤是_________________________________________________________
______________。
打开止水夹a,待试管Ⅰ中反应生成的氢气排尽装置中的空气后,再关闭止水夹a
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是_____________________________________________
____________________。
(5)实验完毕,拔去试管Ⅱ中的橡胶塞,放入一部分空气,此时试管Ⅱ中发生反应的化学方程式为_______________
_________________。
自我测试
1
2
3
试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入
4Fe(OH)2+2H2O
