2024鲁教版高中化学必修第二册同步练习题--第2课时 化学反应与电能(含解析)
文档属性
| 名称 | 2024鲁教版高中化学必修第二册同步练习题--第2课时 化学反应与电能(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 09:58:56 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2024鲁教版高中化学必修第二册同步
第2章 化学键 化学反应规律
第2节 化学反应与能量转化
第2课时 化学反应与电能
基础过关练
题组一 原电池的构成条件
1.(2022河南濮阳期中)下列各组中,不能构成原电池的是( )
A.Zn片、石墨、H2SO4溶液
B.Cu片、Ag片、AgNO3溶液
C.Fe片、Cu片、稀盐酸
D.Zn片、Cu片、蔗糖溶液
2.(2022山西太原期中)同学们设计了以下水果电池,其中正确的是( )
A. B.
C. D.
3.(2022湖南百所学校期中)下面四个化学反应,你认为理论上不可用于设计原电池的是( )
A.Zn+Ag2O+H2O Zn(OH)2+2Ag
B.2Al+6HCl 2AlCl3+3H2↑
C.Cu2(OH)2CO3 2CuO+H2O+CO2↑
D.SO2+Fe2(SO4)3+2H2O 2FeSO4+2H2SO4
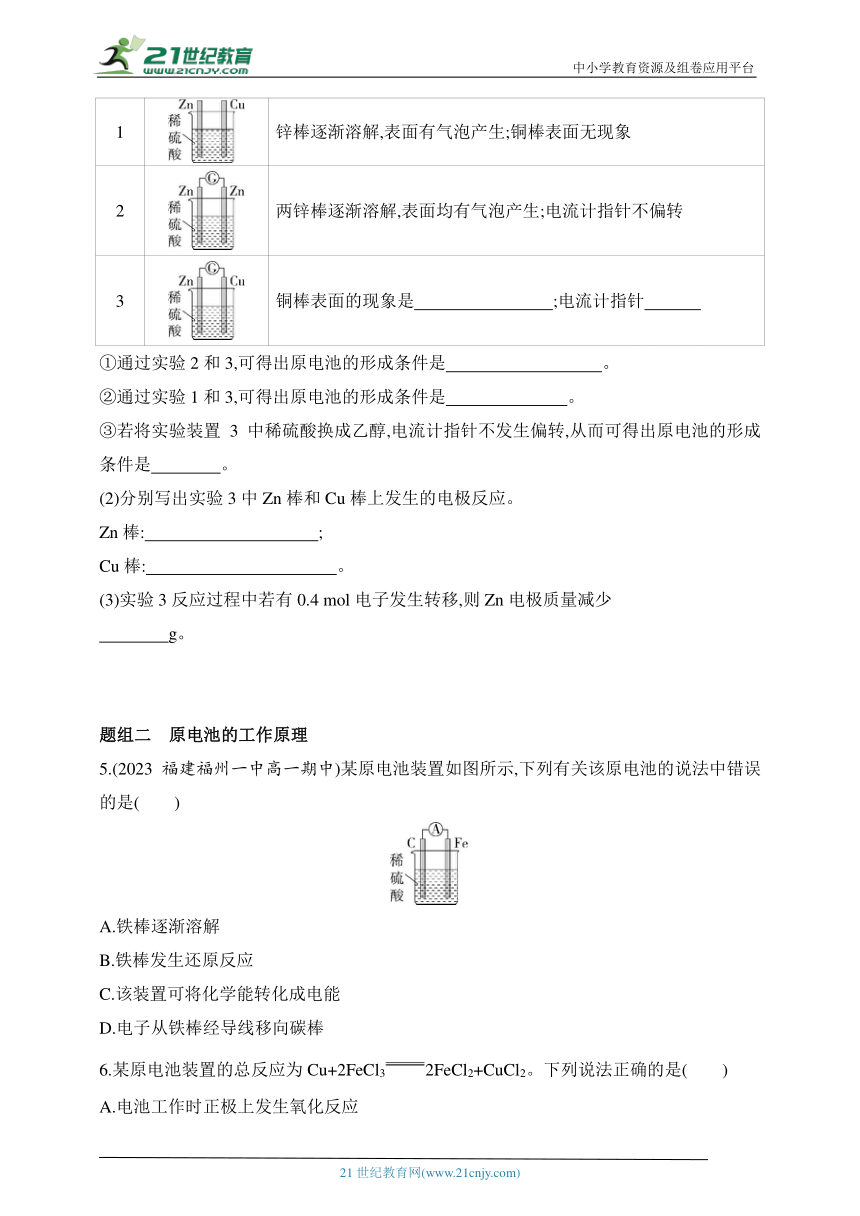
4.(2023北京一○一中学高一期中)某化学研究性学习小组针对原电池的形成条件,设计了实验方案,进行如下探究。
(1)请补全有关实验现象并回答相关问题。
编号 实验装置 实验现象
1 锌棒逐渐溶解,表面有气泡产生;铜棒表面无现象
2 两锌棒逐渐溶解,表面均有气泡产生;电流计指针不偏转
3 铜棒表面的现象是 ;电流计指针
①通过实验2和3,可得出原电池的形成条件是 。
②通过实验1和3,可得出原电池的形成条件是 。
③若将实验装置3中稀硫酸换成乙醇,电流计指针不发生偏转,从而可得出原电池的形成条件是 。
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应。
Zn棒: ;
Cu棒: 。
(3)实验3反应过程中若有0.4 mol电子发生转移,则Zn电极质量减少
g。
题组二 原电池的工作原理
5.(2023福建福州一中高一期中)某原电池装置如图所示,下列有关该原电池的说法中错误的是( )
A.铁棒逐渐溶解
B.铁棒发生还原反应
C.该装置可将化学能转化成电能
D.电子从铁棒经导线移向碳棒
6.某原电池装置的总反应为Cu+2FeCl32FeCl2+CuCl2。下列说法正确的是( )
A.电池工作时正极上发生氧化反应
B.装置工作时,溶液中的Cl-向负极移动
C.可改用Fe做电极材料
D.装置工作时每转移1 mol电子,将消耗64 g Cu
7.(2022湖南长沙一中期中)如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
A.外电路的电流方向为X→外电路→Y
B.若两电极分别为Zn和石墨棒,则X为石墨棒,Y为Zn
C.S移向X电极,Y电极上有氢气产生
D.X极上发生的是还原反应,Y极上发生的是氧化反应
8.常温下,将除去表面氧化膜的Al、Cu片插入浓硝酸中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,下列说法正确的是 ( )
A.0~t1时,原电池的负极是铜片
B.0~t1时,正极的电极反应式是2H++2e- H2↑
C.t1时刻,电流方向发生变化的原因是Al在浓硝酸中发生钝化,铝表面形成的氧化膜阻止了Al进一步反应
D.t1时刻后,电子从铝经过导线流向铜
9.(2023福建龙岩连城二中高一下期中)某原电池装置如图所示,装置中盐桥的作用是使整个装置形成一个闭合回路,电解质溶液足量,闭合开关,观察到电流表指针发生偏转,回答下列问题。
(1)该原电池工作过程中,电池的负极上的电极反应为 ,
石墨电极上发生了 (填“氧化”或“还原”)反应。
(2)该原电池工作时,下列说法正确的是 。
a.电子移动的方向:铁电极石墨电极
b.盐桥中的K+会向右侧烧杯移动
c.FeCl2溶液的颜色会逐渐变浅
d.将KCl盐桥换成AgNO3盐桥,该装置不能长时间正常工作
(3)当铁电极质量减少28 g时,外电路中转移的电子数目为 (设NA为阿伏加德罗常数的值)。
(4)原电池工作时能量转化形式为 ,根据原电池形成条件,下列反应理论上可以设计成原电池的是 (填字母)。
A.Ba(OH)2·8H2O与NH4Cl的反应
B.KOH和HCl的反应
C.Cu和AgNO3的反应
D.H2和O2的反应
能力提升练
题组一 原电池原理的应用
1.(2022福建厦门一中期中)把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,b为正极;c、d相连时,电流由d到c;a、c相连时,c上产生大量气泡;b、d相连时,d溶解减重,则四种金属的活动性顺序由强到弱正确的是( )
A.a>b>c>d B.a>c>d>b
C.c>a>b>d D.b>a>d>c
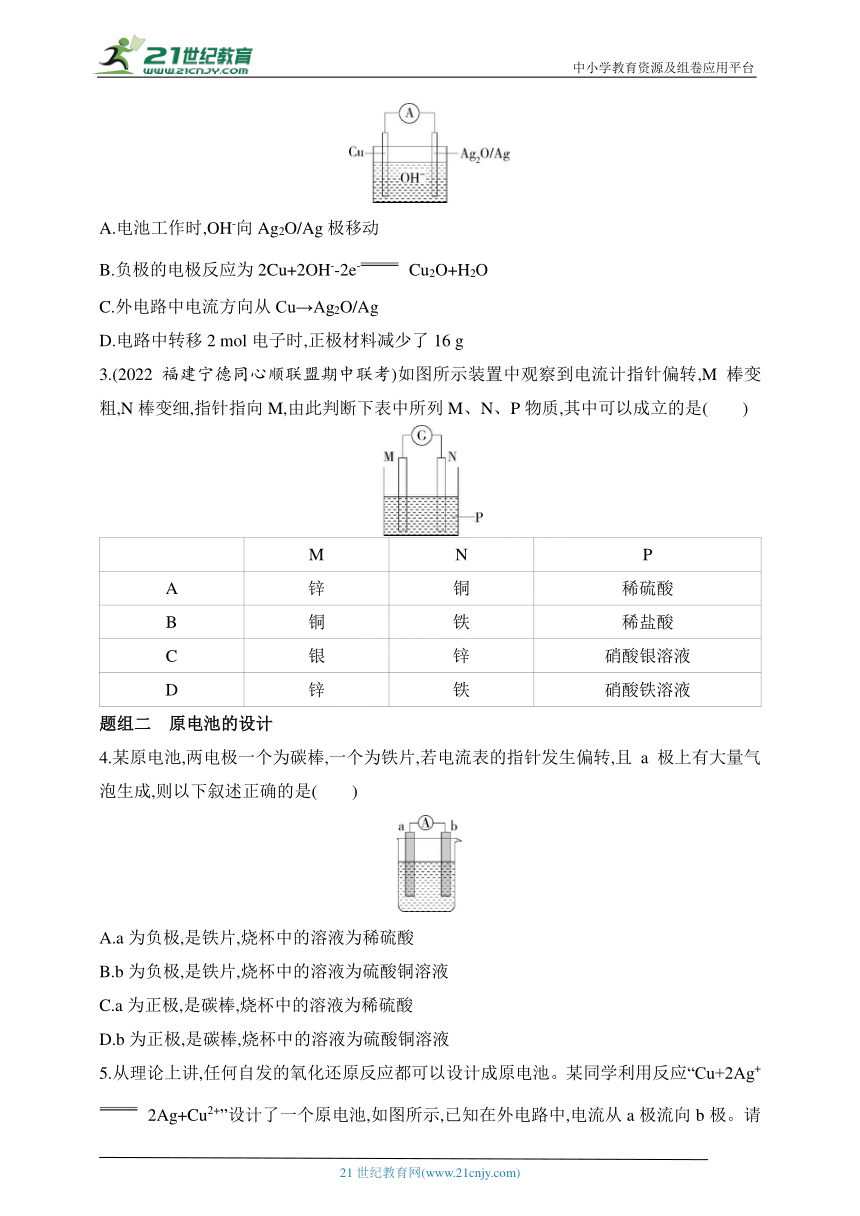
2.(2023江西景德镇高一期中)普通水泥在固化过程中其自由水分子减少并形成碱性溶液,根据这一特点,科学家发明了电动势法测水泥的初凝时间,此法的原理如图所示,反应的总方程式为2Cu+Ag2O Cu2O+2Ag,下列有关说法正确的是( )
A.电池工作时,OH-向Ag2O/Ag极移动
B.负极的电极反应为2Cu+2OH--2e- Cu2O+H2O
C.外电路中电流方向从Cu→Ag2O/Ag
D.电路中转移2 mol电子时,正极材料减少了16 g
3.(2022福建宁德同心顺联盟期中联考)如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的是( )
M N P
A 锌 铜 稀硫酸
B 铜 铁 稀盐酸
C 银 锌 硝酸银溶液
D 锌 铁 硝酸铁溶液
题组二 原电池的设计
4.某原电池,两电极一个为碳棒,一个为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是( )
A.a为负极,是铁片,烧杯中的溶液为稀硫酸
B.b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C.a为正极,是碳棒,烧杯中的溶液为稀硫酸
D.b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液
5.从理论上讲,任何自发的氧化还原反应都可以设计成原电池。某同学利用反应“Cu+2Ag+ 2Ag+Cu2+”设计了一个原电池,如图所示,已知在外电路中,电流从a极流向b极。请回答下列问题:
(1)b极是电池的 极,材料是 ,写出该电极的电极反应式: 。
(2)a可以为 (填字母)。
A.铜 B.银 C.铁 D.石墨
(3)c是 (填字母)。
A.CuSO4溶液
B.AgNO3溶液
C.酒精溶液
(4)若该反应过程中有0.2 mol电子发生转移,则生成的Ag为 g。
6.(2022浙江杭州“六县九校”联盟期中联考)某兴趣小组在“简易电池的设计与制作”的实验探究中,记录如下:
序号 电极 电极间距(cm) 水果种类 电流表示数(μA)
① Cu和Al 2.0 西红柿 78.5
② Cu和Fe a 西红柿 70.3
③ Al和Al 2.0 西红柿 0
④ Cu和Al 2.0 柠檬 45.7
⑤ Cu和Al 1.0 柠檬 98.4
⑥ 石墨棒和Al 1.0 柠檬 104.5
(1)设计实验①④的目的是 。
(2)a为 。
(3)对比实验①②③得出的结论是 。
(4)如将实验①中的西红柿换成硫酸铜溶液,进行实验,电流表示数不为零,Cu片上发生的电极反应为 。
7.(2022河南名校联盟期中)化学电源广泛地应用于现代社会的生产和生活。请回答下列问题:
(1)原电池是一种化学能转化为电能的装置,所以原电池的设计原理与某一类化学反应有关。你认为下列化学反应,可以设计成原电池的是
(填字母)。
A.CH3COOH+NaOH CH3COONa+H2O
B.Cu+2Fe3+ 2Fe2++Cu2+
C.4Fe+3O2+2H2O 2Fe2O3·H2O
D.Fe+H2SO4 FeSO4+H2↑
(2)化学反应均涉及能量变化,为探究这些能量变化,某同学设计了如图两个实验,已知两个实验除是否有导线连接两个金属棒外,其余均相同。
①该同学设计这两个实验的目的是 。
②下列有关实验现象的说法正确的是 (填字母)。
A.图1、图2所示实验的温度传感器测定的体系温度均上升,且图1实验上升值大于图2实验上升值
B.图1、图2所示实验的温度传感器测定的体系温度均上升,且上升值相同
C.图1所示实验的温度传感器测定的体系温度上升,图2所示实验的温度传感器测定的体系温度下降
D.图1所示实验的锌棒表面有气泡产生,图2所示实验的铜棒表面有气泡产生,且产生气泡的速率大于图1所示实验
(3)若将用导线相连,总质量为80.00 g 的锌片和银片同时浸入稀硫酸中,工作一段时间后,取出金属片,进行洗涤、干燥、称量,得金属片的总质量为63.75 g。则装置工作时锌片上的电极反应式为 ,工作时间内装置所产生氢气的体积为 mL(标准状况)。
答案与分层梯度式解析
第2章 化学键 化学反应规律
第2节 化学反应与能量转化
第2课时 化学反应与电能
基础过关练
1.D 2.C 3.C 5.B 6.B 7.C 8.C
1.D A项,锌为负极,石墨为正极,H2SO4溶液为电解质溶液,Zn和H2SO4自发发生氧化还原反应,可形成原电池;B项,铜为负极,银为正极,AgNO3溶液为电解质溶液,Cu和AgNO3自发发生氧化还原反应,可形成原电池;C项,铁为负极,铜为正极,稀盐酸为电解质溶液,Fe和HCl 自发发生氧化还原反应,可形成原电池;D项,蔗糖不是电解质,其溶液不导电,不能形成闭合回路,不能形成原电池;故选D。
方法点拨 一般情况下,构成原电池需要两个活泼性不同的电极、电解质溶液、构成闭合回路、能自发进行的氧化还原反应。
2.C A项、B项中两电极活泼性相同,不能构成原电池;D项,不能形成闭合回路,不能构成原电池;C项,满足构成原电池的条件,能构成原电池;故选C。
3.C 原电池的反应均是氧化还原反应,Cu2(OH)2CO3 2CuO+H2O+CO2↑不是氧化还原反应,不可用于设计原电池,故选C。
4.答案 (1)有气泡产生 偏转 ①有活泼性不同的两个电极 ②形成闭合回路 ③有电解质溶液 (2)Zn-2e- Zn2+ 2H++2e- H2↑ (3)13
解析 (1)实验1和实验2均没有构成原电池,实验3中构成原电池,锌是负极,失电子,锌棒逐渐溶解,铜是正极,溶液中的氢离子得电子,产生氢气,铜棒表面的现象是有气泡产生,且电流计指针发生偏转。①实验2和3相比,可得出原电池的形成条件是有活泼性不同的两个电极;②实验1和3相比实验3中构成闭合回路,可得出原电池的形成条件是形成闭合回路;③若将实验3装置中稀硫酸换成乙醇,电流计指针将不发生偏转,由乙醇不是电解质,硫酸是电解质,可得出原电池形成的条件是有电解质溶液。(2)锌是负极,发生失去电子的氧化反应,电极反应为Zn-2e- Zn2+;铜是正极,溶液中的氢离子放电,电极反应为2H++2e- H2↑。(3)实验3中锌是负极,铜是正极,反应过程中若有0.4 mol电子发生转移,根据Zn-2e- Zn2+可知消耗0.2 mol锌,Zn电极质量减轻0.2 mol×65 g/mol=13 g。
5.B 由题图知,Fe作负极,发生氧化反应,逐渐溶解,A正确、B错误;原电池将化学能转化为电能,故C正确;原电池中电子从负极沿外电路移向正极,即从铁棒经导线移向碳棒,故D正确。
6.B 电池工作时正极发生还原反应,A项错误;装置工作时,阴离子向负极移动,B项正确;若Fe做电极材料,负极发生反应为Fe-2e-Fe2+,C项错误;由总反应可推知负极的电极反应式为Cu-2e-Cu2+,转移1 mol电子,消耗0.5 mol Cu,其质量为32 g,D项错误。
7.C 根据电子的流向可知X是负极,Y是正极,电流的方向是正极→负极,即Y→外电路→X,故A错误;若两电极分别为Zn和石墨棒,由于活泼性Zn>C,则X为Zn,Y是石墨棒,故B错误;阴离子向负极移动,所以S移向X电极,Y电极即正极上发生的电极反应为2H++2e- H2↑,故C正确;X极失去电子,发生氧化反应,Y极上H+得到电子,发生的是还原反应,故D错误。
8.C 0~t1时,Al为负极,被氧化生成氧化铝,Cu为正极,硝酸根离子得电子生成二氧化氮;随着时间推移,铝表面的氧化膜阻碍反应进行,t1后,铜为负极,Al为正极。0~t1时,铜为正极,铝为负极,A错误;0~t1时,正极的电极反应式为2H++N+e- NO2↑+H2O,B错误;随着时间推移,铝表面形成的氧化膜阻止了Al进一步反应,因此t1时刻电流方向发生了变化,C正确;t1时刻后,铜为负极,电子从铜经导线流向铝,D错误。
9.答案 (1)Fe-2e- Fe2+ 还原 (2)bd (3)NA (4)化学能转化为电能 CD
解析 (1)由装置图可知,该电池总反应为Fe+2Fe3+ 3Fe2+,Fe是负极,电极反应为Fe-2e- Fe2+;石墨是正极,石墨电极上Fe3+得电子生成Fe2+,发生了还原反应。(2)铁是负极、石墨是正极,电子移动的方向:铁电极石墨电极,电子不能进入电解质溶液,故a错误;阳离子向正极移动,所以盐桥中的K+会向右侧烧杯移动,故b正确;负极发生反应Fe-2e- Fe2+,FeCl2溶液的浓度增大,颜色会逐渐加深,故c错误;将KCl盐桥换成AgNO3盐桥,Ag+能和电解质溶液中Cl-发生反应生成AgCl沉淀,堵塞盐桥,导致装置不能长时间正常工作,故d正确。(3)负极发生反应Fe-2e- Fe2+,当铁电极质量减少28 g时,外电路中转移的电子物质的量为×2=1 mol,数目为NA。(4)原电池工作时化学能转化为电能。原电池中发生的是自发的氧化还原反应。A项,Ba(OH)2·8H2O与NH4Cl的反应不是氧化还原反应,不能设计成原电池;B项,KOH和HCl的反应不是氧化还原反应,不能设计成原电池;C项,Cu和AgNO3反应生成硝酸铜和银,属于氧化还原反应,有电子转移,能设计成原电池;D项,H2和O2反应生成水,属于氧化还原反应,有电子转移,能设计成原电池;故选CD。
能力提升练
1.B 2.BD 3.C 4.C
1.B 本题考查原电池原理的应用,根据原电池的工作原理可知:
一般活动性强的金属为负极,活动性弱的金属为正极 a、b相连时,b为正极,金属活动性:a>b
电流从正极由外电路流向负极 c、d相连时,电流由d到c,金属活动性:c>d
稀硫酸做电解质溶液时,一般正极发生反应:2H++2e- H2↑ a、c相连时,c上产生大量气泡,说明c为正极,a为负极,金属活动性:a>c
两块金属片浸入稀硫酸中,活泼性强的金属失去电子,做负极 b、d相连时,d溶解减重,则d为负极,金属活动性:d>b
由以上分析可知,四种金属的活动性由强到弱的顺序为a>c>d>b,故选B。
2.BD 根据总反应方程式可知,电池工作时Cu被氧化,为负极,Ag2O/Ag电极为正极,阴离子向负极移动,阳离子向正极移动,故A错误;负极发生氧化反应,电极反应为2Cu+2OH--2e- Cu2O+H2O,故B正确;外电路中电流从正极流向负极,即从Ag2O/Ag→Cu,故C错误;正极电极反应为Ag2O+2e-+H2O 2Ag+2OH-,转移2 mol电子时,电极材料相当于减少1 mol O,质量为16 g,故D正确。
3.C 电流计指针偏转,M棒变粗,N棒变细,说明M、N与P构成了原电池,N棒变细,做原电池的负极,M棒变粗,说明溶液中的金属阳离子在M极上得到电子,生成金属单质,M做原电池的正极。A项,如果是锌、铜、稀硫酸构成原电池,Zn做负极,M极变细;B项,如果是铁、铜、稀盐酸构成原电池,铁是负极,铜棒M上生成氢气,不会变粗;C项,如果是银、锌、硝酸银溶液构成原电池,锌是负极,N棒变细,析出的银附在正极银上,M棒变粗;D项,如果是锌、铁、硝酸铁溶液构成原电池,Zn做负极,M极变细;故选C。
4.C a极上有大量气泡生成,说明a是正极,应该是碳棒,负极b是铁片,烧杯中的溶液可以为稀硫酸,不可以为硫酸铜溶液,否则正极上会析出金属铜,A、B、D错误,C正确。
5.答案 (1)负 Cu Cu-2e- Cu2+
(2)BD
(3)B
(4)21.6
解析 由题干信息可知,原电池中,电流从a极流向b极,则a为正极,得到电子,发生还原反应,b为负极,失去电子,发生氧化反应。(1)根据上述分析知,b是电池的负极,失去电子,反应Cu+2Ag+ 2Ag+Cu2+中Cu失去电子,故Cu做负极,发生的电极反应为Cu-2e- Cu2+。(2)a是电池的正极,电极材料可以是比铜不活泼的Ag,也可以是石墨。(3)电解质溶液c是含有Ag+的溶液。(4)转移0.2 mol电子生成Ag的质量为108 g/mol×0.2 mol=21.6 g。
6.答案 (1)探究水果种类对电池效果的影响
(2)2.0
(3)其他条件相同时,电极材料活泼性差别越大,电池效果越好
(4)Cu2++2e- Cu
解析 (1)实验①④,除了水果种类不同,其他条件都相同,目的是探究水果种类对电池效果的影响。(2)实验①②电极材料有区别,应是探究电极材料对电池效果的影响,要控制变量,保证其他条件相同,所以a=2.0。(3)实验①②③中电极材料有区别,其他条件相同,探究的是电极材料对电池效果的影响,金属活动性顺序:Al>Fe>Cu,根据电流表示数可知,其他条件相同时,电极材料活泼性差别越大,电池效果越好。(4)铝比铜活泼,实验①中的西红柿换成硫酸铜溶液,铝做负极,铜做正极,正极上铜离子得电子生成单质铜,电极反应为Cu2++2e- Cu。
7.答案 (1)BCD
(2)①通过对比实验探究Zn与稀硫酸在不同条件下反应的能量变化 ②AD
(3)Zn-2e- Zn2+ 5 600
解析 (1)自发进行的氧化还原反应才能设计成原电池,A项不是氧化还原反应,B、C、D项均为自发进行的氧化还原反应,能设计成原电池,故选BCD。
(2)①图1中Zn与稀硫酸反应时将化学能转化为热能,图2构成原电池,Zn与稀硫酸反应时将化学能主要转化为电能,设计这两个实验的目的是通过对照实验探究Zn与稀硫酸在不同条件下反应的能量变化;②图1、图2中发生的反应都为Zn+H2SO4 ZnSO4+H2↑,该反应为放热反应,所以图1、图2所示实验的温度传感器测定的体系温度均上升,图1中化学能转化为热能,图2中化学能主要转化为电能、少部分转化为热能,所以图1实验温度上升值大于图2实验温度上升值,故A正确,B、C错误;图1中Zn与稀硫酸反应:Zn+H2SO4 ZnSO4+H2↑,锌棒表面产生气泡,图2构成原电池,Zn为负极,Zn极的电极反应为Zn-2e- Zn2+,锌棒溶解,Cu为正极,Cu极的电极反应为2H++2e- H2↑,铜棒表面有气泡产生,形成原电池加快产生H2的速率,即图2产生H2的速率大于图1,故D正确。
(3)由于Zn比Ag活泼,Zn为负极,Zn极的电极反应式为Zn-2e- Zn2+;该原电池工作时的总反应为Zn+H2SO4 ZnSO4+H2↑,金属片减少的质量为反应消耗Zn的质量,反应消耗Zn的质量为80.00 g-63.75 g=16.25 g,消耗Zn的物质的量为=0.25 mol,则生成H2 0.25 mol,在标准状况下的体积为0.25 mol×22.4 L/mol=5.6 L=5 600 mL。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024鲁教版高中化学必修第二册同步
第2章 化学键 化学反应规律
第2节 化学反应与能量转化
第2课时 化学反应与电能
基础过关练
题组一 原电池的构成条件
1.(2022河南濮阳期中)下列各组中,不能构成原电池的是( )
A.Zn片、石墨、H2SO4溶液
B.Cu片、Ag片、AgNO3溶液
C.Fe片、Cu片、稀盐酸
D.Zn片、Cu片、蔗糖溶液
2.(2022山西太原期中)同学们设计了以下水果电池,其中正确的是( )
A. B.
C. D.
3.(2022湖南百所学校期中)下面四个化学反应,你认为理论上不可用于设计原电池的是( )
A.Zn+Ag2O+H2O Zn(OH)2+2Ag
B.2Al+6HCl 2AlCl3+3H2↑
C.Cu2(OH)2CO3 2CuO+H2O+CO2↑
D.SO2+Fe2(SO4)3+2H2O 2FeSO4+2H2SO4
4.(2023北京一○一中学高一期中)某化学研究性学习小组针对原电池的形成条件,设计了实验方案,进行如下探究。
(1)请补全有关实验现象并回答相关问题。
编号 实验装置 实验现象
1 锌棒逐渐溶解,表面有气泡产生;铜棒表面无现象
2 两锌棒逐渐溶解,表面均有气泡产生;电流计指针不偏转
3 铜棒表面的现象是 ;电流计指针
①通过实验2和3,可得出原电池的形成条件是 。
②通过实验1和3,可得出原电池的形成条件是 。
③若将实验装置3中稀硫酸换成乙醇,电流计指针不发生偏转,从而可得出原电池的形成条件是 。
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应。
Zn棒: ;
Cu棒: 。
(3)实验3反应过程中若有0.4 mol电子发生转移,则Zn电极质量减少
g。
题组二 原电池的工作原理
5.(2023福建福州一中高一期中)某原电池装置如图所示,下列有关该原电池的说法中错误的是( )
A.铁棒逐渐溶解
B.铁棒发生还原反应
C.该装置可将化学能转化成电能
D.电子从铁棒经导线移向碳棒
6.某原电池装置的总反应为Cu+2FeCl32FeCl2+CuCl2。下列说法正确的是( )
A.电池工作时正极上发生氧化反应
B.装置工作时,溶液中的Cl-向负极移动
C.可改用Fe做电极材料
D.装置工作时每转移1 mol电子,将消耗64 g Cu
7.(2022湖南长沙一中期中)如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
A.外电路的电流方向为X→外电路→Y
B.若两电极分别为Zn和石墨棒,则X为石墨棒,Y为Zn
C.S移向X电极,Y电极上有氢气产生
D.X极上发生的是还原反应,Y极上发生的是氧化反应
8.常温下,将除去表面氧化膜的Al、Cu片插入浓硝酸中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,下列说法正确的是 ( )
A.0~t1时,原电池的负极是铜片
B.0~t1时,正极的电极反应式是2H++2e- H2↑
C.t1时刻,电流方向发生变化的原因是Al在浓硝酸中发生钝化,铝表面形成的氧化膜阻止了Al进一步反应
D.t1时刻后,电子从铝经过导线流向铜
9.(2023福建龙岩连城二中高一下期中)某原电池装置如图所示,装置中盐桥的作用是使整个装置形成一个闭合回路,电解质溶液足量,闭合开关,观察到电流表指针发生偏转,回答下列问题。
(1)该原电池工作过程中,电池的负极上的电极反应为 ,
石墨电极上发生了 (填“氧化”或“还原”)反应。
(2)该原电池工作时,下列说法正确的是 。
a.电子移动的方向:铁电极石墨电极
b.盐桥中的K+会向右侧烧杯移动
c.FeCl2溶液的颜色会逐渐变浅
d.将KCl盐桥换成AgNO3盐桥,该装置不能长时间正常工作
(3)当铁电极质量减少28 g时,外电路中转移的电子数目为 (设NA为阿伏加德罗常数的值)。
(4)原电池工作时能量转化形式为 ,根据原电池形成条件,下列反应理论上可以设计成原电池的是 (填字母)。
A.Ba(OH)2·8H2O与NH4Cl的反应
B.KOH和HCl的反应
C.Cu和AgNO3的反应
D.H2和O2的反应
能力提升练
题组一 原电池原理的应用
1.(2022福建厦门一中期中)把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,b为正极;c、d相连时,电流由d到c;a、c相连时,c上产生大量气泡;b、d相连时,d溶解减重,则四种金属的活动性顺序由强到弱正确的是( )
A.a>b>c>d B.a>c>d>b
C.c>a>b>d D.b>a>d>c
2.(2023江西景德镇高一期中)普通水泥在固化过程中其自由水分子减少并形成碱性溶液,根据这一特点,科学家发明了电动势法测水泥的初凝时间,此法的原理如图所示,反应的总方程式为2Cu+Ag2O Cu2O+2Ag,下列有关说法正确的是( )
A.电池工作时,OH-向Ag2O/Ag极移动
B.负极的电极反应为2Cu+2OH--2e- Cu2O+H2O
C.外电路中电流方向从Cu→Ag2O/Ag
D.电路中转移2 mol电子时,正极材料减少了16 g
3.(2022福建宁德同心顺联盟期中联考)如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的是( )
M N P
A 锌 铜 稀硫酸
B 铜 铁 稀盐酸
C 银 锌 硝酸银溶液
D 锌 铁 硝酸铁溶液
题组二 原电池的设计
4.某原电池,两电极一个为碳棒,一个为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是( )
A.a为负极,是铁片,烧杯中的溶液为稀硫酸
B.b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C.a为正极,是碳棒,烧杯中的溶液为稀硫酸
D.b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液
5.从理论上讲,任何自发的氧化还原反应都可以设计成原电池。某同学利用反应“Cu+2Ag+ 2Ag+Cu2+”设计了一个原电池,如图所示,已知在外电路中,电流从a极流向b极。请回答下列问题:
(1)b极是电池的 极,材料是 ,写出该电极的电极反应式: 。
(2)a可以为 (填字母)。
A.铜 B.银 C.铁 D.石墨
(3)c是 (填字母)。
A.CuSO4溶液
B.AgNO3溶液
C.酒精溶液
(4)若该反应过程中有0.2 mol电子发生转移,则生成的Ag为 g。
6.(2022浙江杭州“六县九校”联盟期中联考)某兴趣小组在“简易电池的设计与制作”的实验探究中,记录如下:
序号 电极 电极间距(cm) 水果种类 电流表示数(μA)
① Cu和Al 2.0 西红柿 78.5
② Cu和Fe a 西红柿 70.3
③ Al和Al 2.0 西红柿 0
④ Cu和Al 2.0 柠檬 45.7
⑤ Cu和Al 1.0 柠檬 98.4
⑥ 石墨棒和Al 1.0 柠檬 104.5
(1)设计实验①④的目的是 。
(2)a为 。
(3)对比实验①②③得出的结论是 。
(4)如将实验①中的西红柿换成硫酸铜溶液,进行实验,电流表示数不为零,Cu片上发生的电极反应为 。
7.(2022河南名校联盟期中)化学电源广泛地应用于现代社会的生产和生活。请回答下列问题:
(1)原电池是一种化学能转化为电能的装置,所以原电池的设计原理与某一类化学反应有关。你认为下列化学反应,可以设计成原电池的是
(填字母)。
A.CH3COOH+NaOH CH3COONa+H2O
B.Cu+2Fe3+ 2Fe2++Cu2+
C.4Fe+3O2+2H2O 2Fe2O3·H2O
D.Fe+H2SO4 FeSO4+H2↑
(2)化学反应均涉及能量变化,为探究这些能量变化,某同学设计了如图两个实验,已知两个实验除是否有导线连接两个金属棒外,其余均相同。
①该同学设计这两个实验的目的是 。
②下列有关实验现象的说法正确的是 (填字母)。
A.图1、图2所示实验的温度传感器测定的体系温度均上升,且图1实验上升值大于图2实验上升值
B.图1、图2所示实验的温度传感器测定的体系温度均上升,且上升值相同
C.图1所示实验的温度传感器测定的体系温度上升,图2所示实验的温度传感器测定的体系温度下降
D.图1所示实验的锌棒表面有气泡产生,图2所示实验的铜棒表面有气泡产生,且产生气泡的速率大于图1所示实验
(3)若将用导线相连,总质量为80.00 g 的锌片和银片同时浸入稀硫酸中,工作一段时间后,取出金属片,进行洗涤、干燥、称量,得金属片的总质量为63.75 g。则装置工作时锌片上的电极反应式为 ,工作时间内装置所产生氢气的体积为 mL(标准状况)。
答案与分层梯度式解析
第2章 化学键 化学反应规律
第2节 化学反应与能量转化
第2课时 化学反应与电能
基础过关练
1.D 2.C 3.C 5.B 6.B 7.C 8.C
1.D A项,锌为负极,石墨为正极,H2SO4溶液为电解质溶液,Zn和H2SO4自发发生氧化还原反应,可形成原电池;B项,铜为负极,银为正极,AgNO3溶液为电解质溶液,Cu和AgNO3自发发生氧化还原反应,可形成原电池;C项,铁为负极,铜为正极,稀盐酸为电解质溶液,Fe和HCl 自发发生氧化还原反应,可形成原电池;D项,蔗糖不是电解质,其溶液不导电,不能形成闭合回路,不能形成原电池;故选D。
方法点拨 一般情况下,构成原电池需要两个活泼性不同的电极、电解质溶液、构成闭合回路、能自发进行的氧化还原反应。
2.C A项、B项中两电极活泼性相同,不能构成原电池;D项,不能形成闭合回路,不能构成原电池;C项,满足构成原电池的条件,能构成原电池;故选C。
3.C 原电池的反应均是氧化还原反应,Cu2(OH)2CO3 2CuO+H2O+CO2↑不是氧化还原反应,不可用于设计原电池,故选C。
4.答案 (1)有气泡产生 偏转 ①有活泼性不同的两个电极 ②形成闭合回路 ③有电解质溶液 (2)Zn-2e- Zn2+ 2H++2e- H2↑ (3)13
解析 (1)实验1和实验2均没有构成原电池,实验3中构成原电池,锌是负极,失电子,锌棒逐渐溶解,铜是正极,溶液中的氢离子得电子,产生氢气,铜棒表面的现象是有气泡产生,且电流计指针发生偏转。①实验2和3相比,可得出原电池的形成条件是有活泼性不同的两个电极;②实验1和3相比实验3中构成闭合回路,可得出原电池的形成条件是形成闭合回路;③若将实验3装置中稀硫酸换成乙醇,电流计指针将不发生偏转,由乙醇不是电解质,硫酸是电解质,可得出原电池形成的条件是有电解质溶液。(2)锌是负极,发生失去电子的氧化反应,电极反应为Zn-2e- Zn2+;铜是正极,溶液中的氢离子放电,电极反应为2H++2e- H2↑。(3)实验3中锌是负极,铜是正极,反应过程中若有0.4 mol电子发生转移,根据Zn-2e- Zn2+可知消耗0.2 mol锌,Zn电极质量减轻0.2 mol×65 g/mol=13 g。
5.B 由题图知,Fe作负极,发生氧化反应,逐渐溶解,A正确、B错误;原电池将化学能转化为电能,故C正确;原电池中电子从负极沿外电路移向正极,即从铁棒经导线移向碳棒,故D正确。
6.B 电池工作时正极发生还原反应,A项错误;装置工作时,阴离子向负极移动,B项正确;若Fe做电极材料,负极发生反应为Fe-2e-Fe2+,C项错误;由总反应可推知负极的电极反应式为Cu-2e-Cu2+,转移1 mol电子,消耗0.5 mol Cu,其质量为32 g,D项错误。
7.C 根据电子的流向可知X是负极,Y是正极,电流的方向是正极→负极,即Y→外电路→X,故A错误;若两电极分别为Zn和石墨棒,由于活泼性Zn>C,则X为Zn,Y是石墨棒,故B错误;阴离子向负极移动,所以S移向X电极,Y电极即正极上发生的电极反应为2H++2e- H2↑,故C正确;X极失去电子,发生氧化反应,Y极上H+得到电子,发生的是还原反应,故D错误。
8.C 0~t1时,Al为负极,被氧化生成氧化铝,Cu为正极,硝酸根离子得电子生成二氧化氮;随着时间推移,铝表面的氧化膜阻碍反应进行,t1后,铜为负极,Al为正极。0~t1时,铜为正极,铝为负极,A错误;0~t1时,正极的电极反应式为2H++N+e- NO2↑+H2O,B错误;随着时间推移,铝表面形成的氧化膜阻止了Al进一步反应,因此t1时刻电流方向发生了变化,C正确;t1时刻后,铜为负极,电子从铜经导线流向铝,D错误。
9.答案 (1)Fe-2e- Fe2+ 还原 (2)bd (3)NA (4)化学能转化为电能 CD
解析 (1)由装置图可知,该电池总反应为Fe+2Fe3+ 3Fe2+,Fe是负极,电极反应为Fe-2e- Fe2+;石墨是正极,石墨电极上Fe3+得电子生成Fe2+,发生了还原反应。(2)铁是负极、石墨是正极,电子移动的方向:铁电极石墨电极,电子不能进入电解质溶液,故a错误;阳离子向正极移动,所以盐桥中的K+会向右侧烧杯移动,故b正确;负极发生反应Fe-2e- Fe2+,FeCl2溶液的浓度增大,颜色会逐渐加深,故c错误;将KCl盐桥换成AgNO3盐桥,Ag+能和电解质溶液中Cl-发生反应生成AgCl沉淀,堵塞盐桥,导致装置不能长时间正常工作,故d正确。(3)负极发生反应Fe-2e- Fe2+,当铁电极质量减少28 g时,外电路中转移的电子物质的量为×2=1 mol,数目为NA。(4)原电池工作时化学能转化为电能。原电池中发生的是自发的氧化还原反应。A项,Ba(OH)2·8H2O与NH4Cl的反应不是氧化还原反应,不能设计成原电池;B项,KOH和HCl的反应不是氧化还原反应,不能设计成原电池;C项,Cu和AgNO3反应生成硝酸铜和银,属于氧化还原反应,有电子转移,能设计成原电池;D项,H2和O2反应生成水,属于氧化还原反应,有电子转移,能设计成原电池;故选CD。
能力提升练
1.B 2.BD 3.C 4.C
1.B 本题考查原电池原理的应用,根据原电池的工作原理可知:
一般活动性强的金属为负极,活动性弱的金属为正极 a、b相连时,b为正极,金属活动性:a>b
电流从正极由外电路流向负极 c、d相连时,电流由d到c,金属活动性:c>d
稀硫酸做电解质溶液时,一般正极发生反应:2H++2e- H2↑ a、c相连时,c上产生大量气泡,说明c为正极,a为负极,金属活动性:a>c
两块金属片浸入稀硫酸中,活泼性强的金属失去电子,做负极 b、d相连时,d溶解减重,则d为负极,金属活动性:d>b
由以上分析可知,四种金属的活动性由强到弱的顺序为a>c>d>b,故选B。
2.BD 根据总反应方程式可知,电池工作时Cu被氧化,为负极,Ag2O/Ag电极为正极,阴离子向负极移动,阳离子向正极移动,故A错误;负极发生氧化反应,电极反应为2Cu+2OH--2e- Cu2O+H2O,故B正确;外电路中电流从正极流向负极,即从Ag2O/Ag→Cu,故C错误;正极电极反应为Ag2O+2e-+H2O 2Ag+2OH-,转移2 mol电子时,电极材料相当于减少1 mol O,质量为16 g,故D正确。
3.C 电流计指针偏转,M棒变粗,N棒变细,说明M、N与P构成了原电池,N棒变细,做原电池的负极,M棒变粗,说明溶液中的金属阳离子在M极上得到电子,生成金属单质,M做原电池的正极。A项,如果是锌、铜、稀硫酸构成原电池,Zn做负极,M极变细;B项,如果是铁、铜、稀盐酸构成原电池,铁是负极,铜棒M上生成氢气,不会变粗;C项,如果是银、锌、硝酸银溶液构成原电池,锌是负极,N棒变细,析出的银附在正极银上,M棒变粗;D项,如果是锌、铁、硝酸铁溶液构成原电池,Zn做负极,M极变细;故选C。
4.C a极上有大量气泡生成,说明a是正极,应该是碳棒,负极b是铁片,烧杯中的溶液可以为稀硫酸,不可以为硫酸铜溶液,否则正极上会析出金属铜,A、B、D错误,C正确。
5.答案 (1)负 Cu Cu-2e- Cu2+
(2)BD
(3)B
(4)21.6
解析 由题干信息可知,原电池中,电流从a极流向b极,则a为正极,得到电子,发生还原反应,b为负极,失去电子,发生氧化反应。(1)根据上述分析知,b是电池的负极,失去电子,反应Cu+2Ag+ 2Ag+Cu2+中Cu失去电子,故Cu做负极,发生的电极反应为Cu-2e- Cu2+。(2)a是电池的正极,电极材料可以是比铜不活泼的Ag,也可以是石墨。(3)电解质溶液c是含有Ag+的溶液。(4)转移0.2 mol电子生成Ag的质量为108 g/mol×0.2 mol=21.6 g。
6.答案 (1)探究水果种类对电池效果的影响
(2)2.0
(3)其他条件相同时,电极材料活泼性差别越大,电池效果越好
(4)Cu2++2e- Cu
解析 (1)实验①④,除了水果种类不同,其他条件都相同,目的是探究水果种类对电池效果的影响。(2)实验①②电极材料有区别,应是探究电极材料对电池效果的影响,要控制变量,保证其他条件相同,所以a=2.0。(3)实验①②③中电极材料有区别,其他条件相同,探究的是电极材料对电池效果的影响,金属活动性顺序:Al>Fe>Cu,根据电流表示数可知,其他条件相同时,电极材料活泼性差别越大,电池效果越好。(4)铝比铜活泼,实验①中的西红柿换成硫酸铜溶液,铝做负极,铜做正极,正极上铜离子得电子生成单质铜,电极反应为Cu2++2e- Cu。
7.答案 (1)BCD
(2)①通过对比实验探究Zn与稀硫酸在不同条件下反应的能量变化 ②AD
(3)Zn-2e- Zn2+ 5 600
解析 (1)自发进行的氧化还原反应才能设计成原电池,A项不是氧化还原反应,B、C、D项均为自发进行的氧化还原反应,能设计成原电池,故选BCD。
(2)①图1中Zn与稀硫酸反应时将化学能转化为热能,图2构成原电池,Zn与稀硫酸反应时将化学能主要转化为电能,设计这两个实验的目的是通过对照实验探究Zn与稀硫酸在不同条件下反应的能量变化;②图1、图2中发生的反应都为Zn+H2SO4 ZnSO4+H2↑,该反应为放热反应,所以图1、图2所示实验的温度传感器测定的体系温度均上升,图1中化学能转化为热能,图2中化学能主要转化为电能、少部分转化为热能,所以图1实验温度上升值大于图2实验温度上升值,故A正确,B、C错误;图1中Zn与稀硫酸反应:Zn+H2SO4 ZnSO4+H2↑,锌棒表面产生气泡,图2构成原电池,Zn为负极,Zn极的电极反应为Zn-2e- Zn2+,锌棒溶解,Cu为正极,Cu极的电极反应为2H++2e- H2↑,铜棒表面有气泡产生,形成原电池加快产生H2的速率,即图2产生H2的速率大于图1,故D正确。
(3)由于Zn比Ag活泼,Zn为负极,Zn极的电极反应式为Zn-2e- Zn2+;该原电池工作时的总反应为Zn+H2SO4 ZnSO4+H2↑,金属片减少的质量为反应消耗Zn的质量,反应消耗Zn的质量为80.00 g-63.75 g=16.25 g,消耗Zn的物质的量为=0.25 mol,则生成H2 0.25 mol,在标准状况下的体积为0.25 mol×22.4 L/mol=5.6 L=5 600 mL。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
