2024鲁教版高中化学必修第二册同步练习题--第3课时 化学电池(含解析)
文档属性
| 名称 | 2024鲁教版高中化学必修第二册同步练习题--第3课时 化学电池(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 10:07:23 | ||
图片预览

文档简介
中小学教育资源及组卷应用平台
2024鲁教版高中化学必修第二册同步
第2章 化学键 化学反应规律
第2节 化学反应与能量转化
第3课时 化学电池
基础过关练
题组一 常见化学电池
1.(2023湖南长沙明德中学高一期中)碱性锌锰干电池以氢氧化钾溶液为电解液,电池总反应为Zn+2MnO2+H2O ZnO+2MnOOH。下列说法错误的是( )
A.电池工作时,OH-移向Zn电极
B.该电池工作时化学能转化为电能
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子时,理论上消耗锌的质量为6.5 g
2.纽扣电池的两极材料分别为锌和氧化银,电解质溶液为KOH溶液。放电时两个电极反应式分别为Zn+2OH--2e- Zn(OH)2,Ag2O+H2O+2e- 2Ag+2OH-。下列说法正确的是( )
A.电子从Ag2O流向Zn
B.溶液中OH-向负极移动,K+向正极移动
C.Zn发生还原反应,Ag2O发生氧化反应
D.Zn是正极,氧化银是负极
3.(2022安徽六安二中期中)关于下列四个常用电化学装置的叙述错误的是( )
图Ⅰ水果电池 图Ⅱ干电池
图Ⅲ铅蓄电池 图Ⅳ氢氧燃料电池
A.图Ⅰ所示电池中,电子从锌片流出
B.图Ⅱ所示干电池中石墨做负极
C.图Ⅲ所示电池为二次电池
D.图Ⅳ所示电池中正极反应为O2+4H++4e- 2H2O
题组二 燃料电池
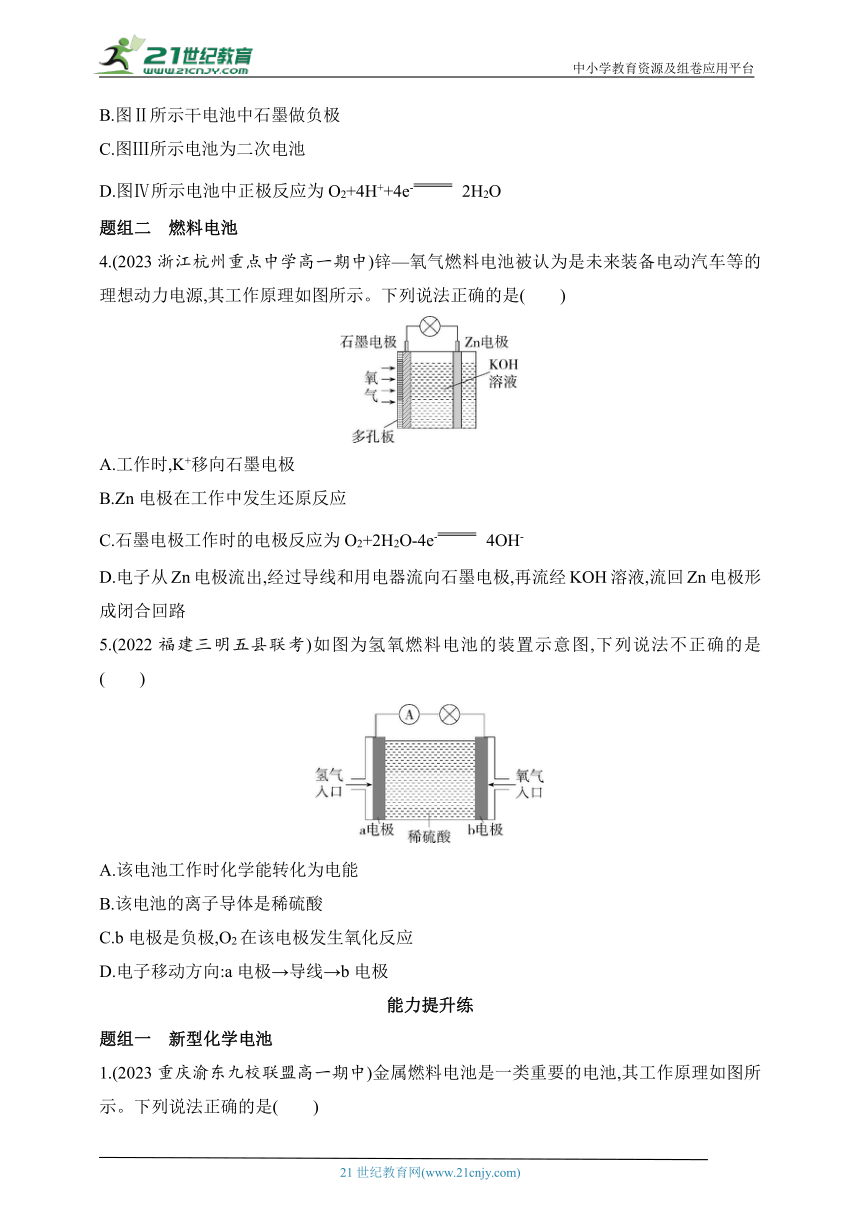
4.(2023浙江杭州重点中学高一期中)锌—氧气燃料电池被认为是未来装备电动汽车等的理想动力电源,其工作原理如图所示。下列说法正确的是( )
A.工作时,K+移向石墨电极
B.Zn电极在工作中发生还原反应
C.石墨电极工作时的电极反应为O2+2H2O-4e- 4OH-
D.电子从Zn电极流出,经过导线和用电器流向石墨电极,再流经KOH溶液,流回Zn电极形成闭合回路
5.(2022福建三明五县联考)如图为氢氧燃料电池的装置示意图,下列说法不正确的是( )
A.该电池工作时化学能转化为电能
B.该电池的离子导体是稀硫酸
C.b电极是负极,O2在该电极发生氧化反应
D.电子移动方向:a电极→导线→b电极
能力提升练
题组一 新型化学电池
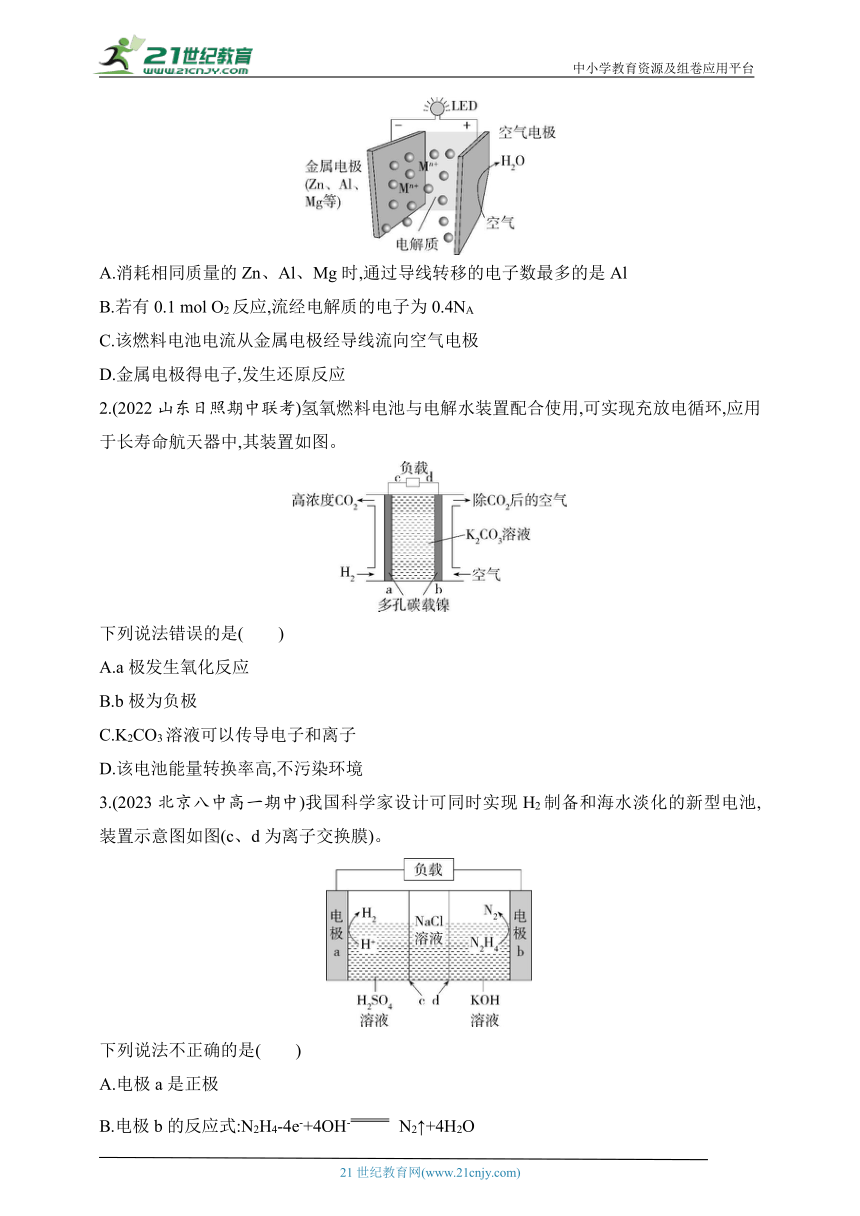
1.(2023重庆渝东九校联盟高一期中)金属燃料电池是一类重要的电池,其工作原理如图所示。下列说法正确的是( )
A.消耗相同质量的Zn、Al、Mg时,通过导线转移的电子数最多的是Al
B.若有0.1 mol O2反应,流经电解质的电子为0.4NA
C.该燃料电池电流从金属电极经导线流向空气电极
D.金属电极得电子,发生还原反应
2.(2022山东日照期中联考)氢氧燃料电池与电解水装置配合使用,可实现充放电循环,应用于长寿命航天器中,其装置如图。
下列说法错误的是( )
A.a极发生氧化反应
B.b极为负极
C.K2CO3溶液可以传导电子和离子
D.该电池能量转换率高,不污染环境
3.(2023北京八中高一期中)我国科学家设计可同时实现H2制备和海水淡化的新型电池,装置示意图如图(c、d为离子交换膜)。
下列说法不正确的是( )
A.电极a是正极
B.电极b的反应式:N2H4-4e-+4OH- N2↑+4H2O
C.每生成1 mol N2,有2 mol NaCl发生迁移
D.离子交换膜c、d分别是阳离子交换膜和阴离子交换膜
题组二 化学电池的相关计算
4.由质量均为10 g的铁片、铜片和足量的CuSO4溶液组成原电池装置,经过一段时间后,两电极的质量差为12 g,则下列说法正确的是( )
A.铁片溶解了12 g
B.导线中通过了0.2 mol电子
C.铜片上析出了6 g Cu
D.铜片溶解了6.4 g
5.一种新型环保电池是采用低毒的铝合金(丢弃的易拉罐)、家庭常用的漂白水、食盐、氢氧化钠(化学药品店常见试剂)等原料制作的。电池的总反应为2Al+3ClO-+2OH-+3H2O 3Cl-+2[Al(OH)4]-。下列说法不正确的是( )
A.该电池的优点是电极材料和电解质用完后可以更换
B.该电池工作时,发生氧化反应的是金属铝
C.电池的正极得到3 mol电子时,负极减轻的质量为54 g
D.当有0.1 mol Al完全溶解时,流经外电路的电子个数约为1.806×1023
答案与分层梯度式解析
第2章 化学键 化学反应规律
第2节 化学反应与能量转化
第3课时 化学电池
基础过关练
1.C 2.B 3.B 4.A 5.C
1.C 根据电池总反应可知,Zn被氧化,为原电池的负极,电极反应式为Zn-2e-+2OH- ZnO+H2O,MnO2为原电池的正极,发生还原反应,电极反应式为2MnO2+2H2O+2e- 2MnOOH+2OH-。原电池工作时,阴离子向负极移动,故OH-向Zn电极移动,A正确;该电池工作时化学能转化为电能,故B正确;原电池工作时,电子由负极通过外电路流向正极,故C错误;由负极反应式可知,转移0.2 mol电子时,消耗n(Zn)=n(e-)=0.1 mol,则m(Zn)=65 g·mol-1×0.1 mol=6.5 g,故D正确。
2.B 原电池中,电子从负极经外电路流向正极,A错误;原电池中阳离子向正极移动,阴离子向负极移动,B正确;锌失电子被氧化,发生氧化反应,氧化银得电子被还原,发生还原反应,C错误;锌失电子做负极,氧化银得电子做正极,D错误。
3.B 图Ⅰ水果电池中,锌活动性比铜强,锌做负极,铜做正极,电子由负极流向正极,故A正确;图Ⅱ为酸性锌锰干电池,锌为金属,做负极,石墨做正极,故B错误;图Ⅲ为铅蓄电池,铅做负极,二氧化铅做正极,是二次电池,即可充电的电池,故C正确;图Ⅳ为氢氧燃料电池,正极电极反应为O2+4H++4e- 2H2O,故D正确。
4.A 根据工作原理图可知,该原电池装置中,Zn失去电子,做负极,氧气在石墨电极上得到电子,石墨电极为正极,原电池工作时,阳离子向正极移动,即K+向石墨电极移动,故A正确;Zn电极为负极,工作时失去电子,发生氧化反应,故B错误;石墨电极为正极,电极反应为O2+4e-+2H2O 4OH-,故C错误;电子不会进入电解质溶液,故D错误。
5.C 该装置为氢氧燃料电池,电池工作时将化学能转化为电能,故A正确;根据图示可知,电解质溶液为稀硫酸,所以电池的离子导体是稀硫酸,故B正确;a电极通入H2,H2失去电子发生氧化反应,a电极为负极,b电极通入O2,O2在b电极上得到电子发生还原反应,b电极为正极,故C错误;原电池中电子由负极移向正极,即由a电极通过导线向b电极移动,故D正确。
能力提升练
1.A 2.BC 3.C 4.B 5.C
1.A 根据工作原理图可知,金属电极为负极,空气电极为正极,消耗1 g金属对应的转移电子的物质的量:Zn为 mol、Al为 mol、Mg为 mol,所以消耗相同质量的Zn、Al、Mg时,通过导线转移的电子数最多的是Al,故A正确;每1 mol O2反应,转移4 mol电子,所以0.1 mol O2反应,转移的电子为0.4 mol,电子只能在导线中移动,不能流经电解质,故B错误;电流从正极流出经外电路流向负极,即从空气电极经导线流向金属电极,故C错误;金属电极为负极,发生氧化反应,故D错误。
2.BC 在氢氧燃料电池中,通入氢气的一极为负极,即a极为负极,发生氧化反应,b极为正极,发生还原反应,故A正确、B错误;K2CO3溶液作为电解质溶液,用于传导离子形成闭合回路,不能传导电子,故C错误;氢氧燃料电池可以连续将燃料和氧化剂的化学能直接转换成电能,能量转换率高,且不污染环境,故D正确。
3.C 该装置为原电池,电极a上氢离子得电子生成氢气,电极a为正极,故A正确;电极b上N2H4在碱性条件下失去电子生成N2,电极b为负极,电极反应式为N2H4-4e-+4OH- N2↑+4H2O,故B正确;每生成1 mol N2,转移4 mol电子,根据电荷守恒可知,有4 mol NaCl发生迁移,故C不正确;在原电池中,阳离子移向正极,阴离子移向负极,钠离子经离子交换膜c移向左侧,氯离子经离子交换膜d移向右侧,所以c、d分别是阳离子交换膜和阴离子交换膜,故D正确。
4.B 负极发生反应Fe-2e- Fe2+,正极发生反应Cu2++2e- Cu,设有x mol Fe失去电子,则正极生成x mol Cu,(10+64x)-(10-56x)=12,解得x=0.1,m(Fe)=0.1 mol×56 g/mol=5.6 g,A错误;转移的电子的物质的量为0.2 mol,B正确;m(Cu)=0.1 mol×64 g/mol=6.4 g,C错误;在正极上析出的铜的质量为6.4 g,D错误。
5.C 该电池所用材料都是生活中常见的物质,电极材料和电解质用完后可以更换,A正确;金属铝是该电池的负极,放电时发生氧化反应,B正确;在正极上,ClO-发生还原反应,得到3 mol电子时,负极发生反应的铝的物质的量是1 mol,负极减轻的质量是27 g,C错误;当有0.1 mol Al完全溶解时,流经外电路的电子的物质的量为 0.3 mol,个数约为1.806×1023,D正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024鲁教版高中化学必修第二册同步
第2章 化学键 化学反应规律
第2节 化学反应与能量转化
第3课时 化学电池
基础过关练
题组一 常见化学电池
1.(2023湖南长沙明德中学高一期中)碱性锌锰干电池以氢氧化钾溶液为电解液,电池总反应为Zn+2MnO2+H2O ZnO+2MnOOH。下列说法错误的是( )
A.电池工作时,OH-移向Zn电极
B.该电池工作时化学能转化为电能
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子时,理论上消耗锌的质量为6.5 g
2.纽扣电池的两极材料分别为锌和氧化银,电解质溶液为KOH溶液。放电时两个电极反应式分别为Zn+2OH--2e- Zn(OH)2,Ag2O+H2O+2e- 2Ag+2OH-。下列说法正确的是( )
A.电子从Ag2O流向Zn
B.溶液中OH-向负极移动,K+向正极移动
C.Zn发生还原反应,Ag2O发生氧化反应
D.Zn是正极,氧化银是负极
3.(2022安徽六安二中期中)关于下列四个常用电化学装置的叙述错误的是( )
图Ⅰ水果电池 图Ⅱ干电池
图Ⅲ铅蓄电池 图Ⅳ氢氧燃料电池
A.图Ⅰ所示电池中,电子从锌片流出
B.图Ⅱ所示干电池中石墨做负极
C.图Ⅲ所示电池为二次电池
D.图Ⅳ所示电池中正极反应为O2+4H++4e- 2H2O
题组二 燃料电池
4.(2023浙江杭州重点中学高一期中)锌—氧气燃料电池被认为是未来装备电动汽车等的理想动力电源,其工作原理如图所示。下列说法正确的是( )
A.工作时,K+移向石墨电极
B.Zn电极在工作中发生还原反应
C.石墨电极工作时的电极反应为O2+2H2O-4e- 4OH-
D.电子从Zn电极流出,经过导线和用电器流向石墨电极,再流经KOH溶液,流回Zn电极形成闭合回路
5.(2022福建三明五县联考)如图为氢氧燃料电池的装置示意图,下列说法不正确的是( )
A.该电池工作时化学能转化为电能
B.该电池的离子导体是稀硫酸
C.b电极是负极,O2在该电极发生氧化反应
D.电子移动方向:a电极→导线→b电极
能力提升练
题组一 新型化学电池
1.(2023重庆渝东九校联盟高一期中)金属燃料电池是一类重要的电池,其工作原理如图所示。下列说法正确的是( )
A.消耗相同质量的Zn、Al、Mg时,通过导线转移的电子数最多的是Al
B.若有0.1 mol O2反应,流经电解质的电子为0.4NA
C.该燃料电池电流从金属电极经导线流向空气电极
D.金属电极得电子,发生还原反应
2.(2022山东日照期中联考)氢氧燃料电池与电解水装置配合使用,可实现充放电循环,应用于长寿命航天器中,其装置如图。
下列说法错误的是( )
A.a极发生氧化反应
B.b极为负极
C.K2CO3溶液可以传导电子和离子
D.该电池能量转换率高,不污染环境
3.(2023北京八中高一期中)我国科学家设计可同时实现H2制备和海水淡化的新型电池,装置示意图如图(c、d为离子交换膜)。
下列说法不正确的是( )
A.电极a是正极
B.电极b的反应式:N2H4-4e-+4OH- N2↑+4H2O
C.每生成1 mol N2,有2 mol NaCl发生迁移
D.离子交换膜c、d分别是阳离子交换膜和阴离子交换膜
题组二 化学电池的相关计算
4.由质量均为10 g的铁片、铜片和足量的CuSO4溶液组成原电池装置,经过一段时间后,两电极的质量差为12 g,则下列说法正确的是( )
A.铁片溶解了12 g
B.导线中通过了0.2 mol电子
C.铜片上析出了6 g Cu
D.铜片溶解了6.4 g
5.一种新型环保电池是采用低毒的铝合金(丢弃的易拉罐)、家庭常用的漂白水、食盐、氢氧化钠(化学药品店常见试剂)等原料制作的。电池的总反应为2Al+3ClO-+2OH-+3H2O 3Cl-+2[Al(OH)4]-。下列说法不正确的是( )
A.该电池的优点是电极材料和电解质用完后可以更换
B.该电池工作时,发生氧化反应的是金属铝
C.电池的正极得到3 mol电子时,负极减轻的质量为54 g
D.当有0.1 mol Al完全溶解时,流经外电路的电子个数约为1.806×1023
答案与分层梯度式解析
第2章 化学键 化学反应规律
第2节 化学反应与能量转化
第3课时 化学电池
基础过关练
1.C 2.B 3.B 4.A 5.C
1.C 根据电池总反应可知,Zn被氧化,为原电池的负极,电极反应式为Zn-2e-+2OH- ZnO+H2O,MnO2为原电池的正极,发生还原反应,电极反应式为2MnO2+2H2O+2e- 2MnOOH+2OH-。原电池工作时,阴离子向负极移动,故OH-向Zn电极移动,A正确;该电池工作时化学能转化为电能,故B正确;原电池工作时,电子由负极通过外电路流向正极,故C错误;由负极反应式可知,转移0.2 mol电子时,消耗n(Zn)=n(e-)=0.1 mol,则m(Zn)=65 g·mol-1×0.1 mol=6.5 g,故D正确。
2.B 原电池中,电子从负极经外电路流向正极,A错误;原电池中阳离子向正极移动,阴离子向负极移动,B正确;锌失电子被氧化,发生氧化反应,氧化银得电子被还原,发生还原反应,C错误;锌失电子做负极,氧化银得电子做正极,D错误。
3.B 图Ⅰ水果电池中,锌活动性比铜强,锌做负极,铜做正极,电子由负极流向正极,故A正确;图Ⅱ为酸性锌锰干电池,锌为金属,做负极,石墨做正极,故B错误;图Ⅲ为铅蓄电池,铅做负极,二氧化铅做正极,是二次电池,即可充电的电池,故C正确;图Ⅳ为氢氧燃料电池,正极电极反应为O2+4H++4e- 2H2O,故D正确。
4.A 根据工作原理图可知,该原电池装置中,Zn失去电子,做负极,氧气在石墨电极上得到电子,石墨电极为正极,原电池工作时,阳离子向正极移动,即K+向石墨电极移动,故A正确;Zn电极为负极,工作时失去电子,发生氧化反应,故B错误;石墨电极为正极,电极反应为O2+4e-+2H2O 4OH-,故C错误;电子不会进入电解质溶液,故D错误。
5.C 该装置为氢氧燃料电池,电池工作时将化学能转化为电能,故A正确;根据图示可知,电解质溶液为稀硫酸,所以电池的离子导体是稀硫酸,故B正确;a电极通入H2,H2失去电子发生氧化反应,a电极为负极,b电极通入O2,O2在b电极上得到电子发生还原反应,b电极为正极,故C错误;原电池中电子由负极移向正极,即由a电极通过导线向b电极移动,故D正确。
能力提升练
1.A 2.BC 3.C 4.B 5.C
1.A 根据工作原理图可知,金属电极为负极,空气电极为正极,消耗1 g金属对应的转移电子的物质的量:Zn为 mol、Al为 mol、Mg为 mol,所以消耗相同质量的Zn、Al、Mg时,通过导线转移的电子数最多的是Al,故A正确;每1 mol O2反应,转移4 mol电子,所以0.1 mol O2反应,转移的电子为0.4 mol,电子只能在导线中移动,不能流经电解质,故B错误;电流从正极流出经外电路流向负极,即从空气电极经导线流向金属电极,故C错误;金属电极为负极,发生氧化反应,故D错误。
2.BC 在氢氧燃料电池中,通入氢气的一极为负极,即a极为负极,发生氧化反应,b极为正极,发生还原反应,故A正确、B错误;K2CO3溶液作为电解质溶液,用于传导离子形成闭合回路,不能传导电子,故C错误;氢氧燃料电池可以连续将燃料和氧化剂的化学能直接转换成电能,能量转换率高,且不污染环境,故D正确。
3.C 该装置为原电池,电极a上氢离子得电子生成氢气,电极a为正极,故A正确;电极b上N2H4在碱性条件下失去电子生成N2,电极b为负极,电极反应式为N2H4-4e-+4OH- N2↑+4H2O,故B正确;每生成1 mol N2,转移4 mol电子,根据电荷守恒可知,有4 mol NaCl发生迁移,故C不正确;在原电池中,阳离子移向正极,阴离子移向负极,钠离子经离子交换膜c移向左侧,氯离子经离子交换膜d移向右侧,所以c、d分别是阳离子交换膜和阴离子交换膜,故D正确。
4.B 负极发生反应Fe-2e- Fe2+,正极发生反应Cu2++2e- Cu,设有x mol Fe失去电子,则正极生成x mol Cu,(10+64x)-(10-56x)=12,解得x=0.1,m(Fe)=0.1 mol×56 g/mol=5.6 g,A错误;转移的电子的物质的量为0.2 mol,B正确;m(Cu)=0.1 mol×64 g/mol=6.4 g,C错误;在正极上析出的铜的质量为6.4 g,D错误。
5.C 该电池所用材料都是生活中常见的物质,电极材料和电解质用完后可以更换,A正确;金属铝是该电池的负极,放电时发生氧化反应,B正确;在正极上,ClO-发生还原反应,得到3 mol电子时,负极发生反应的铝的物质的量是1 mol,负极减轻的质量是27 g,C错误;当有0.1 mol Al完全溶解时,流经外电路的电子的物质的量为 0.3 mol,个数约为1.806×1023,D正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
