专题 晶体结构与性质 课件(共59张PPT)
文档属性
| 名称 | 专题 晶体结构与性质 课件(共59张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 09:06:07 | ||
图片预览







文档简介
(共59张PPT)
专题 晶体结构与性质
考题统计
晶体结构与性质:
广东卷(2023、2022、2021),辽宁卷(2023、2022、2021),山东卷(2023、2022、2021、2020),湖南卷(2023),湖北卷(2023、2022),海南卷(2022、2021),江苏卷(2022、2021),北京卷(2023、2022、2021)
要点1晶体类型与微粒间相互作用力
课标指引:1.通过微粒的种类及微粒之间的相互作用,认识物质的性质与微观结构的关系。知道金属键的特点与金属某些性质的关系。 2.能借助分子晶体、共价晶体、离子晶体、金属晶体等模型说明晶体中的微粒及其微粒间的相互作用。
聚焦核心要点
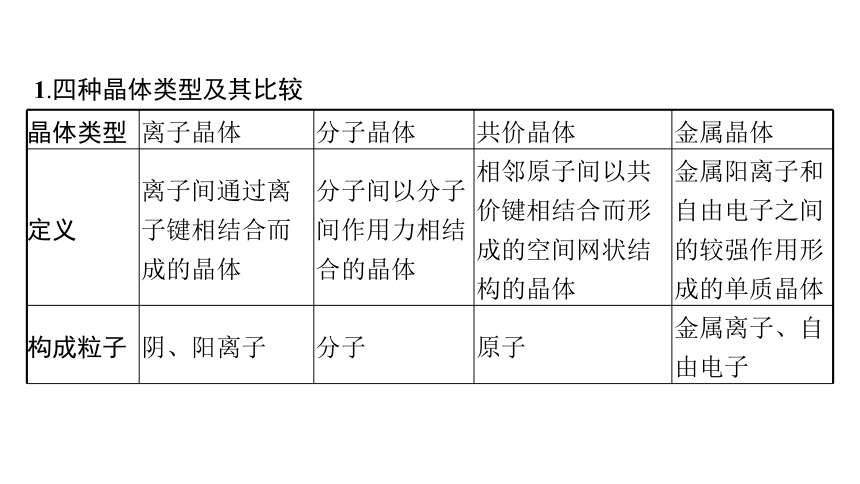
1.四种晶体类型及其比较
晶体类型 离子晶体 分子晶体 共价晶体 金属晶体
定义 离子间通过离子键相结合而成的晶体 分子间以分子间作用力相结合的晶体 相邻原子间以共价键相结合而形成的空间网状结构的晶体 金属阳离子和自由电子之间的较强作用形成的单质晶体
构成粒子 阴、阳离子 分子 原子 金属离子、自由电子
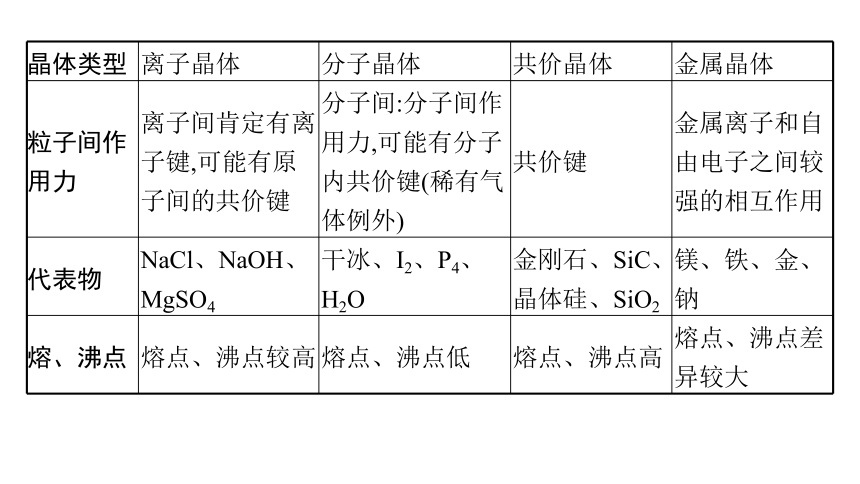
晶体类型 离子晶体 分子晶体 共价晶体 金属晶体
粒子间作用力 离子间肯定有离子键,可能有原子间的共价键 分子间:分子间作用力,可能有分子内共价键(稀有气体例外) 共价键 金属离子和自由电子之间较强的相互作用
代表物 NaCl、NaOH、MgSO4 干冰、I2、P4、H2O 金刚石、SiC、晶体硅、SiO2 镁、铁、金、钠
熔、沸点 熔点、沸点较高 熔点、沸点低 熔点、沸点高 熔点、沸点差异较大
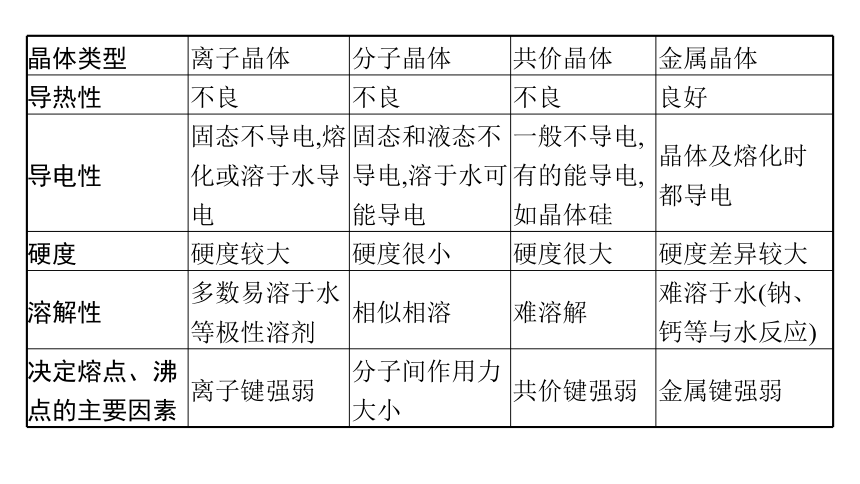
晶体类型 离子晶体 分子晶体 共价晶体 金属晶体
导热性 不良 不良 不良 良好
导电性 固态不导电,熔化或溶于水导电 固态和液态不导电,溶于水可能导电 一般不导电,有的能导电,如晶体硅 晶体及熔化时都导电
硬度 硬度较大 硬度很小 硬度很大 硬度差异较大
溶解性 多数易溶于水等极性溶剂 相似相溶 难溶解 难溶于水(钠、钙等与水反应)
决定熔点、沸 点的主要因素 离子键强弱 分子间作用力大小 共价键强弱 金属键强弱
2.判断晶体类型的两种常用方法
(1)依据构成晶体的微粒和微粒间作用力判断
由阴、阳离子通过离子键构成的晶体为离子晶体;由原子通过共价键构成的晶体为共价晶体;由分子通过分子间作用力形成的晶体为分子晶体;由金属阳离子和自由电子通过金属键形成的晶体为金属晶体。
(2)依据晶体的熔点判断
不同类型晶体熔点高低的一般规律:共价晶体>离子晶体>分子晶体。金属晶体的熔点差别很大,如钨、铂等金属的熔点很高,铯等金属的熔点很低。
3.不同晶体熔、沸点比较的一般思路
(1)看物质所属晶体类型,一般情况下,晶体的熔、沸点:共价晶体>离子晶体>分子晶体。
(2)同类晶体熔、沸点比较的思路
要点2晶胞结构与常见晶体结构分析
课标指引:1.了解晶体中微粒的空间排布存在周期性,认识简单的晶胞。 2.借助分子晶体、共价晶体、离子晶体、金属晶体等模型认识晶体的结构特点。
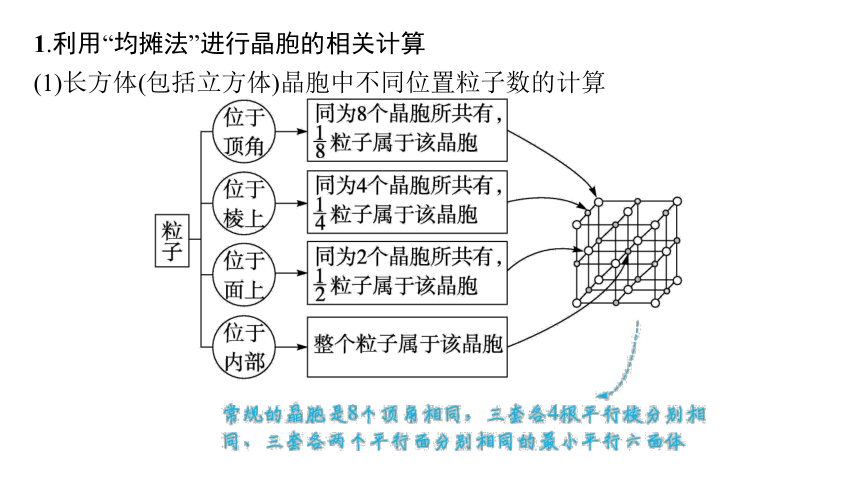
1.利用“均摊法”进行晶胞的相关计算
(1)长方体(包括立方体)晶胞中不同位置粒子数的计算
(2)“三棱柱”和“六棱柱”中不同位置粒子数的计算
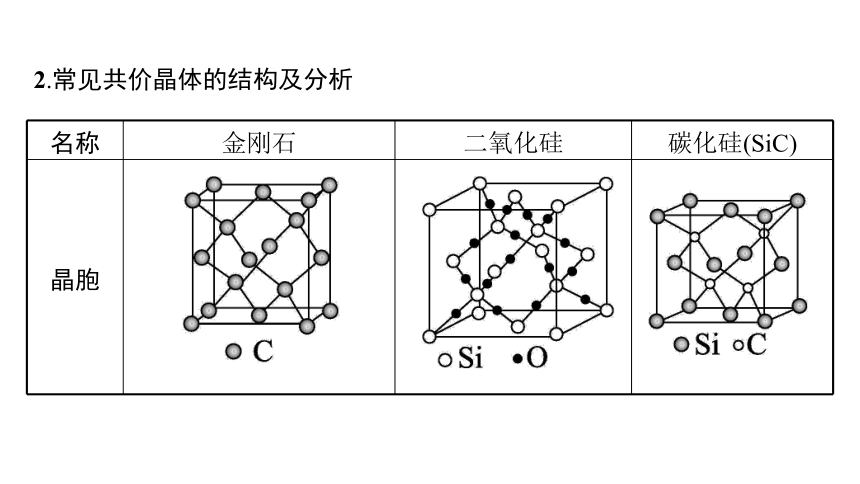
2.常见共价晶体的结构及分析
名称 金刚石 二氧化硅 碳化硅(SiC)
晶胞
名称 金刚石 二氧化硅 碳化硅(SiC)
结构 分析 ①每个C与相邻4个C以共价键结合,形成正四面体结构; ②每个C参与4个C—C的形成,C原子数与C—C数之比为1∶2; ③密度ρ= (a为晶胞边长,NA为阿伏加德罗常数) ①每个Si与4个O以共价键结合,形成正四面体结构; ②最小环上有12个原子,即6个O,6个Si; ③密度 ρ(SiO2)= (a为晶胞边长,NA为阿伏加德罗常数) ①每个原子与另外4个不同种类的原子形成正四面体结构;
②密度:
ρ(SiC)=
(a为晶胞边长,NA为阿伏加德罗常数)
3.常见分子晶体的结构及分析
名称 干冰 冰(类似于金刚石)
晶胞
名称 干冰 冰(类似于金刚石)
结构 分析 ①每8个CO2构成1个立方体且在6个面的面心又各有1个CO2; ②每个CO2分子周围紧邻的CO2分子有12个; ③密度ρ= (a为晶胞边长,NA为阿伏加德罗常数) ①H2O分子位于立方体的面心、内部和顶角;
②每个晶胞中含H2O分子数为8;
③密度ρ=
(a为晶胞边长,NA为阿伏加德罗常数)
4.常见离子晶体的结构及分析
类型 NaCl型 CsCl型 ZnS型 CaF2型
晶胞
配位数 及影响 因素 配位数 6 8 4 F-:4;Ca2+:8
影响 因素 阳离子与阴离子的半径比值越大,配位数越多,另外配位数还与阴、阳离子的电荷比和离子键的纯粹程度有关 5.混合型晶体结构及分析
晶体结构 晶体详解
石墨晶体结构 ①石墨层状晶体中,层与层之间的作用力是分子间作用力;
②平均每个正六边形拥有的碳原子个数为2,碳原子采取的杂化方式是sp2
要点3配位键与配位化合物
课标指引:1.知道配位键的特点,认识简单的配位化合物的成键特征,了解配位化合物的存在与应用。 2.运用离子键、配位键、金属键等模型,解释离子化合物、配合物、金属等物质的某些典型性质。
1.配位键的形成
成键原子一方提供孤电子对,另一方提供空轨道形成的共价键。
2.配合物的组成和结构{以[Zn(NH3)4]SO4为例}
(1)中心离子结构特点:一般是金属离子,特别是过渡金属离子,必须有空轨道,如Zn2+、Cu2+、Fe3+、Ag+等。
(2)配位体必须有孤电子对,常见配位体和配位原子如下表:
配位体 H2O NH3 CO CN- OH-
配位原子 O N C C O
精研核心命题
命题点1晶体类型及熔、沸点的比较
典例1 (2023·北京卷)中国科学家首次成功制得大面积单晶石墨炔,是碳材料科学的一大进步。
下列关于金刚石、石墨、石墨炔的说法正确的是( )
A.三种物质中均有碳碳原子间的σ键
B.三种物质中的碳原子都是sp3杂化
C.三种物质的晶体类型相同
D.三种物质均能导电
答案 A
解析 本题考查了金刚石、石墨、石墨炔三种物质中的共价键类型和碳原子的杂化方式以及形成的晶体类型。三种物质都是由碳原子构成的单质,物质内部含有碳碳键,其中必含σ键,A项正确;金刚石中所有碳原子均采用sp3杂化,石墨中所有碳原子均采用sp2杂化,石墨炔中苯环上的碳原子采用sp2杂化,碳碳三键上的碳原子采用sp杂化,B项错误;金刚石为共价晶体,石墨炔为分子晶体,石墨为混合晶体,三种物质的晶体类型不相同,C项错误;金刚石中没有自由移动的电子,不能导电,D项错误。
A.晶体类型为分子晶体
B.1 mol该分子中存在15 mol σ键
C.三聚氰胺的熔点较高,与氢键有关
D.六元环上的N原子提供孤电子对形成大π键
D
解析 三聚氰胺中原子间的化学键只有共价键,其晶体的构成粒子是分子,晶体类型为分子晶体,A正确;1个三聚氰胺分子中含6个N—H σ键、9个碳氮σ键,1个三聚氰胺分子中含15个σ键,1 mol该分子中存在15 mol σ键,B正确;三聚氰胺分子中含3个—NH2,可形成多个氢键,故其熔点较高,C正确;N原子的价层电子排布式为2s22p3,该分子中—NH2中N原子采取sp3杂化,六元环上的N原子采取sp2杂化,六元环上的每个N原子通过2个杂化轨道与2个碳原子形成碳氮σ键、每个N上剩余的1个杂化轨道容纳1对孤电子对,六元环上的N原子未参与杂化的p轨道上的1个电子形成大π键,孤电子对不形成大π键,D错误。
命题点2晶胞结构及相关计算
典例2 (1)(2023·山东卷,16节选)一定条件下,CuCl2、K与F2反应生成KCl和化合物X。已知X属于四方晶系,晶胞结构如图所示(晶胞参数a=b≠c,α=β=γ=90°),其中Cu化合价为+2价。上述反应的化学方程式为 。若阿伏加德罗常
数的值为NA,化合物X的密度ρ= g·cm-3(用含
NA的代数式表示)。
4K+2F2+CuCl2 ══ K2CuF4+2KCl
(2)(2022·重庆卷,18节选)X晶体具有面心立方结构,其晶胞由8个结构相似的组成单元(如图)构成。
配体L2-
X晶胞的组成单元
X晶胞的组成单元的对角面中
[Zn4O]6+与L2-配位示意图
①晶胞中与同一配体相连的两个[Zn4O]6+的不同之处在于
。
②X晶体中Zn2+的配位数为 。
③已知ZnO键长为d nm,理论上图中A、B两个Zn2+之间的最短距离的计算式为 nm。
④已知晶胞参数为2a nm,阿伏加德罗常数的值为NA,L2-与[Zn4O]6+的相对
分子质量分别为M1和M2,则X的晶体密度为 g·cm-3(列出化简的计
算式)。
与Zn2+相连的双键氧原子不在对称轴的同侧
1.25
(2)①由X晶胞的组成单元的对角面可知,晶胞中与同一配体相连的两个[Zn4O]6+的不同之处在于与Zn2+相连的双键氧原子不在对称轴的同侧。②由X晶胞的组成单元的对角面可知,每个锌离子与2个氧离子相连,其中1个氧离子为4个锌离子所共有,则每个锌离子实际上与1+0.25=1.25个氧离子相连,故X晶体中锌离子的配位数为1.25。
变式演练(1)(2022·辽宁卷,16节选)某种新型储氢材料的晶胞如图,八面体中心为M金属离子,顶点均为NH3配体;四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为188 g·mol-1,则M元素为 (填元素符号);在该化合物中,M离子的价层电子排布式为 。
Fe
3d6
(2)(2022·北京卷,15节选)FeS2晶胞为立方体,边长为a nm,如图所示。
①与Fe2+紧邻的阴离子个数为 。
②晶胞的密度为ρ= g·cm-3(设NA为阿伏加德罗常数的值)。
6
解析 (1)根据“均摊法”可知,每个晶胞中含有 个数为 ,含有 个数为8,即含4个M(NH3)6和8个BH4,二者个数之比为1∶2,故该晶体的化学式为M(NH3)6(BH4)2。又知该化合物的摩尔质量为188 g·mol-1,则有x+17×6+15×2=188,解得x=56,故M元素为Fe。根据化合物中各元素化合价代数和为0推知,Fe显+2价,则Fe2+的价层电子排布为3d6。
【思维建模】
有关晶体中的计算
(1)计算晶体密度的思维流程
(2)计算晶胞中粒子的空间利用率(占有率)的方法
①空间利用率(η)是指构成晶胞的原子、离子或分子的总体积在整个晶胞空间中所占用的体积百分比。
②晶胞中粒子所占的总体积:V(粒子)=N(粒子)×V(单个粒子),而单个粒子的体积V(单个粒子)= πr3(r是粒子的半径)。
[注意]晶胞计算中的重要关系
命题点3配位键和配位化合物
典例3 (1)(2022·北京卷,15节选)FeSO4·H2O结构如图所示。
H2O与Fe2+、 和H2O的作用分别
为 、 。
(2)(2022·海南卷,19节选)金属Zn能溶于氨水,
生成以氨为配体,配位数为4的配离子,Zn与氨水
反应的离子方程式为 。
(3)(2022·河北卷,17节选)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是 (填字母)。
A.[Cu(NH3)2]Cl B.[Cu(NH3)4]SO4
C.[Zn(NH3)4]SO4 D.Na2[Zn(OH)4]
配位键
氢键
Zn+4NH3·H2O ══[Zn(NH3)4]2++H2↑+2OH-+2H2O
B
解析 (2)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,该配离子为[Zn(NH3)4]2+,Zn被氧化,同时生成还原产物H2。
(3)根据题意,具有顺磁性物质含有未成对电子。[Cu(NH3)2]Cl、[Zn(NH3)4]SO4、Na2[Zn(OH)4]中各原子核外电子均已成对,都不是顺磁性物质。[Cu(NH3)4]SO4中的Cu2+价层电子排布为3d9,有1个未成对电子,属于顺磁性物质。
变式演练(1)(2021·全国乙卷,35节选)三价铬离子能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子是 ,中心离子的配位数为 。
(2)(2021·海南卷,19节选)金属羰基配位化合物在催化反应中有着重要应用。HMn(CO)5是锰的一种简单羰基配位化合物,其结构示意图如下。
配位化合物中的中心原子配位数是指和中心原子直接成键的原子的数目。HMn(CO)5中锰原子的配位数为 。
N、O、Cl
6
6
训练分层落实
练真题·明考向
1.(2023·辽宁卷)晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是( )
B.图1中O原子的配位数为6
C.图2表示的化学式为LiMg2OClxBr1-x
D.Mg2+取代产生的空位有利于Li+传导
C
解析 根据均摊原理,图1晶胞中Li、Cl、O原子个数分别为3、1、1,即化学式为Li3OCl,则晶体的密度为 ,A正确;从图1看,O原子与6个Li形成正八面体结构,B正确;图2晶胞中Li的个数为1,O的个数为1,Cl和Br的个数之和也为1,结合化合价代数和为0,则该晶体的化学式为LiMgOClxBr1-x,C错误;Mg2+取代及卤素共掺杂后获得高性能固体电解质材料,则是由于空位的存在,有利于Li+传导,D正确。
2.(2023·湖北卷)镧La和H可以形成一系列晶体材料LaHn,在储氢和超导等领域具有重要应用。LaHn属于立方晶系,晶胞结构和参数如图所示。高压下,LaH2中的每个H结合4个H形成类似CH4的结构,即得到晶体LaHx。下列说法错误的是( )
A.LaH2晶体中La的配位数为8
B.晶体中H和H的最短距离:LaH2>LaHx
C.在LaHx晶胞中,H形成一个顶点数为
40的闭合多面体笼
D.LaHx单位体积中含氢质量的计算式为
C
解析 LaH2晶体中La的配位数是8,A正确;LaH2的晶胞边长大于LaHx,且LaHx中存在以一个H为中心与另外4个H形成类似于甲烷的结构,导致氢原子密度大,距离近,故H和H的最短距离:LaH2>LaHx,B正确;LaHx晶胞中共40个氢原子,其中一部分H在形成的立方体结构内,并不是40个顶点,C错误;每个LaHx晶胞中有40个氢原子,晶胞体积为(4.84×10-8)3 cm3,故含氢质量为
3.(2023·湖南卷)科学家合成了一种高温超导材料,其晶胞结构如图所示,该立方晶胞参数为a pm,阿伏加德罗常数的值为NA,下列说法错误的是( )
A.晶体最简化学式为KCaB6C6
B.晶体中与K+最近且距离相等的Ca2+有8个
C.晶胞中B和C原子构成的多面体有12个面
C
4.(2023·全国甲卷,35节选)将酞菁—钴钛菁—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。
(1)如图所示的几种碳单质,它们互为 ,其中属于共价晶体的是 ,C60间的作用力是 。
同素异形体
金刚石
范德华力(或分子间作用力)
(2)AlF3的熔点为1 090 ℃,远高于AlCl3的192 ℃,由此可以判断铝氟之间的化学键为 键。AlF3结构属立方晶系,晶胞如图所示,F-的配位数
为 。若晶胞参数为a pm,晶体密度ρ= g·cm-3(列出计算式,阿伏加德罗常数的值为NA)。
离子
2
练易错·避陷阱
5.(2023·山东滨州一模)Cu2+可以与缩二脲(H2NCONHCONH2)形成紫色配离子,结构如图所示。下列说法正确的是( )
A.该配离子需在碱性条件下制备
B.该配离子中碳原子和氮原子都采取sp3杂化
C.该配离子中配位键强度:Cu—ND.1 mol该配离子中含有的配位键数目为6NA(设NA为阿伏加德罗常数的值)
A
解析 缩二脲含有—NH2,易与酸反应生成盐,故该配离子需要在碱性条件下制备,A正确;该配离子中双键碳原子采取sp2杂化,B错误;O元素的电负性比N元素大,与Cu2+形成配位键时,N原子给出孤电子对的能力比O原子强,故配位键的强度:Cu—N>Cu—O,C错误;1个铜离子通过四个配位键与其他原子结合,故1 mol该配离子中含有的配位键数目为8NA,D错误。
6.(2023·河南名校联盟联考)砷化硼是一种超高热导率半导体材料,其晶胞结构如图所示。下列说法错误的是( )
A.和元素As位于同一周期且含有相同未
成对电子数的元素有两种
B.BAs晶体中硼原子和砷原子均采取sp3杂化
C.根据X、Y的坐标可知,1号砷原子的坐标为
D.若晶胞中As原子到B原子的最近距离为a pm,则该晶体的密度为
D
练预测·押考向
7.我国科研工作者利用冷冻透射电子显微镜同步辐射等技术,在还原氧化石墨烯膜上直接观察到了自然环境下生成的某二维晶体,其结构如图所示。下列说法正确的是( )
A.该二维晶体的化学式为CaCl2
B.Ca—Cl—Ca的键角为120°
C.Can+和Cl-的配位数均为3
D.该晶体可由钙在氯气中燃烧制得
C
解析 由俯视图可知,一个钙离子形成键结合3个氯离子,同样一个氯离子形成键结合3个钙离子,则该二维晶体的化学式为CaCl,A错误;结合侧视图可知,Ca—Cl—Ca构成的为非平面六边形,其Ca—Cl—Ca的键角不是120°,B错误;Can+、Cl-周围最近的离子数均为3,故配位数均为3,C正确;钙在氯气中燃烧生成CaCl2,不能得到该晶体,D错误。
8.氮化钼作为锂离子电池的负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在Mo原子立方晶格的八面体空隙中,晶胞结构如图所示,其中氮化钼晶胞参数为a nm。设NA为阿伏加德罗常数的值,下列说法正确的是( )
D
9.已知图甲为金属钠的晶胞,晶胞边长为a pm,其晶胞截面如图乙所示。图丙为ZnS晶胞截面,已知ZnS属于立方晶体,假设晶胞边长为d pm。下列关于ZnS晶胞的描述错误的是( )
图甲
图乙
图丙
A.每个晶胞中含有的S2-数目为4
B.与Zn2+距离最近且相等的S2-有8个
答案 B
专题 晶体结构与性质
考题统计
晶体结构与性质:
广东卷(2023、2022、2021),辽宁卷(2023、2022、2021),山东卷(2023、2022、2021、2020),湖南卷(2023),湖北卷(2023、2022),海南卷(2022、2021),江苏卷(2022、2021),北京卷(2023、2022、2021)
要点1晶体类型与微粒间相互作用力
课标指引:1.通过微粒的种类及微粒之间的相互作用,认识物质的性质与微观结构的关系。知道金属键的特点与金属某些性质的关系。 2.能借助分子晶体、共价晶体、离子晶体、金属晶体等模型说明晶体中的微粒及其微粒间的相互作用。
聚焦核心要点
1.四种晶体类型及其比较
晶体类型 离子晶体 分子晶体 共价晶体 金属晶体
定义 离子间通过离子键相结合而成的晶体 分子间以分子间作用力相结合的晶体 相邻原子间以共价键相结合而形成的空间网状结构的晶体 金属阳离子和自由电子之间的较强作用形成的单质晶体
构成粒子 阴、阳离子 分子 原子 金属离子、自由电子
晶体类型 离子晶体 分子晶体 共价晶体 金属晶体
粒子间作用力 离子间肯定有离子键,可能有原子间的共价键 分子间:分子间作用力,可能有分子内共价键(稀有气体例外) 共价键 金属离子和自由电子之间较强的相互作用
代表物 NaCl、NaOH、MgSO4 干冰、I2、P4、H2O 金刚石、SiC、晶体硅、SiO2 镁、铁、金、钠
熔、沸点 熔点、沸点较高 熔点、沸点低 熔点、沸点高 熔点、沸点差异较大
晶体类型 离子晶体 分子晶体 共价晶体 金属晶体
导热性 不良 不良 不良 良好
导电性 固态不导电,熔化或溶于水导电 固态和液态不导电,溶于水可能导电 一般不导电,有的能导电,如晶体硅 晶体及熔化时都导电
硬度 硬度较大 硬度很小 硬度很大 硬度差异较大
溶解性 多数易溶于水等极性溶剂 相似相溶 难溶解 难溶于水(钠、钙等与水反应)
决定熔点、沸 点的主要因素 离子键强弱 分子间作用力大小 共价键强弱 金属键强弱
2.判断晶体类型的两种常用方法
(1)依据构成晶体的微粒和微粒间作用力判断
由阴、阳离子通过离子键构成的晶体为离子晶体;由原子通过共价键构成的晶体为共价晶体;由分子通过分子间作用力形成的晶体为分子晶体;由金属阳离子和自由电子通过金属键形成的晶体为金属晶体。
(2)依据晶体的熔点判断
不同类型晶体熔点高低的一般规律:共价晶体>离子晶体>分子晶体。金属晶体的熔点差别很大,如钨、铂等金属的熔点很高,铯等金属的熔点很低。
3.不同晶体熔、沸点比较的一般思路
(1)看物质所属晶体类型,一般情况下,晶体的熔、沸点:共价晶体>离子晶体>分子晶体。
(2)同类晶体熔、沸点比较的思路
要点2晶胞结构与常见晶体结构分析
课标指引:1.了解晶体中微粒的空间排布存在周期性,认识简单的晶胞。 2.借助分子晶体、共价晶体、离子晶体、金属晶体等模型认识晶体的结构特点。
1.利用“均摊法”进行晶胞的相关计算
(1)长方体(包括立方体)晶胞中不同位置粒子数的计算
(2)“三棱柱”和“六棱柱”中不同位置粒子数的计算
2.常见共价晶体的结构及分析
名称 金刚石 二氧化硅 碳化硅(SiC)
晶胞
名称 金刚石 二氧化硅 碳化硅(SiC)
结构 分析 ①每个C与相邻4个C以共价键结合,形成正四面体结构; ②每个C参与4个C—C的形成,C原子数与C—C数之比为1∶2; ③密度ρ= (a为晶胞边长,NA为阿伏加德罗常数) ①每个Si与4个O以共价键结合,形成正四面体结构; ②最小环上有12个原子,即6个O,6个Si; ③密度 ρ(SiO2)= (a为晶胞边长,NA为阿伏加德罗常数) ①每个原子与另外4个不同种类的原子形成正四面体结构;
②密度:
ρ(SiC)=
(a为晶胞边长,NA为阿伏加德罗常数)
3.常见分子晶体的结构及分析
名称 干冰 冰(类似于金刚石)
晶胞
名称 干冰 冰(类似于金刚石)
结构 分析 ①每8个CO2构成1个立方体且在6个面的面心又各有1个CO2; ②每个CO2分子周围紧邻的CO2分子有12个; ③密度ρ= (a为晶胞边长,NA为阿伏加德罗常数) ①H2O分子位于立方体的面心、内部和顶角;
②每个晶胞中含H2O分子数为8;
③密度ρ=
(a为晶胞边长,NA为阿伏加德罗常数)
4.常见离子晶体的结构及分析
类型 NaCl型 CsCl型 ZnS型 CaF2型
晶胞
配位数 及影响 因素 配位数 6 8 4 F-:4;Ca2+:8
影响 因素 阳离子与阴离子的半径比值越大,配位数越多,另外配位数还与阴、阳离子的电荷比和离子键的纯粹程度有关 5.混合型晶体结构及分析
晶体结构 晶体详解
石墨晶体结构 ①石墨层状晶体中,层与层之间的作用力是分子间作用力;
②平均每个正六边形拥有的碳原子个数为2,碳原子采取的杂化方式是sp2
要点3配位键与配位化合物
课标指引:1.知道配位键的特点,认识简单的配位化合物的成键特征,了解配位化合物的存在与应用。 2.运用离子键、配位键、金属键等模型,解释离子化合物、配合物、金属等物质的某些典型性质。
1.配位键的形成
成键原子一方提供孤电子对,另一方提供空轨道形成的共价键。
2.配合物的组成和结构{以[Zn(NH3)4]SO4为例}
(1)中心离子结构特点:一般是金属离子,特别是过渡金属离子,必须有空轨道,如Zn2+、Cu2+、Fe3+、Ag+等。
(2)配位体必须有孤电子对,常见配位体和配位原子如下表:
配位体 H2O NH3 CO CN- OH-
配位原子 O N C C O
精研核心命题
命题点1晶体类型及熔、沸点的比较
典例1 (2023·北京卷)中国科学家首次成功制得大面积单晶石墨炔,是碳材料科学的一大进步。
下列关于金刚石、石墨、石墨炔的说法正确的是( )
A.三种物质中均有碳碳原子间的σ键
B.三种物质中的碳原子都是sp3杂化
C.三种物质的晶体类型相同
D.三种物质均能导电
答案 A
解析 本题考查了金刚石、石墨、石墨炔三种物质中的共价键类型和碳原子的杂化方式以及形成的晶体类型。三种物质都是由碳原子构成的单质,物质内部含有碳碳键,其中必含σ键,A项正确;金刚石中所有碳原子均采用sp3杂化,石墨中所有碳原子均采用sp2杂化,石墨炔中苯环上的碳原子采用sp2杂化,碳碳三键上的碳原子采用sp杂化,B项错误;金刚石为共价晶体,石墨炔为分子晶体,石墨为混合晶体,三种物质的晶体类型不相同,C项错误;金刚石中没有自由移动的电子,不能导电,D项错误。
A.晶体类型为分子晶体
B.1 mol该分子中存在15 mol σ键
C.三聚氰胺的熔点较高,与氢键有关
D.六元环上的N原子提供孤电子对形成大π键
D
解析 三聚氰胺中原子间的化学键只有共价键,其晶体的构成粒子是分子,晶体类型为分子晶体,A正确;1个三聚氰胺分子中含6个N—H σ键、9个碳氮σ键,1个三聚氰胺分子中含15个σ键,1 mol该分子中存在15 mol σ键,B正确;三聚氰胺分子中含3个—NH2,可形成多个氢键,故其熔点较高,C正确;N原子的价层电子排布式为2s22p3,该分子中—NH2中N原子采取sp3杂化,六元环上的N原子采取sp2杂化,六元环上的每个N原子通过2个杂化轨道与2个碳原子形成碳氮σ键、每个N上剩余的1个杂化轨道容纳1对孤电子对,六元环上的N原子未参与杂化的p轨道上的1个电子形成大π键,孤电子对不形成大π键,D错误。
命题点2晶胞结构及相关计算
典例2 (1)(2023·山东卷,16节选)一定条件下,CuCl2、K与F2反应生成KCl和化合物X。已知X属于四方晶系,晶胞结构如图所示(晶胞参数a=b≠c,α=β=γ=90°),其中Cu化合价为+2价。上述反应的化学方程式为 。若阿伏加德罗常
数的值为NA,化合物X的密度ρ= g·cm-3(用含
NA的代数式表示)。
4K+2F2+CuCl2 ══ K2CuF4+2KCl
(2)(2022·重庆卷,18节选)X晶体具有面心立方结构,其晶胞由8个结构相似的组成单元(如图)构成。
配体L2-
X晶胞的组成单元
X晶胞的组成单元的对角面中
[Zn4O]6+与L2-配位示意图
①晶胞中与同一配体相连的两个[Zn4O]6+的不同之处在于
。
②X晶体中Zn2+的配位数为 。
③已知ZnO键长为d nm,理论上图中A、B两个Zn2+之间的最短距离的计算式为 nm。
④已知晶胞参数为2a nm,阿伏加德罗常数的值为NA,L2-与[Zn4O]6+的相对
分子质量分别为M1和M2,则X的晶体密度为 g·cm-3(列出化简的计
算式)。
与Zn2+相连的双键氧原子不在对称轴的同侧
1.25
(2)①由X晶胞的组成单元的对角面可知,晶胞中与同一配体相连的两个[Zn4O]6+的不同之处在于与Zn2+相连的双键氧原子不在对称轴的同侧。②由X晶胞的组成单元的对角面可知,每个锌离子与2个氧离子相连,其中1个氧离子为4个锌离子所共有,则每个锌离子实际上与1+0.25=1.25个氧离子相连,故X晶体中锌离子的配位数为1.25。
变式演练(1)(2022·辽宁卷,16节选)某种新型储氢材料的晶胞如图,八面体中心为M金属离子,顶点均为NH3配体;四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为188 g·mol-1,则M元素为 (填元素符号);在该化合物中,M离子的价层电子排布式为 。
Fe
3d6
(2)(2022·北京卷,15节选)FeS2晶胞为立方体,边长为a nm,如图所示。
①与Fe2+紧邻的阴离子个数为 。
②晶胞的密度为ρ= g·cm-3(设NA为阿伏加德罗常数的值)。
6
解析 (1)根据“均摊法”可知,每个晶胞中含有 个数为 ,含有 个数为8,即含4个M(NH3)6和8个BH4,二者个数之比为1∶2,故该晶体的化学式为M(NH3)6(BH4)2。又知该化合物的摩尔质量为188 g·mol-1,则有x+17×6+15×2=188,解得x=56,故M元素为Fe。根据化合物中各元素化合价代数和为0推知,Fe显+2价,则Fe2+的价层电子排布为3d6。
【思维建模】
有关晶体中的计算
(1)计算晶体密度的思维流程
(2)计算晶胞中粒子的空间利用率(占有率)的方法
①空间利用率(η)是指构成晶胞的原子、离子或分子的总体积在整个晶胞空间中所占用的体积百分比。
②晶胞中粒子所占的总体积:V(粒子)=N(粒子)×V(单个粒子),而单个粒子的体积V(单个粒子)= πr3(r是粒子的半径)。
[注意]晶胞计算中的重要关系
命题点3配位键和配位化合物
典例3 (1)(2022·北京卷,15节选)FeSO4·H2O结构如图所示。
H2O与Fe2+、 和H2O的作用分别
为 、 。
(2)(2022·海南卷,19节选)金属Zn能溶于氨水,
生成以氨为配体,配位数为4的配离子,Zn与氨水
反应的离子方程式为 。
(3)(2022·河北卷,17节选)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是 (填字母)。
A.[Cu(NH3)2]Cl B.[Cu(NH3)4]SO4
C.[Zn(NH3)4]SO4 D.Na2[Zn(OH)4]
配位键
氢键
Zn+4NH3·H2O ══[Zn(NH3)4]2++H2↑+2OH-+2H2O
B
解析 (2)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,该配离子为[Zn(NH3)4]2+,Zn被氧化,同时生成还原产物H2。
(3)根据题意,具有顺磁性物质含有未成对电子。[Cu(NH3)2]Cl、[Zn(NH3)4]SO4、Na2[Zn(OH)4]中各原子核外电子均已成对,都不是顺磁性物质。[Cu(NH3)4]SO4中的Cu2+价层电子排布为3d9,有1个未成对电子,属于顺磁性物质。
变式演练(1)(2021·全国乙卷,35节选)三价铬离子能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子是 ,中心离子的配位数为 。
(2)(2021·海南卷,19节选)金属羰基配位化合物在催化反应中有着重要应用。HMn(CO)5是锰的一种简单羰基配位化合物,其结构示意图如下。
配位化合物中的中心原子配位数是指和中心原子直接成键的原子的数目。HMn(CO)5中锰原子的配位数为 。
N、O、Cl
6
6
训练分层落实
练真题·明考向
1.(2023·辽宁卷)晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是( )
B.图1中O原子的配位数为6
C.图2表示的化学式为LiMg2OClxBr1-x
D.Mg2+取代产生的空位有利于Li+传导
C
解析 根据均摊原理,图1晶胞中Li、Cl、O原子个数分别为3、1、1,即化学式为Li3OCl,则晶体的密度为 ,A正确;从图1看,O原子与6个Li形成正八面体结构,B正确;图2晶胞中Li的个数为1,O的个数为1,Cl和Br的个数之和也为1,结合化合价代数和为0,则该晶体的化学式为LiMgOClxBr1-x,C错误;Mg2+取代及卤素共掺杂后获得高性能固体电解质材料,则是由于空位的存在,有利于Li+传导,D正确。
2.(2023·湖北卷)镧La和H可以形成一系列晶体材料LaHn,在储氢和超导等领域具有重要应用。LaHn属于立方晶系,晶胞结构和参数如图所示。高压下,LaH2中的每个H结合4个H形成类似CH4的结构,即得到晶体LaHx。下列说法错误的是( )
A.LaH2晶体中La的配位数为8
B.晶体中H和H的最短距离:LaH2>LaHx
C.在LaHx晶胞中,H形成一个顶点数为
40的闭合多面体笼
D.LaHx单位体积中含氢质量的计算式为
C
解析 LaH2晶体中La的配位数是8,A正确;LaH2的晶胞边长大于LaHx,且LaHx中存在以一个H为中心与另外4个H形成类似于甲烷的结构,导致氢原子密度大,距离近,故H和H的最短距离:LaH2>LaHx,B正确;LaHx晶胞中共40个氢原子,其中一部分H在形成的立方体结构内,并不是40个顶点,C错误;每个LaHx晶胞中有40个氢原子,晶胞体积为(4.84×10-8)3 cm3,故含氢质量为
3.(2023·湖南卷)科学家合成了一种高温超导材料,其晶胞结构如图所示,该立方晶胞参数为a pm,阿伏加德罗常数的值为NA,下列说法错误的是( )
A.晶体最简化学式为KCaB6C6
B.晶体中与K+最近且距离相等的Ca2+有8个
C.晶胞中B和C原子构成的多面体有12个面
C
4.(2023·全国甲卷,35节选)将酞菁—钴钛菁—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。
(1)如图所示的几种碳单质,它们互为 ,其中属于共价晶体的是 ,C60间的作用力是 。
同素异形体
金刚石
范德华力(或分子间作用力)
(2)AlF3的熔点为1 090 ℃,远高于AlCl3的192 ℃,由此可以判断铝氟之间的化学键为 键。AlF3结构属立方晶系,晶胞如图所示,F-的配位数
为 。若晶胞参数为a pm,晶体密度ρ= g·cm-3(列出计算式,阿伏加德罗常数的值为NA)。
离子
2
练易错·避陷阱
5.(2023·山东滨州一模)Cu2+可以与缩二脲(H2NCONHCONH2)形成紫色配离子,结构如图所示。下列说法正确的是( )
A.该配离子需在碱性条件下制备
B.该配离子中碳原子和氮原子都采取sp3杂化
C.该配离子中配位键强度:Cu—N
A
解析 缩二脲含有—NH2,易与酸反应生成盐,故该配离子需要在碱性条件下制备,A正确;该配离子中双键碳原子采取sp2杂化,B错误;O元素的电负性比N元素大,与Cu2+形成配位键时,N原子给出孤电子对的能力比O原子强,故配位键的强度:Cu—N>Cu—O,C错误;1个铜离子通过四个配位键与其他原子结合,故1 mol该配离子中含有的配位键数目为8NA,D错误。
6.(2023·河南名校联盟联考)砷化硼是一种超高热导率半导体材料,其晶胞结构如图所示。下列说法错误的是( )
A.和元素As位于同一周期且含有相同未
成对电子数的元素有两种
B.BAs晶体中硼原子和砷原子均采取sp3杂化
C.根据X、Y的坐标可知,1号砷原子的坐标为
D.若晶胞中As原子到B原子的最近距离为a pm,则该晶体的密度为
D
练预测·押考向
7.我国科研工作者利用冷冻透射电子显微镜同步辐射等技术,在还原氧化石墨烯膜上直接观察到了自然环境下生成的某二维晶体,其结构如图所示。下列说法正确的是( )
A.该二维晶体的化学式为CaCl2
B.Ca—Cl—Ca的键角为120°
C.Can+和Cl-的配位数均为3
D.该晶体可由钙在氯气中燃烧制得
C
解析 由俯视图可知,一个钙离子形成键结合3个氯离子,同样一个氯离子形成键结合3个钙离子,则该二维晶体的化学式为CaCl,A错误;结合侧视图可知,Ca—Cl—Ca构成的为非平面六边形,其Ca—Cl—Ca的键角不是120°,B错误;Can+、Cl-周围最近的离子数均为3,故配位数均为3,C正确;钙在氯气中燃烧生成CaCl2,不能得到该晶体,D错误。
8.氮化钼作为锂离子电池的负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在Mo原子立方晶格的八面体空隙中,晶胞结构如图所示,其中氮化钼晶胞参数为a nm。设NA为阿伏加德罗常数的值,下列说法正确的是( )
D
9.已知图甲为金属钠的晶胞,晶胞边长为a pm,其晶胞截面如图乙所示。图丙为ZnS晶胞截面,已知ZnS属于立方晶体,假设晶胞边长为d pm。下列关于ZnS晶胞的描述错误的是( )
图甲
图乙
图丙
A.每个晶胞中含有的S2-数目为4
B.与Zn2+距离最近且相等的S2-有8个
答案 B
同课章节目录
