专题 物质结构与性质综合题 课件(共34张PPT)
文档属性
| 名称 | 专题 物质结构与性质综合题 课件(共34张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 09:07:52 | ||
图片预览





文档简介
(共34张PPT)
专题 物质结构与性质综合题
2024
高考指引:近几年,全国卷及北京、重庆、山东、广东、河北、湖南等省市化学试题都考查了物质结构与性质综合题,大多以某种新材料、新药物等为命题载体,考查内容涵盖整个“物质结构与性质”模块,侧重考查考生的“理解与辨析能力”“分析与推测能力”“归纳与论证能力”等关键能力。
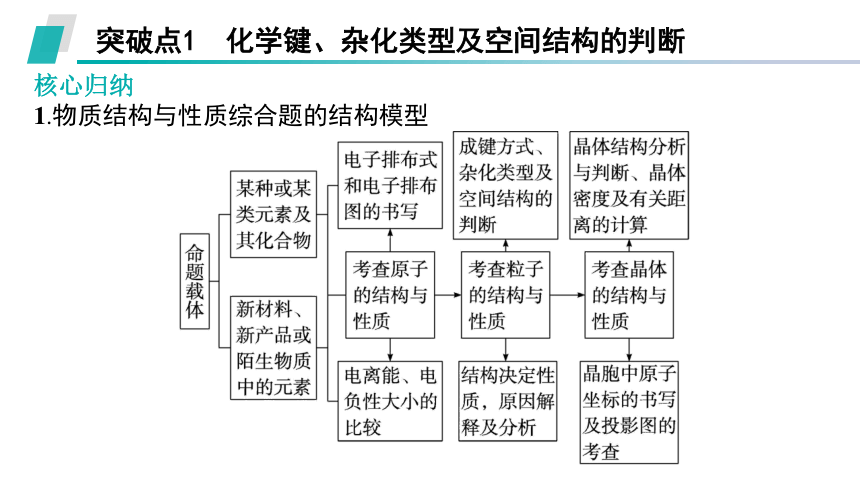
突破点1 化学键、杂化类型及空间结构的判断
核心归纳
1.物质结构与性质综合题的结构模型
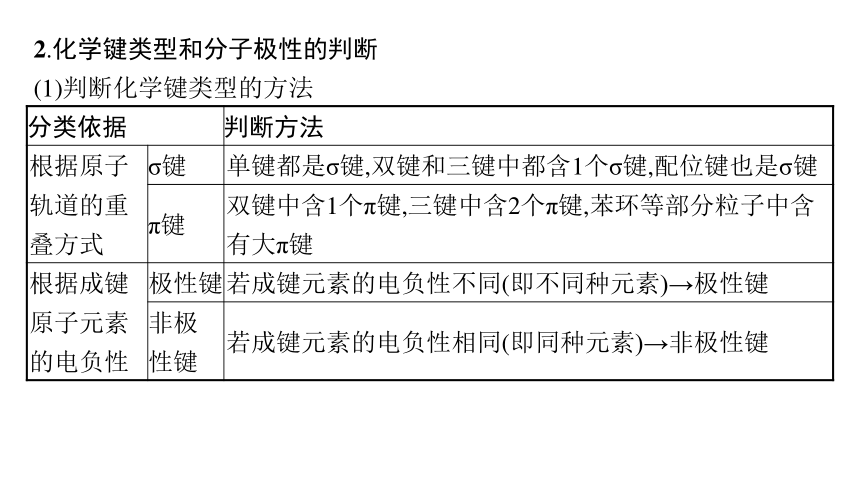
2.化学键类型和分子极性的判断
(1)判断化学键类型的方法
分类依据 判断方法
根据原子轨道的重叠方式 σ键 单键都是σ键,双键和三键中都含1个σ键,配位键也是σ键
π键 双键中含1个π键,三键中含2个π键,苯环等部分粒子中含有大π键
根据成键原子元素的电负性 极性键 若成键元素的电负性不同(即不同种元素)→极性键
非极 性键 若成键元素的电负性相同(即同种元素)→非极性键
(2)判断分子极性的方法
①双原子分子:分子的极性与键的极性一致,如HCl含有极性键,则HCl是极性分子。
②多原子分子:
多原子分子
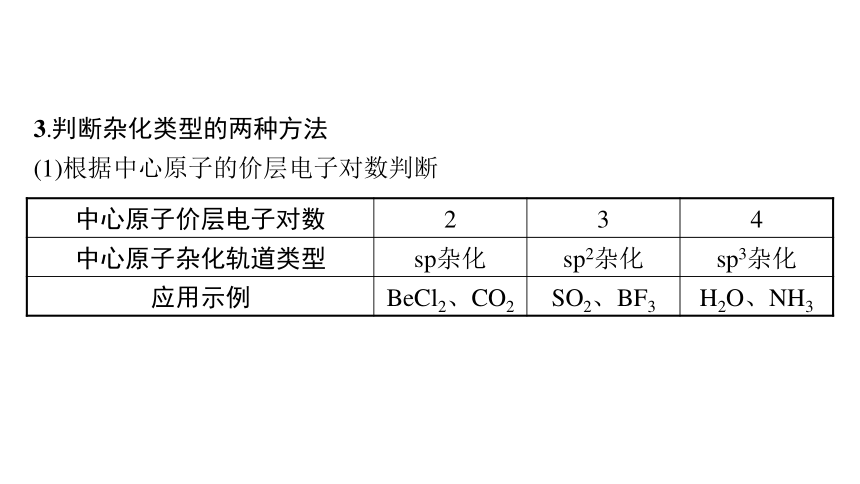
3.判断杂化类型的两种方法
(1)根据中心原子的价层电子对数判断
中心原子价层电子对数 2 3 4
中心原子杂化轨道类型 sp杂化 sp2杂化 sp3杂化
应用示例 BeCl2、CO2 SO2、BF3 H2O、NH3
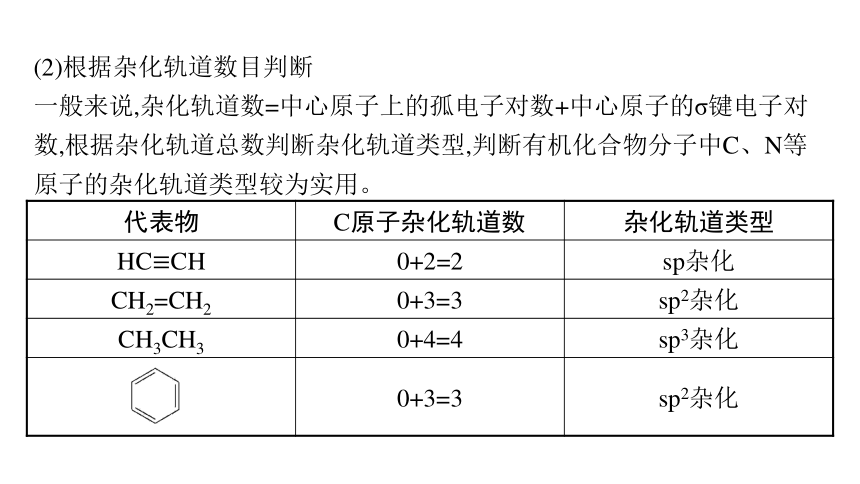
(2)根据杂化轨道数目判断
一般来说,杂化轨道数=中心原子上的孤电子对数+中心原子的σ键电子对数,根据杂化轨道总数判断杂化轨道类型,判断有机化合物分子中C、N等原子的杂化轨道类型较为实用。
代表物 C原子杂化轨道数 杂化轨道类型
HC≡CH 0+2=2 sp杂化
CH2=CH2 0+3=3 sp2杂化
CH3CH3 0+4=4 sp3杂化
0+3=3 sp2杂化
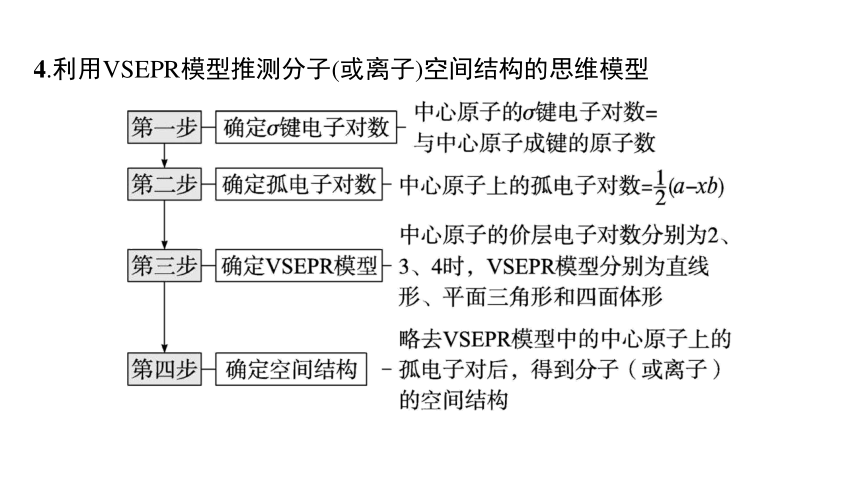
4.利用VSEPR模型推测分子(或离子)空间结构的思维模型
真题感悟
1.(1)(2023·全国乙卷,35节选)已知一些物质的熔点数据如下表:
物质 熔点/℃
NaCl 800.7
SiCl4 -68.8
GeCl4 -51.5
SnCl4 -34.1
Na与Si均为第三周期元素。NaCl熔点明显高于SiCl4。原因是 。分析同族元素的氯化物SiCl4、GeCl4、SnCl4熔点变化趋势及其原因:_______________________________
。
NaCl是离子晶体,SiCl4是分子晶体
SiCl4、GeCl4、SnCl4熔点依次升高,三者
均为分子晶体,范德华力随着相对分子质量的增大而递增,使得熔点依次升高
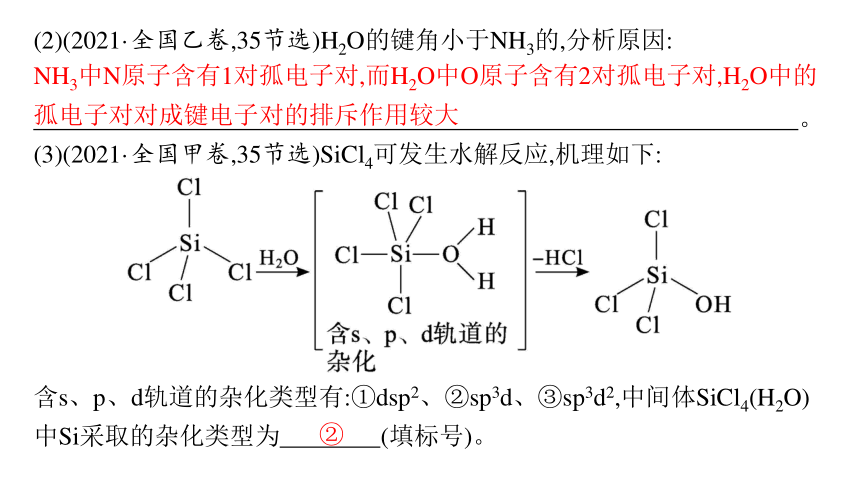
(3)(2021·全国甲卷,35节选)SiCl4可发生水解反应,机理如下:
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为 (填标号)。
(2)(2021·全国乙卷,35节选)H2O的键角小于NH3的,分析原因:
。
NH3中N原子含有1对孤电子对,而H2O中O原子含有2对孤电子对,H2O中的孤电子对对成键电子对的排斥作用较大
②
(3)由图可知,中间体SiCl4(H2O)中Si原子形成5条共价键,则Si的杂化轨道总数为5,根据杂化过程中原子轨道总数不变可知,Si采取sp3d杂化。
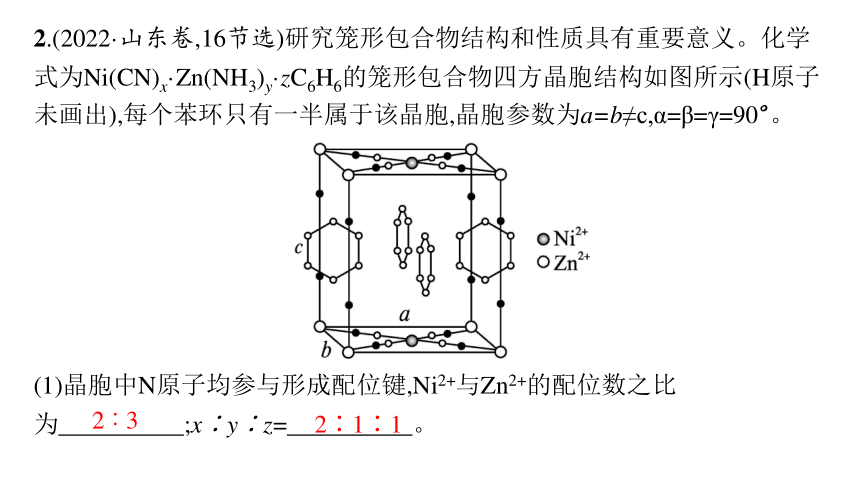
2.(2022·山东卷,16节选)研究笼形包合物结构和性质具有重要意义。化学式为Ni(CN)x·Zn(NH3)y·zC6H6的笼形包合物四方晶胞结构如图所示(H原子未画出),每个苯环只有一半属于该晶胞,晶胞参数为a=b≠c,α=β=γ=90°。
(1)晶胞中N原子均参与形成配位键,Ni2+与Zn2+的配位数之比为 ;x∶y∶z= 。
2∶3
2∶1∶1
突破点2 结构与性质的关系及原因分析
核心归纳
1.电离能的比较及原因分析
比较 方法 ①根据元素周期表中同周期(或同主族)元素第一电离能的变化规律比较,若为同周期元素,要考虑价层电子排布产生的影响;②逐级电离能的比较,一般遵循规律“I1>I2>I3>……”
原因 分析 基态原子电子占据的最高能级ns轨道全充满(ⅡA族)、np轨道半充满(ⅤA族)时为稳定状态,相应元素的第一电离能大于同周期相邻元素
2.分子的稳定性比较及原因分析
比较 方法 根据键长和键能两个键参数来比较分子的稳定性,一般来说,键长越短,分子的稳定性越强
原因 分析 键长越短,键能越大,化学键越不易断裂,分子的稳定性越强
3.键角的比较及原因分析
比较 方法 ①分析中心原子的价层电子对数(成键电子对和孤电子对);
②中心原子价层电子对数相同时,孤电子对数越大,键角越小;
③考虑中心原子或成键原子的电负性,根据成键电子对的偏移程度判断,成键电子对越偏向中心原子,键角越大,相反,越偏离中心原子,键角越小
原因 分析 电子对之间排斥力:孤电子对—孤电子对>孤电子对—成键电子对>成键电子对—成键电子对,含有孤电子对越多,键角越小
4.配合物稳定性的比较及原因分析
比较 方法 相同中心离子与不同配体形成配位键,比较提供孤电子对的原子对应元素的电负性,一般电负性越小,形成的配位键就越稳定
原因 分析 成键原子的电负性越小,形成配位键时越易提供孤电子对,形成的配位键越稳定
5.晶体熔、沸点的比较及原因分析
比较 方法 ①判断所属晶体类型,看清影响晶体熔、沸点的因素,如分子晶体(范德华力、氢键)、共价晶体(共价键)、离子晶体(离子键)、金属晶体(金属键)等;
②同种晶体类型,结合微粒间作用力及影响因素,判断熔、沸点的高低
原因 分析 原因分析模板:先指明晶体类型及影响其熔、沸点的因素,再从微粒间作用力的角度比较其大小,最后得出晶体的熔、沸点高低
真题感悟
3.(1)(2022·广东卷,20节选)H2Se的沸点低于H2O,其原因是 。
(2)(2022·全国乙卷,35节选)卤化物CsICl2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为 。解释X的熔点比Y高的原因: 。
H2Se分子间只存在范德华力,H2O分子间形成氢键
CsCl
CsCl为离子晶体,ICl为分子晶体,离子键强于分子间作用力
4.(2022·海南卷,19节选)(1)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是________________________________________________
。
(2)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn—N键中离子键成分的百分数小于Zn—O键,原因是
。
Cu、Zn等金属由金属阳离子和自由电子构成,自由电子
在外加电场中作定向移动
电负性:O>N,O对电子的吸引能力更强,Zn和O更易形成离子键
突破点3 晶体结构及相关计算
核心归纳
1.“三步法”确定晶胞中原子的分数坐标
2.分析晶胞投影图的方法
(1)分析晶胞沿x轴方向、y轴方向、z轴方向的投影图,确定晶胞中各粒子的具体位置。
(2)结合晶胞参数,利用“均摊法”计算晶体的密度、原子的空间利用率等。
(3)结合三维坐标系及晶胞中原子的位置,确定相关原子的分数坐标。
真题感悟
5.(2023·北京卷,15节选)硫代硫酸盐是一类具有应用前景的浸金试剂。硫代硫酸根 中的一个O原子被S原子取代的产物。
(1)MgS2O3·6H2O的晶胞形状为长方体,边长分别为a nm、b nm、c nm,结构如图所示。
晶胞中的[Mg(H2O)6]2+个数为 。已知MgS2O3·6H2O的摩尔质量是M g·mol-1,阿伏加德罗常数的值为NA,该晶体的密度
为 g·cm-3。(1 nm=10-7 cm)
4
中的中心原子S的价层电子对数为4,无孤电子对,不能做配位原子;端基S原子含有孤电子对,能做配位原子
6.(2022·广东卷,20节选)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
图1
图2
(1)X的化学式为 。
(2)设X的最简式的式量为Mr,晶体密度为ρ g·cm-3,则X中相邻K之间的最短
距离为 nm(列出计算式,NA为阿伏加德罗常数的值)。
K2SeBr6
考向预测演练
(2023·河南濮阳一模)铬是重要的金属元素之一,其化合物有着广泛的用途。回答下列问题:
(1)基态铬原子的未成对电子数是 。
(2)CrO2Cl2是重要的氯化剂。制备CrO2Cl2的反应的化学方程式为K2Cr2O7+3CCl4 ══ 2KCl+2CrO2Cl2+3COCl2↑。
①COCl2中C、O和Cl元素的电负性由大到小的顺序是 (用元素符号表示)。
②CrO2Cl2在常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2分子的空间结构是 (填“平面四边形”或“四面体形”)。
6
O>Cl>C
平面四边形
(3)三价铬丙二酸配合物
[Cr(C3H2O4)(H2O)4][Cr(C3H2O4)2(H2O)2]·4H2O在有机合成方面具有优良的催化性能,其中阴离子的结构如下:
①阴离子中碳原子的杂化轨道类型是 。
②在丙二酸根与Cr3+配位时,配位原子为1号氧而不是2号氧的原因是
。
sp3、sp2
1号氧比2号氧的孤电子对数多,且带负电,更易提供孤电子对(合理即可)
(4)Cr-N系列涂层具有良好的耐磨性和抗腐蚀性,在抗微动磨损上表现尤佳。某氮化铬的晶胞结构与氯化钠的相同。已知N原子在晶胞中的位置如图所示:
①下列为晶胞中Cr原子沿x轴方向投影的是 (填字母)。
b
②若晶胞中最近的Cr原子和N原子相切,原子半径分别为r(Cr) nm和
r(N) nm;晶胞中N原子的分数坐标是A(0,0,0)、B( ,0),则距A和B最近的Cr原子的分数坐标是 ,该原子到C原子的距离是
nm[用含r(Cr)、r(N)的代数式表示]。
3[r(Cr)+r(N)]
解析 (2)①C、O、Cl三种元素的电负性由大到小的顺序是O>Cl>C;②CrO2Cl2能与CCl4、CS2等互溶,CCl4、CS2都属于非极性分子,根据“相似相溶”推出CrO2Cl2为非极性分子,若CrO2Cl2空间结构为四面体形,则CrO2Cl2为极性分子,不符合上述推断,因此CrO2Cl2为平面四边形。
(4)①氮化铬的晶胞结构与NaCl的相同,根据N原子在晶胞中的位置可推出
Cr原子在晶胞的位置为体心和棱上,沿x轴方向的投影为 ,故选
项b符合题意;②Cr原子位于体心和棱的中心,距A、B最近的Cr原子有两个,
专题 物质结构与性质综合题
2024
高考指引:近几年,全国卷及北京、重庆、山东、广东、河北、湖南等省市化学试题都考查了物质结构与性质综合题,大多以某种新材料、新药物等为命题载体,考查内容涵盖整个“物质结构与性质”模块,侧重考查考生的“理解与辨析能力”“分析与推测能力”“归纳与论证能力”等关键能力。
突破点1 化学键、杂化类型及空间结构的判断
核心归纳
1.物质结构与性质综合题的结构模型
2.化学键类型和分子极性的判断
(1)判断化学键类型的方法
分类依据 判断方法
根据原子轨道的重叠方式 σ键 单键都是σ键,双键和三键中都含1个σ键,配位键也是σ键
π键 双键中含1个π键,三键中含2个π键,苯环等部分粒子中含有大π键
根据成键原子元素的电负性 极性键 若成键元素的电负性不同(即不同种元素)→极性键
非极 性键 若成键元素的电负性相同(即同种元素)→非极性键
(2)判断分子极性的方法
①双原子分子:分子的极性与键的极性一致,如HCl含有极性键,则HCl是极性分子。
②多原子分子:
多原子分子
3.判断杂化类型的两种方法
(1)根据中心原子的价层电子对数判断
中心原子价层电子对数 2 3 4
中心原子杂化轨道类型 sp杂化 sp2杂化 sp3杂化
应用示例 BeCl2、CO2 SO2、BF3 H2O、NH3
(2)根据杂化轨道数目判断
一般来说,杂化轨道数=中心原子上的孤电子对数+中心原子的σ键电子对数,根据杂化轨道总数判断杂化轨道类型,判断有机化合物分子中C、N等原子的杂化轨道类型较为实用。
代表物 C原子杂化轨道数 杂化轨道类型
HC≡CH 0+2=2 sp杂化
CH2=CH2 0+3=3 sp2杂化
CH3CH3 0+4=4 sp3杂化
0+3=3 sp2杂化
4.利用VSEPR模型推测分子(或离子)空间结构的思维模型
真题感悟
1.(1)(2023·全国乙卷,35节选)已知一些物质的熔点数据如下表:
物质 熔点/℃
NaCl 800.7
SiCl4 -68.8
GeCl4 -51.5
SnCl4 -34.1
Na与Si均为第三周期元素。NaCl熔点明显高于SiCl4。原因是 。分析同族元素的氯化物SiCl4、GeCl4、SnCl4熔点变化趋势及其原因:_______________________________
。
NaCl是离子晶体,SiCl4是分子晶体
SiCl4、GeCl4、SnCl4熔点依次升高,三者
均为分子晶体,范德华力随着相对分子质量的增大而递增,使得熔点依次升高
(3)(2021·全国甲卷,35节选)SiCl4可发生水解反应,机理如下:
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为 (填标号)。
(2)(2021·全国乙卷,35节选)H2O的键角小于NH3的,分析原因:
。
NH3中N原子含有1对孤电子对,而H2O中O原子含有2对孤电子对,H2O中的孤电子对对成键电子对的排斥作用较大
②
(3)由图可知,中间体SiCl4(H2O)中Si原子形成5条共价键,则Si的杂化轨道总数为5,根据杂化过程中原子轨道总数不变可知,Si采取sp3d杂化。
2.(2022·山东卷,16节选)研究笼形包合物结构和性质具有重要意义。化学式为Ni(CN)x·Zn(NH3)y·zC6H6的笼形包合物四方晶胞结构如图所示(H原子未画出),每个苯环只有一半属于该晶胞,晶胞参数为a=b≠c,α=β=γ=90°。
(1)晶胞中N原子均参与形成配位键,Ni2+与Zn2+的配位数之比为 ;x∶y∶z= 。
2∶3
2∶1∶1
突破点2 结构与性质的关系及原因分析
核心归纳
1.电离能的比较及原因分析
比较 方法 ①根据元素周期表中同周期(或同主族)元素第一电离能的变化规律比较,若为同周期元素,要考虑价层电子排布产生的影响;②逐级电离能的比较,一般遵循规律“I1>I2>I3>……”
原因 分析 基态原子电子占据的最高能级ns轨道全充满(ⅡA族)、np轨道半充满(ⅤA族)时为稳定状态,相应元素的第一电离能大于同周期相邻元素
2.分子的稳定性比较及原因分析
比较 方法 根据键长和键能两个键参数来比较分子的稳定性,一般来说,键长越短,分子的稳定性越强
原因 分析 键长越短,键能越大,化学键越不易断裂,分子的稳定性越强
3.键角的比较及原因分析
比较 方法 ①分析中心原子的价层电子对数(成键电子对和孤电子对);
②中心原子价层电子对数相同时,孤电子对数越大,键角越小;
③考虑中心原子或成键原子的电负性,根据成键电子对的偏移程度判断,成键电子对越偏向中心原子,键角越大,相反,越偏离中心原子,键角越小
原因 分析 电子对之间排斥力:孤电子对—孤电子对>孤电子对—成键电子对>成键电子对—成键电子对,含有孤电子对越多,键角越小
4.配合物稳定性的比较及原因分析
比较 方法 相同中心离子与不同配体形成配位键,比较提供孤电子对的原子对应元素的电负性,一般电负性越小,形成的配位键就越稳定
原因 分析 成键原子的电负性越小,形成配位键时越易提供孤电子对,形成的配位键越稳定
5.晶体熔、沸点的比较及原因分析
比较 方法 ①判断所属晶体类型,看清影响晶体熔、沸点的因素,如分子晶体(范德华力、氢键)、共价晶体(共价键)、离子晶体(离子键)、金属晶体(金属键)等;
②同种晶体类型,结合微粒间作用力及影响因素,判断熔、沸点的高低
原因 分析 原因分析模板:先指明晶体类型及影响其熔、沸点的因素,再从微粒间作用力的角度比较其大小,最后得出晶体的熔、沸点高低
真题感悟
3.(1)(2022·广东卷,20节选)H2Se的沸点低于H2O,其原因是 。
(2)(2022·全国乙卷,35节选)卤化物CsICl2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为 。解释X的熔点比Y高的原因: 。
H2Se分子间只存在范德华力,H2O分子间形成氢键
CsCl
CsCl为离子晶体,ICl为分子晶体,离子键强于分子间作用力
4.(2022·海南卷,19节选)(1)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是________________________________________________
。
(2)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn—N键中离子键成分的百分数小于Zn—O键,原因是
。
Cu、Zn等金属由金属阳离子和自由电子构成,自由电子
在外加电场中作定向移动
电负性:O>N,O对电子的吸引能力更强,Zn和O更易形成离子键
突破点3 晶体结构及相关计算
核心归纳
1.“三步法”确定晶胞中原子的分数坐标
2.分析晶胞投影图的方法
(1)分析晶胞沿x轴方向、y轴方向、z轴方向的投影图,确定晶胞中各粒子的具体位置。
(2)结合晶胞参数,利用“均摊法”计算晶体的密度、原子的空间利用率等。
(3)结合三维坐标系及晶胞中原子的位置,确定相关原子的分数坐标。
真题感悟
5.(2023·北京卷,15节选)硫代硫酸盐是一类具有应用前景的浸金试剂。硫代硫酸根 中的一个O原子被S原子取代的产物。
(1)MgS2O3·6H2O的晶胞形状为长方体,边长分别为a nm、b nm、c nm,结构如图所示。
晶胞中的[Mg(H2O)6]2+个数为 。已知MgS2O3·6H2O的摩尔质量是M g·mol-1,阿伏加德罗常数的值为NA,该晶体的密度
为 g·cm-3。(1 nm=10-7 cm)
4
中的中心原子S的价层电子对数为4,无孤电子对,不能做配位原子;端基S原子含有孤电子对,能做配位原子
6.(2022·广东卷,20节选)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
图1
图2
(1)X的化学式为 。
(2)设X的最简式的式量为Mr,晶体密度为ρ g·cm-3,则X中相邻K之间的最短
距离为 nm(列出计算式,NA为阿伏加德罗常数的值)。
K2SeBr6
考向预测演练
(2023·河南濮阳一模)铬是重要的金属元素之一,其化合物有着广泛的用途。回答下列问题:
(1)基态铬原子的未成对电子数是 。
(2)CrO2Cl2是重要的氯化剂。制备CrO2Cl2的反应的化学方程式为K2Cr2O7+3CCl4 ══ 2KCl+2CrO2Cl2+3COCl2↑。
①COCl2中C、O和Cl元素的电负性由大到小的顺序是 (用元素符号表示)。
②CrO2Cl2在常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2分子的空间结构是 (填“平面四边形”或“四面体形”)。
6
O>Cl>C
平面四边形
(3)三价铬丙二酸配合物
[Cr(C3H2O4)(H2O)4][Cr(C3H2O4)2(H2O)2]·4H2O在有机合成方面具有优良的催化性能,其中阴离子的结构如下:
①阴离子中碳原子的杂化轨道类型是 。
②在丙二酸根与Cr3+配位时,配位原子为1号氧而不是2号氧的原因是
。
sp3、sp2
1号氧比2号氧的孤电子对数多,且带负电,更易提供孤电子对(合理即可)
(4)Cr-N系列涂层具有良好的耐磨性和抗腐蚀性,在抗微动磨损上表现尤佳。某氮化铬的晶胞结构与氯化钠的相同。已知N原子在晶胞中的位置如图所示:
①下列为晶胞中Cr原子沿x轴方向投影的是 (填字母)。
b
②若晶胞中最近的Cr原子和N原子相切,原子半径分别为r(Cr) nm和
r(N) nm;晶胞中N原子的分数坐标是A(0,0,0)、B( ,0),则距A和B最近的Cr原子的分数坐标是 ,该原子到C原子的距离是
nm[用含r(Cr)、r(N)的代数式表示]。
3[r(Cr)+r(N)]
解析 (2)①C、O、Cl三种元素的电负性由大到小的顺序是O>Cl>C;②CrO2Cl2能与CCl4、CS2等互溶,CCl4、CS2都属于非极性分子,根据“相似相溶”推出CrO2Cl2为非极性分子,若CrO2Cl2空间结构为四面体形,则CrO2Cl2为极性分子,不符合上述推断,因此CrO2Cl2为平面四边形。
(4)①氮化铬的晶胞结构与NaCl的相同,根据N原子在晶胞中的位置可推出
Cr原子在晶胞的位置为体心和棱上,沿x轴方向的投影为 ,故选
项b符合题意;②Cr原子位于体心和棱的中心,距A、B最近的Cr原子有两个,
同课章节目录
