专题 物质结构与性质(共26张PPT)
文档属性
| 名称 | 专题 物质结构与性质(共26张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 09:35:54 | ||
图片预览







文档简介
(共26张PPT)
专题 物质结构与性质--基础巩固练
2024
基础巩固练
D
2.(2023·北京朝阳区一模)34Se和S均属于ⅥA族元素。下列关于Se及其化合物性质的比较不正确的是( )
A.第一电离能:Se>33As
B.原子半径:SeC.还原性:H2Se>H2S
D.沸点:H2Se>H2S
A
解析 As的4p轨道处于半充满的稳定状态,较难失去电子,其第一电离能更大,故第一电离能:Se<33As,A错误。
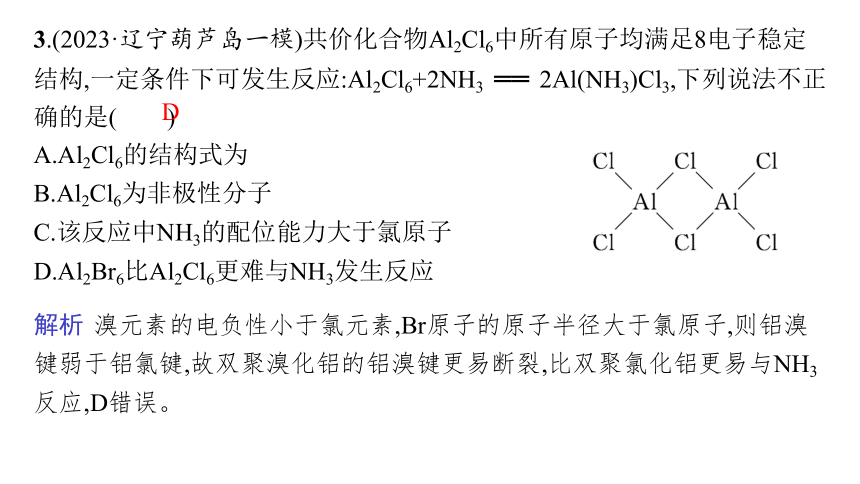
3.(2023·辽宁葫芦岛一模)共价化合物Al2Cl6中所有原子均满足8电子稳定结构,一定条件下可发生反应:Al2Cl6+2NH3 ══ 2Al(NH3)Cl3,下列说法不正确的是( )
A.Al2Cl6的结构式为
B.Al2Cl6为非极性分子
C.该反应中NH3的配位能力大于氯原子
D.Al2Br6比Al2Cl6更难与NH3发生反应
D
解析 溴元素的电负性小于氯元素,Br原子的原子半径大于氯原子,则铝溴键弱于铝氯键,故双聚溴化铝的铝溴键更易断裂,比双聚氯化铝更易与NH3反应,D错误。
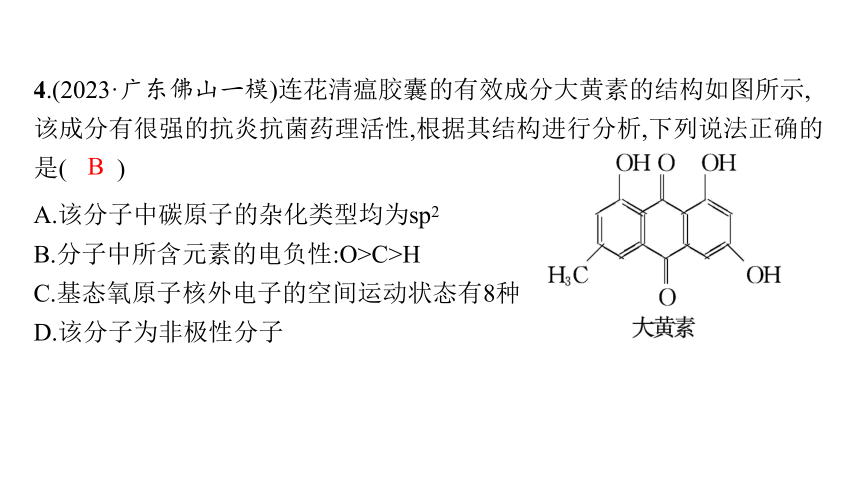
4.(2023·广东佛山一模)连花清瘟胶囊的有效成分大黄素的结构如图所示,该成分有很强的抗炎抗菌药理活性,根据其结构进行分析,下列说法正确的是( )
A.该分子中碳原子的杂化类型均为sp2
B.分子中所含元素的电负性:O>C>H
C.基态氧原子核外电子的空间运动状态有8种
D.该分子为非极性分子
B
解析 该分子中除—CH3中的碳原子采用sp3杂化之外,其余碳原子的杂化类型均为sp2,A错误;根据同周期主族元素从左往右元素的电负性依次增大,则电负性:O>C,再结合碳氢化合物中碳显负电性、H显正电性可知,电负性:O>C>H,B正确;O原子核外有8个电子,基态氧原子的核外电子排布式为1s22s22p4,共占据5个不同的轨道,故基态氧原子核外电子的空间运动状态有5种,C错误;该分子结构不对称,则正电中心和负电中心不重合,故为极性分子,D错误。
5.(2023·北京东城区一模)对下列事实的解释不正确的是( )
选项 事实 解释
A 稳定性:HF>HI HF分子间存在氢键,HI分子间不存在氢键
B 键角: >H2O 中心原子均采取sp3杂化,孤电子对有较大的斥力
C 熔点:石英>干冰 石英是共价晶体,干冰是分子晶体;共价键比分子间作用力强
D 酸性: CF3COOH>CCl3COOH F的电负性大于Cl,F—C的极性大于Cl—C,使F3C—的极性大于Cl3C—的极性
A
解析 氢化物的稳定性与键能大小有关,与氢键无关,A错误。
6.(2023·北京顺义区一模)下表为元素周期表的一部分,其中X、Y、W、Z为短周期元素,W的单质常温下为黄绿色气体。下列说法不正确的是( )
Y Z
X W
R
A.X、Y的单质均存在同素异形体
B.Y、Z的简单氢化物的稳定性依次递增
C.R的单质可用于制造半导体材料
D.工业上电解饱和NaW溶液得W2可使用阴离子交换膜
D
解析 W的单质常温下为黄绿色气体,则W为Cl元素,由元素在周期表中的位置可知,X为P元素,Y为O元素,Z为F元素,R为Ge元素。P对应的同素异形体有红磷、白磷等,O对应的同素异形体有氧气、臭氧等,A正确;同周期主族元素从左到右元素的非金属性增强,元素的非金属性越强,对应的氢化物越稳定,故Y、Z的简单氢化物的稳定性依次递增,B正确;Ge和Si位于同一主族,均为重要的半导体材料,C正确;工业上电解饱和食盐水可制得Cl2,因需要将产生的NaOH和Cl2分开,只允许阳离子通过离子交换膜,故需使用阳离子交换膜,D错误。
7.(2023·江西鹰潭一模)原子序数依次增大的五种短周期主族元素X、Y、Z、Q、W组成的化合物的结构如图所示,基态Q原子最外层电子数是电子层数的3倍。下列说法正确的是( )
A.W和Z形成的某种化合物受到撞击时
能瞬间释放出大量的气体
B.简单离子半径W>Q
C.氢化物的沸点YD.由X、Y、Q、W形成的化合物的水溶液一定显碱性
A
解析 基态Q原子最外层电子数是电子层数的3倍,则Q为O元素,W形成+1价阳离子且为短周期元素,则W为Na元素,根据结构可知X为H元素,Z形成三条单键,则Z为N元素,Y为C元素。Na和N形成的化合物NaN3受撞击时发生下列反应:2NaN3 3N2↑+2Na,瞬间释放大量气体,常用作汽车安全气囊,A正确;Na+和O2-的电子层结构相同,则离子半径:O2->Na+,B错误;碳的氢化物有多种,随着碳原子数的增大,其氢化物沸点越高,很多碳氢化合物的沸点高于H2O的沸点,C错误;H、C、O、Na形成的化合物的水溶液未必显碱性,如NaHCO3溶液呈碱性,NaHC2O4溶液呈酸性,D错误。
8.(2023·全国新课标卷)一种可吸附甲醇的材料,其化学式为[C(NH2)3]4[B(OCH3)4]3Cl,部分晶体结构如图所示,其中[C(NH2)3]+为平面结构。
下列说法正确的是( )
A.该晶体中存在N—H…O氢键
B.基态原子的第一电离能:CC.基态原子未成对电子数:BD.晶体中B、N和O原子轨道的杂化类型相同
A
解析 根据图示信息,结合原子的成键规律可知图中虚线表示的是N—H…O氢键,A正确;基态N原子的2p轨道处于半充满状态,其第一电离能大于C、O,即第一电离能C9.(2023·黑龙江哈尔滨一模)某新型漂白剂的结构如图,其组成元素均为短周期元素,其中X与Y同周期,X与W对应的简单离子核外电子排布相同,且W、Y、Z的最外层电子数之和等于X的最外层电子数。下列说法错误的是( )
A.四种元素中X的电负性最大
B.简单离子半径:WC.由Z和X两种元素可能形成非极性分子
D.第一电离能介于X与Y之间的同周期元素只有2种
C
解析 短线可表示共价键和配位键,X形成两个键,X可能是O或S,Z形成一个键,Z可能是H或F或Cl,根据“W、Y、Z的最外层电子数之和等于X的最外层电子数”,Z只能是H,W原子最外层有2个电子,可推出Y最外层3个电子,说明结构中Y形成化学键中有配位键,再根据“X与W对应的简单离子核外电子排布相同”,且X与Y同周期,则W只能是Mg,X是O,Y是B,Z是H。四种元素中,氧元素的电负性最大,A正确;Mg2+与O2-的核外电子排布相同,Mg2+的核电荷数大,则Mg2+的半径小于O2-,B正确;X是O,Z是H,二者可形成H2O和H2O2,均为极性分子,C错误;第一电离能介于O和B之间的同周期元素有Be和C两种,D正确。
10.(2023·安徽宿州一模)我国科学家在嫦娥五号月壤样品中发现一种新矿物,命名为“嫦娥石”,其中含有原子序数依次增大的短周期主族元素W、X、Y、Z,W在地壳中含量最多,X的原子半径在同周期主族元素中最大,基态Y原子无未成对电子,Z的第一电离能大于同周期相邻元素。下列叙述正确的是( )
A.W的简单氢化物的稳定性弱于Z
B.最高价氧化物对应水化物的碱性X小于Y
C.Z的简单氢化物的空间结构为三角锥形
D.W分别与X、Y、Z形成晶体,其类型相同
C
解析 原子序数依次增大的短周期主族元素W、X、Y、Z,W在地壳中含量最多,故W为O;X的原子半径在同周期主族元素中最大,则X为第三周期原子半径最大的元素,即X为Na;基态Y原子无未成对电子,则Y为Mg;Z的第一电离能大于同周期相邻元素,则Z为P。W为O,Z为P,由于O的非金属性强于P,故H2O的稳定性强于PH3,A错误;X为Na,Y为Mg,同一周期从左往右金属性依次减弱,则最高价氧化物对应水化物的碱性:NaOH>Mg(OH)2,B错误;Z为P,Z的简单氢化物为PH3,中心原子P的价层电子对数为4,含1对孤电子对,根据价层电子对互斥模型可知,其空间结构为三角锥形,C正确;W、X、Y、Z分别为O、Na、Mg、P,则W分别与X、Y、Z形成晶体的类型不完全相同,依次为离子晶体、离子晶体和分子晶体,D错误。
11.(2023·湖南常德一模)作为储氢材料的镧镍合金被广泛应用于电动车辆,某种镧镍合金储氢后所得晶体的化学式为LaNi5H6,其晶胞结构如图,晶胞参数为a,下列有关表述不正确的是( )
A.Z表示的微粒为H2
B.每个X原子周围最近且等距离的X原子有6个
C.若A的分数坐标为(0,0.5,0.5),B的分数坐标为(0.75,0.75,0),则C的分数坐标为(1,0.5,1)
D.若四条竖直棱的棱心位置均插入Z,则晶体的化学式为LaNi5H7
D
12.(2023·湖南邵阳一模)R、G、Y、X为原子序数依次增大的四种短周期元素,Y与G同周期,X与Y同主族。甲、乙、丙、丁、戊为这四种元素组成的化合物,其转化关系如图。下列说法中正确的是( )
A.Y的氢化物沸点高于G的氢化物沸点
B.基态X原子核外电子有9种空间运动状态
C.丁的稀溶液在反应③中作催化剂
D.G的最高价氧化物的水化物的酸性比X的强
B
解析 根据短周期元素Y的原子能形成2个共价键可知,Y为O元素;Y与G同周期即均为第二周期元素,G原子形成4个共价键,则G为C元素;X与Y同主族,则X为S元素;R能形成1个共价键且原子序数最小,则R为H元素。Y为O元素,Y形成的氢化物H2O、H2O2常温下均为液态,G为碳元素,G形成的氢化物中碳原子数目较大时为固态,则氧的氢化物的沸点可能低于碳的氢化物的沸点,A错误;X为S元素,基态S原子的核外电子排布式为1s22s22p63s23p4,空间运动状态有9种,B正确;丁为H2SO4,丙为CH3CH2OH,甲为CH2=CH2,乙为H2O,反应③为CH3CH2OH发生消去反应生成CH2=CH2和水,浓硫酸在反应③中作催化剂和脱水剂,C错误;G为C元素,X为S元素,非金属性:S>C,则最高价氧化物的水化物的酸性:H2CO313.(2023·江西赣州一模)碳元素是形成化合物最多的元素,碳及其化合物构成了丰富多彩的物质世界。回答下列问题:
(1)基态碳原子的电子占据的最高能级电子云形状为 ,与碳元素同主族的第四周期元素基态原子的价层电子排布式为 。
(2)CH3CH2OH是常见的含碳化合物,其组成元素的电负性从大到小的顺序为 ,该分子中具有孤电子对的原子是 。
(3)碳酸盐是构成岩石、土壤等的主要成分,其阴离子 的空间结构为 。已知碳酸镁的热分解温度比碳酸钙低,试解释原因:
。
哑铃形
4s24p2
O>C>H
O
平面正三角形
碳酸镁分解产物是MgO和CO2,碳酸钙分解产物是CaO和CO2,MgO的离子键强于CaO,更加稳定
(4)在碳酸氢盐中,存在阴离子 的多聚链状结构(其结构单元如图),连接结构单元的主要作用力是氢键,请在下图中前后各连接一个结构单元,该
结构中,碳原子杂化方式为 。
sp2杂化
(5)一种碳化钨晶体的晶胞结构如图,若晶胞的高为b pm,阿伏加德罗常数的值为NA,晶体的密度为ρ g·cm-3,则晶胞底面六边形的边长为
pm(列出计算式)。
专题 物质结构与性质--基础巩固练
2024
基础巩固练
D
2.(2023·北京朝阳区一模)34Se和S均属于ⅥA族元素。下列关于Se及其化合物性质的比较不正确的是( )
A.第一电离能:Se>33As
B.原子半径:Se
D.沸点:H2Se>H2S
A
解析 As的4p轨道处于半充满的稳定状态,较难失去电子,其第一电离能更大,故第一电离能:Se<33As,A错误。
3.(2023·辽宁葫芦岛一模)共价化合物Al2Cl6中所有原子均满足8电子稳定结构,一定条件下可发生反应:Al2Cl6+2NH3 ══ 2Al(NH3)Cl3,下列说法不正确的是( )
A.Al2Cl6的结构式为
B.Al2Cl6为非极性分子
C.该反应中NH3的配位能力大于氯原子
D.Al2Br6比Al2Cl6更难与NH3发生反应
D
解析 溴元素的电负性小于氯元素,Br原子的原子半径大于氯原子,则铝溴键弱于铝氯键,故双聚溴化铝的铝溴键更易断裂,比双聚氯化铝更易与NH3反应,D错误。
4.(2023·广东佛山一模)连花清瘟胶囊的有效成分大黄素的结构如图所示,该成分有很强的抗炎抗菌药理活性,根据其结构进行分析,下列说法正确的是( )
A.该分子中碳原子的杂化类型均为sp2
B.分子中所含元素的电负性:O>C>H
C.基态氧原子核外电子的空间运动状态有8种
D.该分子为非极性分子
B
解析 该分子中除—CH3中的碳原子采用sp3杂化之外,其余碳原子的杂化类型均为sp2,A错误;根据同周期主族元素从左往右元素的电负性依次增大,则电负性:O>C,再结合碳氢化合物中碳显负电性、H显正电性可知,电负性:O>C>H,B正确;O原子核外有8个电子,基态氧原子的核外电子排布式为1s22s22p4,共占据5个不同的轨道,故基态氧原子核外电子的空间运动状态有5种,C错误;该分子结构不对称,则正电中心和负电中心不重合,故为极性分子,D错误。
5.(2023·北京东城区一模)对下列事实的解释不正确的是( )
选项 事实 解释
A 稳定性:HF>HI HF分子间存在氢键,HI分子间不存在氢键
B 键角: >H2O 中心原子均采取sp3杂化,孤电子对有较大的斥力
C 熔点:石英>干冰 石英是共价晶体,干冰是分子晶体;共价键比分子间作用力强
D 酸性: CF3COOH>CCl3COOH F的电负性大于Cl,F—C的极性大于Cl—C,使F3C—的极性大于Cl3C—的极性
A
解析 氢化物的稳定性与键能大小有关,与氢键无关,A错误。
6.(2023·北京顺义区一模)下表为元素周期表的一部分,其中X、Y、W、Z为短周期元素,W的单质常温下为黄绿色气体。下列说法不正确的是( )
Y Z
X W
R
A.X、Y的单质均存在同素异形体
B.Y、Z的简单氢化物的稳定性依次递增
C.R的单质可用于制造半导体材料
D.工业上电解饱和NaW溶液得W2可使用阴离子交换膜
D
解析 W的单质常温下为黄绿色气体,则W为Cl元素,由元素在周期表中的位置可知,X为P元素,Y为O元素,Z为F元素,R为Ge元素。P对应的同素异形体有红磷、白磷等,O对应的同素异形体有氧气、臭氧等,A正确;同周期主族元素从左到右元素的非金属性增强,元素的非金属性越强,对应的氢化物越稳定,故Y、Z的简单氢化物的稳定性依次递增,B正确;Ge和Si位于同一主族,均为重要的半导体材料,C正确;工业上电解饱和食盐水可制得Cl2,因需要将产生的NaOH和Cl2分开,只允许阳离子通过离子交换膜,故需使用阳离子交换膜,D错误。
7.(2023·江西鹰潭一模)原子序数依次增大的五种短周期主族元素X、Y、Z、Q、W组成的化合物的结构如图所示,基态Q原子最外层电子数是电子层数的3倍。下列说法正确的是( )
A.W和Z形成的某种化合物受到撞击时
能瞬间释放出大量的气体
B.简单离子半径W>Q
C.氢化物的沸点Y
A
解析 基态Q原子最外层电子数是电子层数的3倍,则Q为O元素,W形成+1价阳离子且为短周期元素,则W为Na元素,根据结构可知X为H元素,Z形成三条单键,则Z为N元素,Y为C元素。Na和N形成的化合物NaN3受撞击时发生下列反应:2NaN3 3N2↑+2Na,瞬间释放大量气体,常用作汽车安全气囊,A正确;Na+和O2-的电子层结构相同,则离子半径:O2->Na+,B错误;碳的氢化物有多种,随着碳原子数的增大,其氢化物沸点越高,很多碳氢化合物的沸点高于H2O的沸点,C错误;H、C、O、Na形成的化合物的水溶液未必显碱性,如NaHCO3溶液呈碱性,NaHC2O4溶液呈酸性,D错误。
8.(2023·全国新课标卷)一种可吸附甲醇的材料,其化学式为[C(NH2)3]4[B(OCH3)4]3Cl,部分晶体结构如图所示,其中[C(NH2)3]+为平面结构。
下列说法正确的是( )
A.该晶体中存在N—H…O氢键
B.基态原子的第一电离能:C
A
解析 根据图示信息,结合原子的成键规律可知图中虚线表示的是N—H…O氢键,A正确;基态N原子的2p轨道处于半充满状态,其第一电离能大于C、O,即第一电离能C
A.四种元素中X的电负性最大
B.简单离子半径:W
D.第一电离能介于X与Y之间的同周期元素只有2种
C
解析 短线可表示共价键和配位键,X形成两个键,X可能是O或S,Z形成一个键,Z可能是H或F或Cl,根据“W、Y、Z的最外层电子数之和等于X的最外层电子数”,Z只能是H,W原子最外层有2个电子,可推出Y最外层3个电子,说明结构中Y形成化学键中有配位键,再根据“X与W对应的简单离子核外电子排布相同”,且X与Y同周期,则W只能是Mg,X是O,Y是B,Z是H。四种元素中,氧元素的电负性最大,A正确;Mg2+与O2-的核外电子排布相同,Mg2+的核电荷数大,则Mg2+的半径小于O2-,B正确;X是O,Z是H,二者可形成H2O和H2O2,均为极性分子,C错误;第一电离能介于O和B之间的同周期元素有Be和C两种,D正确。
10.(2023·安徽宿州一模)我国科学家在嫦娥五号月壤样品中发现一种新矿物,命名为“嫦娥石”,其中含有原子序数依次增大的短周期主族元素W、X、Y、Z,W在地壳中含量最多,X的原子半径在同周期主族元素中最大,基态Y原子无未成对电子,Z的第一电离能大于同周期相邻元素。下列叙述正确的是( )
A.W的简单氢化物的稳定性弱于Z
B.最高价氧化物对应水化物的碱性X小于Y
C.Z的简单氢化物的空间结构为三角锥形
D.W分别与X、Y、Z形成晶体,其类型相同
C
解析 原子序数依次增大的短周期主族元素W、X、Y、Z,W在地壳中含量最多,故W为O;X的原子半径在同周期主族元素中最大,则X为第三周期原子半径最大的元素,即X为Na;基态Y原子无未成对电子,则Y为Mg;Z的第一电离能大于同周期相邻元素,则Z为P。W为O,Z为P,由于O的非金属性强于P,故H2O的稳定性强于PH3,A错误;X为Na,Y为Mg,同一周期从左往右金属性依次减弱,则最高价氧化物对应水化物的碱性:NaOH>Mg(OH)2,B错误;Z为P,Z的简单氢化物为PH3,中心原子P的价层电子对数为4,含1对孤电子对,根据价层电子对互斥模型可知,其空间结构为三角锥形,C正确;W、X、Y、Z分别为O、Na、Mg、P,则W分别与X、Y、Z形成晶体的类型不完全相同,依次为离子晶体、离子晶体和分子晶体,D错误。
11.(2023·湖南常德一模)作为储氢材料的镧镍合金被广泛应用于电动车辆,某种镧镍合金储氢后所得晶体的化学式为LaNi5H6,其晶胞结构如图,晶胞参数为a,下列有关表述不正确的是( )
A.Z表示的微粒为H2
B.每个X原子周围最近且等距离的X原子有6个
C.若A的分数坐标为(0,0.5,0.5),B的分数坐标为(0.75,0.75,0),则C的分数坐标为(1,0.5,1)
D.若四条竖直棱的棱心位置均插入Z,则晶体的化学式为LaNi5H7
D
12.(2023·湖南邵阳一模)R、G、Y、X为原子序数依次增大的四种短周期元素,Y与G同周期,X与Y同主族。甲、乙、丙、丁、戊为这四种元素组成的化合物,其转化关系如图。下列说法中正确的是( )
A.Y的氢化物沸点高于G的氢化物沸点
B.基态X原子核外电子有9种空间运动状态
C.丁的稀溶液在反应③中作催化剂
D.G的最高价氧化物的水化物的酸性比X的强
B
解析 根据短周期元素Y的原子能形成2个共价键可知,Y为O元素;Y与G同周期即均为第二周期元素,G原子形成4个共价键,则G为C元素;X与Y同主族,则X为S元素;R能形成1个共价键且原子序数最小,则R为H元素。Y为O元素,Y形成的氢化物H2O、H2O2常温下均为液态,G为碳元素,G形成的氢化物中碳原子数目较大时为固态,则氧的氢化物的沸点可能低于碳的氢化物的沸点,A错误;X为S元素,基态S原子的核外电子排布式为1s22s22p63s23p4,空间运动状态有9种,B正确;丁为H2SO4,丙为CH3CH2OH,甲为CH2=CH2,乙为H2O,反应③为CH3CH2OH发生消去反应生成CH2=CH2和水,浓硫酸在反应③中作催化剂和脱水剂,C错误;G为C元素,X为S元素,非金属性:S>C,则最高价氧化物的水化物的酸性:H2CO3
(1)基态碳原子的电子占据的最高能级电子云形状为 ,与碳元素同主族的第四周期元素基态原子的价层电子排布式为 。
(2)CH3CH2OH是常见的含碳化合物,其组成元素的电负性从大到小的顺序为 ,该分子中具有孤电子对的原子是 。
(3)碳酸盐是构成岩石、土壤等的主要成分,其阴离子 的空间结构为 。已知碳酸镁的热分解温度比碳酸钙低,试解释原因:
。
哑铃形
4s24p2
O>C>H
O
平面正三角形
碳酸镁分解产物是MgO和CO2,碳酸钙分解产物是CaO和CO2,MgO的离子键强于CaO,更加稳定
(4)在碳酸氢盐中,存在阴离子 的多聚链状结构(其结构单元如图),连接结构单元的主要作用力是氢键,请在下图中前后各连接一个结构单元,该
结构中,碳原子杂化方式为 。
sp2杂化
(5)一种碳化钨晶体的晶胞结构如图,若晶胞的高为b pm,阿伏加德罗常数的值为NA,晶体的密度为ρ g·cm-3,则晶胞底面六边形的边长为
pm(列出计算式)。
同课章节目录
