专题 物质结构与性质--能力提升练(共29张PPT)
文档属性
| 名称 | 专题 物质结构与性质--能力提升练(共29张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 09:37:19 | ||
图片预览







文档简介
(共29张PPT)
专题 物质结构与性质--能力提升练
2024
能力提升练
1.(2023·广东广州一模)四氯化锗(GeCl4)是光导纤维的常用掺杂剂,锗与硅同族。下列说法不正确的是( )
A.基态Ge原子的价层电子排布式为4s24p2
B.GeCl4的熔点比SiCl4低
C.GeCl4的空间结构为正四面体形
D.第一电离能大小:Cl>Si>Ge
B
解析 锗是32号元素,基态Ge原子的价层电子排布式为4s24p2,A正确;GeCl4与SiCl4晶体都属于分子晶体,GeCl4的相对分子质量大,GeCl4晶体内的分子间作用力大,则GeCl4的熔点比SiCl4高,B错误;GeCl4分子中Ge原子形成了4个σ键,孤电子对数为 (4-1×4)=0,价层电子对数为4,中心原子的杂化类型为sp3,空间结构为正四面体形,C正确;元素非金属性越强,其第一电离能越大,非金属性大小为Cl>Si>Ge,则第一电离能:Cl>Si>Ge,D正确。
2.(2023·湖北七市州3月联考)氟锑酸(HSbF6)可由氢氟酸和五氟化锑反应得到,其酸性是纯硫酸的2×1019倍,只能用特氟龙(即聚四氟乙烯)为材料的容器盛装。下列有关说法不正确的是( )
A.基态Sb原子的简化电子排布式为[Kr]5s25p3
B.SbF6的VSEPR模型为正八面体形
C.HSbF6分子中含有配位键
D.特氟龙号称“塑料之王”,可通过CF2=CF2发生加聚反应制备
A
解析 Sb为第五周期第ⅤA族元素,则基态Sb原子的简化电子排布式为[Kr]4d105s25p3,A错误;SbF6中心原子Sb形成6个共价键,其VSEPR模型为正八面体形,B正确;HSbF6分子中含有配位键,C正确;CF2=CF2分子中存在碳碳双键,可以通过加聚反应制备特氟龙,D正确。
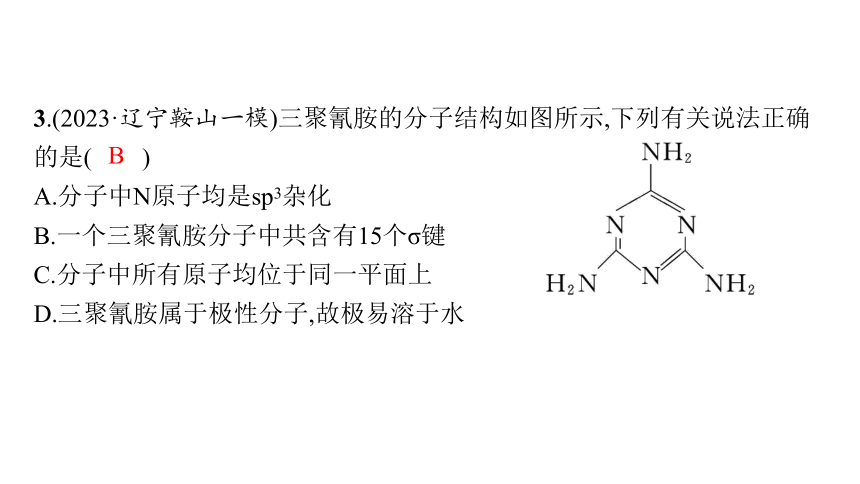
3.(2023·辽宁鞍山一模)三聚氰胺的分子结构如图所示,下列有关说法正确的是( )
A.分子中N原子均是sp3杂化
B.一个三聚氰胺分子中共含有15个σ键
C.分子中所有原子均位于同一平面上
D.三聚氰胺属于极性分子,故极易溶于水
B
解析 由结构简式可知,三聚氰胺分子中单键氮原子的杂化方式为sp3杂化,双键氮原子的杂化方式为sp2杂化,A错误;分子中的单键为σ键,双键中有1个σ键和1个π键,则三聚氰胺分子中共含有15个σ键,B正确;三聚氰胺分子中单键氮原子的杂化方式为sp3杂化,故分子中所有原子不可能位于同一平面上,C错误;三聚氰胺的分子结构对称,正、负电荷中心重合,属于非极性分子,D错误。
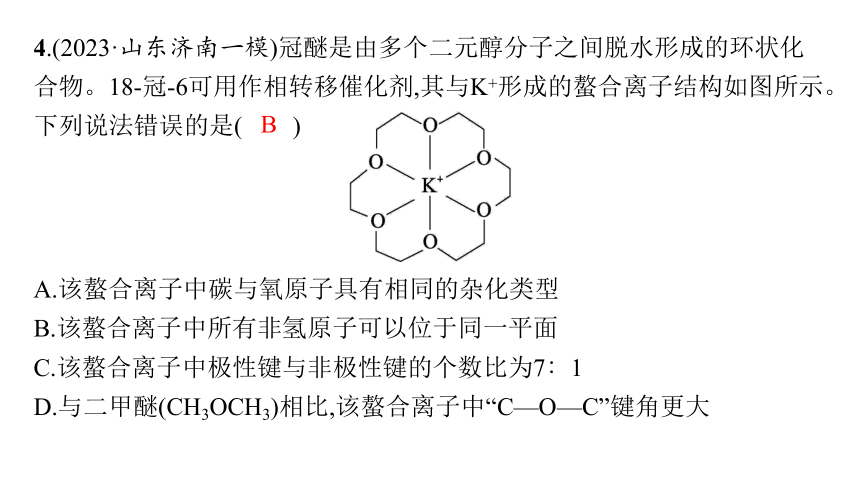
4.(2023·山东济南一模)冠醚是由多个二元醇分子之间脱水形成的环状化合物。18-冠-6可用作相转移催化剂,其与K+形成的螯合离子结构如图所示。下列说法错误的是( )
A.该螯合离子中碳与氧原子具有相同的杂化类型
B.该螯合离子中所有非氢原子可以位于同一平面
C.该螯合离子中极性键与非极性键的个数比为7∶1
D.与二甲醚(CH3OCH3)相比,该螯合离子中“C—O—C”键角更大
B
解析 该螯合离子中碳与氧原子均采取sp3杂化,具有相同的杂化类型,A正确;该螯合离子中碳原子为饱和碳原子,所有的氧原子和碳原子不在同一平面,B错误;该螯合离子中的极性键为24个C—H、12个C—O和6个配位键,共42个极性键,非极性键为6个C—C,二者个数比为7∶1,C正确;与二甲醚(CH3OCH3)相比,该螯合离子中O的孤电子对数从2对变成1对,排斥作用减小,则“C—O—C”键角更大,D正确。
5.(2023·山东潍坊一模)“点击化学”研究获得2022年诺贝尔化学奖表彰,利用该原理可制得如图所示含 大π键的产物。已知杂化轨道中s成分越多,所形成的化学键越稳定。下列说法错误的是( )
A.铜离子降低了反应的活化能
B.反应物中黑球对应元素的电负性强于N
C.产物中α、β两位置的N原子中,α位置的N原子更容易形成配位键
D.反应物中氮氮键比产物中氮氮键的键长短
B
解析 铜离子在反应中作催化剂,能降低反应的活化能,从而加快反应速率,A正确;由 可知,α位置的N原子带正电,则与黑球直接连接的N应该显一定负电性,黑球对应元素应显一定正电性,故黑球对应元素的电负性弱于N,B错误;α位置的N原子中含有1对孤电子对,容易形成配位键,C正确;杂化轨道中s成分越多,所形成的化学键越稳定,反应物中氮氮键更稳定、键长更短,故反应物中氮氮键比产物中氮氮键的键长短,D正确。
6.(2023·陕西榆林一模)短周期主族元素X、Y、Z、W、R的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物对应的水化物的稀溶液中,却不溶于其浓溶液。下列说法正确的是( )
A.简单离子半径:R>W>X>Y>Z
B.Y与W具有相同的最高化合价
C.Z、W的简单离子都能促进水的电离
D.向元素X的最简单氢化物的稀溶液中滴加酚酞,无明显变化
C
解析 常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液,可联想到Al在浓硝酸、浓硫酸中的钝化,则Z应为Al元素,W的原子序数大于Al,则W为S元素,R为原子序数大于S的短周期主族元素,则R为Cl元素;X的气态氢化物极易溶于Y的氢化物中,且X的原子序数小于Y,应是指氨气极易溶于水,则X为N元素,Y为O元素。核外电子排布相同的简单离子,原子序数越小半径越大,另外电子层数越多,半径越大,故简单离子半径:W>R>X>Y>Z,A错误;W为S元素,Y为O元素,S的最高化合价为+6价,O没有+6价,最高化合价不同,B错误;Z、W的简单离子分别为Al3+、S2-,都可以发生水解,从而促进水的电离,C正确;X为N元素,N的气态氢化物为NH3,其水溶液显碱性,滴加酚酞,溶液显红色,D错误。
7.(2023·湖南岳阳一模)一种麻醉剂的分子结构式如图所示。X的原子核只有1个质子,其中X、Y、Z、W原子序数依次增大,且Y、Z、W均位于X的下一周期;元素E的原子比W原子多8个电子。下列说法一定正确的是( )
A.分子中Z原子的杂化轨道类型为sp
B.W与85号元素位于周期表中的同一主族
C.X、Y、Z、W的原子核外未成对电子数分别为1、4、2、1
D.氢化物的沸点:YB
解析 X的原子核只有1个质子,则X为H;元素Y、Z、W原子序数依次增大,且均位于X的下一周期,由化合物中化学键可知,Y为C、Z为O、W为F;元素E的原子比W原子多8个电子,E的质子数为9+8=17,E为Cl。Z为O,分子中Z原子含有2对孤电子对,形成两个单键,杂化轨道类型为sp3,A错误;W为F,85号元素为At,两者均位于第ⅦA族,B正确;X、Y、Z、W分别为H、C、O、F,原子核外未成对电子数分别为1、2、2、1,C错误;Y为C,其氢化物可以是各类烃,其沸点可能高于Z的氢化物,D错误。
8.(2023·湖北八市联考)某种离子液体的结构如图所示,X、Y、Z、M、Q为原子序数依次增大的短周期元素,Y、Z、M为同周期相邻元素,Z的原子序数等于X、Y原子序数之和,Q为非金属性最强的元素。下列说法错误的是( )
A.基态原子未成对电子数:Y>Q
B.简单气态氢化物的稳定性:MC.阴离子Y空间结构为正四面体形
D.基态原子第一电离能由大到小的顺序为Q>M>Z>Y
A
解析 根据阳离子的结构可知,Z原子形成四个键,可知Z为C原子;Y、Z、M为同周期相邻元素,那么Y为B,M为N,X为H;根据阴离子的结构及Q为非金属性最强的元素可知,Q为F。Y的基态原子电子排布式为1s22s22p1,Q的基态原子电子排布式为1s22s22p5,未成对电子数均为1,A错误;非金属性NN>C>B,D正确。
9.(2023·河北沧州一模)ZnS是一种重要的光导体材料。如图是ZnS的某种晶胞沿z轴方向在xy平面的投影,原子旁边标注的数字是该原子位于z轴上的高度(部分相同位置的原子未标注),下列说法正确的是( )
A.S2-周围等距离且最近的S2-有6个
B.基态Zn原子核外有15种空间运动状态不同的电子
C.Zn2+与S2-的最短距离为 pm
D.在第三周期中,比S元素第一电离能大的元素有两种
B
10.(2023·广东茂名一模)我国科学家合成了一种深紫外非线性光学晶体新材料,该晶体中阴离子为[M11XY19Z3]3-。元素M、X、Y、Z均为短周期元素,M、Y与Z同周期,M的最外层电子数比次外层电子数多1,Z为电负性最强的元素,Y是地壳中含量最高的元素,X的3p轨道有3个电子。下列说法中不正确的是( )
A.电负性:Y>X
B.简单离子半径:Y>Z
C.简单气态氢化物的稳定性:XD.M最高价氧化物对应水化物能与盐酸反应
D
解析 元素M、X、Y、Z均为短周期元素,M的最外层电子数比次外层电子数多1,则M是B;Z为电负性最强的元素,则Z是F;Y是地壳中含量最高的元素,则Y是O;X的3p轨道有3个电子,则X是P。根据元素周期表中元素电负性的变化规律可知,电负性:O>N>P,则Y>X,A正确;电子层结构相同的离子,核电荷数越大,半径越小,故简单离子半径:O2->F-,B正确;非金属性:F>P,则简单气态氢化物的稳定性:HF>PH3,C正确;M的最高价氧化物对应水化物为硼酸,硼酸不与盐酸反应,D错误。
11.(2023·河北邯郸一模)氮化镓是一种优异的半导体,硬度很大,熔点约为
1 700 ℃,氮化镓有三种晶体结构,其中最稳定的晶体的结构如图。下列关于该结构及其对应晶体的说法正确的是( )
A.氮化镓晶体属于分子晶体
B.该结构中有8个N原子
C.Ga原子周围等距离且最近的Ga原子数为6
D
12.(2023·辽宁辽阳一模)我国科学家开发铜钯催化剂高效实现电催化CO还原制备乙酸,铜钯的晶胞结构如图。已知:Cu、Pd的原子半径分别为a pm、b pm。下列叙述正确的是( )
A.乙酸的同分异构体均易溶于水
B.该晶胞对应晶体的化学式为CuPd2
C.距离Cu最近的Cu有8个
D
13.(2023·山东菏泽一模)我国在新材料领域研究的重大突破为“天宫”空间站的建设提供了坚实的物质基础。“天宫”空间站使用的材料中含有B、C、N、Ni、Cu等元素。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是
(填字母,下同),用光谱仪可捕捉到发射光谱的是 。
A
D
(2)铵盐大多不稳定。从结构的角度解释NH4F比NH4I更易分解的原因是
。
(3)镍能形成多种配合物,其中Ni(CO)4是无色挥发性液体,K2[Ni(CN)4]是红黄色单斜晶体。K2[Ni(CN)4]中的配位原子是 ;K2[Ni(CN)4]的熔点高于Ni(CO)4的原因是 。
氟离子半径小于碘离子,氢氟键键能更大,更容易形成,故氟更易夺取铵根离子中的氢生成HF
C
K2[Ni(CN)4]为离子晶体,而Ni(CO)4为分子晶体
(4)氮化硼(BN)晶体存在如图所示的两种结构,六方氮化硼的结构与石墨类似,可用作润滑剂;立方氮化硼的结构与金刚石类似,可用作研磨剂。六方氮化硼的晶体类型为 ;立方氮化硼晶胞的密度为ρ g·cm-3,晶胞的边长为a cm。设NA为阿伏加德罗常数的值,则阿伏加德罗常数的值
NA= 。
混合型晶体
专题 物质结构与性质--能力提升练
2024
能力提升练
1.(2023·广东广州一模)四氯化锗(GeCl4)是光导纤维的常用掺杂剂,锗与硅同族。下列说法不正确的是( )
A.基态Ge原子的价层电子排布式为4s24p2
B.GeCl4的熔点比SiCl4低
C.GeCl4的空间结构为正四面体形
D.第一电离能大小:Cl>Si>Ge
B
解析 锗是32号元素,基态Ge原子的价层电子排布式为4s24p2,A正确;GeCl4与SiCl4晶体都属于分子晶体,GeCl4的相对分子质量大,GeCl4晶体内的分子间作用力大,则GeCl4的熔点比SiCl4高,B错误;GeCl4分子中Ge原子形成了4个σ键,孤电子对数为 (4-1×4)=0,价层电子对数为4,中心原子的杂化类型为sp3,空间结构为正四面体形,C正确;元素非金属性越强,其第一电离能越大,非金属性大小为Cl>Si>Ge,则第一电离能:Cl>Si>Ge,D正确。
2.(2023·湖北七市州3月联考)氟锑酸(HSbF6)可由氢氟酸和五氟化锑反应得到,其酸性是纯硫酸的2×1019倍,只能用特氟龙(即聚四氟乙烯)为材料的容器盛装。下列有关说法不正确的是( )
A.基态Sb原子的简化电子排布式为[Kr]5s25p3
B.SbF6的VSEPR模型为正八面体形
C.HSbF6分子中含有配位键
D.特氟龙号称“塑料之王”,可通过CF2=CF2发生加聚反应制备
A
解析 Sb为第五周期第ⅤA族元素,则基态Sb原子的简化电子排布式为[Kr]4d105s25p3,A错误;SbF6中心原子Sb形成6个共价键,其VSEPR模型为正八面体形,B正确;HSbF6分子中含有配位键,C正确;CF2=CF2分子中存在碳碳双键,可以通过加聚反应制备特氟龙,D正确。
3.(2023·辽宁鞍山一模)三聚氰胺的分子结构如图所示,下列有关说法正确的是( )
A.分子中N原子均是sp3杂化
B.一个三聚氰胺分子中共含有15个σ键
C.分子中所有原子均位于同一平面上
D.三聚氰胺属于极性分子,故极易溶于水
B
解析 由结构简式可知,三聚氰胺分子中单键氮原子的杂化方式为sp3杂化,双键氮原子的杂化方式为sp2杂化,A错误;分子中的单键为σ键,双键中有1个σ键和1个π键,则三聚氰胺分子中共含有15个σ键,B正确;三聚氰胺分子中单键氮原子的杂化方式为sp3杂化,故分子中所有原子不可能位于同一平面上,C错误;三聚氰胺的分子结构对称,正、负电荷中心重合,属于非极性分子,D错误。
4.(2023·山东济南一模)冠醚是由多个二元醇分子之间脱水形成的环状化合物。18-冠-6可用作相转移催化剂,其与K+形成的螯合离子结构如图所示。下列说法错误的是( )
A.该螯合离子中碳与氧原子具有相同的杂化类型
B.该螯合离子中所有非氢原子可以位于同一平面
C.该螯合离子中极性键与非极性键的个数比为7∶1
D.与二甲醚(CH3OCH3)相比,该螯合离子中“C—O—C”键角更大
B
解析 该螯合离子中碳与氧原子均采取sp3杂化,具有相同的杂化类型,A正确;该螯合离子中碳原子为饱和碳原子,所有的氧原子和碳原子不在同一平面,B错误;该螯合离子中的极性键为24个C—H、12个C—O和6个配位键,共42个极性键,非极性键为6个C—C,二者个数比为7∶1,C正确;与二甲醚(CH3OCH3)相比,该螯合离子中O的孤电子对数从2对变成1对,排斥作用减小,则“C—O—C”键角更大,D正确。
5.(2023·山东潍坊一模)“点击化学”研究获得2022年诺贝尔化学奖表彰,利用该原理可制得如图所示含 大π键的产物。已知杂化轨道中s成分越多,所形成的化学键越稳定。下列说法错误的是( )
A.铜离子降低了反应的活化能
B.反应物中黑球对应元素的电负性强于N
C.产物中α、β两位置的N原子中,α位置的N原子更容易形成配位键
D.反应物中氮氮键比产物中氮氮键的键长短
B
解析 铜离子在反应中作催化剂,能降低反应的活化能,从而加快反应速率,A正确;由 可知,α位置的N原子带正电,则与黑球直接连接的N应该显一定负电性,黑球对应元素应显一定正电性,故黑球对应元素的电负性弱于N,B错误;α位置的N原子中含有1对孤电子对,容易形成配位键,C正确;杂化轨道中s成分越多,所形成的化学键越稳定,反应物中氮氮键更稳定、键长更短,故反应物中氮氮键比产物中氮氮键的键长短,D正确。
6.(2023·陕西榆林一模)短周期主族元素X、Y、Z、W、R的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物对应的水化物的稀溶液中,却不溶于其浓溶液。下列说法正确的是( )
A.简单离子半径:R>W>X>Y>Z
B.Y与W具有相同的最高化合价
C.Z、W的简单离子都能促进水的电离
D.向元素X的最简单氢化物的稀溶液中滴加酚酞,无明显变化
C
解析 常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液,可联想到Al在浓硝酸、浓硫酸中的钝化,则Z应为Al元素,W的原子序数大于Al,则W为S元素,R为原子序数大于S的短周期主族元素,则R为Cl元素;X的气态氢化物极易溶于Y的氢化物中,且X的原子序数小于Y,应是指氨气极易溶于水,则X为N元素,Y为O元素。核外电子排布相同的简单离子,原子序数越小半径越大,另外电子层数越多,半径越大,故简单离子半径:W>R>X>Y>Z,A错误;W为S元素,Y为O元素,S的最高化合价为+6价,O没有+6价,最高化合价不同,B错误;Z、W的简单离子分别为Al3+、S2-,都可以发生水解,从而促进水的电离,C正确;X为N元素,N的气态氢化物为NH3,其水溶液显碱性,滴加酚酞,溶液显红色,D错误。
7.(2023·湖南岳阳一模)一种麻醉剂的分子结构式如图所示。X的原子核只有1个质子,其中X、Y、Z、W原子序数依次增大,且Y、Z、W均位于X的下一周期;元素E的原子比W原子多8个电子。下列说法一定正确的是( )
A.分子中Z原子的杂化轨道类型为sp
B.W与85号元素位于周期表中的同一主族
C.X、Y、Z、W的原子核外未成对电子数分别为1、4、2、1
D.氢化物的沸点:Y
解析 X的原子核只有1个质子,则X为H;元素Y、Z、W原子序数依次增大,且均位于X的下一周期,由化合物中化学键可知,Y为C、Z为O、W为F;元素E的原子比W原子多8个电子,E的质子数为9+8=17,E为Cl。Z为O,分子中Z原子含有2对孤电子对,形成两个单键,杂化轨道类型为sp3,A错误;W为F,85号元素为At,两者均位于第ⅦA族,B正确;X、Y、Z、W分别为H、C、O、F,原子核外未成对电子数分别为1、2、2、1,C错误;Y为C,其氢化物可以是各类烃,其沸点可能高于Z的氢化物,D错误。
8.(2023·湖北八市联考)某种离子液体的结构如图所示,X、Y、Z、M、Q为原子序数依次增大的短周期元素,Y、Z、M为同周期相邻元素,Z的原子序数等于X、Y原子序数之和,Q为非金属性最强的元素。下列说法错误的是( )
A.基态原子未成对电子数:Y>Q
B.简单气态氢化物的稳定性:M
D.基态原子第一电离能由大到小的顺序为Q>M>Z>Y
A
解析 根据阳离子的结构可知,Z原子形成四个键,可知Z为C原子;Y、Z、M为同周期相邻元素,那么Y为B,M为N,X为H;根据阴离子的结构及Q为非金属性最强的元素可知,Q为F。Y的基态原子电子排布式为1s22s22p1,Q的基态原子电子排布式为1s22s22p5,未成对电子数均为1,A错误;非金属性N
9.(2023·河北沧州一模)ZnS是一种重要的光导体材料。如图是ZnS的某种晶胞沿z轴方向在xy平面的投影,原子旁边标注的数字是该原子位于z轴上的高度(部分相同位置的原子未标注),下列说法正确的是( )
A.S2-周围等距离且最近的S2-有6个
B.基态Zn原子核外有15种空间运动状态不同的电子
C.Zn2+与S2-的最短距离为 pm
D.在第三周期中,比S元素第一电离能大的元素有两种
B
10.(2023·广东茂名一模)我国科学家合成了一种深紫外非线性光学晶体新材料,该晶体中阴离子为[M11XY19Z3]3-。元素M、X、Y、Z均为短周期元素,M、Y与Z同周期,M的最外层电子数比次外层电子数多1,Z为电负性最强的元素,Y是地壳中含量最高的元素,X的3p轨道有3个电子。下列说法中不正确的是( )
A.电负性:Y>X
B.简单离子半径:Y>Z
C.简单气态氢化物的稳定性:X
D
解析 元素M、X、Y、Z均为短周期元素,M的最外层电子数比次外层电子数多1,则M是B;Z为电负性最强的元素,则Z是F;Y是地壳中含量最高的元素,则Y是O;X的3p轨道有3个电子,则X是P。根据元素周期表中元素电负性的变化规律可知,电负性:O>N>P,则Y>X,A正确;电子层结构相同的离子,核电荷数越大,半径越小,故简单离子半径:O2->F-,B正确;非金属性:F>P,则简单气态氢化物的稳定性:HF>PH3,C正确;M的最高价氧化物对应水化物为硼酸,硼酸不与盐酸反应,D错误。
11.(2023·河北邯郸一模)氮化镓是一种优异的半导体,硬度很大,熔点约为
1 700 ℃,氮化镓有三种晶体结构,其中最稳定的晶体的结构如图。下列关于该结构及其对应晶体的说法正确的是( )
A.氮化镓晶体属于分子晶体
B.该结构中有8个N原子
C.Ga原子周围等距离且最近的Ga原子数为6
D
12.(2023·辽宁辽阳一模)我国科学家开发铜钯催化剂高效实现电催化CO还原制备乙酸,铜钯的晶胞结构如图。已知:Cu、Pd的原子半径分别为a pm、b pm。下列叙述正确的是( )
A.乙酸的同分异构体均易溶于水
B.该晶胞对应晶体的化学式为CuPd2
C.距离Cu最近的Cu有8个
D
13.(2023·山东菏泽一模)我国在新材料领域研究的重大突破为“天宫”空间站的建设提供了坚实的物质基础。“天宫”空间站使用的材料中含有B、C、N、Ni、Cu等元素。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是
(填字母,下同),用光谱仪可捕捉到发射光谱的是 。
A
D
(2)铵盐大多不稳定。从结构的角度解释NH4F比NH4I更易分解的原因是
。
(3)镍能形成多种配合物,其中Ni(CO)4是无色挥发性液体,K2[Ni(CN)4]是红黄色单斜晶体。K2[Ni(CN)4]中的配位原子是 ;K2[Ni(CN)4]的熔点高于Ni(CO)4的原因是 。
氟离子半径小于碘离子,氢氟键键能更大,更容易形成,故氟更易夺取铵根离子中的氢生成HF
C
K2[Ni(CN)4]为离子晶体,而Ni(CO)4为分子晶体
(4)氮化硼(BN)晶体存在如图所示的两种结构,六方氮化硼的结构与石墨类似,可用作润滑剂;立方氮化硼的结构与金刚石类似,可用作研磨剂。六方氮化硼的晶体类型为 ;立方氮化硼晶胞的密度为ρ g·cm-3,晶胞的边长为a cm。设NA为阿伏加德罗常数的值,则阿伏加德罗常数的值
NA= 。
混合型晶体
同课章节目录
