2024鲁教版高中化学选择性必修2同步练习题--第1课时 金属晶体与离子晶体(含解析)
文档属性
| 名称 | 2024鲁教版高中化学选择性必修2同步练习题--第1课时 金属晶体与离子晶体(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 00:00:00 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2024鲁教版高中化学选择性必修2同步
第2节 几种简单的晶体结构模型
第1课时 金属晶体与离子晶体
基础过关练
题组一 金属晶体的通性
1.(经典题)(2022山东聊城第三中学月考)金属晶体中含有的粒子是( )
A.金属原子和“自由电子”
B.只有金属离子
C.金属原子和金属离子
D.金属离子与“自由电子”
2.(经典题)(2022福建建瓯阶段考试)金属晶体熔点高低和硬度大小一般取决于金属键的强弱,而金属键的强弱与金属阳离子所带电荷数的多少及半径大小有关。由此判断下列说法正确的是( )
A.金属镁的硬度大于金属铝
B.碱金属单质的熔点从Li到Cs是逐渐增大的
C.金属镁的熔点大于金属钠
D.金属镁的硬度小于金属钙
题组二 离子晶体的结构和性质
3.(2022北京丰台第二中学期末)CaF2晶体的晶胞结构如图所示,其中Ca2+以表示,F-以○表示。下列关于该离子晶体的说法中正确的是 ( )
A.CaF2与BaF2的晶体类型相同,CaF2的熔点比BaF2的大
B.该晶体中含有离子键和共价键
C.每个晶胞中含6个Ca2+
D.每个Ca2+周围有4个与它等距且最近的Ca2+
4.(经典题)北京大学和中国科学院的化学工作者成功研制出碱金属K与C60形成的球碳盐K3C60。实验测知该物质属于离子晶体,具有良好的超导性。下列关于K3C60的组成和结构的分析中正确的是( )
A.K3C60晶体中既有离子键又有极性键
B.K3C60晶体的熔点比C60晶体的熔点低
C.该晶体熔融状态时能导电
D.C60分子中碳原子采取sp3杂化
5.(2022山东菏泽一中月考)下列关于离子晶体的描述不正确的是( )
A.离子晶体是阳离子和阴离子通过静电吸引力结合而成的晶体
B.稳定性:Na2O>Na2S>Na2Se
C.硬度:MgCl2>CaCl2>BaCl2
D.在氯化钠晶体中,Na+和Cl-的配位数均为6
题组三 晶格能
6.下列关于晶体的描述正确的是( )
A.在CsCl晶体中,每个Cs+周围与其距离最近且相等的Cs+有12个
B.晶格能通常取正值,但是有时也取负值
C.离子晶体的晶格能越大,形成的离子晶体越稳定,熔点越高
D.晶格能越大,物质的硬度反而越小
7.已知钠与两种卤族元素形成的化合物Q、P,它们的晶格能分别为923 kJ·mol-1、786 kJ·mol-1,下列有关说法中不正确的是( )
A.Q的熔点比P的高
B.若P是NaCl,则Q一定是NaF
C.Q中成键离子核间距较小
D.若P是NaCl,则Q可能是NaBr
能力提升练
题组一 金属晶体的结构及相关计算
1.(经典题)(2022安徽合肥一六八中学期中)右图为某金属的面心立方晶胞,则该金属的一个晶胞中实际拥有的原子数为( )
A.3 B.4 C.7 D.9
2.(2023北京东城期末)因生产金属铁的工艺和温度等因素不同,产生的铁单质的晶体结构也不同。两种铁晶胞(均为立方体,边长分别为a nm和1.22a nm)的结构示意图如图所示。下列说法不正确的是( )
图1 图2
A.用X射线衍射可测定铁晶体的结构
B.图2代表的铁单质中,一个铁原子周围最多有4个紧邻的铁原子
C.图1与图2代表的铁单质中,原子之间以金属键相互结合
D.图1与图2代表的铁单质的密度不同
题组二 离子晶体的结构及相关计算
3.(2022安徽合肥第一中学期中)X是第四周期元素,其原子最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层电子数相同,X与Y形成的一种化合物的立方晶胞如图所示。下列说法错误的是( )
A.单质X的晶体类型为金属晶体
B.该化合物的化学式为CuCl2
C.与每个X离子距离相等且最近的X离子有12个
D.元素Y的基态原子的核外电子排布式为1s22s22p63s23p5
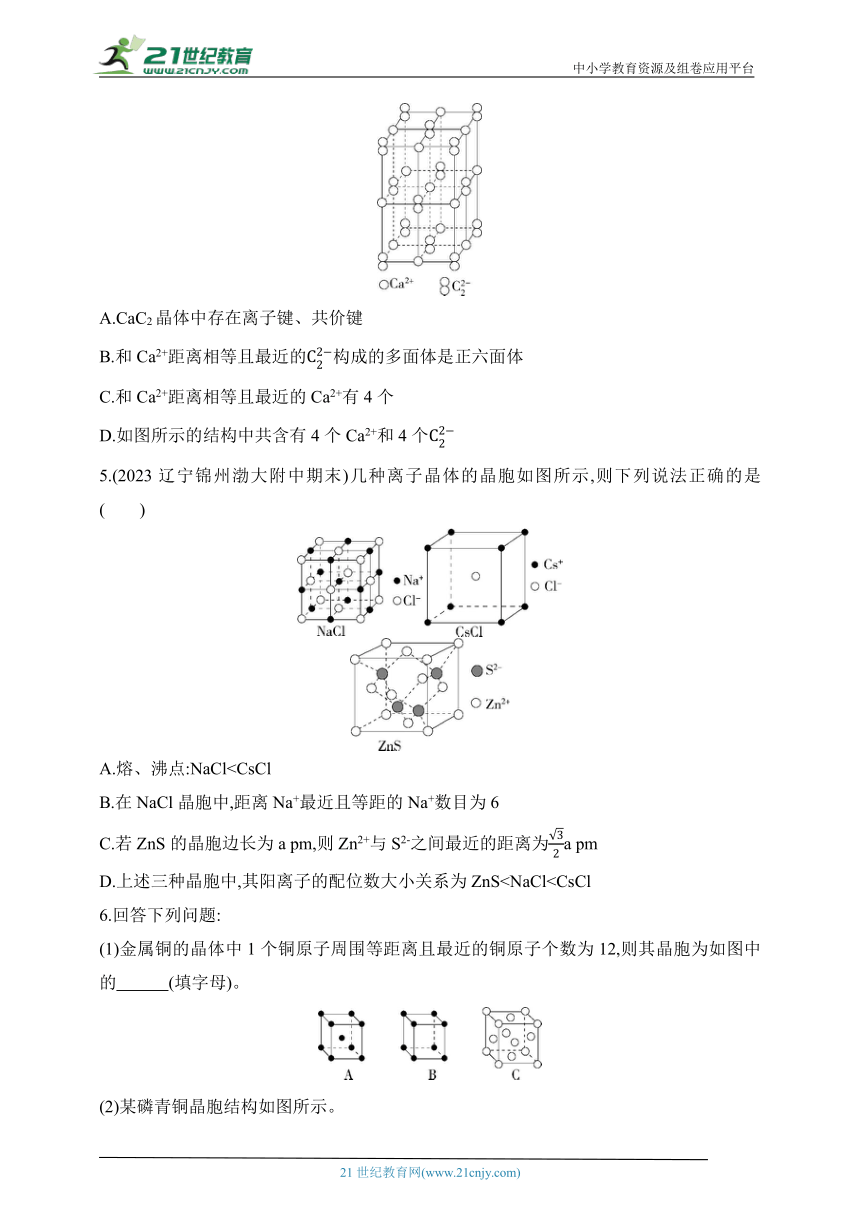
4.(2022山东临沂检测)乙炔可用于照明、焊接及切断金属(氧炔焰),也是制造乙醛、醋酸、合成橡胶、合成纤维等的基本原料。乙炔可以用CaC2与水反应制取,CaC2晶体的晶胞结构如图所示,CaC2晶体中由于的存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的描述错误的是( )
A.CaC2晶体中存在离子键、共价键
B.和Ca2+距离相等且最近的构成的多面体是正六面体
C.和Ca2+距离相等且最近的Ca2+有4个
D.如图所示的结构中共含有4个Ca2+和4个
5.(2023辽宁锦州渤大附中期末)几种离子晶体的晶胞如图所示,则下列说法正确的是( )
A.熔、沸点:NaClB.在NaCl晶胞中,距离Na+最近且等距的Na+数目为6
C.若ZnS的晶胞边长为a pm,则Zn2+与S2-之间最近的距离为a pm
D.上述三种晶胞中,其阳离子的配位数大小关系为ZnS6.回答下列问题:
(1)金属铜的晶体中1个铜原子周围等距离且最近的铜原子个数为12,则其晶胞为如图中的 (填字母)。
(2)某磷青铜晶胞结构如图所示。
①其化学式为 。
②该晶体中距离Cu原子最近的Sn原子有 个,这些Sn原子所呈现的构型为 。
(3)某镍白铜合金的立方晶胞结构如图所示。
①晶胞中铜原子与镍原子的数目比为 。
②若合金的密度为d g·cm-3,晶胞边长为 nm。(列出计算式即可,NA表示阿伏加德罗常数的值)
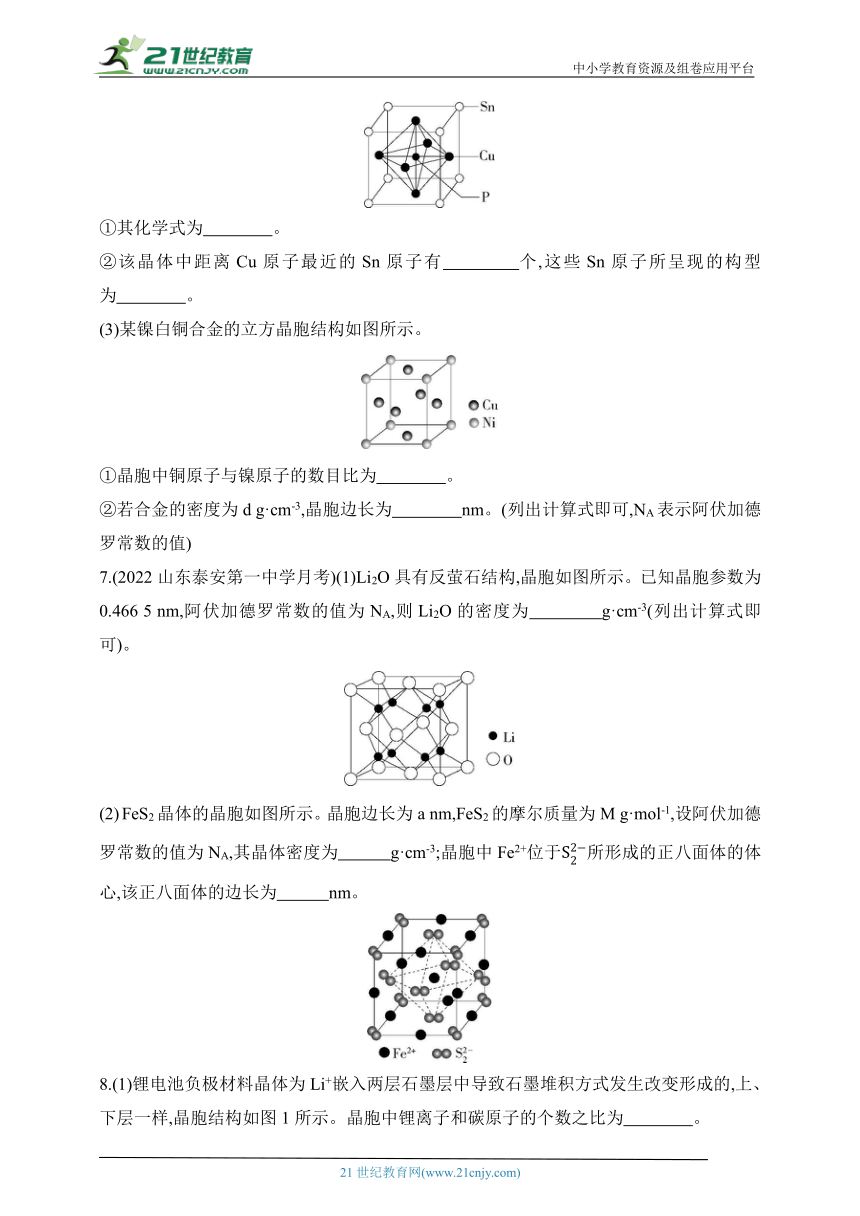
7.(2022山东泰安第一中学月考)(1)Li2O具有反萤石结构,晶胞如图所示。已知晶胞参数为0.466 5 nm,阿伏加德罗常数的值为NA,则Li2O的密度为 g·cm-3(列出计算式即可)。
FeS2晶体的晶胞如图所示。晶胞边长为a nm,FeS2的摩尔质量为M g·mol-1,设阿伏加德罗常数的值为NA,其晶体密度为 g·cm-3;晶胞中Fe2+位于所形成的正八面体的体心,该正八面体的边长为 nm。
8.(1)锂电池负极材料晶体为Li+嵌入两层石墨层中导致石墨堆积方式发生改变形成的,上、下层一样,晶胞结构如图1所示。晶胞中锂离子和碳原子的个数之比为 。
(2)Li2NH为反萤石结构,其晶胞结构如图2所示。若Li+的半径为
a pm,NH2-的半径为b pm,Li2NH的摩尔质量为M g·mol-1,设NA表示阿伏加德罗常数的值,则Li2NH的密度为 g·cm-3(用含a、b、M、NA的代数式表示,列出计算式即可)。
第2节 几种简单的晶体结构模型
第1课时 金属晶体与离子晶体
基础过关练
1.D 2.C 3.A 4.C 5.A 6.C 7.D
1.D 金属晶体中含有的粒子是金属阳离子和“自由电子”。
2.C Mg2+的半径比Al3+ 的大且所带的电荷数少,所以金属镁的金属键比金属铝弱,硬度小,A错误;从Li到Cs,其离子半径逐渐增大,所带电荷数相同,金属键逐渐减弱,熔点逐渐减小,B错误;Mg2+的半径比Na+的小且所带电荷数多,金属镁的熔点比金属钠的大,C正确;Mg2+的半径比Ca2+的小而所带电荷数相同,金属镁的金属键比金属钙的强,金属镁的硬度比金属钙的大,D错误。
3.A CaF2与BaF2均属于离子晶体,Ca2+和Ba2+所带电荷数相等,且离子半径:Ca2+BaF2,A正确;CaF2晶体中只含离子键,B错误;每个晶胞中所含Ca2+的个数为8×+6×=4,C错误;根据题图,Ca2+位于晶胞的顶点和面心,每个Ca2+周围有12个与它等距且最近的Ca2+,D错误。
4.C K3C60晶体中的共价键均是非极性键,A错误;K3C60晶体为离子晶体,而C60是分子晶体,离子晶体的熔点通常比分子晶体的熔点高,B错误;K3C60晶体中有K+和,该晶体熔化时能电离出自由移动的离子,所以能导电,C正确;C60分子中碳原子采取sp2杂化,D错误。
5.A 离子晶体是阳离子和阴离子通过静电作用结合而成,静电作用包括静电斥力和静电吸引力,A错误;Na2O、Na2S、Na2Se中离子所带电荷数相同,r(O2-)Na2S>Na2Se,B正确;MgCl2、CaCl2、BaCl2中离子所带电荷数相同,r(Mg2+)CaCl2>BaCl2,C正确;在氯化钠晶体中,Na+(或Cl-)周围距离最近且相等的Cl-(或Na+)数目为6,D正确。
6.C 在CsCl晶体中,每个Cs+周围与其距离最近的Cs+有6个,A错误;晶格能取正值,而不取负值,B错误;离子晶体的晶格能越大,形成的离子晶体越稳定,熔点越高,硬度越大,C正确、D错误。
7.D Q的晶格能大于P的晶格能,Q的熔点比P的熔点高,A正确;因F-的半径比Cl-的小,NaF的晶格能大于NaCl的晶格能,B正确;离子晶体中成键离子核间距越小,离子所带电荷数越多,晶格能越大,因Q、P中成键离子所带电荷数相同,所以Q中成键离子核间距较小,C正确;因Br-的半径比Cl-的大,NaBr的晶格能小于NaCl的晶格能,D错误。
能力提升练
1.B 2.B 3.B 4.B 5.D
1.B 面心立方晶胞中有8个原子位于顶点,6个原子位于面心,根据“切割法”可知,该晶胞中含有的原子个数为8×+6×=4。
2.B 用X射线衍射可测定铁晶体的结构,鉴别晶体与非晶体的最科学的方法是进行X射线衍射实验,故A正确;图2代表的铁单质中,以底面中心的铁原子为研究对象,上层、同层、下层各有4个紧邻的铁原子,所以一个铁原子周围最多有12个紧邻的铁原子,故B不正确;铁为金属晶体,铁单质中原子之间以金属键相互结合,故C正确;根据“切割法”,图1的晶胞中含有Fe的个数为8×+1=2,所以晶体的密度为×1021 g·cm-3=×1021 g·cm-3,同理,图2代表的晶体的密度为×1021 g·cm-3,所以图1与图2代表的铁单质的密度不同,故D正确。
3.B 由题意可知X为Cu,Y为Cl。Cu属于金属元素,铜单质为金属晶体,A正确;每个晶胞中含有的Cu个数为8×+6×=4,Cl个数为4,则该化合物的化学式为CuCl,B错误;与每个X离子距离相等且最近的X离子有12个,C正确;Y原子核外电子数为17,基态原子核外电子排布式为1s22s22p63s23p5,D正确。
4.B CaC2中含离子键,属于离子晶体,其中中含非极性共价键,A正确;由于晶胞沿一个方向拉长,故和Ca2+距离相等且最近的只有4个,且在同一平面上(与拉长方向垂直的面),构成的是正方形,B错误;和Ca2+距离相等且最近的Ca2+只有4个,且在同一平面上(与拉长方向垂直的面),C正确;晶胞中Ca2+的个数为12×+1=4,的个数为8×+6×=4,D正确。
5.D NaCl和CsCl都是离子晶体,Na+半径小于Cs+半径,NaCl中的离子键较强,熔、沸点较高,故A项错误;由NaCl的晶胞结构可知,距离Na+最近且等距的Na+数目为12,故B错误;ZnS的晶胞边长为a pm,
Zn2+与S2-之间的最近距离为体对角线长度的,所以Zn2+与S2-之间最近的距离为a pm,故C错误;ZnS中阳离子的配位数为4,NaCl中阳离子的配位数为6,CsCl中阳离子的配位数为8,则三种晶胞中阳离子的配位数大小关系为ZnS6.答案 (1)C (2)①SnCu3P ②4 平面正方形 (3)①3∶1 ②×107
解析 (1)金属铜的晶体中1个铜原子周围等距离且最近的铜原子个数为12,C符合题意。
(2)①根据磷青铜晶胞结构可知,晶胞中含有Cu的个数为 6×=3,Sn的个数为8×=1,P的个数为1,故化学式为SnCu3P。②该晶体中距离Cu原子最近的Sn原子有4个,这些Sn原子所呈现的构型为平面正方形。
(3)①晶胞中Ni处于顶点,Cu处于面心,则晶胞中Ni原子数目为8×=1,Cu原子数目为6×=3,故Cu与Ni原子数目之比为3∶1。
②设晶胞边长为a nm,晶胞质量为 g,根据m=ρV有 g=
d g·cm-3×(a×10-7 cm)3,解得a=×107。
7.答案 (1)
(2)×1021 a
解析 (1)1个氧化锂晶胞中含O的个数为8×+6×=4,含Li的个数为8,Li2O的密度为 g·cm-3。
(2)该晶胞中Fe2+位于棱上和体心,个数为12×+1=4,位于顶点和面心,个数为8×+6×=4,故晶体密度为×1021 g·cm-3。根据晶胞结构,所形成的正八面体的边长等于面对角线长度的一半,故该正八面体的边长为a nm。
8.答案 (1)1∶6
(2)×1030
解析 (1)由图1知2个碳原子处于体内,其他碳原子都在面上,一个晶胞中的碳原子数为2+8×=6,而Li+处于晶胞的顶点,一个晶胞中的Li+数为8×=1,因此晶胞中锂离子和碳原子的个数之比为1∶6。
根据Li2NH晶胞结构图可知,一个晶胞中Li+为8个,NH2-数为8×+6×=4,设晶胞的边长为c pm,由题图分析可知,晶胞的体对角线长为4(a+b) pm,故c=4(a+b),c=(a+b),ρ==×1030 g·
cm-3=×1030 g·cm-3。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024鲁教版高中化学选择性必修2同步
第2节 几种简单的晶体结构模型
第1课时 金属晶体与离子晶体
基础过关练
题组一 金属晶体的通性
1.(经典题)(2022山东聊城第三中学月考)金属晶体中含有的粒子是( )
A.金属原子和“自由电子”
B.只有金属离子
C.金属原子和金属离子
D.金属离子与“自由电子”
2.(经典题)(2022福建建瓯阶段考试)金属晶体熔点高低和硬度大小一般取决于金属键的强弱,而金属键的强弱与金属阳离子所带电荷数的多少及半径大小有关。由此判断下列说法正确的是( )
A.金属镁的硬度大于金属铝
B.碱金属单质的熔点从Li到Cs是逐渐增大的
C.金属镁的熔点大于金属钠
D.金属镁的硬度小于金属钙
题组二 离子晶体的结构和性质
3.(2022北京丰台第二中学期末)CaF2晶体的晶胞结构如图所示,其中Ca2+以表示,F-以○表示。下列关于该离子晶体的说法中正确的是 ( )
A.CaF2与BaF2的晶体类型相同,CaF2的熔点比BaF2的大
B.该晶体中含有离子键和共价键
C.每个晶胞中含6个Ca2+
D.每个Ca2+周围有4个与它等距且最近的Ca2+
4.(经典题)北京大学和中国科学院的化学工作者成功研制出碱金属K与C60形成的球碳盐K3C60。实验测知该物质属于离子晶体,具有良好的超导性。下列关于K3C60的组成和结构的分析中正确的是( )
A.K3C60晶体中既有离子键又有极性键
B.K3C60晶体的熔点比C60晶体的熔点低
C.该晶体熔融状态时能导电
D.C60分子中碳原子采取sp3杂化
5.(2022山东菏泽一中月考)下列关于离子晶体的描述不正确的是( )
A.离子晶体是阳离子和阴离子通过静电吸引力结合而成的晶体
B.稳定性:Na2O>Na2S>Na2Se
C.硬度:MgCl2>CaCl2>BaCl2
D.在氯化钠晶体中,Na+和Cl-的配位数均为6
题组三 晶格能
6.下列关于晶体的描述正确的是( )
A.在CsCl晶体中,每个Cs+周围与其距离最近且相等的Cs+有12个
B.晶格能通常取正值,但是有时也取负值
C.离子晶体的晶格能越大,形成的离子晶体越稳定,熔点越高
D.晶格能越大,物质的硬度反而越小
7.已知钠与两种卤族元素形成的化合物Q、P,它们的晶格能分别为923 kJ·mol-1、786 kJ·mol-1,下列有关说法中不正确的是( )
A.Q的熔点比P的高
B.若P是NaCl,则Q一定是NaF
C.Q中成键离子核间距较小
D.若P是NaCl,则Q可能是NaBr
能力提升练
题组一 金属晶体的结构及相关计算
1.(经典题)(2022安徽合肥一六八中学期中)右图为某金属的面心立方晶胞,则该金属的一个晶胞中实际拥有的原子数为( )
A.3 B.4 C.7 D.9
2.(2023北京东城期末)因生产金属铁的工艺和温度等因素不同,产生的铁单质的晶体结构也不同。两种铁晶胞(均为立方体,边长分别为a nm和1.22a nm)的结构示意图如图所示。下列说法不正确的是( )
图1 图2
A.用X射线衍射可测定铁晶体的结构
B.图2代表的铁单质中,一个铁原子周围最多有4个紧邻的铁原子
C.图1与图2代表的铁单质中,原子之间以金属键相互结合
D.图1与图2代表的铁单质的密度不同
题组二 离子晶体的结构及相关计算
3.(2022安徽合肥第一中学期中)X是第四周期元素,其原子最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层电子数相同,X与Y形成的一种化合物的立方晶胞如图所示。下列说法错误的是( )
A.单质X的晶体类型为金属晶体
B.该化合物的化学式为CuCl2
C.与每个X离子距离相等且最近的X离子有12个
D.元素Y的基态原子的核外电子排布式为1s22s22p63s23p5
4.(2022山东临沂检测)乙炔可用于照明、焊接及切断金属(氧炔焰),也是制造乙醛、醋酸、合成橡胶、合成纤维等的基本原料。乙炔可以用CaC2与水反应制取,CaC2晶体的晶胞结构如图所示,CaC2晶体中由于的存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的描述错误的是( )
A.CaC2晶体中存在离子键、共价键
B.和Ca2+距离相等且最近的构成的多面体是正六面体
C.和Ca2+距离相等且最近的Ca2+有4个
D.如图所示的结构中共含有4个Ca2+和4个
5.(2023辽宁锦州渤大附中期末)几种离子晶体的晶胞如图所示,则下列说法正确的是( )
A.熔、沸点:NaCl
C.若ZnS的晶胞边长为a pm,则Zn2+与S2-之间最近的距离为a pm
D.上述三种晶胞中,其阳离子的配位数大小关系为ZnS
(1)金属铜的晶体中1个铜原子周围等距离且最近的铜原子个数为12,则其晶胞为如图中的 (填字母)。
(2)某磷青铜晶胞结构如图所示。
①其化学式为 。
②该晶体中距离Cu原子最近的Sn原子有 个,这些Sn原子所呈现的构型为 。
(3)某镍白铜合金的立方晶胞结构如图所示。
①晶胞中铜原子与镍原子的数目比为 。
②若合金的密度为d g·cm-3,晶胞边长为 nm。(列出计算式即可,NA表示阿伏加德罗常数的值)
7.(2022山东泰安第一中学月考)(1)Li2O具有反萤石结构,晶胞如图所示。已知晶胞参数为0.466 5 nm,阿伏加德罗常数的值为NA,则Li2O的密度为 g·cm-3(列出计算式即可)。
FeS2晶体的晶胞如图所示。晶胞边长为a nm,FeS2的摩尔质量为M g·mol-1,设阿伏加德罗常数的值为NA,其晶体密度为 g·cm-3;晶胞中Fe2+位于所形成的正八面体的体心,该正八面体的边长为 nm。
8.(1)锂电池负极材料晶体为Li+嵌入两层石墨层中导致石墨堆积方式发生改变形成的,上、下层一样,晶胞结构如图1所示。晶胞中锂离子和碳原子的个数之比为 。
(2)Li2NH为反萤石结构,其晶胞结构如图2所示。若Li+的半径为
a pm,NH2-的半径为b pm,Li2NH的摩尔质量为M g·mol-1,设NA表示阿伏加德罗常数的值,则Li2NH的密度为 g·cm-3(用含a、b、M、NA的代数式表示,列出计算式即可)。
第2节 几种简单的晶体结构模型
第1课时 金属晶体与离子晶体
基础过关练
1.D 2.C 3.A 4.C 5.A 6.C 7.D
1.D 金属晶体中含有的粒子是金属阳离子和“自由电子”。
2.C Mg2+的半径比Al3+ 的大且所带的电荷数少,所以金属镁的金属键比金属铝弱,硬度小,A错误;从Li到Cs,其离子半径逐渐增大,所带电荷数相同,金属键逐渐减弱,熔点逐渐减小,B错误;Mg2+的半径比Na+的小且所带电荷数多,金属镁的熔点比金属钠的大,C正确;Mg2+的半径比Ca2+的小而所带电荷数相同,金属镁的金属键比金属钙的强,金属镁的硬度比金属钙的大,D错误。
3.A CaF2与BaF2均属于离子晶体,Ca2+和Ba2+所带电荷数相等,且离子半径:Ca2+
4.C K3C60晶体中的共价键均是非极性键,A错误;K3C60晶体为离子晶体,而C60是分子晶体,离子晶体的熔点通常比分子晶体的熔点高,B错误;K3C60晶体中有K+和,该晶体熔化时能电离出自由移动的离子,所以能导电,C正确;C60分子中碳原子采取sp2杂化,D错误。
5.A 离子晶体是阳离子和阴离子通过静电作用结合而成,静电作用包括静电斥力和静电吸引力,A错误;Na2O、Na2S、Na2Se中离子所带电荷数相同,r(O2-)
6.C 在CsCl晶体中,每个Cs+周围与其距离最近的Cs+有6个,A错误;晶格能取正值,而不取负值,B错误;离子晶体的晶格能越大,形成的离子晶体越稳定,熔点越高,硬度越大,C正确、D错误。
7.D Q的晶格能大于P的晶格能,Q的熔点比P的熔点高,A正确;因F-的半径比Cl-的小,NaF的晶格能大于NaCl的晶格能,B正确;离子晶体中成键离子核间距越小,离子所带电荷数越多,晶格能越大,因Q、P中成键离子所带电荷数相同,所以Q中成键离子核间距较小,C正确;因Br-的半径比Cl-的大,NaBr的晶格能小于NaCl的晶格能,D错误。
能力提升练
1.B 2.B 3.B 4.B 5.D
1.B 面心立方晶胞中有8个原子位于顶点,6个原子位于面心,根据“切割法”可知,该晶胞中含有的原子个数为8×+6×=4。
2.B 用X射线衍射可测定铁晶体的结构,鉴别晶体与非晶体的最科学的方法是进行X射线衍射实验,故A正确;图2代表的铁单质中,以底面中心的铁原子为研究对象,上层、同层、下层各有4个紧邻的铁原子,所以一个铁原子周围最多有12个紧邻的铁原子,故B不正确;铁为金属晶体,铁单质中原子之间以金属键相互结合,故C正确;根据“切割法”,图1的晶胞中含有Fe的个数为8×+1=2,所以晶体的密度为×1021 g·cm-3=×1021 g·cm-3,同理,图2代表的晶体的密度为×1021 g·cm-3,所以图1与图2代表的铁单质的密度不同,故D正确。
3.B 由题意可知X为Cu,Y为Cl。Cu属于金属元素,铜单质为金属晶体,A正确;每个晶胞中含有的Cu个数为8×+6×=4,Cl个数为4,则该化合物的化学式为CuCl,B错误;与每个X离子距离相等且最近的X离子有12个,C正确;Y原子核外电子数为17,基态原子核外电子排布式为1s22s22p63s23p5,D正确。
4.B CaC2中含离子键,属于离子晶体,其中中含非极性共价键,A正确;由于晶胞沿一个方向拉长,故和Ca2+距离相等且最近的只有4个,且在同一平面上(与拉长方向垂直的面),构成的是正方形,B错误;和Ca2+距离相等且最近的Ca2+只有4个,且在同一平面上(与拉长方向垂直的面),C正确;晶胞中Ca2+的个数为12×+1=4,的个数为8×+6×=4,D正确。
5.D NaCl和CsCl都是离子晶体,Na+半径小于Cs+半径,NaCl中的离子键较强,熔、沸点较高,故A项错误;由NaCl的晶胞结构可知,距离Na+最近且等距的Na+数目为12,故B错误;ZnS的晶胞边长为a pm,
Zn2+与S2-之间的最近距离为体对角线长度的,所以Zn2+与S2-之间最近的距离为a pm,故C错误;ZnS中阳离子的配位数为4,NaCl中阳离子的配位数为6,CsCl中阳离子的配位数为8,则三种晶胞中阳离子的配位数大小关系为ZnS
解析 (1)金属铜的晶体中1个铜原子周围等距离且最近的铜原子个数为12,C符合题意。
(2)①根据磷青铜晶胞结构可知,晶胞中含有Cu的个数为 6×=3,Sn的个数为8×=1,P的个数为1,故化学式为SnCu3P。②该晶体中距离Cu原子最近的Sn原子有4个,这些Sn原子所呈现的构型为平面正方形。
(3)①晶胞中Ni处于顶点,Cu处于面心,则晶胞中Ni原子数目为8×=1,Cu原子数目为6×=3,故Cu与Ni原子数目之比为3∶1。
②设晶胞边长为a nm,晶胞质量为 g,根据m=ρV有 g=
d g·cm-3×(a×10-7 cm)3,解得a=×107。
7.答案 (1)
(2)×1021 a
解析 (1)1个氧化锂晶胞中含O的个数为8×+6×=4,含Li的个数为8,Li2O的密度为 g·cm-3。
(2)该晶胞中Fe2+位于棱上和体心,个数为12×+1=4,位于顶点和面心,个数为8×+6×=4,故晶体密度为×1021 g·cm-3。根据晶胞结构,所形成的正八面体的边长等于面对角线长度的一半,故该正八面体的边长为a nm。
8.答案 (1)1∶6
(2)×1030
解析 (1)由图1知2个碳原子处于体内,其他碳原子都在面上,一个晶胞中的碳原子数为2+8×=6,而Li+处于晶胞的顶点,一个晶胞中的Li+数为8×=1,因此晶胞中锂离子和碳原子的个数之比为1∶6。
根据Li2NH晶胞结构图可知,一个晶胞中Li+为8个,NH2-数为8×+6×=4,设晶胞的边长为c pm,由题图分析可知,晶胞的体对角线长为4(a+b) pm,故c=4(a+b),c=(a+b),ρ==×1030 g·
cm-3=×1030 g·cm-3。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
