2024鲁教版高中化学选择性必修2同步练习题--第3章 不同聚集状态的物质与性质拔高练(含解析)
文档属性
| 名称 | 2024鲁教版高中化学选择性必修2同步练习题--第3章 不同聚集状态的物质与性质拔高练(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 20:25:16 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2024鲁教版高中化学选择性必修2同步
综合拔高练
五年高考练
考点1 晶体的类型及性质
1.(高考组合)回答下列问题:
(1)(2023浙江1月选考,17节选)Si与P形成的某化合物晶体的晶胞如图。该晶体类型是 ,该化合物的化学式为 。
(2)(2023全国甲,35节选)将酞菁—钴酞菁—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。如图所示的几种碳单质,它们互为 ,其中属于原子晶体的是 ,C60间的作用力是 。
(3)(2023山东,16节选)卤素可形成许多结构和性质特殊的化合物。-40 ℃时,F2与冰反应生成HOF和HF。常温常压下,HOF为无色气体,固态HOF的晶体类型为 。
2.(高考组合)回答下列问题:
(1)(2022全国乙,35节选)卤化物CsICl2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为 。解释X的熔点比Y高的原因 。
(2)(2021浙江6月选考,26节选)已知3种原子晶体的熔点数据如下表:
金刚石 碳化硅 晶体硅
熔点/℃ >3 550 2 600 1 415
金刚石熔点比晶体硅熔点高的原因是 。
考点2 晶体的结构及相关计算
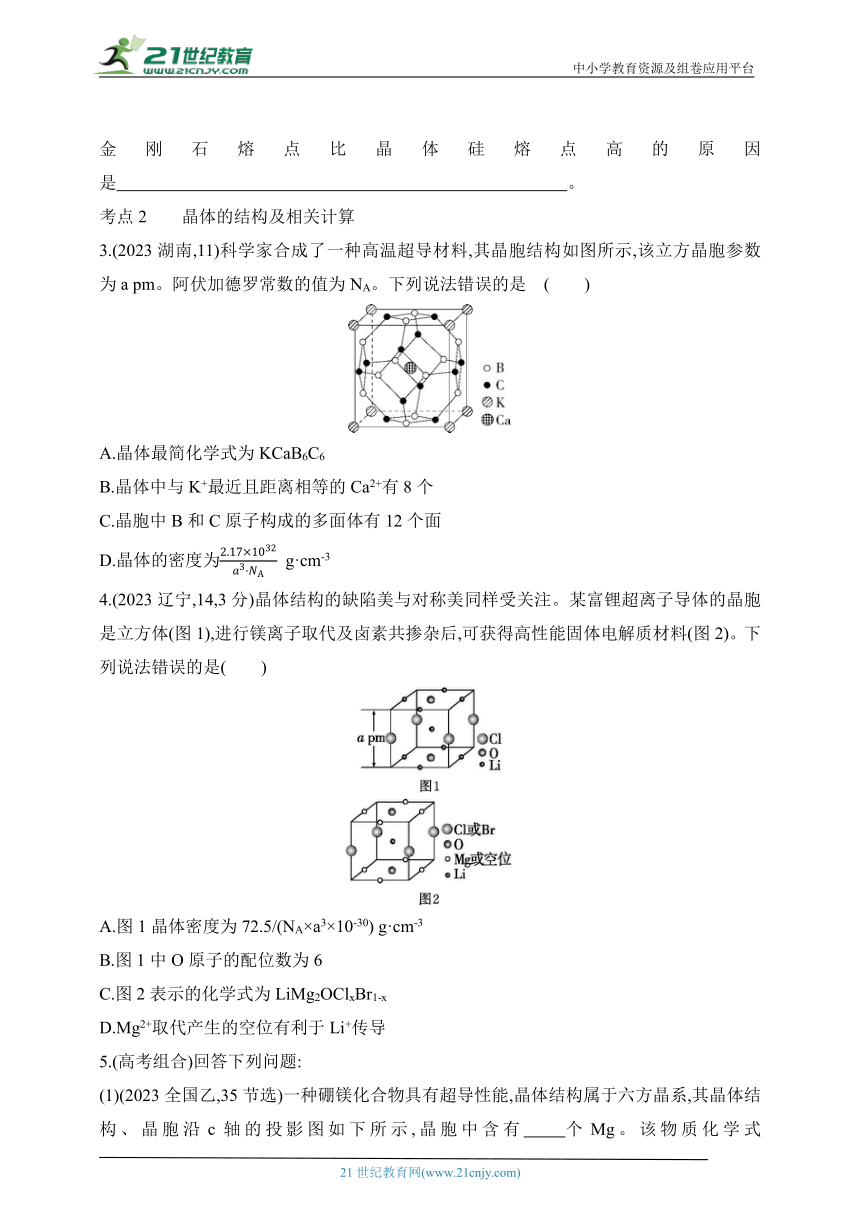
3.(2023湖南,11)科学家合成了一种高温超导材料,其晶胞结构如图所示,该立方晶胞参数为a pm。阿伏加德罗常数的值为NA。下列说法错误的是 ( )
A.晶体最简化学式为KCaB6C6
B.晶体中与K+最近且距离相等的Ca2+有8个
C.晶胞中B和C原子构成的多面体有12个面
D.晶体的密度为 g·cm-3
4.(2023辽宁,14,3分)晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是( )
A.图1晶体密度为72.5/(NA×a3×10-30) g·cm-3
B.图1中O原子的配位数为6
C.图2表示的化学式为LiMg2OClxBr1-x
D.Mg2+取代产生的空位有利于Li+传导
5.(高考组合)回答下列问题:
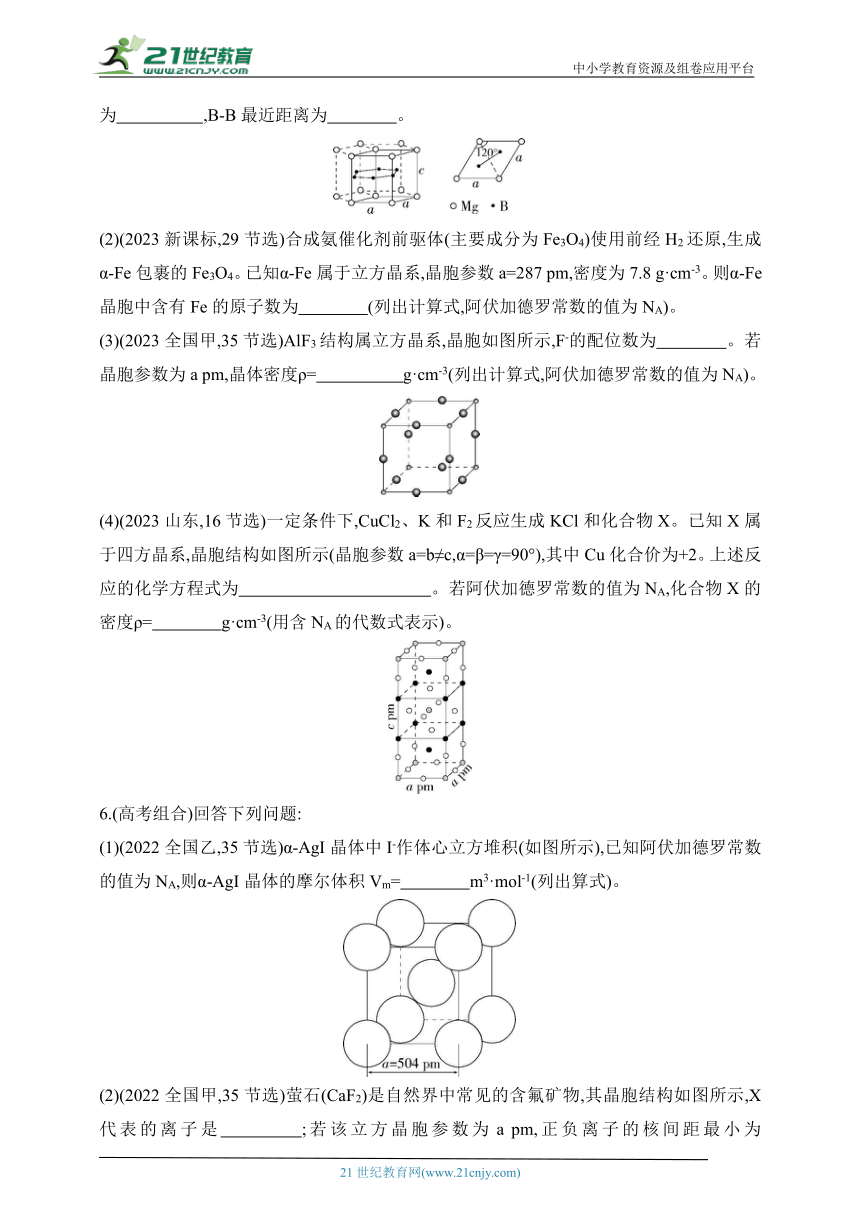
(1)(2023全国乙,35节选)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,晶胞中含有 个Mg。该物质化学式为 ,B-B最近距离为 。
(2)(2023新课标,29节选)合成氨催化剂前驱体(主要成分为Fe3O4)使用前经H2还原,生成α-Fe包裹的Fe3O4。已知α-Fe属于立方晶系,晶胞参数a=287 pm,密度为7.8 g·cm-3。则α-Fe晶胞中含有Fe的原子数为 (列出计算式,阿伏加德罗常数的值为NA)。
(3)(2023全国甲,35节选)AlF3结构属立方晶系,晶胞如图所示,F-的配位数为 。若晶胞参数为a pm,晶体密度ρ= g·cm-3(列出计算式,阿伏加德罗常数的值为NA)。
(4)(2023山东,16节选)一定条件下,CuCl2、K和F2反应生成KCl和化合物X。已知X属于四方晶系,晶胞结构如图所示(晶胞参数a=b≠c,α=β=γ=90°),其中Cu化合价为+2。上述反应的化学方程式为 。若阿伏加德罗常数的值为NA,化合物X的密度ρ= g·cm-3(用含NA的代数式表示)。
6.(高考组合)回答下列问题:
(1)(2022全国乙,35节选)α-AgI晶体中I-作体心立方堆积(如图所示),已知阿伏加德罗常数的值为NA,则α-AgI晶体的摩尔体积Vm= m3·mol-1(列出算式)。
(2)(2022全国甲,35节选)萤石(CaF2)是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是 ;若该立方晶胞参数为a pm,正负离子的核间距最小为 pm。
(3)(2022北京,15节选)FeS2晶体的晶胞形状为立方体,边长为a nm,结构如图所示。
①距离Fe2+最近的阴离子有 个。
②FeS2的摩尔质量为120 g·mol-1,阿伏加德罗常数的值为NA。该晶体的密度为 g·cm-3。(1 nm=10-9 m)
7.(2021全国甲,35改编)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+在晶胞中的配位数是 ,晶胞参数为a pm、a pm、c pm,该晶体密度为 g·cm-3(写出表达式)。在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1-xOy,则y= (用x表示)。
8.(2021广东,20节选)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。
①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是
。
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为 ;该晶胞中粒子个数比Hg∶Ge∶Sb= 。
③设X的最简式的式量为Mr,则X晶体的密度为 g/cm3(列出算式)。
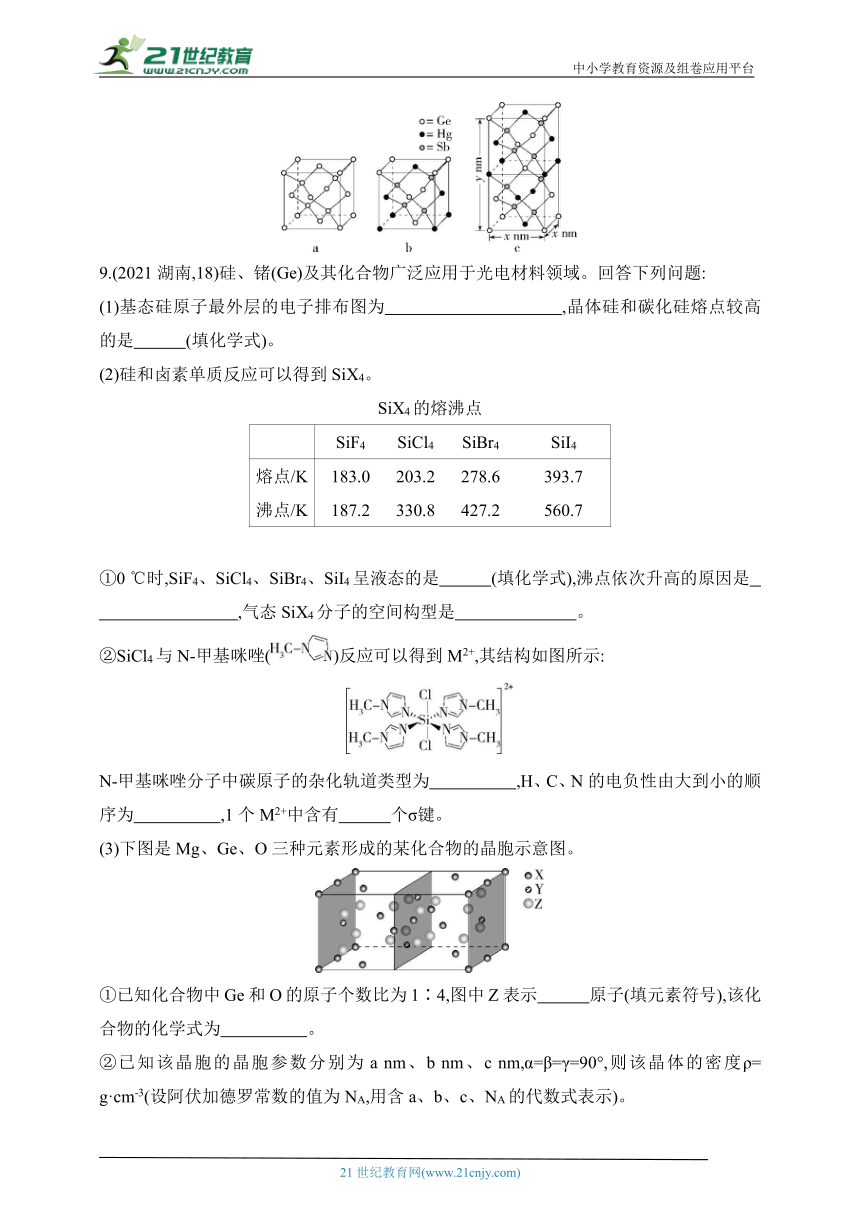
9.(2021湖南,18)硅、锗(Ge)及其化合物广泛应用于光电材料领域。回答下列问题:
(1)基态硅原子最外层的电子排布图为 ,晶体硅和碳化硅熔点较高的是 (填化学式)。
(2)硅和卤素单质反应可以得到SiX4。
SiX4的熔沸点
SiF4 SiCl4 SiBr4 SiI4
熔点/K 183.0 203.2 278.6 393.7
沸点/K 187.2 330.8 427.2 560.7
①0 ℃时,SiF4、SiCl4、SiBr4、SiI4呈液态的是 (填化学式),沸点依次升高的原因是
,气态SiX4分子的空间构型是 。
②SiCl4与N-甲基咪唑()反应可以得到M2+,其结构如图所示:
N-甲基咪唑分子中碳原子的杂化轨道类型为 ,H、C、N的电负性由大到小的顺序为 ,1个M2+中含有 个σ键。
(3)下图是Mg、Ge、O三种元素形成的某化合物的晶胞示意图。
①已知化合物中Ge和O的原子个数比为1∶4,图中Z表示 原子(填元素符号),该化合物的化学式为 。
②已知该晶胞的晶胞参数分别为a nm、b nm、c nm,α=β=γ=90°,则该晶体的密度ρ= g·cm-3(设阿伏加德罗常数的值为NA,用含a、b、c、NA的代数式表示)。
三年模拟练
应用实践
1.(2022天津南开中学月考)下列有关晶体结构的叙述正确的是( )
A.SiO2 晶体中最小环上的原子个数为 6
B.在晶体中只要有阳离子就一定有阴离子
C.12 g石墨烯中含有六元环的个数为0.5×6.02×1023
D.晶体熔点:金刚石>食盐>干冰>冰
2.(2022安徽马鞍山第二中学期中)C3N4和Si3N4晶体结构相似,是新型的非金属高温陶瓷材料。下列说法正确的是( )
A.C3N4和Si3N4晶体中N的化合价均为+3
B.熔、沸点C3N4小于Si3N4
C.C3N4晶体的硬度比Si3N4晶体的硬度大
D.C3N4和Si3N4晶体均为分子晶体
3.(2023山东潍坊昌乐一中阶段测试)氧化铈(CeO2)是一种重要的光催化材料,光催化过程中立方晶胞的组成变化如图所示。假设CeO2晶胞边长为a pm,下列说法不正确的是( )
A.基态O原子的价电子排布式为2s22p4
B.CeO2晶体结构中每个Ce4+周围距离最近且相等的Ce4+有12个
C.CeO2晶胞中Ce4+与距离最近的O2-的核间距为a pm
D.每个CeO2-x晶胞中Ce4+个数为1-2x
4.钛有“生物金属”和“未来金属”之称,钛及其化合物的应用越来越受到人们的关注。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①TiCl4的熔点为-24 ℃,沸点为136.4 ℃,室温下为无色液体,可溶于甲苯和氯代烃,则TiCl4属于 晶体。
②LiBH4中B的空间结构是 ,B原子的杂化轨道类型是 。
(2)硫酸氧钛晶体中阳离子为链状聚合形式,部分结构如图1所示。该阳离子中Ti与O的个数之比为 ,已知Ti在晶体中显+4价,则其化学式为 。
(3)TiO2晶胞结构如图2所示,晶胞参数为a nm和c nm,设NA为阿伏加德罗常数的值,则该晶体的密度为 (写出计算式即可)g·cm-3。
图1
图2
5.(2022山东泰安第一中学月考)(1)第三周期元素氟化物的熔点如表:
化合物 NaF MgF2 AlF3 SiF4 PF5 SF6
熔点/℃ 993 1 261 1 291 -90 -83 -50.5
解释表中氟化物熔点变化的原因:
。 (2)GaN、GaP都是很好的半导体材料,晶体结构与晶体硅类似,熔点如表所示:
物质 GaN GaP
熔点/℃ 1 700 1 480
解释GaN、GaP熔点变化的原因:
。
(3)氯酸钾熔化,粒子间克服了 ;二氧化硅熔化,粒子间克服了 ;碘升华,粒子间克服了 ;三种晶体的熔点由高到低的顺序是 。
(4)元素X的基态原子中的电子共占据7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子,在气体分析中,常用XCl的HCl溶液吸收并定量测定CO的含量,通过对XCl晶体的X射线衍射图像的分析,可以得出XCl的晶胞结构如图所示,则距离每个X+最近的Cl-的个数为 ,若X原子的半径为a pm,晶体的密度为ρ g/cm3,试计算阿伏加德罗常数的值为 (列计算式即可)。
迁移创新
6.(2023福建德化一中月考)某水性钠离子电池电极材料由Na+、Fe2+、Fe3+、CN-组成,随着立方晶胞嵌入和嵌出Na+,Fe2+与Fe3+的含量发生变化,依次变为格林绿、普鲁士蓝、普鲁士白三种物质,其过程如图。下列说法不正确的是( )
A.基态Fe原子的价电子排布式为3d64s2,失去4s电子转化为Fe2+
B.普鲁士蓝的导电能力小于普鲁士白
C.普鲁士蓝中Fe2+与Fe3+的个数比为1∶2
D.普鲁士白的化学式可表示为NaFe(CN)3
7.Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在我国已实现了产业化。
(1)NiO、FeO、MgO的晶体结构均与氯化钠相似,Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点:NiO (填“<”或“>”)FeO;某同学画出的MgO晶胞结构示意图如图所示,请指出图中的错误: 。
(2)NiO晶胞中Ni和O的配位数分别为 、 。
(3)储氢材料金属镍与镧(La)形成的晶体晶胞结构示意图如图所示(部分原子间连线未画出)。
①该晶体的化学式为 。
②已知该晶胞的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是 cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511 pm,c=397 pm;标准状况下氢气的密度为8.98×10-5 g·cm-3;储氢能力=。若忽略储氢前后晶胞的体积变化,则该储氢材料的储氢能力为
(列出表达式即可)。
综合拔高练
五年高考练
1.答案 (1)共价晶体 SiP2 (2)同素异形体 金刚石 范德华力 (3)分子晶体
解析 (1)由题中晶胞图可知,该晶体为空间网状结构,属于共价晶体;从晶胞图中原子的分布可知,Si在晶胞的顶点与面心,因此1个晶胞中Si的个数为8×+6×=4,P都在晶胞内部,共8个,所以Si、P原子个数比为1∶2,该化合物的化学式为SiP2。(2)题图中的四种物质为碳元素的不同单质,它们互为同素异形体。这四种物质中金刚石属于原子晶体(共价晶体),石墨属于混合型晶体,碳纳米管是一种管状的纳米级石墨晶体,C60属于分子晶体。C60属于分子晶体,故C60间的作用力是范德华力。(3)常温常压下 HOF为无色气体,说明其沸点低,可推知固态HOF为分子晶体。
2.答案 (1)CsCl CsCl是离子晶体,ICl是分子晶体
(2)原子半径CSi—Si
解析 (1)CsICl2中氯元素为-1价,碘元素为+1价,受热发生非氧化还原反应,生成无色晶体和红棕色液体,则生成的无色晶体为CsCl,红棕色液体为ICl;CsCl为离子晶体,熔化时,克服的是离子键,ICl为分子晶体,熔化时,克服的是分子间作用力,所以CsCl的熔点比ICl高。
(2)原子晶体中,原子半径越小,共价键键长越短,则共价键键能越大,原子晶体的熔点就越高。
3.C 1个晶胞中的K原子数为8×=1,Ca原子数为1,B原子数为12×=6,C原子数为12×=6,故晶体最简化学式为KCaB6C6,A项正确;K+位于顶点,Ca2+位于体心,与K+最近且距离相等的Ca2+位于共用1个顶点的8个立方晶胞的体心,B项正确;晶胞中B和C原子构成的多面体有14个面,6个位于晶胞的面上,8个位于晶胞内部,垂直于体对角线,C项错误;由A项分析可知1个晶胞中有1个“KCaB6C6”,晶胞的体积为(a×10-10)3 cm3,质量为(×1)g,晶体密度为 g·cm-3,即 g·cm-3,D项正确。
4.C A项,根据均摊法计算,图1晶胞中含有1个Cl,1个O,3个Li,密度ρ= g·cm-3= g·cm-3,正确;B项,图1中与氧原子距离最近(a/2 pm)的Li有6个,则O原子的配位数为6,正确;C项,根据均摊法计算,图2晶胞中含有1个Li,Mg或空位共2个,1个O,Cl或Br共1个,根据化合物中各元素正负化合价代数和为0,得Mg有1个,所以化学式为LiMgOClxBr1-x,错误;D项,Mg2+取代Li+后,产生的空位可供Li+移动传导电荷,增强导电性,正确。
5.答案 (1)1 MgB2 a
(2)
(3)2 (或×1030)
(4)CuCl2+4K+2F2 2KCl+K2CuF4
解析 (1)根据均摊法,结合晶胞沿c轴的投影可知,1个晶胞中,Mg原子数为4×+4×=1,B原子数为2,则化学式为MgB2;B-B最近距离为两个正三角形中心的距离,
在投影图中作辅助线,如图所示,d=×=a,B-B最近距离为a。
(2)设晶胞中含Fe原子数为N,则密度ρ=g·cm-3=7.8 g·cm-3,得出N=。(3)由题图可知,1个该晶胞中顶点处粒子的数目为8×=1,棱心处粒子的数目为12×=3,故顶点处粒子为Al3+,棱心处粒子为F-,F-最邻近的Al3+的数目为2,故F-的配位数为2。晶胞质量m= g,晶胞体积V=(a×10-10)3 cm3,晶体密度ρ== g·cm-3=×1030 g·cm-3。(4)CuCl2+K+F2 KCl+X,由元素质量守恒可知化合物X中一定含有Cu和F,根据晶胞结构,利用均摊法可知,1个晶胞中白球(A)的个数为16×+4×+2=8,灰球(B)的个数为8×+1=2,黑球(C)的个数为8×+2=4,其最简式为C2BA4,又因为Cu为+2价,K为+1价,F为-1价,故X为K2CuF4,则反应的化学方程式为CuCl2+4K+2F2 2KCl+K2CuF4。1个晶胞中含有4个K、2个Cu和8个F,则晶胞质量m= g= g,晶胞体积V=(a×10-10 cm)2×c×10-10 cm=a2c×10-30 cm3,故化合物X的密度ρ== g·cm-3。
6.答案 (1)
(2)Ca2+ a
(3)①6 ②
解析 (1)一个该晶胞中含有I-的个数为8×+1=2,由AgI的化学式可知,一个晶胞中含有Ag+个数也为2,即该晶胞中含有2个AgI,所以α-AgI晶体的摩尔体积Vm== mol-1= m3·mol-1。
(2)根据萤石晶胞结构可知,1个晶胞中含有X的个数为8×+6×=4,Y在晶胞内部,1个晶胞中含有8个Y,萤石的化学式为CaF2,则X为Ca2+;根据题给晶胞图可知,Ca2+与F-之间最短距离为晶胞体对角线长的,晶胞参数为a pm,体对角线长为a pm,故晶体中正负离子的核间距最小为a pm。
(3)①由晶胞结构可知,晶胞中距离Fe2+最近的阴离子有6个。②由晶胞结构可知,一个晶胞中含有Fe2+的个数为8×+6×=4,个数为12×+1=4,则该晶体密度为 g·cm-3。
7.答案 8 2-x
解析 配位数是指一个离子周围最邻近的异电性离子的数目,根据四方ZrO2晶胞图知,Zr4+的配位数为8;利用切割法,1个晶胞中含Zr原子数为8×+6×=4,O原子数为8,晶胞体积为a2c pm3=a2c×10-30 cm3,故其密度为 g·cm-3;根据化合物中各元素正、负化合价代数和为0知,(+2)x+(+4)(1-x)+(-2)y=0,解得y=2-x。
8.答案 ①不能无隙并置成晶体,不是最小重复单元
②4 1∶1∶2 ③
解析 ①组成晶体的最小重复单元称为晶胞,整块晶体可以看成是无数晶胞无隙并置而成的,而题图b不符合此条件,故不是晶胞。②题图c晶胞中底面面心的原子是Hg原子,与其距离最近的Sb有两个,其下方的晶胞中还有两个距离最近的Sb,故X的晶体中与Hg距离最近的Sb的数目为4;每个晶胞中Hg原子数目为4×+6×=4,Ge原子数目为8×+4×+1=4,Sb原子数目为8,故该晶胞中粒子个数比Hg∶Ge∶Sb=1∶1∶2。③每个晶胞含有的“HgGeSb2”数目为4,则
1 mol“HgGeSb2”的体积为×NA,1 mol “HgGeSb2”的质量为Mr g,故X晶体的密度为 g/cm3。(令NA为阿伏加德罗常数的值)
9.答案 (1)
↑↓
↑ ↑
SiC
(2)①SiCl4 都是分子晶体,相对分子质量越大,范德华力越大,沸点越高 正四面体 ②sp3、sp2 N>C>H 54
(3)①O Mg2GeO4 ②
解析 (1)基态硅原子的电子排布图为
↑↓
↑↓
↑↓ ↑↓ ↑↓
↑↓
↑ ↑
,
故其最外层电子排布图为
↑↓
↑ ↑
;
C原子半径比Si原子小,所以C—Si键键长比Si—Si键短,C—Si键键能较大,则碳化硅熔点较高。(2)①0 ℃即273.15 K,此时呈液态的只有SiCl4;SiX4中Si原子采取sp3杂化,没有孤电子对,空间构型为正四面体。②由结构可知,N-甲基咪唑中碳原子的杂化轨道类型为sp2、sp3;1个N-甲基咪唑中含有6个C—H键、4个C—N键、1个碳碳双键和1个碳氮双键,单键、配位键属于σ键,1个双键中有1个σ键和1个π键,所以1个M2+中含有12×4+6=54个σ键。(3)①由题图可知,一个晶胞中X原子数目为8×+4×+6×+3=8,Y原子数目为4,Z原子数目为16,Ge和O的原子个数比为1∶4,则Z表示O原子,Y表示Ge原子,X表示Mg原子,该化合物的化学式为Mg2GeO4。
②晶体的密度为 g·cm-3。
三年模拟练
1.C 2.C 3.D 6.C
1.C SiO2晶体中每个Si原子连接4个O原子,每个O原子连接2个Si原子,最小环上有12个原子,其中包括6个Si原子,6个O原子,故A错误;金属晶体的构成微粒是金属阳离子和“自由电子”,所以在晶体中有阳离子不一定有阴离子,故B错误;石墨烯中每个碳原子被3个环共用,对一个环的贡献是,则平均每个六元环含碳原子数为6×=2,12 g石墨烯中C的物质的量为1 mol,1 mol碳原子含有六元环的物质的量为0.5 mol,数目为0.5×6.02×1023,故C正确;晶体熔点:金刚石>食盐>冰>干冰,故D错误。
素养解读 能从微观层面理解晶胞的组成、结构和性质,能判断晶体的构成微粒以及微粒间的作用力,明确影响晶体性质的因素,能从宏观和微观相结合的视角分析与解决实际问题,体现了宏观辨识与微观探析的化学学科核心素养。
2.C 氮元素的电负性大于碳元素和硅元素,在C3N4和Si3N4中,氮元素显-3价,A错误;C3N4和Si3N4均为新型的非金属高温陶瓷材料,都是共价晶体,C原子半径小于Si原子半径,则键长C—NSi—N,故C3N4晶体的硬度以及熔、沸点均比Si3N4晶体的大,C正确,B、D错误。
3.D 基态O原子的价电子排布式为2s22p4,故A正确;由晶胞结构可知,以任一顶点的Ce4+为研究对象,距离其最近的Ce4+位于该顶点所在的三个面的面心,一个顶点被8个晶胞共用,则每个Ce4+周围距离最近且相等的Ce4+的个数为=12,故B正确;CeO2晶胞中Ce4+与距离最近的O2-的核间距为晶胞体对角线长度的,即a pm,故C正确;假设CeO2-x中的Ce4+和Ce3+的个数分别为m、n,m+n=1,由化合物中元素正、负化合价代数和为0可得4m+3n=4-2x,解得m=1-2x,由晶胞结构可知,位于顶点和面心的Ce4+或Ce3+的个数为8×+6×=4,所以每个晶胞中Ce4+的个数为4-8x,故D不正确。
4.答案 (1)①分子 ②正四面体形 sp3
(2)1∶1 TiO2+或[TiO (3)
解析 (1)①TiCl4的熔、沸点较低,可溶于甲苯和氯代烃,则TiCl4属于分子晶体。②B中B原子孤电子对数==0,价电子对数=4+0=4,则B的空间结构为正四面体形,B原子采取sp3杂化。
(2)由题图1可知,每个Ti原子被2个O原子共用,每个O原子被2个Ti原子共用,则该阳离子中Ti与O的数目之比为1∶1;该阳离子中Ti元素显+4价,O元素显-2价,则化学式为TiO2+或[TiO。
(3)1个TiO2晶胞中Ti原子数目为1+8×=2,O原子数目为2+4×=4,所以1个TiO2晶胞的质量为 g,晶体密度为 g÷(a×
10-7 cm×a×10-7 cm×c×10-7 cm)= g·cm-3。
5.答案 (1)NaF、MgF2 、AlF3为离子晶体,Na+、Mg2+、Al3+的半径依次减小,离子所带电荷数依次增多,晶格能依次增大;SiF4、PF5、SF6为分子晶体,相对分子质量依次增大,分子间作用力依次增大
(2)GaN、GaP均属于共价晶体,半径NGa—P,故GaN的熔点比GaP的高
(3)离子键 共价键 分子间作用力 SiO2>KClO3>I2
(4)4
解析 (1)根据题表中各物质熔点可判断NaF、MgF2、AlF3为离子晶体,其熔点逐渐升高是因为Na+、Mg2+、Al3+的半径依次减小,离子所带电荷数依次增多,故它们的晶格能依次增大;SiF4、PF5、SF6为分子晶体,由于其相对分子质量逐渐增大,分子间作用力增大,故其熔点逐渐升高。
(2)GaN、GaP都是很好的半导体材料,晶体结构与晶体硅类似,都属于共价晶体,原子半径NGa—P,故GaN熔点比GaP高。
(3)氯酸钾是离子晶体,熔化时需克服离子键;二氧化硅是共价晶体,熔化时需克服共价键;碘为分子晶体,碘升华时需克服分子间作用力。一般共价晶体的熔点最高;其次是离子晶体;分子间作用力与化学键相比要弱得多,所以熔点由高到低的顺序是SiO2>KClO3>I2。
(4)X是Cu元素,在CuCl的晶胞中,距离每个Cu+最近的Cl-的个数为4,若Cu原子的半径为a pm,面对角线长是4a pm,晶胞的边长是 pm,设阿伏加德罗常数的值为NA,每个晶胞中有4个Cu+和4个Cl-,ρ
=,NA=。
6.C 基态Fe原子的价电子排布式为3d64s2,失去2个电子后,转化为Fe2+,故A正确;Na+嵌入越多,导电性越好,根据晶胞结构可知,1个普鲁士蓝晶胞中含有4个Na+,1个普鲁士白晶胞中含有8个Na+,所以普鲁士蓝的导电能力小于普鲁士白,故B正确;1个普鲁士蓝晶胞中含有CN-的个数为24×+24×+6=24,Fe2+和Fe3+的总个数为8×+6×+12×+1=8,Na+的个数为4,则化学式为NaFe2(CN)6,其中CN-的化合价为-1价,Na+的化合价为+1价,Fe元素的平均化合价为+2.5价,则Fe2+与Fe3+的个数比为1∶1,故C不正确;1个普鲁士白晶胞中含有Na+的个数为8,Fe2+和Fe3+的总个数为8×+6×+12×+1=8,CN-的个数为24×+24×+6=24,则普鲁士白的化学式可表示为NaFe(CN)3,故D正确。
7.答案 (1)> ⑧应为灰球
(2)6 6
(3)①LaNi5 ②
③
解析 (1)离子晶体中其他因素相同时,离子半径越大,物质熔点越低。
(2)由信息可知NiO与氯化钠的晶胞结构相似,所以Ni和O的配位数均为6。
(3)①由题图可知,晶胞中心有一个镍原子,其他8个镍原子都在晶胞面上,镧原子都在晶胞顶点,所以每个晶胞中含有的镍原子数为1+×8=5,含有的镧原子数为1,晶体的化学式为LaNi5。②一个该晶胞的质量为 g,则该晶胞的体积为 cm3。③LaNi5合金储氢后的密度ρ== g·cm-3,由储氢能力=
= g·cm-3÷(8.98×10-5)g·cm-3
=。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024鲁教版高中化学选择性必修2同步
综合拔高练
五年高考练
考点1 晶体的类型及性质
1.(高考组合)回答下列问题:
(1)(2023浙江1月选考,17节选)Si与P形成的某化合物晶体的晶胞如图。该晶体类型是 ,该化合物的化学式为 。
(2)(2023全国甲,35节选)将酞菁—钴酞菁—三氯化铝复合嵌接在碳纳米管上,制得一种高效催化还原二氧化碳的催化剂。如图所示的几种碳单质,它们互为 ,其中属于原子晶体的是 ,C60间的作用力是 。
(3)(2023山东,16节选)卤素可形成许多结构和性质特殊的化合物。-40 ℃时,F2与冰反应生成HOF和HF。常温常压下,HOF为无色气体,固态HOF的晶体类型为 。
2.(高考组合)回答下列问题:
(1)(2022全国乙,35节选)卤化物CsICl2受热发生非氧化还原反应,生成无色晶体X和红棕色液体Y。X为 。解释X的熔点比Y高的原因 。
(2)(2021浙江6月选考,26节选)已知3种原子晶体的熔点数据如下表:
金刚石 碳化硅 晶体硅
熔点/℃ >3 550 2 600 1 415
金刚石熔点比晶体硅熔点高的原因是 。
考点2 晶体的结构及相关计算
3.(2023湖南,11)科学家合成了一种高温超导材料,其晶胞结构如图所示,该立方晶胞参数为a pm。阿伏加德罗常数的值为NA。下列说法错误的是 ( )
A.晶体最简化学式为KCaB6C6
B.晶体中与K+最近且距离相等的Ca2+有8个
C.晶胞中B和C原子构成的多面体有12个面
D.晶体的密度为 g·cm-3
4.(2023辽宁,14,3分)晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是( )
A.图1晶体密度为72.5/(NA×a3×10-30) g·cm-3
B.图1中O原子的配位数为6
C.图2表示的化学式为LiMg2OClxBr1-x
D.Mg2+取代产生的空位有利于Li+传导
5.(高考组合)回答下列问题:
(1)(2023全国乙,35节选)一种硼镁化合物具有超导性能,晶体结构属于六方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,晶胞中含有 个Mg。该物质化学式为 ,B-B最近距离为 。
(2)(2023新课标,29节选)合成氨催化剂前驱体(主要成分为Fe3O4)使用前经H2还原,生成α-Fe包裹的Fe3O4。已知α-Fe属于立方晶系,晶胞参数a=287 pm,密度为7.8 g·cm-3。则α-Fe晶胞中含有Fe的原子数为 (列出计算式,阿伏加德罗常数的值为NA)。
(3)(2023全国甲,35节选)AlF3结构属立方晶系,晶胞如图所示,F-的配位数为 。若晶胞参数为a pm,晶体密度ρ= g·cm-3(列出计算式,阿伏加德罗常数的值为NA)。
(4)(2023山东,16节选)一定条件下,CuCl2、K和F2反应生成KCl和化合物X。已知X属于四方晶系,晶胞结构如图所示(晶胞参数a=b≠c,α=β=γ=90°),其中Cu化合价为+2。上述反应的化学方程式为 。若阿伏加德罗常数的值为NA,化合物X的密度ρ= g·cm-3(用含NA的代数式表示)。
6.(高考组合)回答下列问题:
(1)(2022全国乙,35节选)α-AgI晶体中I-作体心立方堆积(如图所示),已知阿伏加德罗常数的值为NA,则α-AgI晶体的摩尔体积Vm= m3·mol-1(列出算式)。
(2)(2022全国甲,35节选)萤石(CaF2)是自然界中常见的含氟矿物,其晶胞结构如图所示,X代表的离子是 ;若该立方晶胞参数为a pm,正负离子的核间距最小为 pm。
(3)(2022北京,15节选)FeS2晶体的晶胞形状为立方体,边长为a nm,结构如图所示。
①距离Fe2+最近的阴离子有 个。
②FeS2的摩尔质量为120 g·mol-1,阿伏加德罗常数的值为NA。该晶体的密度为 g·cm-3。(1 nm=10-9 m)
7.(2021全国甲,35改编)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+在晶胞中的配位数是 ,晶胞参数为a pm、a pm、c pm,该晶体密度为 g·cm-3(写出表达式)。在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1-xOy,则y= (用x表示)。
8.(2021广东,20节选)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。
①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是
。
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为 ;该晶胞中粒子个数比Hg∶Ge∶Sb= 。
③设X的最简式的式量为Mr,则X晶体的密度为 g/cm3(列出算式)。
9.(2021湖南,18)硅、锗(Ge)及其化合物广泛应用于光电材料领域。回答下列问题:
(1)基态硅原子最外层的电子排布图为 ,晶体硅和碳化硅熔点较高的是 (填化学式)。
(2)硅和卤素单质反应可以得到SiX4。
SiX4的熔沸点
SiF4 SiCl4 SiBr4 SiI4
熔点/K 183.0 203.2 278.6 393.7
沸点/K 187.2 330.8 427.2 560.7
①0 ℃时,SiF4、SiCl4、SiBr4、SiI4呈液态的是 (填化学式),沸点依次升高的原因是
,气态SiX4分子的空间构型是 。
②SiCl4与N-甲基咪唑()反应可以得到M2+,其结构如图所示:
N-甲基咪唑分子中碳原子的杂化轨道类型为 ,H、C、N的电负性由大到小的顺序为 ,1个M2+中含有 个σ键。
(3)下图是Mg、Ge、O三种元素形成的某化合物的晶胞示意图。
①已知化合物中Ge和O的原子个数比为1∶4,图中Z表示 原子(填元素符号),该化合物的化学式为 。
②已知该晶胞的晶胞参数分别为a nm、b nm、c nm,α=β=γ=90°,则该晶体的密度ρ= g·cm-3(设阿伏加德罗常数的值为NA,用含a、b、c、NA的代数式表示)。
三年模拟练
应用实践
1.(2022天津南开中学月考)下列有关晶体结构的叙述正确的是( )
A.SiO2 晶体中最小环上的原子个数为 6
B.在晶体中只要有阳离子就一定有阴离子
C.12 g石墨烯中含有六元环的个数为0.5×6.02×1023
D.晶体熔点:金刚石>食盐>干冰>冰
2.(2022安徽马鞍山第二中学期中)C3N4和Si3N4晶体结构相似,是新型的非金属高温陶瓷材料。下列说法正确的是( )
A.C3N4和Si3N4晶体中N的化合价均为+3
B.熔、沸点C3N4小于Si3N4
C.C3N4晶体的硬度比Si3N4晶体的硬度大
D.C3N4和Si3N4晶体均为分子晶体
3.(2023山东潍坊昌乐一中阶段测试)氧化铈(CeO2)是一种重要的光催化材料,光催化过程中立方晶胞的组成变化如图所示。假设CeO2晶胞边长为a pm,下列说法不正确的是( )
A.基态O原子的价电子排布式为2s22p4
B.CeO2晶体结构中每个Ce4+周围距离最近且相等的Ce4+有12个
C.CeO2晶胞中Ce4+与距离最近的O2-的核间距为a pm
D.每个CeO2-x晶胞中Ce4+个数为1-2x
4.钛有“生物金属”和“未来金属”之称,钛及其化合物的应用越来越受到人们的关注。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①TiCl4的熔点为-24 ℃,沸点为136.4 ℃,室温下为无色液体,可溶于甲苯和氯代烃,则TiCl4属于 晶体。
②LiBH4中B的空间结构是 ,B原子的杂化轨道类型是 。
(2)硫酸氧钛晶体中阳离子为链状聚合形式,部分结构如图1所示。该阳离子中Ti与O的个数之比为 ,已知Ti在晶体中显+4价,则其化学式为 。
(3)TiO2晶胞结构如图2所示,晶胞参数为a nm和c nm,设NA为阿伏加德罗常数的值,则该晶体的密度为 (写出计算式即可)g·cm-3。
图1
图2
5.(2022山东泰安第一中学月考)(1)第三周期元素氟化物的熔点如表:
化合物 NaF MgF2 AlF3 SiF4 PF5 SF6
熔点/℃ 993 1 261 1 291 -90 -83 -50.5
解释表中氟化物熔点变化的原因:
。 (2)GaN、GaP都是很好的半导体材料,晶体结构与晶体硅类似,熔点如表所示:
物质 GaN GaP
熔点/℃ 1 700 1 480
解释GaN、GaP熔点变化的原因:
。
(3)氯酸钾熔化,粒子间克服了 ;二氧化硅熔化,粒子间克服了 ;碘升华,粒子间克服了 ;三种晶体的熔点由高到低的顺序是 。
(4)元素X的基态原子中的电子共占据7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子,在气体分析中,常用XCl的HCl溶液吸收并定量测定CO的含量,通过对XCl晶体的X射线衍射图像的分析,可以得出XCl的晶胞结构如图所示,则距离每个X+最近的Cl-的个数为 ,若X原子的半径为a pm,晶体的密度为ρ g/cm3,试计算阿伏加德罗常数的值为 (列计算式即可)。
迁移创新
6.(2023福建德化一中月考)某水性钠离子电池电极材料由Na+、Fe2+、Fe3+、CN-组成,随着立方晶胞嵌入和嵌出Na+,Fe2+与Fe3+的含量发生变化,依次变为格林绿、普鲁士蓝、普鲁士白三种物质,其过程如图。下列说法不正确的是( )
A.基态Fe原子的价电子排布式为3d64s2,失去4s电子转化为Fe2+
B.普鲁士蓝的导电能力小于普鲁士白
C.普鲁士蓝中Fe2+与Fe3+的个数比为1∶2
D.普鲁士白的化学式可表示为NaFe(CN)3
7.Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在我国已实现了产业化。
(1)NiO、FeO、MgO的晶体结构均与氯化钠相似,Ni2+和Fe2+的半径分别为69 pm和78 pm,则熔点:NiO (填“<”或“>”)FeO;某同学画出的MgO晶胞结构示意图如图所示,请指出图中的错误: 。
(2)NiO晶胞中Ni和O的配位数分别为 、 。
(3)储氢材料金属镍与镧(La)形成的晶体晶胞结构示意图如图所示(部分原子间连线未画出)。
①该晶体的化学式为 。
②已知该晶胞的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是 cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511 pm,c=397 pm;标准状况下氢气的密度为8.98×10-5 g·cm-3;储氢能力=。若忽略储氢前后晶胞的体积变化,则该储氢材料的储氢能力为
(列出表达式即可)。
综合拔高练
五年高考练
1.答案 (1)共价晶体 SiP2 (2)同素异形体 金刚石 范德华力 (3)分子晶体
解析 (1)由题中晶胞图可知,该晶体为空间网状结构,属于共价晶体;从晶胞图中原子的分布可知,Si在晶胞的顶点与面心,因此1个晶胞中Si的个数为8×+6×=4,P都在晶胞内部,共8个,所以Si、P原子个数比为1∶2,该化合物的化学式为SiP2。(2)题图中的四种物质为碳元素的不同单质,它们互为同素异形体。这四种物质中金刚石属于原子晶体(共价晶体),石墨属于混合型晶体,碳纳米管是一种管状的纳米级石墨晶体,C60属于分子晶体。C60属于分子晶体,故C60间的作用力是范德华力。(3)常温常压下 HOF为无色气体,说明其沸点低,可推知固态HOF为分子晶体。
2.答案 (1)CsCl CsCl是离子晶体,ICl是分子晶体
(2)原子半径C
解析 (1)CsICl2中氯元素为-1价,碘元素为+1价,受热发生非氧化还原反应,生成无色晶体和红棕色液体,则生成的无色晶体为CsCl,红棕色液体为ICl;CsCl为离子晶体,熔化时,克服的是离子键,ICl为分子晶体,熔化时,克服的是分子间作用力,所以CsCl的熔点比ICl高。
(2)原子晶体中,原子半径越小,共价键键长越短,则共价键键能越大,原子晶体的熔点就越高。
3.C 1个晶胞中的K原子数为8×=1,Ca原子数为1,B原子数为12×=6,C原子数为12×=6,故晶体最简化学式为KCaB6C6,A项正确;K+位于顶点,Ca2+位于体心,与K+最近且距离相等的Ca2+位于共用1个顶点的8个立方晶胞的体心,B项正确;晶胞中B和C原子构成的多面体有14个面,6个位于晶胞的面上,8个位于晶胞内部,垂直于体对角线,C项错误;由A项分析可知1个晶胞中有1个“KCaB6C6”,晶胞的体积为(a×10-10)3 cm3,质量为(×1)g,晶体密度为 g·cm-3,即 g·cm-3,D项正确。
4.C A项,根据均摊法计算,图1晶胞中含有1个Cl,1个O,3个Li,密度ρ= g·cm-3= g·cm-3,正确;B项,图1中与氧原子距离最近(a/2 pm)的Li有6个,则O原子的配位数为6,正确;C项,根据均摊法计算,图2晶胞中含有1个Li,Mg或空位共2个,1个O,Cl或Br共1个,根据化合物中各元素正负化合价代数和为0,得Mg有1个,所以化学式为LiMgOClxBr1-x,错误;D项,Mg2+取代Li+后,产生的空位可供Li+移动传导电荷,增强导电性,正确。
5.答案 (1)1 MgB2 a
(2)
(3)2 (或×1030)
(4)CuCl2+4K+2F2 2KCl+K2CuF4
解析 (1)根据均摊法,结合晶胞沿c轴的投影可知,1个晶胞中,Mg原子数为4×+4×=1,B原子数为2,则化学式为MgB2;B-B最近距离为两个正三角形中心的距离,
在投影图中作辅助线,如图所示,d=×=a,B-B最近距离为a。
(2)设晶胞中含Fe原子数为N,则密度ρ=g·cm-3=7.8 g·cm-3,得出N=。(3)由题图可知,1个该晶胞中顶点处粒子的数目为8×=1,棱心处粒子的数目为12×=3,故顶点处粒子为Al3+,棱心处粒子为F-,F-最邻近的Al3+的数目为2,故F-的配位数为2。晶胞质量m= g,晶胞体积V=(a×10-10)3 cm3,晶体密度ρ== g·cm-3=×1030 g·cm-3。(4)CuCl2+K+F2 KCl+X,由元素质量守恒可知化合物X中一定含有Cu和F,根据晶胞结构,利用均摊法可知,1个晶胞中白球(A)的个数为16×+4×+2=8,灰球(B)的个数为8×+1=2,黑球(C)的个数为8×+2=4,其最简式为C2BA4,又因为Cu为+2价,K为+1价,F为-1价,故X为K2CuF4,则反应的化学方程式为CuCl2+4K+2F2 2KCl+K2CuF4。1个晶胞中含有4个K、2个Cu和8个F,则晶胞质量m= g= g,晶胞体积V=(a×10-10 cm)2×c×10-10 cm=a2c×10-30 cm3,故化合物X的密度ρ== g·cm-3。
6.答案 (1)
(2)Ca2+ a
(3)①6 ②
解析 (1)一个该晶胞中含有I-的个数为8×+1=2,由AgI的化学式可知,一个晶胞中含有Ag+个数也为2,即该晶胞中含有2个AgI,所以α-AgI晶体的摩尔体积Vm== mol-1= m3·mol-1。
(2)根据萤石晶胞结构可知,1个晶胞中含有X的个数为8×+6×=4,Y在晶胞内部,1个晶胞中含有8个Y,萤石的化学式为CaF2,则X为Ca2+;根据题给晶胞图可知,Ca2+与F-之间最短距离为晶胞体对角线长的,晶胞参数为a pm,体对角线长为a pm,故晶体中正负离子的核间距最小为a pm。
(3)①由晶胞结构可知,晶胞中距离Fe2+最近的阴离子有6个。②由晶胞结构可知,一个晶胞中含有Fe2+的个数为8×+6×=4,个数为12×+1=4,则该晶体密度为 g·cm-3。
7.答案 8 2-x
解析 配位数是指一个离子周围最邻近的异电性离子的数目,根据四方ZrO2晶胞图知,Zr4+的配位数为8;利用切割法,1个晶胞中含Zr原子数为8×+6×=4,O原子数为8,晶胞体积为a2c pm3=a2c×10-30 cm3,故其密度为 g·cm-3;根据化合物中各元素正、负化合价代数和为0知,(+2)x+(+4)(1-x)+(-2)y=0,解得y=2-x。
8.答案 ①不能无隙并置成晶体,不是最小重复单元
②4 1∶1∶2 ③
解析 ①组成晶体的最小重复单元称为晶胞,整块晶体可以看成是无数晶胞无隙并置而成的,而题图b不符合此条件,故不是晶胞。②题图c晶胞中底面面心的原子是Hg原子,与其距离最近的Sb有两个,其下方的晶胞中还有两个距离最近的Sb,故X的晶体中与Hg距离最近的Sb的数目为4;每个晶胞中Hg原子数目为4×+6×=4,Ge原子数目为8×+4×+1=4,Sb原子数目为8,故该晶胞中粒子个数比Hg∶Ge∶Sb=1∶1∶2。③每个晶胞含有的“HgGeSb2”数目为4,则
1 mol“HgGeSb2”的体积为×NA,1 mol “HgGeSb2”的质量为Mr g,故X晶体的密度为 g/cm3。(令NA为阿伏加德罗常数的值)
9.答案 (1)
↑↓
↑ ↑
SiC
(2)①SiCl4 都是分子晶体,相对分子质量越大,范德华力越大,沸点越高 正四面体 ②sp3、sp2 N>C>H 54
(3)①O Mg2GeO4 ②
解析 (1)基态硅原子的电子排布图为
↑↓
↑↓
↑↓ ↑↓ ↑↓
↑↓
↑ ↑
,
故其最外层电子排布图为
↑↓
↑ ↑
;
C原子半径比Si原子小,所以C—Si键键长比Si—Si键短,C—Si键键能较大,则碳化硅熔点较高。(2)①0 ℃即273.15 K,此时呈液态的只有SiCl4;SiX4中Si原子采取sp3杂化,没有孤电子对,空间构型为正四面体。②由结构可知,N-甲基咪唑中碳原子的杂化轨道类型为sp2、sp3;1个N-甲基咪唑中含有6个C—H键、4个C—N键、1个碳碳双键和1个碳氮双键,单键、配位键属于σ键,1个双键中有1个σ键和1个π键,所以1个M2+中含有12×4+6=54个σ键。(3)①由题图可知,一个晶胞中X原子数目为8×+4×+6×+3=8,Y原子数目为4,Z原子数目为16,Ge和O的原子个数比为1∶4,则Z表示O原子,Y表示Ge原子,X表示Mg原子,该化合物的化学式为Mg2GeO4。
②晶体的密度为 g·cm-3。
三年模拟练
1.C 2.C 3.D 6.C
1.C SiO2晶体中每个Si原子连接4个O原子,每个O原子连接2个Si原子,最小环上有12个原子,其中包括6个Si原子,6个O原子,故A错误;金属晶体的构成微粒是金属阳离子和“自由电子”,所以在晶体中有阳离子不一定有阴离子,故B错误;石墨烯中每个碳原子被3个环共用,对一个环的贡献是,则平均每个六元环含碳原子数为6×=2,12 g石墨烯中C的物质的量为1 mol,1 mol碳原子含有六元环的物质的量为0.5 mol,数目为0.5×6.02×1023,故C正确;晶体熔点:金刚石>食盐>冰>干冰,故D错误。
素养解读 能从微观层面理解晶胞的组成、结构和性质,能判断晶体的构成微粒以及微粒间的作用力,明确影响晶体性质的因素,能从宏观和微观相结合的视角分析与解决实际问题,体现了宏观辨识与微观探析的化学学科核心素养。
2.C 氮元素的电负性大于碳元素和硅元素,在C3N4和Si3N4中,氮元素显-3价,A错误;C3N4和Si3N4均为新型的非金属高温陶瓷材料,都是共价晶体,C原子半径小于Si原子半径,则键长C—N
3.D 基态O原子的价电子排布式为2s22p4,故A正确;由晶胞结构可知,以任一顶点的Ce4+为研究对象,距离其最近的Ce4+位于该顶点所在的三个面的面心,一个顶点被8个晶胞共用,则每个Ce4+周围距离最近且相等的Ce4+的个数为=12,故B正确;CeO2晶胞中Ce4+与距离最近的O2-的核间距为晶胞体对角线长度的,即a pm,故C正确;假设CeO2-x中的Ce4+和Ce3+的个数分别为m、n,m+n=1,由化合物中元素正、负化合价代数和为0可得4m+3n=4-2x,解得m=1-2x,由晶胞结构可知,位于顶点和面心的Ce4+或Ce3+的个数为8×+6×=4,所以每个晶胞中Ce4+的个数为4-8x,故D不正确。
4.答案 (1)①分子 ②正四面体形 sp3
(2)1∶1 TiO2+或[TiO (3)
解析 (1)①TiCl4的熔、沸点较低,可溶于甲苯和氯代烃,则TiCl4属于分子晶体。②B中B原子孤电子对数==0,价电子对数=4+0=4,则B的空间结构为正四面体形,B原子采取sp3杂化。
(2)由题图1可知,每个Ti原子被2个O原子共用,每个O原子被2个Ti原子共用,则该阳离子中Ti与O的数目之比为1∶1;该阳离子中Ti元素显+4价,O元素显-2价,则化学式为TiO2+或[TiO。
(3)1个TiO2晶胞中Ti原子数目为1+8×=2,O原子数目为2+4×=4,所以1个TiO2晶胞的质量为 g,晶体密度为 g÷(a×
10-7 cm×a×10-7 cm×c×10-7 cm)= g·cm-3。
5.答案 (1)NaF、MgF2 、AlF3为离子晶体,Na+、Mg2+、Al3+的半径依次减小,离子所带电荷数依次增多,晶格能依次增大;SiF4、PF5、SF6为分子晶体,相对分子质量依次增大,分子间作用力依次增大
(2)GaN、GaP均属于共价晶体,半径N
(3)离子键 共价键 分子间作用力 SiO2>KClO3>I2
(4)4
解析 (1)根据题表中各物质熔点可判断NaF、MgF2、AlF3为离子晶体,其熔点逐渐升高是因为Na+、Mg2+、Al3+的半径依次减小,离子所带电荷数依次增多,故它们的晶格能依次增大;SiF4、PF5、SF6为分子晶体,由于其相对分子质量逐渐增大,分子间作用力增大,故其熔点逐渐升高。
(2)GaN、GaP都是很好的半导体材料,晶体结构与晶体硅类似,都属于共价晶体,原子半径N
(3)氯酸钾是离子晶体,熔化时需克服离子键;二氧化硅是共价晶体,熔化时需克服共价键;碘为分子晶体,碘升华时需克服分子间作用力。一般共价晶体的熔点最高;其次是离子晶体;分子间作用力与化学键相比要弱得多,所以熔点由高到低的顺序是SiO2>KClO3>I2。
(4)X是Cu元素,在CuCl的晶胞中,距离每个Cu+最近的Cl-的个数为4,若Cu原子的半径为a pm,面对角线长是4a pm,晶胞的边长是 pm,设阿伏加德罗常数的值为NA,每个晶胞中有4个Cu+和4个Cl-,ρ
=,NA=。
6.C 基态Fe原子的价电子排布式为3d64s2,失去2个电子后,转化为Fe2+,故A正确;Na+嵌入越多,导电性越好,根据晶胞结构可知,1个普鲁士蓝晶胞中含有4个Na+,1个普鲁士白晶胞中含有8个Na+,所以普鲁士蓝的导电能力小于普鲁士白,故B正确;1个普鲁士蓝晶胞中含有CN-的个数为24×+24×+6=24,Fe2+和Fe3+的总个数为8×+6×+12×+1=8,Na+的个数为4,则化学式为NaFe2(CN)6,其中CN-的化合价为-1价,Na+的化合价为+1价,Fe元素的平均化合价为+2.5价,则Fe2+与Fe3+的个数比为1∶1,故C不正确;1个普鲁士白晶胞中含有Na+的个数为8,Fe2+和Fe3+的总个数为8×+6×+12×+1=8,CN-的个数为24×+24×+6=24,则普鲁士白的化学式可表示为NaFe(CN)3,故D正确。
7.答案 (1)> ⑧应为灰球
(2)6 6
(3)①LaNi5 ②
③
解析 (1)离子晶体中其他因素相同时,离子半径越大,物质熔点越低。
(2)由信息可知NiO与氯化钠的晶胞结构相似,所以Ni和O的配位数均为6。
(3)①由题图可知,晶胞中心有一个镍原子,其他8个镍原子都在晶胞面上,镧原子都在晶胞顶点,所以每个晶胞中含有的镍原子数为1+×8=5,含有的镧原子数为1,晶体的化学式为LaNi5。②一个该晶胞的质量为 g,则该晶胞的体积为 cm3。③LaNi5合金储氢后的密度ρ== g·cm-3,由储氢能力=
= g·cm-3÷(8.98×10-5)g·cm-3
=。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
