2024鲁教版高中化学选择性必修2同步练习题--第3章 不同聚集状态的物质与性质复习提升(含解析)
文档属性
| 名称 | 2024鲁教版高中化学选择性必修2同步练习题--第3章 不同聚集状态的物质与性质复习提升(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 20:26:20 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2024鲁教版高中化学选择性必修2同步
本章复习提升
易混易错练
易错点1 晶体类型判断错误导致比较晶体的性质时出错
1.(2022湖南长沙检测)下列各组物质的熔点均与所含化学键强弱无关的是( )
A.金属钠与干冰 B.纯碱与冰醋酸
C.金刚砂与石墨 D.硫黄与碘
2.下列物质性质递变规律正确的是( )
A.Na、K、Cs的熔点依次升高
B.HCl、H2S、PH3的稳定性依次减弱
C.H2CO3、H2SiO3、H2SO4的酸性依次增强
D.单晶硅、CsCl、干冰的熔点依次升高
3.下列有关晶体的叙述中,正确的是( )
A.熔点I2>Cl2;沸点PH3>NH3
B.熔点SiO2>CH4;沸点C(CH3)4>(CH3)2CHCH2CH3>CH3CH2CH2CH2CH3
C.共价晶体的构成粒子是分子,故共价晶体都不导电
D.金属晶体的导电、导热性均与“自由电子”密切相关
4.(2022安徽芜湖第一中学月考)有A、B、C、D、E五种短周期元素,其中A、B、C、D同周期,C、E同主族;A+与E2-具有相同的电子层结构;离子半径C2->D-;B的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是( )
A.两种元素A、E形成的两种化合物的晶体类型不同
B.元素D、C、E的简单氢化物都是分子晶体,其沸点依次降低
C.元素B、C、D的单质晶体属于同种类型的晶体
D.元素B和E形成的化合物具有较大的硬度和较高的熔点
易错点2 晶体结构判断错误导致计算出错
5.(2023河北唐山第二中学期末)有关晶体的结构如图所示,下列说法中不正确的是( )
A.在NaCl晶体中,距Na+最近的Cl-有6个
B.上述气态团簇分子的分子式为EF或FE
C.在CaF2晶体中,每个晶胞平均占有4个C
D.在金刚石晶体中,碳原子与碳碳键个数之比为1∶2
6.(2022河北石家庄第一中学月考)Mg2Si具有反萤石结构,其晶胞结构如图所示,晶胞棱长为0.635 nm。下列叙述错误的是( )
A.Si的配位数为8
B.紧邻的两个Mg原子的距离为 nm
C.紧邻的两个Si原子间的距离为 nm
D.Mg2Si晶体的密度为 g·cm-3
思想方法练
利用建模思想解答晶胞中的相关计算问题
方法概述
有关晶胞计算类试题,可以将晶胞中原子“质点”化,构成立体模型,根据模型确定晶胞结构,推算物质化学式,再进一步计算密度、
微粒间的距离等。此类试题中常见的计算:
(1)化学式:利用“切割法”计算一个晶胞中所含组成微粒的个数。
(2)晶体的密度:ρ=。式中ρ为晶体的密度,V为一个晶胞的体积,M为构成晶胞微粒的摩尔质量,N为晶胞所含微粒个数,NA为阿伏加德罗常数。
(3)微粒间的距离:分析晶胞构成及晶胞几何构型中各线性关系求算,若立方体晶胞的边长是a,则面对角线长是a,体对角线长是a。
1.(2022山东枣庄第三中学期中)已知NixMg1-xO晶体属于立方晶系,晶胞边长为a。将Li+掺杂到该晶体的晶胞中,可得到一种高性能的太阳能电池材料,其结构单元如图所示。假定掺杂后的晶胞参数不发生变化,下列说法正确的是( )
A.该结构单元中O原子数为3
B.Ni和Mg间的最短距离是a
C.Ni的配位数为4
D.该物质的化学式为Li0.5Mg1.12Ni2.38O3
2.(2023山东昌乐一中段测)常见的铜的硫化物有CuS和Cu2S两种。已知晶胞中S2-的位置如图1所示,Cu2+、Cu+位于硫离子所构成的四面体中心,它们的晶胞具有相同的侧视图,如图2所示。Cu2S的晶胞参数为a pm,阿伏加德罗常数的值为NA。下列说法正确的是( )
图1 图2
A.S2-是面心立方最密堆积
B.Cu2S晶胞中,Cu+填充了晶胞中一半四面体空隙
C.CuS晶胞中S2-的配位数为8
D.Cu2S晶体的密度为 g·cm-3
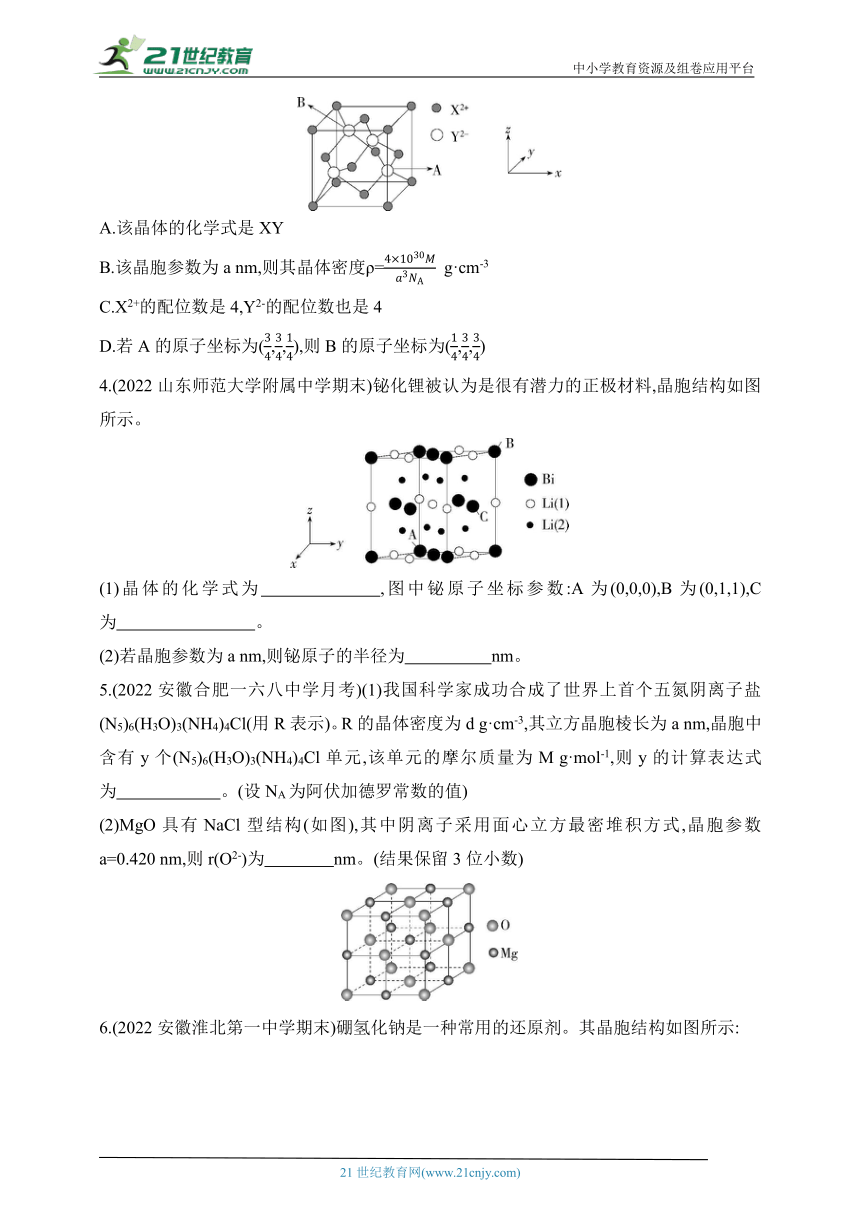
3.(2023浙江舟山模拟)某荧光材料由X2+与Y2-组成,其摩尔质量为
M g· mol-1,NA为阿伏加德罗常数的值,其晶胞结构如图所示。下列叙述不正确的是( )
A.该晶体的化学式是XY
B.该晶胞参数为a nm,则其晶体密度ρ= g·cm-3
C.X2+的配位数是4,Y2-的配位数也是4
D.若A的原子坐标为(,,),则B的原子坐标为(,,)
4.(2022山东师范大学附属中学期末)铋化锂被认为是很有潜力的正极材料,晶胞结构如图所示。
(1)晶体的化学式为 ,图中铋原子坐标参数:A为(0,0,0),B为(0,1,1),C为 。
(2)若晶胞参数为a nm,则铋原子的半径为 nm。
5.(2022安徽合肥一六八中学月考)(1)我国科学家成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R表示)。R的晶体密度为d g·cm-3,其立方晶胞棱长为a nm,晶胞中含有y个(N5)6(H3O)3(NH4)4Cl单元,该单元的摩尔质量为M g·mol-1,则y的计算表达式为 。(设NA为阿伏加德罗常数的值)
(2)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,晶胞参数a=0.420 nm,则r(O2-)为 nm。(结果保留3位小数)
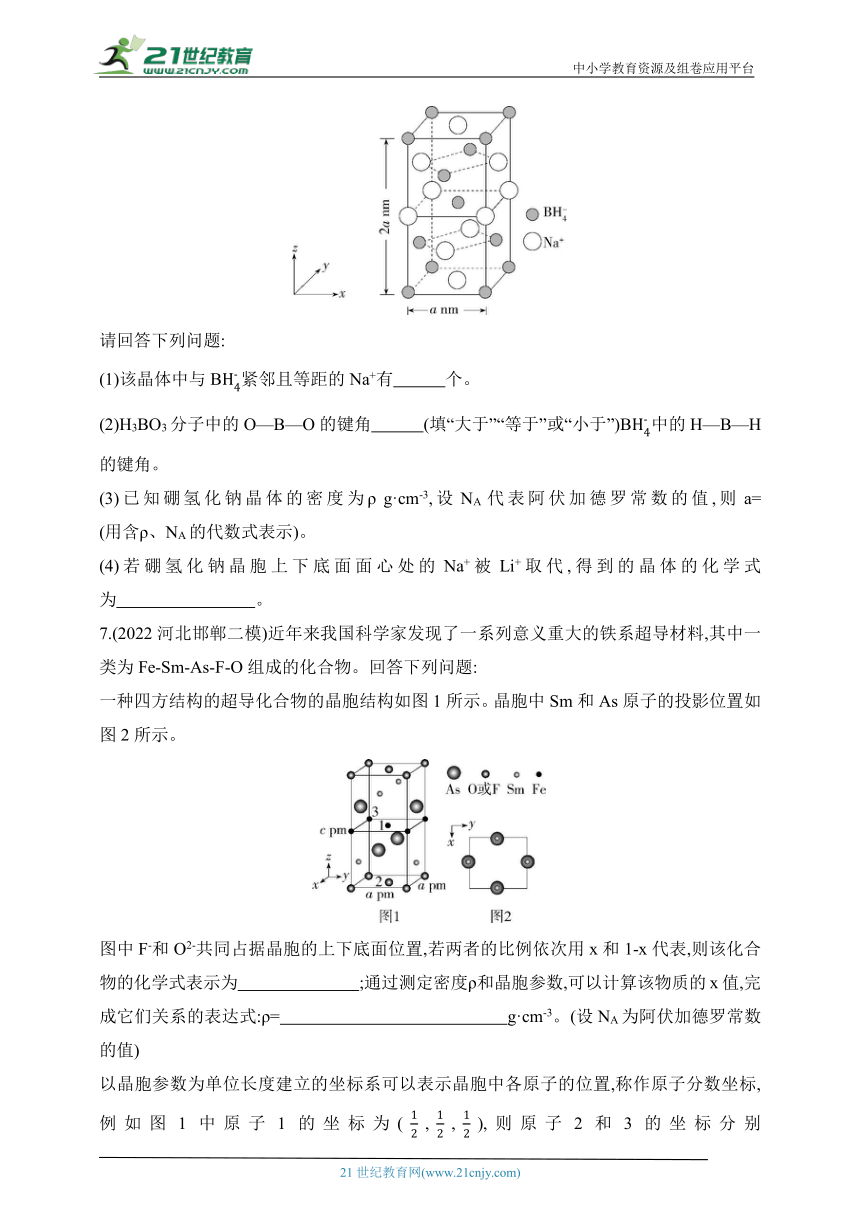
6.(2022安徽淮北第一中学期末)硼氢化钠是一种常用的还原剂。其晶胞结构如图所示:
请回答下列问题:
(1)该晶体中与B紧邻且等距的Na+有 个。
(2)H3BO3分子中的O—B—O的键角 (填“大于”“等于”或“小于”)B中的H—B—H的键角。
(3)已知硼氢化钠晶体的密度为ρ g·cm-3,设NA代表阿伏加德罗常数的值,则a= (用含ρ、NA的代数式表示)。
(4)若硼氢化钠晶胞上下底面面心处的Na+被Li+取代,得到的晶体的化学式为 。
7.(2022河北邯郸二模)近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe-Sm-As-F-O组成的化合物。回答下列问题:
一种四方结构的超导化合物的晶胞结构如图1所示。晶胞中Sm和As原子的投影位置如图2所示。
图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为 ;通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系的表达式:ρ= g·cm-3。(设NA为阿伏加德罗常数的值)
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(,,),则原子2和3的坐标分别为 、 。
本章复习提升
易混易错练
1.D 2.B 3.D 4.D 5.B 6.D
1.D 干冰、冰醋酸、硫黄与碘均属于分子晶体,其熔点的高低与分子间作用力的大小有关,D符合题意;金刚砂为SiC,属于共价晶体,纯碱是离子晶体,金属钠是金属晶体,三者的熔点高低取决于其所含化学键的强弱,A、B、C不符合题意。
易错分析 (1)离子晶体、共价晶体、金属晶体的熔点均与所含化学键强弱有关。
(2)分子晶体的熔点与分子间作用力的大小有关。
(3)一般来说,晶体的熔、沸点:共价晶体>离子晶体>分子晶体。
2.B 碱金属的熔点随着电子层数的增多而降低,所以Na、K、Cs的熔点依次降低,A不正确;元素非金属性越强,其简单气态氢化物越稳定,所以HCl、H2S、PH3的稳定性依次减弱,B正确;元素非金属性越强,其最高价氧化物对应水化物的酸性越强,所以H2SiO3、H2CO3、H2SO4的酸性依次增强,C不正确;一般来说,晶体的熔点:共价晶体>离子晶体>分子晶体,单晶硅、CsCl、干冰的熔点依次降低,D不正确。
易错分析 (1)同类晶体熔、沸点比较时,共价晶体根据共价键强弱判断;离子晶体根据离子键强弱判断;金属晶体根据金属键强弱判断。
(2)分子晶体熔、沸点判断时应注意具有分子间氢键的熔、沸点反常得高,如H2O>H2Te>H2Se>H2S。一般来说,组成和结构相似的分子晶体(不含氢键),相对分子质量越大,熔、沸点越高,如SnH4>GeH4>SiH4>CH4。
3.D 一般来说,组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,所以熔点I2>Cl2;由于NH3分子间存在氢键,故沸点NH3>PH3,A错误。SiO2是共价晶体,CH4是分子晶体,熔点SiO2>CH4;碳原子数相同的烷烃,支链越多,沸点越低,因此沸点CH3CH2CH2CH2CH3>(CH3)2CHCH2CH3>C(CH3)4,B错误。共价晶体的构成粒子是原子,共价晶体一般不导电,C错误。金属晶体的导电、导热性均与“自由电子”密切相关,D正确。
4.D 由题干信息可确定A、B、C、D、E分别为钠、硅、硫、氯、氧元素。钠元素和氧元素可以形成氧化钠和过氧化钠,氧化钠和过氧化钠都是离子晶体,A错误;水分子间存在氢键,沸点最高,B错误;晶体硅为共价晶体,硫和氯气的晶体为分子晶体,C错误;元素B和E形成的化合物SiO2具有较大的硬度和较高的熔点,D正确。
5.B 在氯化钠晶体中,距Na+最近的Cl-有6个,故A正确;1个题述气态团簇分子中含有4个E原子和4个F原子,则该气态团簇分子的分子式为E4F4或F4E4,故B错误;Ca2+位于晶胞的顶点和面心,数目为8×+6×=4,即每个晶胞平均占有4个Ca2+,故C正确;金刚石晶体中碳碳键被两个碳原子共有,每个碳原子形成4个共价键,即平均
1 mol C原子形成2 mol C—C键,碳原子与碳碳键个数之比为1∶2,故D正确。
易错分析 离子晶体、共价晶体、分子晶体等按照“切割法”计算晶胞中微粒个数;气态团簇分子按照组成分子的原子的个数书写分子式。
6.D 一个硅原子周围距离最近且相等的镁原子有8个,硅原子的配位数为8,A正确;紧邻的两个镁原子的距离等于晶胞棱长的一半,为 nm,B正确;紧邻的两个硅原子间的距离等于面对角线长的一半,为 nm,C正确;该晶体的密度为 g·cm-3,D错误。
思想方法练
1.B 2.AD 3.B
B 由“切割法”可知该结构单元中O原子数为1+12×=4,A项错误;Ni和Mg间的最短距离为晶胞面对角线长的一半,即×=
a,B项正确;由结构单元可知Ni的配位数为6,C项错误;1个该结构单元中Li的个数为1×0.5=0.5,Mg的个数为2×0.5+1×=1.125,Ni的个数为7×+3×0.5=2.375,O的个数为4,因此该物质的化学式为Li0.5Mg1.125Ni2.375O4,D项错误。
方法点津 计算晶胞微粒数的步骤
1.认清类型:正确解答此类题目的关键之一是分析晶胞所代表的晶体类型,因为晶胞是从晶体中截取出的基本重复单元,故采用“切割法”求晶体的化学式。
2.分析位置:分清粒子是位于晶胞的顶点、面上、棱上还是晶胞内。
3.判断贡献:如果在晶胞内,则该微粒专属该晶胞,对晶胞的贡献为1;若位于顶点,对晶胞的贡献为;若位于棱上,对晶胞的贡献为;若位于面上,对晶胞的贡献为。
4.计算个数:晶胞中某种微粒的个数与该微粒对晶胞贡献的乘积和为该晶胞平均拥有该微粒的数目。
2.AD 根据题图1可知,S2-位于立方体的顶点和面心,为面心立方最密堆积,故A正确;一个晶胞中S2-的个数为6×+8×=4,化学式为Cu2S,则一个晶胞中Cu+的个数为8,所以Cu+占据了8个四面体空隙,即全部的四面体空隙,故B错误;CuS晶胞中Cu2+位于四面体空隙中,Cu2+的配位数为4,所以S2-的配位数为4,故C错误;Cu2S晶胞的质量为 g= g,晶胞的体积为a3 pm3=a3×10-30 cm3,所以密度为= g·cm-3,故D正确。
3.B 由晶胞的结构可知,1个晶胞中含有X2+的个数为8×+6×=4,Y2-的个数为4,则该晶体的化学式是XY,故A正确;1个晶胞中含有4个XY,即1个晶胞的质量为4× g,晶胞体积为(a×10-7 cm)3,所以晶体密度ρ= g·cm-3,故B不正确;由题图可知,距离X2+最近且等距的Y2-有4个,距离Y2-最近且等距的X2+有4个,故C正确;若A的原子坐标为(,,),则原点位于左下前方的顶点,根据晶胞结构可知,B的原子坐标为(,,),故D正确。
方法点津 晶胞中原子的空间坐标确定方法
(1)明确坐标原点位置及三维空间坐标方向。
(2)分析已知坐标的原子和待求坐标的原子的相对位置。
(3)确定待求坐标的原子与坐标原点的空间位置。
(4)按(x,y,z)顺序写出待求原子坐标。
4.答案 (1)BiLi3(或Li3Bi) (,1,) (2)a
解析 (1)Bi位于晶胞的顶点和面心,个数为8×+6×=4,Li(1)位于棱上和体心,个数为12×+1=4,Li(2)位于体内,个数为8, Bi、Li个数比为4∶(8+4)=1∶3,晶体的化学式为BiLi3或Li3Bi。C处于右侧面的面心,原子坐标参数为(,1,)。
(2)设Bi的原子半径为x nm,则4x=a,解得x=a。
5.答案 (1)×10-21
(2)0.148
解析 (1)该晶胞的体积为(a×10-7 cm)3,根据×M=(a×10-7)3d,可求出y=×10-21。
(2)因为O2-采用面心立方最密堆积方式,所以面对角线长度是O2-半径的4倍,则有4r(O2-)=a,解得r(O2-)=×0.420 nm≈0.148 nm。
6.答案 (1)8 (2)大于 (3)×107
(4)Na3Li(BH4)4
解析 (1)以体心的B为研究对象,与之紧邻且等距的Na+位于晶胞棱心、晶胞中上面立方体左右侧面面心、晶胞中下面立方体前后面的面心,共有8个。
(2)H3BO3分子中中心原子是sp2杂化,且不含孤电子对,B中中心原子是sp3杂化,H3BO3分子中的O—B—O的键角大于B中的H—B—H的键角。
(3)一个晶胞中B数目为1+8×+4×=4,Na+数目为6×+4×=4,
ρ g·cm-3= g·cm-3,解得a=×107。
(4)若硼氢化钠晶胞上下底面面心处的Na+被Li+取代,晶胞中Li+数目为1,Na+数目为4×+4×=3,得到的晶体的化学式为Na3Li(BH4)4。
7.答案 SmFeAsO1-xFx (,,0) (0,0,)
解析 根据晶胞的结构可知,1个晶胞中As、Fe、Sm各有两个,F和O的原子数之和为2,则该化合物的化学式为SmFeAsO1-xFx。每个晶胞的质量为 g;该晶胞为长方体,其体积为a2·c×10-30 cm3,则ρ= g·cm-3。根据坐标系和原子1的坐标可知,底面左后方的O或F原子为坐标原点,其坐标是(0,0,0),则原子2的坐标为(,,0),原子3的坐标为(0,0,)。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024鲁教版高中化学选择性必修2同步
本章复习提升
易混易错练
易错点1 晶体类型判断错误导致比较晶体的性质时出错
1.(2022湖南长沙检测)下列各组物质的熔点均与所含化学键强弱无关的是( )
A.金属钠与干冰 B.纯碱与冰醋酸
C.金刚砂与石墨 D.硫黄与碘
2.下列物质性质递变规律正确的是( )
A.Na、K、Cs的熔点依次升高
B.HCl、H2S、PH3的稳定性依次减弱
C.H2CO3、H2SiO3、H2SO4的酸性依次增强
D.单晶硅、CsCl、干冰的熔点依次升高
3.下列有关晶体的叙述中,正确的是( )
A.熔点I2>Cl2;沸点PH3>NH3
B.熔点SiO2>CH4;沸点C(CH3)4>(CH3)2CHCH2CH3>CH3CH2CH2CH2CH3
C.共价晶体的构成粒子是分子,故共价晶体都不导电
D.金属晶体的导电、导热性均与“自由电子”密切相关
4.(2022安徽芜湖第一中学月考)有A、B、C、D、E五种短周期元素,其中A、B、C、D同周期,C、E同主族;A+与E2-具有相同的电子层结构;离子半径C2->D-;B的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是( )
A.两种元素A、E形成的两种化合物的晶体类型不同
B.元素D、C、E的简单氢化物都是分子晶体,其沸点依次降低
C.元素B、C、D的单质晶体属于同种类型的晶体
D.元素B和E形成的化合物具有较大的硬度和较高的熔点
易错点2 晶体结构判断错误导致计算出错
5.(2023河北唐山第二中学期末)有关晶体的结构如图所示,下列说法中不正确的是( )
A.在NaCl晶体中,距Na+最近的Cl-有6个
B.上述气态团簇分子的分子式为EF或FE
C.在CaF2晶体中,每个晶胞平均占有4个C
D.在金刚石晶体中,碳原子与碳碳键个数之比为1∶2
6.(2022河北石家庄第一中学月考)Mg2Si具有反萤石结构,其晶胞结构如图所示,晶胞棱长为0.635 nm。下列叙述错误的是( )
A.Si的配位数为8
B.紧邻的两个Mg原子的距离为 nm
C.紧邻的两个Si原子间的距离为 nm
D.Mg2Si晶体的密度为 g·cm-3
思想方法练
利用建模思想解答晶胞中的相关计算问题
方法概述
有关晶胞计算类试题,可以将晶胞中原子“质点”化,构成立体模型,根据模型确定晶胞结构,推算物质化学式,再进一步计算密度、
微粒间的距离等。此类试题中常见的计算:
(1)化学式:利用“切割法”计算一个晶胞中所含组成微粒的个数。
(2)晶体的密度:ρ=。式中ρ为晶体的密度,V为一个晶胞的体积,M为构成晶胞微粒的摩尔质量,N为晶胞所含微粒个数,NA为阿伏加德罗常数。
(3)微粒间的距离:分析晶胞构成及晶胞几何构型中各线性关系求算,若立方体晶胞的边长是a,则面对角线长是a,体对角线长是a。
1.(2022山东枣庄第三中学期中)已知NixMg1-xO晶体属于立方晶系,晶胞边长为a。将Li+掺杂到该晶体的晶胞中,可得到一种高性能的太阳能电池材料,其结构单元如图所示。假定掺杂后的晶胞参数不发生变化,下列说法正确的是( )
A.该结构单元中O原子数为3
B.Ni和Mg间的最短距离是a
C.Ni的配位数为4
D.该物质的化学式为Li0.5Mg1.12Ni2.38O3
2.(2023山东昌乐一中段测)常见的铜的硫化物有CuS和Cu2S两种。已知晶胞中S2-的位置如图1所示,Cu2+、Cu+位于硫离子所构成的四面体中心,它们的晶胞具有相同的侧视图,如图2所示。Cu2S的晶胞参数为a pm,阿伏加德罗常数的值为NA。下列说法正确的是( )
图1 图2
A.S2-是面心立方最密堆积
B.Cu2S晶胞中,Cu+填充了晶胞中一半四面体空隙
C.CuS晶胞中S2-的配位数为8
D.Cu2S晶体的密度为 g·cm-3
3.(2023浙江舟山模拟)某荧光材料由X2+与Y2-组成,其摩尔质量为
M g· mol-1,NA为阿伏加德罗常数的值,其晶胞结构如图所示。下列叙述不正确的是( )
A.该晶体的化学式是XY
B.该晶胞参数为a nm,则其晶体密度ρ= g·cm-3
C.X2+的配位数是4,Y2-的配位数也是4
D.若A的原子坐标为(,,),则B的原子坐标为(,,)
4.(2022山东师范大学附属中学期末)铋化锂被认为是很有潜力的正极材料,晶胞结构如图所示。
(1)晶体的化学式为 ,图中铋原子坐标参数:A为(0,0,0),B为(0,1,1),C为 。
(2)若晶胞参数为a nm,则铋原子的半径为 nm。
5.(2022安徽合肥一六八中学月考)(1)我国科学家成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R表示)。R的晶体密度为d g·cm-3,其立方晶胞棱长为a nm,晶胞中含有y个(N5)6(H3O)3(NH4)4Cl单元,该单元的摩尔质量为M g·mol-1,则y的计算表达式为 。(设NA为阿伏加德罗常数的值)
(2)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,晶胞参数a=0.420 nm,则r(O2-)为 nm。(结果保留3位小数)
6.(2022安徽淮北第一中学期末)硼氢化钠是一种常用的还原剂。其晶胞结构如图所示:
请回答下列问题:
(1)该晶体中与B紧邻且等距的Na+有 个。
(2)H3BO3分子中的O—B—O的键角 (填“大于”“等于”或“小于”)B中的H—B—H的键角。
(3)已知硼氢化钠晶体的密度为ρ g·cm-3,设NA代表阿伏加德罗常数的值,则a= (用含ρ、NA的代数式表示)。
(4)若硼氢化钠晶胞上下底面面心处的Na+被Li+取代,得到的晶体的化学式为 。
7.(2022河北邯郸二模)近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe-Sm-As-F-O组成的化合物。回答下列问题:
一种四方结构的超导化合物的晶胞结构如图1所示。晶胞中Sm和As原子的投影位置如图2所示。
图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为 ;通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系的表达式:ρ= g·cm-3。(设NA为阿伏加德罗常数的值)
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(,,),则原子2和3的坐标分别为 、 。
本章复习提升
易混易错练
1.D 2.B 3.D 4.D 5.B 6.D
1.D 干冰、冰醋酸、硫黄与碘均属于分子晶体,其熔点的高低与分子间作用力的大小有关,D符合题意;金刚砂为SiC,属于共价晶体,纯碱是离子晶体,金属钠是金属晶体,三者的熔点高低取决于其所含化学键的强弱,A、B、C不符合题意。
易错分析 (1)离子晶体、共价晶体、金属晶体的熔点均与所含化学键强弱有关。
(2)分子晶体的熔点与分子间作用力的大小有关。
(3)一般来说,晶体的熔、沸点:共价晶体>离子晶体>分子晶体。
2.B 碱金属的熔点随着电子层数的增多而降低,所以Na、K、Cs的熔点依次降低,A不正确;元素非金属性越强,其简单气态氢化物越稳定,所以HCl、H2S、PH3的稳定性依次减弱,B正确;元素非金属性越强,其最高价氧化物对应水化物的酸性越强,所以H2SiO3、H2CO3、H2SO4的酸性依次增强,C不正确;一般来说,晶体的熔点:共价晶体>离子晶体>分子晶体,单晶硅、CsCl、干冰的熔点依次降低,D不正确。
易错分析 (1)同类晶体熔、沸点比较时,共价晶体根据共价键强弱判断;离子晶体根据离子键强弱判断;金属晶体根据金属键强弱判断。
(2)分子晶体熔、沸点判断时应注意具有分子间氢键的熔、沸点反常得高,如H2O>H2Te>H2Se>H2S。一般来说,组成和结构相似的分子晶体(不含氢键),相对分子质量越大,熔、沸点越高,如SnH4>GeH4>SiH4>CH4。
3.D 一般来说,组成和结构相似的分子晶体,相对分子质量越大,熔、沸点越高,所以熔点I2>Cl2;由于NH3分子间存在氢键,故沸点NH3>PH3,A错误。SiO2是共价晶体,CH4是分子晶体,熔点SiO2>CH4;碳原子数相同的烷烃,支链越多,沸点越低,因此沸点CH3CH2CH2CH2CH3>(CH3)2CHCH2CH3>C(CH3)4,B错误。共价晶体的构成粒子是原子,共价晶体一般不导电,C错误。金属晶体的导电、导热性均与“自由电子”密切相关,D正确。
4.D 由题干信息可确定A、B、C、D、E分别为钠、硅、硫、氯、氧元素。钠元素和氧元素可以形成氧化钠和过氧化钠,氧化钠和过氧化钠都是离子晶体,A错误;水分子间存在氢键,沸点最高,B错误;晶体硅为共价晶体,硫和氯气的晶体为分子晶体,C错误;元素B和E形成的化合物SiO2具有较大的硬度和较高的熔点,D正确。
5.B 在氯化钠晶体中,距Na+最近的Cl-有6个,故A正确;1个题述气态团簇分子中含有4个E原子和4个F原子,则该气态团簇分子的分子式为E4F4或F4E4,故B错误;Ca2+位于晶胞的顶点和面心,数目为8×+6×=4,即每个晶胞平均占有4个Ca2+,故C正确;金刚石晶体中碳碳键被两个碳原子共有,每个碳原子形成4个共价键,即平均
1 mol C原子形成2 mol C—C键,碳原子与碳碳键个数之比为1∶2,故D正确。
易错分析 离子晶体、共价晶体、分子晶体等按照“切割法”计算晶胞中微粒个数;气态团簇分子按照组成分子的原子的个数书写分子式。
6.D 一个硅原子周围距离最近且相等的镁原子有8个,硅原子的配位数为8,A正确;紧邻的两个镁原子的距离等于晶胞棱长的一半,为 nm,B正确;紧邻的两个硅原子间的距离等于面对角线长的一半,为 nm,C正确;该晶体的密度为 g·cm-3,D错误。
思想方法练
1.B 2.AD 3.B
B 由“切割法”可知该结构单元中O原子数为1+12×=4,A项错误;Ni和Mg间的最短距离为晶胞面对角线长的一半,即×=
a,B项正确;由结构单元可知Ni的配位数为6,C项错误;1个该结构单元中Li的个数为1×0.5=0.5,Mg的个数为2×0.5+1×=1.125,Ni的个数为7×+3×0.5=2.375,O的个数为4,因此该物质的化学式为Li0.5Mg1.125Ni2.375O4,D项错误。
方法点津 计算晶胞微粒数的步骤
1.认清类型:正确解答此类题目的关键之一是分析晶胞所代表的晶体类型,因为晶胞是从晶体中截取出的基本重复单元,故采用“切割法”求晶体的化学式。
2.分析位置:分清粒子是位于晶胞的顶点、面上、棱上还是晶胞内。
3.判断贡献:如果在晶胞内,则该微粒专属该晶胞,对晶胞的贡献为1;若位于顶点,对晶胞的贡献为;若位于棱上,对晶胞的贡献为;若位于面上,对晶胞的贡献为。
4.计算个数:晶胞中某种微粒的个数与该微粒对晶胞贡献的乘积和为该晶胞平均拥有该微粒的数目。
2.AD 根据题图1可知,S2-位于立方体的顶点和面心,为面心立方最密堆积,故A正确;一个晶胞中S2-的个数为6×+8×=4,化学式为Cu2S,则一个晶胞中Cu+的个数为8,所以Cu+占据了8个四面体空隙,即全部的四面体空隙,故B错误;CuS晶胞中Cu2+位于四面体空隙中,Cu2+的配位数为4,所以S2-的配位数为4,故C错误;Cu2S晶胞的质量为 g= g,晶胞的体积为a3 pm3=a3×10-30 cm3,所以密度为= g·cm-3,故D正确。
3.B 由晶胞的结构可知,1个晶胞中含有X2+的个数为8×+6×=4,Y2-的个数为4,则该晶体的化学式是XY,故A正确;1个晶胞中含有4个XY,即1个晶胞的质量为4× g,晶胞体积为(a×10-7 cm)3,所以晶体密度ρ= g·cm-3,故B不正确;由题图可知,距离X2+最近且等距的Y2-有4个,距离Y2-最近且等距的X2+有4个,故C正确;若A的原子坐标为(,,),则原点位于左下前方的顶点,根据晶胞结构可知,B的原子坐标为(,,),故D正确。
方法点津 晶胞中原子的空间坐标确定方法
(1)明确坐标原点位置及三维空间坐标方向。
(2)分析已知坐标的原子和待求坐标的原子的相对位置。
(3)确定待求坐标的原子与坐标原点的空间位置。
(4)按(x,y,z)顺序写出待求原子坐标。
4.答案 (1)BiLi3(或Li3Bi) (,1,) (2)a
解析 (1)Bi位于晶胞的顶点和面心,个数为8×+6×=4,Li(1)位于棱上和体心,个数为12×+1=4,Li(2)位于体内,个数为8, Bi、Li个数比为4∶(8+4)=1∶3,晶体的化学式为BiLi3或Li3Bi。C处于右侧面的面心,原子坐标参数为(,1,)。
(2)设Bi的原子半径为x nm,则4x=a,解得x=a。
5.答案 (1)×10-21
(2)0.148
解析 (1)该晶胞的体积为(a×10-7 cm)3,根据×M=(a×10-7)3d,可求出y=×10-21。
(2)因为O2-采用面心立方最密堆积方式,所以面对角线长度是O2-半径的4倍,则有4r(O2-)=a,解得r(O2-)=×0.420 nm≈0.148 nm。
6.答案 (1)8 (2)大于 (3)×107
(4)Na3Li(BH4)4
解析 (1)以体心的B为研究对象,与之紧邻且等距的Na+位于晶胞棱心、晶胞中上面立方体左右侧面面心、晶胞中下面立方体前后面的面心,共有8个。
(2)H3BO3分子中中心原子是sp2杂化,且不含孤电子对,B中中心原子是sp3杂化,H3BO3分子中的O—B—O的键角大于B中的H—B—H的键角。
(3)一个晶胞中B数目为1+8×+4×=4,Na+数目为6×+4×=4,
ρ g·cm-3= g·cm-3,解得a=×107。
(4)若硼氢化钠晶胞上下底面面心处的Na+被Li+取代,晶胞中Li+数目为1,Na+数目为4×+4×=3,得到的晶体的化学式为Na3Li(BH4)4。
7.答案 SmFeAsO1-xFx (,,0) (0,0,)
解析 根据晶胞的结构可知,1个晶胞中As、Fe、Sm各有两个,F和O的原子数之和为2,则该化合物的化学式为SmFeAsO1-xFx。每个晶胞的质量为 g;该晶胞为长方体,其体积为a2·c×10-30 cm3,则ρ= g·cm-3。根据坐标系和原子1的坐标可知,底面左后方的O或F原子为坐标原点,其坐标是(0,0,0),则原子2的坐标为(,,0),原子3的坐标为(0,0,)。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
