2024鲁教版高中化学选择性必修2同步练习题--全书综合测评(含解析)
文档属性
| 名称 | 2024鲁教版高中化学选择性必修2同步练习题--全书综合测评(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 20:28:22 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2024鲁教版高中化学选择性必修2同步
全书综合测评
1.全卷满分100分 考试用时90分钟。
2.可能用到的相对原子质量:H 1 C 12 N 14 O 16 P 31 Cl 35.5 Fe 56 Cu 64 Ag 108。
一、选择题(本题共10小题,每小题2分,共20分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.化学与生产、生活、科技等密切相关。下列说法正确的是( )
A.冬奥会部分场馆建筑应用了新材料碲化镉发电玻璃,碲和镉均属于过渡元素
B.近年来的材料新宠——石墨烯,其与金刚石互为同位素
C.用干冰作为制冷剂,干冰升华过程中破坏了共价键
D.焰火、激光都与原子核外电子跃迁释放能量有关
2.2021年诺贝尔化学奖颁给了“在不对称催化方面”做出突出贡献的两位科学家,脯氨酸()是不对称有机催化剂中的一种。下列关于脯氨酸分子的说法错误的是( )
A.该分子为极性分子
B.分子中所有原子可能共面
C.分子中存在手性碳原子
D.可形成分子内氢键
3.“点击化学”又称为“链接化学”“速配接合组合式化学”,是指借助标准“接口”模块化组装的一类反应。如图为“点击化学”的一种反应,下列关于Ⅰ~Ⅲ三种物质的说法正确的是(已知NA为阿伏加德罗常数的值)( )
A.Ⅰ中所含元素中O元素的电负性最大
B.1 molⅡ分子中含有σ键个数为9NA
C.Ⅲ中碳氧键的键长相等
D.Ⅲ中含有手性碳原子
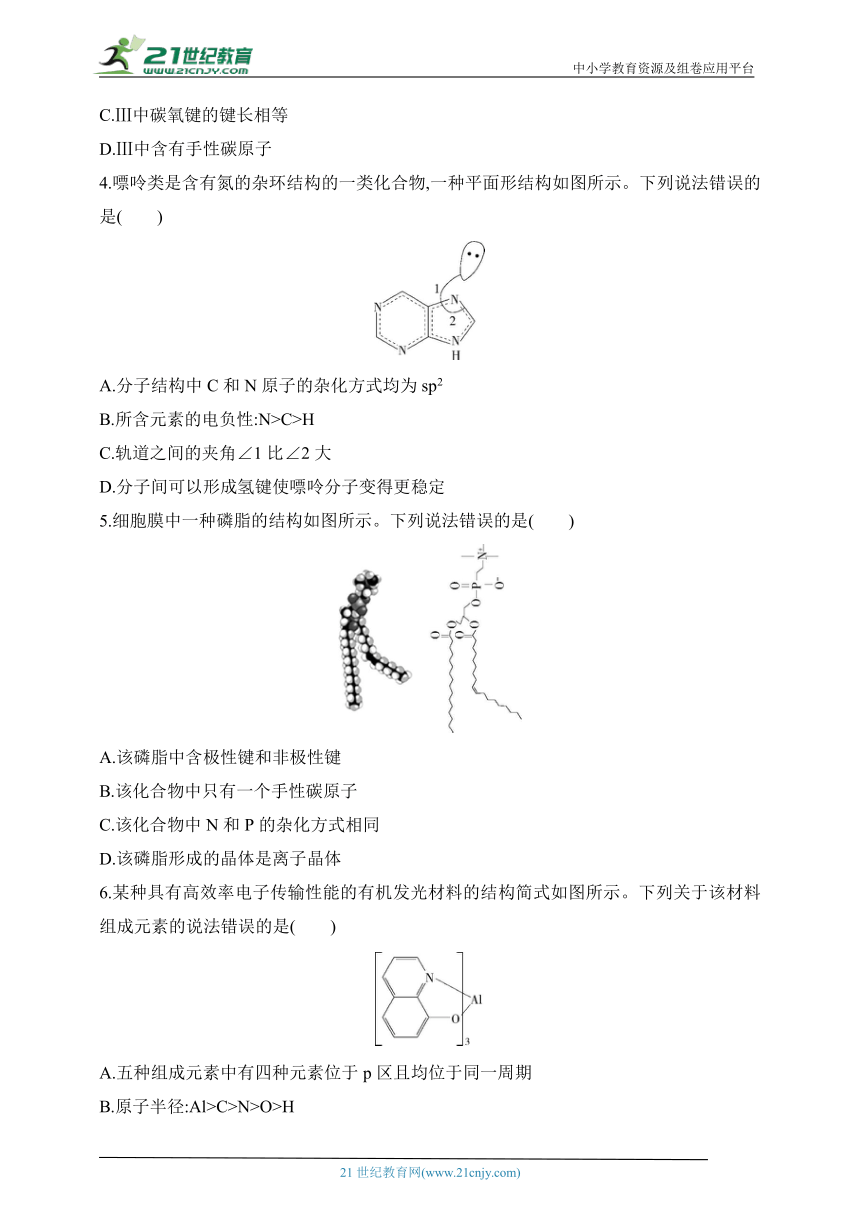
4.嘌呤类是含有氮的杂环结构的一类化合物,一种平面形结构如图所示。下列说法错误的是( )
A.分子结构中C和N原子的杂化方式均为sp2
B.所含元素的电负性:N>C>H
C.轨道之间的夹角∠1比∠2大
D.分子间可以形成氢键使嘌呤分子变得更稳定
5.细胞膜中一种磷脂的结构如图所示。下列说法错误的是( )
A.该磷脂中含极性键和非极性键
B.该化合物中只有一个手性碳原子
C.该化合物中N和P的杂化方式相同
D.该磷脂形成的晶体是离子晶体
6.某种具有高效率电子传输性能的有机发光材料的结构简式如图所示。下列关于该材料组成元素的说法错误的是( )
A.五种组成元素中有四种元素位于p区且均位于同一周期
B.原子半径:Al>C>N>O>H
C.简单氢化物的稳定性:H2O>NH3>CH4
D.基态N原子核外有7种运动状态不同的电子
7.无公害肥料的主要成分是氰氨化钙(CaCN2),CaCN2的制备原理为CaCO3+2HCN CaCN2+CO↑+H2↑+CO2↑,下列叙述正确的是( )
A.第一电离能:S>P>Si
B.C、HCN中碳原子的杂化方式相同
C.CaCN2和CO2中所含化学键的类型相同
D.CaCN2晶体熔化时破坏的是离子键
8.短周期元素X、Y、Z的原子序数依次增大,X元素基态原子有2个未成对电子,Y元素基态原子的核外p电子比s电子少1个,Z的一种超原子具有40个价电子。下列说法错误的是( )
A.X的空间结构为平面三角形
B.简单离子半径:YC.Y中心原子的杂化方式为sp2
D.Z晶体含金属键,具有良好的延展性、导电性、导热性
9.下列说法正确的是( )
A.凡AB3型的共价化合物,其中心原子A均采取sp3杂化
B.著名的硫氮化合物分子(如图所示)中只含有极性共价键
C.CO2、HClO、HCHO分子中都既有σ键又有π键
D.C—H键比Si—H键的键长短,故CH4比SiH4更稳定
10.1-乙基-3-甲基咪唑四氟硼酸盐是一种常见的离子液体(结构如图),其环状结构中存在大π键。下列说法正确的是 ( )
A.阳离子中碳原子采用sp2、sp3杂化
B.B的空间结构为平面正方形
C.该化合物形成的晶体属于分子晶体
D.该化合物中存在离子键、配位键和氢键
二、选择题(本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全都选对得4分,选对但不全的得2分,有选错的得0分)
11.短周期元素X、Y、Z、M原子序数依次增大,Z的基态原子2p轨道半充满,M的最高正价与最低负价绝对值之差为4,它们组成的一种分子结构如图。下列说法正确的是( )
A.电负性:X>Y>Z
B.原子半径:Y>Z>X
C.分子中Z原子的杂化方式均为sp3
D.Y、Z、M的最高价氧化物的水化物均为强酸
12.《科学在线》发表了武汉大学科研团队利用新型Fe基复合催化剂高效抑制CO2生成,实现水煤气(主要成分为CO和H2)直接制取烯烃的研究成果,原理如图所示。下列说法错误的是( )
A.水中存在氢键,所以CO2、H2O形成的晶体类型不同
B.每个Fe(CO)5分子中含有10个σ键
C.CO2分子和乙烯分子中C原子的杂化方式不同
D.CO2和H2O晶体中键的极性和分子的极性相同
13.在TiCl3的饱和溶液中通入适量HCl,再加入乙醚生成绿色晶体,如果不加入乙醚,直接通入HCl得到的是紫色晶体,已知两种晶体分子式均为TiCl3·6H2O,配位数都是6。分别取0.01 mol两种晶体,在水溶液中用过量AgNO3处理,绿色晶体得到的白色沉淀质量为紫色晶体得到白色沉淀质量的,则下列有关说法不正确的是( )
A.该绿色晶体配体是氯离子和水,它们物质的量之比为5∶1
B.紫色晶体配合物的化学式为[Ti(H2O)6]Cl3
C.上述两种晶体的分子式相同,但结构不同,所以性质不同
D.0.01 mol紫色晶体在水溶液中与过量AgNO3作用最多可得到2.87 g沉淀
14.常温下,W、X、Y、Z四种短周期元素的最高价氧化物对应的水化物溶液(浓度均为0.01 mol·L-1)的pH和原子半径、原子序数的关系如图所示。下列说法错误的是( )
A.第一电离能:W>Z>Y>X
B.简单离子的半径:Y>Z>W>X
C.W的氢化物空间构型不一定是三角锥形
D.Z的单质具有强氧化性和漂白性
15.砷化镉晶胞结构如图,图中①和②位是“真空”,晶胞参数为a pm,建立如图所示的原子坐标系,①号位的坐标为(,,)。已知:砷化镉的摩尔质量为M g·mol-1,NA为阿伏加德罗常数的值。下列说法错误的是( )
A.砷化镉中Cd与As原子个数比为3∶2
B.两个Cd原子间最短距离为0.5a pm
C.③号原子坐标参数为(,1,)
D.该晶体的密度为 g·cm-3
三、非选择题(本题共5小题,共60分)
16.(12分)氯吡苯脲的相关信息如表所示:
分子式 C12H10ClN3O
结构简式
外观 白色结晶粉末
熔点 170~172 ℃
溶解性 易溶于水
(1)氯元素基态原子核外电子的未成对电子数为 。
(2)氯吡苯脲固体中,氮原子的杂化方式为 。
(3)氯吡苯脲固体中,存在的作用力类型有 (填字母)。
A.离子键 B.金属键 C.共价键 D.配位键 E.氢键
(4)氯吡苯脲易溶于水的原因是 。
(5)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲。
+
设NA为阿伏加德罗常数的值,反应过程中,每生成1 mol氯吡苯脲,断裂化学键的数目为 。
(6)构成氯吡苯脲的元素中,电负性最大的是 (填元素符号)。
(7)已知苯酚中苯环上连接的—OH能电离出H+(),苯酚的酸性大于(邻羟基苯甲醛),其原因是 。
17.(12分)青蒿素(C15H22O5)的结构如图甲所示。请回答下列问题:
甲
乙
丙
(1)组成青蒿素的三种元素电负性由大到小的顺序是 ;画出基态N原子价电子的轨道表示式: ;在基态O原子中,核外存在 对自旋状态不同的电子。
(2)下列关于青蒿素的说法正确的是 (填字母)。
A.青蒿素分子属于极性分子
B.在青蒿素分子中,所有碳原子均处于同一平面
C.图中数字标记的五个碳原子均只以σ键与其他原子成键
D.1个青蒿素分子中含有7个手性碳原子
(3)在确定青蒿素结构的过程中,可采用硼氢化钠(NaBH4)作为还原剂,其制备原理为4NaH+B(OCH3)3 NaBH4+3CH3ONa。
①NaH为 晶体,图乙是NaH晶体的晶胞结构,若晶胞棱长为a nm,则Na原子间最小核间距为 nm。
②B(OCH3)3中B原子采用的杂化方式是 。
③NaBH4结构如图丙所示,NaBH4中存在的作用力有 。NaBH4是有机化学中的一种常用还原剂,其在热水中水解生成四羟基合硼酸钠和氢气,该反应的化学方程式为 。
18.(12分)铜是人类最早使用的金属之一,铜的使用对早期人类文明的进步影响深远。按要求回答下列问题:
(1)基态Cu+比Cu2+稳定的原因是 。
(2)白铜是铜镍合金,呈银白色,有金属光泽,白铜中存在的化学键是 ;元素铜与镍的第二电离能分别为1 958 kJ·mol-1、1 753 kJ·mol-1,铜的第二电离能大于镍的原因是 。
(3)某含铜配合物的结构简式如图所示,其中Cu2+的配位数是 ,C原子的杂化方式为 ;C、N、O三种元素的简单氢化物中能形成氢键的是 (填化学式)。
(4)以甲醇为溶剂,Co2+可与色胺酮分子配位结合形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示)。色胺酮分子中所含元素(H、C、N、O)第一电离能由大到小的顺序为 ,色氨酮分子中N原子的杂化方式为 。X射线衍射分析显示色胺酮钴配合物晶胞中还含有一个CH3OH分子,CH3OH是通过 (填作用力名称)与色胺酮钴配合物相结合的。
19.(12分)联合国宣布2019年是“国际化学元素周期表年”。回答下列问题:
(1)焰色试验是检测金属元素常用的方法,下列元素不能用焰色试验检测的是 (填字母)。
A.Fe B.Cu C.Ba D.Ca
(2)KSCN、K4[Fe(CN)6]是实验室常用的试剂。KSCN中C原子的杂化方式为 ,SCN-中π键和σ键的数目之比为 ,K4[Fe(CN)6]中存在的作用力类型有 (填字母)。
A.金属键 B.离子键 C.共价键
D.配位键 E.氢键 F.范德华力
(3)人体正常的血红蛋白中含有Fe2+,但Fe2+很容易与CO生成正八面体结构的配离子而使血红蛋白失去携带氧气的功能,
则该配离子中配位数是 。
(4)铁氮化合物的一种晶胞结构如图所示,一个该晶胞的质量为 g。(用NA表示阿伏加德罗常数的值)
20.(12分)周期表中前四周期元素R、W、X、Y、Z的原子序数依次增大。R元素基态原子中,电子占据的最高电子层符号为L,占据的最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y元素原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z元素基态原子的最外电子层只有一个电子,其他电子层均已充满电子。请回答下列问题:
(1)Y的空间构型是 。
(2)结构简式为RX(WH2)2的化合物中R原子的杂化轨道类型为 ;1 mol RX(WH2)2分子中含有σ键的数目为 。(H为氢元素,下同)
(3)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是 (填字母)。
A.[Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+提供孤电子对,WH3提供空轨道
C.[Z(WH3)4]SO4的组成元素中第一电离能最大的是氧元素
(4)某Y与Z形成的化合物的晶胞结构如图所示(代表Z原子)。
①该晶体的化学式为 。
②已知该晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则该晶体中Z原子和Y原子之间的最短距离为
cm(列出计算式即可)(Z原子位于体对角线上)。
答案与解析
1.D 2.B 3.A 4.D 5.D 6.A 7.D 8.B
9.D 10.A 11.BC 12.AD 13.AD 14.D 15.D
1.D 碲属于ⅥA族元素,不属于过渡元素,故A错误;金刚石、石墨烯是由碳元素组成的单质,互为同素异形体,故B错误;干冰升华过程中,只发生状态的改变,破坏了分子间作用力,不破坏共价键,故C错误;焰火、激光的产生与原子核外电子跃迁释放能量有关,故D正确。
2.B 脯氨酸分子中存在sp3杂化的碳原子,故分子中所有原子不可能共面,B项错误。
3.A Ⅰ分子中含有的元素为C、H、O、N,其中电负性最大的元素为O元素,故A正确;一个Ⅱ分子中含有σ键的个数为14,则1 mol Ⅱ分子中含有σ键的个数为14NA,故B错误;Ⅲ中存在碳氧单键和碳氧双键,键长不相等,故C错误;Ⅲ中采取sp3杂化的碳原子都连接2个H原子,所以Ⅲ分子中不含有手性碳原子,故D错误。
4.D 该分子是一种平面形结构,则C和N原子的杂化方式均为sp2,A正确;电负性:N>C>H,B正确;由于孤电子对和成键电子对之间的排斥力大于成键电子对之间的排斥力,所以轨道之间的夹角∠1比∠2大,C正确;氢键只影响物质的物理性质,与分子的稳定性无关,D错误。
5.D 该磷脂中有碳碳非极性键及碳氧键、碳氮键、碳磷键、碳氢键等极性键,A正确;磷脂分子结构中有一个手性碳原子,B正确;由磷脂的结构可知,N、P均为sp3杂化,C正确;由磷脂分子结构可知,形成的晶体是分子晶体,D错误。
6.A 该物质的五种组成元素为C、N、O、Al、H,C、N、O、Al四种元素位于p区,但只有C、N、O三种元素位于同一周期,A错误;H只有一个电子层,Al有三个电子层,C、N、O均有两个电子层,同一周期主族元素从左到右原子半径逐渐减小,则原子半径Al>C>N>O>H,B正确;同一周期从左到右主族元素的非金属性逐渐增强,简单氢化物的稳定性也逐渐增强,故简单氢化物的稳定性:H2O>NH3>CH4,C正确;N原子核外有7个电子,每一个电子的运动状态都不同,即基态N原子核外有7种运动状态不同的电子,D正确。
7.D 磷原子的3p轨道是半充满状态,难失电子,第一电离能P>S>Si,A错误;C中碳原子是sp2杂化、HCN中碳原子是sp杂化,B错误;CaCN2含离子键和共价键,CO2只含共价键,C错误;CaCN2属于离子晶体,熔化时破坏的是离子键,D正确。
8.B 短周期元素X、Y、Z的原子序数依次增大,Y元素基态原子的核外p电子比s电子少1个,则Y为N元素;X元素基态原子有2个未成对电子,且元素X的原子序数小于N,则X为C元素;Z的一种超原子具有40个价电子,则Z的价电子数为=3,Z为Al元素。C中心原子的价电子对数为3,不含孤电子对,空间结构为平面三角形,A正确;N3-与Al3+的核外电子排布相同,离子半径:N3->Al3+,B错误;N中心原子的价电子对数为3,不含孤电子对,采用sp2杂化,C正确;Al单质属于金属晶体,具有良好的延展性、导电性、导热性,D正确。
9.D AB3型的共价化合物,中心原子A可能采取sp3杂化,也可能采取sp2杂化,比如BF3中的B原子的价电子对数=3+(3-3×1)=3,B采取sp2杂化,故A错误;由题图可知,硫氮化合物分子中既含有极性共价键,又含有硫原子之间形成的非极性共价键,故B错误;HClO分子中只有单键,即分子中只有σ键而没有π键,故C错误;C—H键比Si—H键的键长短,C—H键的键能比Si—H键大,所以CH4比SiH4更稳定,故D正确。
10.A 阳离子中五元环上双键C原子是sp2杂化,—CH3和—CH2—上碳原子是sp3杂化,A正确;B的空间结构是正四面体形,B错误;该化合物为离子液体,不是分子晶体,一定含有离子键,B中存在配位键,其中B提供空轨道,F-提供孤电子对,不存在氢键,C、D错误。
11.BC 根据Z的基态原子2p轨道半充满,推出Z是氮元素;M的最高正价与最低负价绝对值之差为4,则M是硫元素;根据短周期元素X、Y、Z、M原子序数依次增大及它们组成的分子结构图推出X是氢元素,Y是碳元素。电负性XZ>X,B正确;分子中N采取sp3杂化,C正确;碳酸是弱酸,D错误。
12.AD CO2、H2O形成的晶体都是分子晶体,A错误;Fe(CO)5分子中,每个配体CO存在1个σ键,配体与Fe形成5个配位键,也是σ键,所以每个Fe(CO)5分子中共含有10个σ键,B正确;CO2分子的中心原子C原子采取sp杂化,乙烯分子的中心原子C原子采取sp2杂化,C正确;CO2和H2O中均存在极性键,CO2是非极性分子,H2O是极性分子,D错误。
13.AD 根据题意分析,1个绿色晶体配合物外界含2个氯离子,该晶体配合物的化学式为[TiCl(H2O)5]Cl2·H2O,该绿色晶体配体是氯离子和水,它们物质的量之比为1∶5,A错误;1个紫色晶体配合物外界含3个氯离子,配位数是6,紫色晶体配合物的化学式为[Ti(H2O)6]Cl3,B正确;两种晶体的结构不同,所以性质不同,C正确;1个紫色晶体配合物外界含3个氯离子,0.01 mol紫色晶体在水溶液中与过量AgNO3作用最多可得到0.03 mol AgCl沉淀,沉淀质量为0.03 mol×143.5 g·mol-1=4.305 g,D错误。
14.D 据图可知,0.01 mol·L-1W、Z的最高价氧化物对应的水化物溶液pH均为2,均为一元强酸,应为HNO3和HClO4,再结合原子半径WCl>S>Na,A正确;简单离子半径:S2->Cl->N3->Na+,B正确;W为N元素,气态氢化物有NH3、N2H4等,NH3是三角锥形,而N2H4不是三角锥形,C正确;Z为Cl元素,Cl2不具有漂白性,D错误。
15.D 一个晶胞中As个数为8×+6×=4,Cd的个数为6,砷化镉中Cd与As原子个数比为6∶4=3∶2,A正确;由图示晶胞可知,两个Cd原子间最短距离为0.5a pm,B正确;由图示可知,③号原子位于右侧面的面心上,原子坐标参数为(,1,),C正确;一个晶胞中含有6个Cd和4个As,即含有2个As2Cd3,该晶体的密度为 g·cm-3,D错误。
16.答案 (除标注外,每空2分)(1)1(1分)
(2)sp2、sp3
(3)CE
(4)氯吡苯脲可以与水分子形成氢键
(5)2NA
(6)O(1分)
(7)邻羟基苯甲醛会形成分子内氢键,使得羟基上的氢原子难以电离
解析 (1)氯元素基态原子的核外电子排布式是1s22s22p63s23p5,所以未成对电子数为1。
(2)根据氯吡苯脲的结构简式可知,有2个氮原子各形成3个单键,且它们各有1对孤电子对,属于sp3杂化,另外1个氮原子形成双键和单键,属于sp2杂化。
(3)氯吡苯脲分子为共价化合物,分子内存在共价键。由于氯吡苯脲分子中含—NH—,故分子间能形成氢键。
(4)氯吡苯脲能与水分子形成氢键,使其在水中的溶解度增大,所以易溶于水。
(5)由于单键都是σ键,1个双键是由1个σ键和1个π键构成的,所以根据反应的化学方程式可知,每生成
1 mol氯吡苯脲,断裂NA个N—H σ键和NA个C N键中的π键。
(6)氯吡苯脲分子中含有H、C、O、N、Cl元素,其中电负性最大的是氧元素。
(7)邻羟基苯甲醛分子中醛基与羟基处于邻位,容易形成分子内氢键,导致羟基上的氢原子难以电离。
17.答案 (除标注外,每空1分)(1)O>C>H
↑↓
↑ ↑ ↑
3
(2)AD(2分)
(3)①离子 ②sp2 ③离子键、配位键、共价键(2分) NaBH4+4H2O Na[B(OH)4]+4H2↑(2分)
解析 (1)组成青蒿素的元素为H、C、O,元素的非金属性越强,电负性越大,元素的非金属性:O>C>H,所以电负性由大到小的顺序是O>C>H;基态N原子的价电子排布式为2s22p3,则价电子的轨道表示式为
↑↓
↑ ↑ ↑
;
基态O原子的核外电子排布式为1s22s22p4,其中有3个轨道有成对电子,即核外存在3对自旋状态不同的电子。
(2)青蒿素分子为极性分子,A正确;1号C原子为sp3杂化,并且连接了3个碳原子,所以所有碳原子不可能处于同一平面,B错误;CO键中含有π键,C错误;手性碳原子连有四个不同的原子或原子团,根据青蒿素的结构可知,1个青蒿素分子中含有7个手性碳原子,D正确。
(3)①NaH是由Na+、H-构成的,为离子晶体,NaH晶体中晶胞的棱长为a nm,则Na原子间最小核间距为 nm。②B(OCH3)3中每个B原子与3个O原子成键,没有孤电子对,B原子的杂化方式为sp2。③NaBH4中存在的作用力有离子键、配位键和共价键。NaBH4在热水中水解生成四羟基合硼酸钠和氢气,反应的化学方程式为NaBH4+4H2O Na[B(OH)4]+4H2↑。
18.答案 (除标注外,每空1分)(1)Cu+的价电子排布式为3d10,为全充满稳定状态,Cu2+的价电子排布式为3d9,较不稳定
(2)金属键 Cu+失去1个电子是全充满的3d10上的电子,较难失去,Ni+失去1个电子是4s1上的电子,较易失去(2分)
(3)4 sp2、sp3(2分) NH3、H2O
(4)N>O>C>H sp2、sp3(2分) 氢键
解析 (1)基态Cu+比Cu2+稳定的原因是Cu+的价电子排布式为3d10,为全充满状态,结构稳定,Cu2+的价电子排布式为3d9,较不稳定。
(2)白铜是铜镍合金,铜镍合金属于金属晶体,存在金属键;铜元素原子失去1个电子后的电子排布式为1s22s22p63s23p63d10,达到全充满稳定状态,很难失去第2个电子,而镍失去1个电子后的电子排布式为1s22s22p63s23p63d84s1,很不稳定,易失去4s的1个电子,所以第二电离能Cu>Ni。
(3)由含铜配合物结构可知,Cu2+形成4个配位键,Cu2+的配位数是4;C原子的杂化方式为sp2、sp3;C、N、O三种元素的简单氢化物中,NH3、H2O能形成氢键。
(4)H、C、N、O的第一电离能由大到小的顺序为N>O>C>H;色胺酮分子中氮原子杂化方式为sp2、sp3;CH3OH是通过氢键与色胺酮钴配合物相结合的。
19.答案 (每空2分)(1)A
(2)sp 1∶1 BCD
(3)6
(4)
解析 (1)Ca、Ba、Cu灼烧都产生不同的焰色,铁元素灼烧时不能观察到焰色,所以铁元素不能用焰色试验检验。
(2)SCN-中C原子的杂化方式为sp,含有π键和σ键的数目之比为1∶1。K4[Fe(CN)6]中钾离子与[Fe(CN)6]4-之间存在离子键,亚铁离子与CN-之间存在配位键,CN-中C与N之间存在共价键,K4[Fe(CN)6]中存在的作用力类型有离子键、配位键、共价键。
(3)Fe2+很容易与CO生成正八面体结构的配离子,说明Fe2+周围有6个配体一氧化碳,故其配位数为6。
(4)根据“切割法”可知,一个晶胞中实际包含1个氮原子和4个铁原子,故一个晶胞的质量为 g= g。
20.答案 (每空2分)(1)正四面体形
(2)sp2 7NA
(3)A
(4)①CuCl ②×
解析 R元素基态原子中,电子占据的最高电子层符号为L,占据的最高能级上只有两个自旋方向相同的电子,推知R的原子序数是6,为C元素;工业上通过分离液态空气获得X单质,推知X是N或O,由于W的原子序数介于R和X之间,所以X只能是O元素,W是N元素;Y元素原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和,所以Y是第3周期的氯元素;Z元素基态原子的最外电子层只有一个电子,其他电子层均已充满电子,则Z是Cu元素。
(1)根据上述分析可知,Y为Cl,氯原子的价电子对数为4+×(7+1-2×4)=4,没有孤电子对,故Cl的空间构型是正四面体形。
(2)结构简式为RX(WH2)2的化合物是CO(NH2)2,C原子采取sp2杂化;1个CO(NH2)2分子中含有σ键的个数为7,则1 mol CO(NH2)2分子中含有σ键的数目为7NA。
(3)在[Cu(NH3)4]SO4中,[Cu(NH3)4]2+与S之间形成离子键,Cu2+与NH3之间形成配位键,NH3中N原子与H原子之间形成极性键,故A正确;在[Cu(NH3)4]2+中Cu2+提供空轨道,N提供孤电子对,故B错误;[Cu(NH3)4]SO4的组成元素中第一电离能最大的是氮元素,故C错误。
(4)①Y、Z分别为Cl、Cu,根据晶胞结构可知,Cl在晶胞中占据的位置是8个顶点、6个面心,一个晶胞中含有8×+6×=4个Cl原子;Cu在晶胞内部,全部属于晶胞,一个晶胞中含有4个Cu原子,则该晶体的化学式为CuCl;②设棱长为a cm,该晶体的密度ρ g·cm-3== g·cm-3= g·cm-3,则a=,该晶胞类似于金刚石的晶胞,Cu和Cl最短的距离是体对角线长的,为× cm。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024鲁教版高中化学选择性必修2同步
全书综合测评
1.全卷满分100分 考试用时90分钟。
2.可能用到的相对原子质量:H 1 C 12 N 14 O 16 P 31 Cl 35.5 Fe 56 Cu 64 Ag 108。
一、选择题(本题共10小题,每小题2分,共20分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.化学与生产、生活、科技等密切相关。下列说法正确的是( )
A.冬奥会部分场馆建筑应用了新材料碲化镉发电玻璃,碲和镉均属于过渡元素
B.近年来的材料新宠——石墨烯,其与金刚石互为同位素
C.用干冰作为制冷剂,干冰升华过程中破坏了共价键
D.焰火、激光都与原子核外电子跃迁释放能量有关
2.2021年诺贝尔化学奖颁给了“在不对称催化方面”做出突出贡献的两位科学家,脯氨酸()是不对称有机催化剂中的一种。下列关于脯氨酸分子的说法错误的是( )
A.该分子为极性分子
B.分子中所有原子可能共面
C.分子中存在手性碳原子
D.可形成分子内氢键
3.“点击化学”又称为“链接化学”“速配接合组合式化学”,是指借助标准“接口”模块化组装的一类反应。如图为“点击化学”的一种反应,下列关于Ⅰ~Ⅲ三种物质的说法正确的是(已知NA为阿伏加德罗常数的值)( )
A.Ⅰ中所含元素中O元素的电负性最大
B.1 molⅡ分子中含有σ键个数为9NA
C.Ⅲ中碳氧键的键长相等
D.Ⅲ中含有手性碳原子
4.嘌呤类是含有氮的杂环结构的一类化合物,一种平面形结构如图所示。下列说法错误的是( )
A.分子结构中C和N原子的杂化方式均为sp2
B.所含元素的电负性:N>C>H
C.轨道之间的夹角∠1比∠2大
D.分子间可以形成氢键使嘌呤分子变得更稳定
5.细胞膜中一种磷脂的结构如图所示。下列说法错误的是( )
A.该磷脂中含极性键和非极性键
B.该化合物中只有一个手性碳原子
C.该化合物中N和P的杂化方式相同
D.该磷脂形成的晶体是离子晶体
6.某种具有高效率电子传输性能的有机发光材料的结构简式如图所示。下列关于该材料组成元素的说法错误的是( )
A.五种组成元素中有四种元素位于p区且均位于同一周期
B.原子半径:Al>C>N>O>H
C.简单氢化物的稳定性:H2O>NH3>CH4
D.基态N原子核外有7种运动状态不同的电子
7.无公害肥料的主要成分是氰氨化钙(CaCN2),CaCN2的制备原理为CaCO3+2HCN CaCN2+CO↑+H2↑+CO2↑,下列叙述正确的是( )
A.第一电离能:S>P>Si
B.C、HCN中碳原子的杂化方式相同
C.CaCN2和CO2中所含化学键的类型相同
D.CaCN2晶体熔化时破坏的是离子键
8.短周期元素X、Y、Z的原子序数依次增大,X元素基态原子有2个未成对电子,Y元素基态原子的核外p电子比s电子少1个,Z的一种超原子具有40个价电子。下列说法错误的是( )
A.X的空间结构为平面三角形
B.简单离子半径:Y
D.Z晶体含金属键,具有良好的延展性、导电性、导热性
9.下列说法正确的是( )
A.凡AB3型的共价化合物,其中心原子A均采取sp3杂化
B.著名的硫氮化合物分子(如图所示)中只含有极性共价键
C.CO2、HClO、HCHO分子中都既有σ键又有π键
D.C—H键比Si—H键的键长短,故CH4比SiH4更稳定
10.1-乙基-3-甲基咪唑四氟硼酸盐是一种常见的离子液体(结构如图),其环状结构中存在大π键。下列说法正确的是 ( )
A.阳离子中碳原子采用sp2、sp3杂化
B.B的空间结构为平面正方形
C.该化合物形成的晶体属于分子晶体
D.该化合物中存在离子键、配位键和氢键
二、选择题(本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全都选对得4分,选对但不全的得2分,有选错的得0分)
11.短周期元素X、Y、Z、M原子序数依次增大,Z的基态原子2p轨道半充满,M的最高正价与最低负价绝对值之差为4,它们组成的一种分子结构如图。下列说法正确的是( )
A.电负性:X>Y>Z
B.原子半径:Y>Z>X
C.分子中Z原子的杂化方式均为sp3
D.Y、Z、M的最高价氧化物的水化物均为强酸
12.《科学在线》发表了武汉大学科研团队利用新型Fe基复合催化剂高效抑制CO2生成,实现水煤气(主要成分为CO和H2)直接制取烯烃的研究成果,原理如图所示。下列说法错误的是( )
A.水中存在氢键,所以CO2、H2O形成的晶体类型不同
B.每个Fe(CO)5分子中含有10个σ键
C.CO2分子和乙烯分子中C原子的杂化方式不同
D.CO2和H2O晶体中键的极性和分子的极性相同
13.在TiCl3的饱和溶液中通入适量HCl,再加入乙醚生成绿色晶体,如果不加入乙醚,直接通入HCl得到的是紫色晶体,已知两种晶体分子式均为TiCl3·6H2O,配位数都是6。分别取0.01 mol两种晶体,在水溶液中用过量AgNO3处理,绿色晶体得到的白色沉淀质量为紫色晶体得到白色沉淀质量的,则下列有关说法不正确的是( )
A.该绿色晶体配体是氯离子和水,它们物质的量之比为5∶1
B.紫色晶体配合物的化学式为[Ti(H2O)6]Cl3
C.上述两种晶体的分子式相同,但结构不同,所以性质不同
D.0.01 mol紫色晶体在水溶液中与过量AgNO3作用最多可得到2.87 g沉淀
14.常温下,W、X、Y、Z四种短周期元素的最高价氧化物对应的水化物溶液(浓度均为0.01 mol·L-1)的pH和原子半径、原子序数的关系如图所示。下列说法错误的是( )
A.第一电离能:W>Z>Y>X
B.简单离子的半径:Y>Z>W>X
C.W的氢化物空间构型不一定是三角锥形
D.Z的单质具有强氧化性和漂白性
15.砷化镉晶胞结构如图,图中①和②位是“真空”,晶胞参数为a pm,建立如图所示的原子坐标系,①号位的坐标为(,,)。已知:砷化镉的摩尔质量为M g·mol-1,NA为阿伏加德罗常数的值。下列说法错误的是( )
A.砷化镉中Cd与As原子个数比为3∶2
B.两个Cd原子间最短距离为0.5a pm
C.③号原子坐标参数为(,1,)
D.该晶体的密度为 g·cm-3
三、非选择题(本题共5小题,共60分)
16.(12分)氯吡苯脲的相关信息如表所示:
分子式 C12H10ClN3O
结构简式
外观 白色结晶粉末
熔点 170~172 ℃
溶解性 易溶于水
(1)氯元素基态原子核外电子的未成对电子数为 。
(2)氯吡苯脲固体中,氮原子的杂化方式为 。
(3)氯吡苯脲固体中,存在的作用力类型有 (填字母)。
A.离子键 B.金属键 C.共价键 D.配位键 E.氢键
(4)氯吡苯脲易溶于水的原因是 。
(5)查文献可知,可用2-氯-4-氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲。
+
设NA为阿伏加德罗常数的值,反应过程中,每生成1 mol氯吡苯脲,断裂化学键的数目为 。
(6)构成氯吡苯脲的元素中,电负性最大的是 (填元素符号)。
(7)已知苯酚中苯环上连接的—OH能电离出H+(),苯酚的酸性大于(邻羟基苯甲醛),其原因是 。
17.(12分)青蒿素(C15H22O5)的结构如图甲所示。请回答下列问题:
甲
乙
丙
(1)组成青蒿素的三种元素电负性由大到小的顺序是 ;画出基态N原子价电子的轨道表示式: ;在基态O原子中,核外存在 对自旋状态不同的电子。
(2)下列关于青蒿素的说法正确的是 (填字母)。
A.青蒿素分子属于极性分子
B.在青蒿素分子中,所有碳原子均处于同一平面
C.图中数字标记的五个碳原子均只以σ键与其他原子成键
D.1个青蒿素分子中含有7个手性碳原子
(3)在确定青蒿素结构的过程中,可采用硼氢化钠(NaBH4)作为还原剂,其制备原理为4NaH+B(OCH3)3 NaBH4+3CH3ONa。
①NaH为 晶体,图乙是NaH晶体的晶胞结构,若晶胞棱长为a nm,则Na原子间最小核间距为 nm。
②B(OCH3)3中B原子采用的杂化方式是 。
③NaBH4结构如图丙所示,NaBH4中存在的作用力有 。NaBH4是有机化学中的一种常用还原剂,其在热水中水解生成四羟基合硼酸钠和氢气,该反应的化学方程式为 。
18.(12分)铜是人类最早使用的金属之一,铜的使用对早期人类文明的进步影响深远。按要求回答下列问题:
(1)基态Cu+比Cu2+稳定的原因是 。
(2)白铜是铜镍合金,呈银白色,有金属光泽,白铜中存在的化学键是 ;元素铜与镍的第二电离能分别为1 958 kJ·mol-1、1 753 kJ·mol-1,铜的第二电离能大于镍的原因是 。
(3)某含铜配合物的结构简式如图所示,其中Cu2+的配位数是 ,C原子的杂化方式为 ;C、N、O三种元素的简单氢化物中能形成氢键的是 (填化学式)。
(4)以甲醇为溶剂,Co2+可与色胺酮分子配位结合形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示)。色胺酮分子中所含元素(H、C、N、O)第一电离能由大到小的顺序为 ,色氨酮分子中N原子的杂化方式为 。X射线衍射分析显示色胺酮钴配合物晶胞中还含有一个CH3OH分子,CH3OH是通过 (填作用力名称)与色胺酮钴配合物相结合的。
19.(12分)联合国宣布2019年是“国际化学元素周期表年”。回答下列问题:
(1)焰色试验是检测金属元素常用的方法,下列元素不能用焰色试验检测的是 (填字母)。
A.Fe B.Cu C.Ba D.Ca
(2)KSCN、K4[Fe(CN)6]是实验室常用的试剂。KSCN中C原子的杂化方式为 ,SCN-中π键和σ键的数目之比为 ,K4[Fe(CN)6]中存在的作用力类型有 (填字母)。
A.金属键 B.离子键 C.共价键
D.配位键 E.氢键 F.范德华力
(3)人体正常的血红蛋白中含有Fe2+,但Fe2+很容易与CO生成正八面体结构的配离子而使血红蛋白失去携带氧气的功能,
则该配离子中配位数是 。
(4)铁氮化合物的一种晶胞结构如图所示,一个该晶胞的质量为 g。(用NA表示阿伏加德罗常数的值)
20.(12分)周期表中前四周期元素R、W、X、Y、Z的原子序数依次增大。R元素基态原子中,电子占据的最高电子层符号为L,占据的最高能级上只有两个自旋方向相同的电子。工业上通过分离液态空气获得X单质。Y元素原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和。Z元素基态原子的最外电子层只有一个电子,其他电子层均已充满电子。请回答下列问题:
(1)Y的空间构型是 。
(2)结构简式为RX(WH2)2的化合物中R原子的杂化轨道类型为 ;1 mol RX(WH2)2分子中含有σ键的数目为 。(H为氢元素,下同)
(3)往Z的硫酸盐溶液中通入过量的WH3,可生成[Z(WH3)4]SO4,下列说法正确的是 (填字母)。
A.[Z(WH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Z(WH3)4]2+中Z2+提供孤电子对,WH3提供空轨道
C.[Z(WH3)4]SO4的组成元素中第一电离能最大的是氧元素
(4)某Y与Z形成的化合物的晶胞结构如图所示(代表Z原子)。
①该晶体的化学式为 。
②已知该晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则该晶体中Z原子和Y原子之间的最短距离为
cm(列出计算式即可)(Z原子位于体对角线上)。
答案与解析
1.D 2.B 3.A 4.D 5.D 6.A 7.D 8.B
9.D 10.A 11.BC 12.AD 13.AD 14.D 15.D
1.D 碲属于ⅥA族元素,不属于过渡元素,故A错误;金刚石、石墨烯是由碳元素组成的单质,互为同素异形体,故B错误;干冰升华过程中,只发生状态的改变,破坏了分子间作用力,不破坏共价键,故C错误;焰火、激光的产生与原子核外电子跃迁释放能量有关,故D正确。
2.B 脯氨酸分子中存在sp3杂化的碳原子,故分子中所有原子不可能共面,B项错误。
3.A Ⅰ分子中含有的元素为C、H、O、N,其中电负性最大的元素为O元素,故A正确;一个Ⅱ分子中含有σ键的个数为14,则1 mol Ⅱ分子中含有σ键的个数为14NA,故B错误;Ⅲ中存在碳氧单键和碳氧双键,键长不相等,故C错误;Ⅲ中采取sp3杂化的碳原子都连接2个H原子,所以Ⅲ分子中不含有手性碳原子,故D错误。
4.D 该分子是一种平面形结构,则C和N原子的杂化方式均为sp2,A正确;电负性:N>C>H,B正确;由于孤电子对和成键电子对之间的排斥力大于成键电子对之间的排斥力,所以轨道之间的夹角∠1比∠2大,C正确;氢键只影响物质的物理性质,与分子的稳定性无关,D错误。
5.D 该磷脂中有碳碳非极性键及碳氧键、碳氮键、碳磷键、碳氢键等极性键,A正确;磷脂分子结构中有一个手性碳原子,B正确;由磷脂的结构可知,N、P均为sp3杂化,C正确;由磷脂分子结构可知,形成的晶体是分子晶体,D错误。
6.A 该物质的五种组成元素为C、N、O、Al、H,C、N、O、Al四种元素位于p区,但只有C、N、O三种元素位于同一周期,A错误;H只有一个电子层,Al有三个电子层,C、N、O均有两个电子层,同一周期主族元素从左到右原子半径逐渐减小,则原子半径Al>C>N>O>H,B正确;同一周期从左到右主族元素的非金属性逐渐增强,简单氢化物的稳定性也逐渐增强,故简单氢化物的稳定性:H2O>NH3>CH4,C正确;N原子核外有7个电子,每一个电子的运动状态都不同,即基态N原子核外有7种运动状态不同的电子,D正确。
7.D 磷原子的3p轨道是半充满状态,难失电子,第一电离能P>S>Si,A错误;C中碳原子是sp2杂化、HCN中碳原子是sp杂化,B错误;CaCN2含离子键和共价键,CO2只含共价键,C错误;CaCN2属于离子晶体,熔化时破坏的是离子键,D正确。
8.B 短周期元素X、Y、Z的原子序数依次增大,Y元素基态原子的核外p电子比s电子少1个,则Y为N元素;X元素基态原子有2个未成对电子,且元素X的原子序数小于N,则X为C元素;Z的一种超原子具有40个价电子,则Z的价电子数为=3,Z为Al元素。C中心原子的价电子对数为3,不含孤电子对,空间结构为平面三角形,A正确;N3-与Al3+的核外电子排布相同,离子半径:N3->Al3+,B错误;N中心原子的价电子对数为3,不含孤电子对,采用sp2杂化,C正确;Al单质属于金属晶体,具有良好的延展性、导电性、导热性,D正确。
9.D AB3型的共价化合物,中心原子A可能采取sp3杂化,也可能采取sp2杂化,比如BF3中的B原子的价电子对数=3+(3-3×1)=3,B采取sp2杂化,故A错误;由题图可知,硫氮化合物分子中既含有极性共价键,又含有硫原子之间形成的非极性共价键,故B错误;HClO分子中只有单键,即分子中只有σ键而没有π键,故C错误;C—H键比Si—H键的键长短,C—H键的键能比Si—H键大,所以CH4比SiH4更稳定,故D正确。
10.A 阳离子中五元环上双键C原子是sp2杂化,—CH3和—CH2—上碳原子是sp3杂化,A正确;B的空间结构是正四面体形,B错误;该化合物为离子液体,不是分子晶体,一定含有离子键,B中存在配位键,其中B提供空轨道,F-提供孤电子对,不存在氢键,C、D错误。
11.BC 根据Z的基态原子2p轨道半充满,推出Z是氮元素;M的最高正价与最低负价绝对值之差为4,则M是硫元素;根据短周期元素X、Y、Z、M原子序数依次增大及它们组成的分子结构图推出X是氢元素,Y是碳元素。电负性X
12.AD CO2、H2O形成的晶体都是分子晶体,A错误;Fe(CO)5分子中,每个配体CO存在1个σ键,配体与Fe形成5个配位键,也是σ键,所以每个Fe(CO)5分子中共含有10个σ键,B正确;CO2分子的中心原子C原子采取sp杂化,乙烯分子的中心原子C原子采取sp2杂化,C正确;CO2和H2O中均存在极性键,CO2是非极性分子,H2O是极性分子,D错误。
13.AD 根据题意分析,1个绿色晶体配合物外界含2个氯离子,该晶体配合物的化学式为[TiCl(H2O)5]Cl2·H2O,该绿色晶体配体是氯离子和水,它们物质的量之比为1∶5,A错误;1个紫色晶体配合物外界含3个氯离子,配位数是6,紫色晶体配合物的化学式为[Ti(H2O)6]Cl3,B正确;两种晶体的结构不同,所以性质不同,C正确;1个紫色晶体配合物外界含3个氯离子,0.01 mol紫色晶体在水溶液中与过量AgNO3作用最多可得到0.03 mol AgCl沉淀,沉淀质量为0.03 mol×143.5 g·mol-1=4.305 g,D错误。
14.D 据图可知,0.01 mol·L-1W、Z的最高价氧化物对应的水化物溶液pH均为2,均为一元强酸,应为HNO3和HClO4,再结合原子半径W
15.D 一个晶胞中As个数为8×+6×=4,Cd的个数为6,砷化镉中Cd与As原子个数比为6∶4=3∶2,A正确;由图示晶胞可知,两个Cd原子间最短距离为0.5a pm,B正确;由图示可知,③号原子位于右侧面的面心上,原子坐标参数为(,1,),C正确;一个晶胞中含有6个Cd和4个As,即含有2个As2Cd3,该晶体的密度为 g·cm-3,D错误。
16.答案 (除标注外,每空2分)(1)1(1分)
(2)sp2、sp3
(3)CE
(4)氯吡苯脲可以与水分子形成氢键
(5)2NA
(6)O(1分)
(7)邻羟基苯甲醛会形成分子内氢键,使得羟基上的氢原子难以电离
解析 (1)氯元素基态原子的核外电子排布式是1s22s22p63s23p5,所以未成对电子数为1。
(2)根据氯吡苯脲的结构简式可知,有2个氮原子各形成3个单键,且它们各有1对孤电子对,属于sp3杂化,另外1个氮原子形成双键和单键,属于sp2杂化。
(3)氯吡苯脲分子为共价化合物,分子内存在共价键。由于氯吡苯脲分子中含—NH—,故分子间能形成氢键。
(4)氯吡苯脲能与水分子形成氢键,使其在水中的溶解度增大,所以易溶于水。
(5)由于单键都是σ键,1个双键是由1个σ键和1个π键构成的,所以根据反应的化学方程式可知,每生成
1 mol氯吡苯脲,断裂NA个N—H σ键和NA个C N键中的π键。
(6)氯吡苯脲分子中含有H、C、O、N、Cl元素,其中电负性最大的是氧元素。
(7)邻羟基苯甲醛分子中醛基与羟基处于邻位,容易形成分子内氢键,导致羟基上的氢原子难以电离。
17.答案 (除标注外,每空1分)(1)O>C>H
↑↓
↑ ↑ ↑
3
(2)AD(2分)
(3)①离子 ②sp2 ③离子键、配位键、共价键(2分) NaBH4+4H2O Na[B(OH)4]+4H2↑(2分)
解析 (1)组成青蒿素的元素为H、C、O,元素的非金属性越强,电负性越大,元素的非金属性:O>C>H,所以电负性由大到小的顺序是O>C>H;基态N原子的价电子排布式为2s22p3,则价电子的轨道表示式为
↑↓
↑ ↑ ↑
;
基态O原子的核外电子排布式为1s22s22p4,其中有3个轨道有成对电子,即核外存在3对自旋状态不同的电子。
(2)青蒿素分子为极性分子,A正确;1号C原子为sp3杂化,并且连接了3个碳原子,所以所有碳原子不可能处于同一平面,B错误;CO键中含有π键,C错误;手性碳原子连有四个不同的原子或原子团,根据青蒿素的结构可知,1个青蒿素分子中含有7个手性碳原子,D正确。
(3)①NaH是由Na+、H-构成的,为离子晶体,NaH晶体中晶胞的棱长为a nm,则Na原子间最小核间距为 nm。②B(OCH3)3中每个B原子与3个O原子成键,没有孤电子对,B原子的杂化方式为sp2。③NaBH4中存在的作用力有离子键、配位键和共价键。NaBH4在热水中水解生成四羟基合硼酸钠和氢气,反应的化学方程式为NaBH4+4H2O Na[B(OH)4]+4H2↑。
18.答案 (除标注外,每空1分)(1)Cu+的价电子排布式为3d10,为全充满稳定状态,Cu2+的价电子排布式为3d9,较不稳定
(2)金属键 Cu+失去1个电子是全充满的3d10上的电子,较难失去,Ni+失去1个电子是4s1上的电子,较易失去(2分)
(3)4 sp2、sp3(2分) NH3、H2O
(4)N>O>C>H sp2、sp3(2分) 氢键
解析 (1)基态Cu+比Cu2+稳定的原因是Cu+的价电子排布式为3d10,为全充满状态,结构稳定,Cu2+的价电子排布式为3d9,较不稳定。
(2)白铜是铜镍合金,铜镍合金属于金属晶体,存在金属键;铜元素原子失去1个电子后的电子排布式为1s22s22p63s23p63d10,达到全充满稳定状态,很难失去第2个电子,而镍失去1个电子后的电子排布式为1s22s22p63s23p63d84s1,很不稳定,易失去4s的1个电子,所以第二电离能Cu>Ni。
(3)由含铜配合物结构可知,Cu2+形成4个配位键,Cu2+的配位数是4;C原子的杂化方式为sp2、sp3;C、N、O三种元素的简单氢化物中,NH3、H2O能形成氢键。
(4)H、C、N、O的第一电离能由大到小的顺序为N>O>C>H;色胺酮分子中氮原子杂化方式为sp2、sp3;CH3OH是通过氢键与色胺酮钴配合物相结合的。
19.答案 (每空2分)(1)A
(2)sp 1∶1 BCD
(3)6
(4)
解析 (1)Ca、Ba、Cu灼烧都产生不同的焰色,铁元素灼烧时不能观察到焰色,所以铁元素不能用焰色试验检验。
(2)SCN-中C原子的杂化方式为sp,含有π键和σ键的数目之比为1∶1。K4[Fe(CN)6]中钾离子与[Fe(CN)6]4-之间存在离子键,亚铁离子与CN-之间存在配位键,CN-中C与N之间存在共价键,K4[Fe(CN)6]中存在的作用力类型有离子键、配位键、共价键。
(3)Fe2+很容易与CO生成正八面体结构的配离子,说明Fe2+周围有6个配体一氧化碳,故其配位数为6。
(4)根据“切割法”可知,一个晶胞中实际包含1个氮原子和4个铁原子,故一个晶胞的质量为 g= g。
20.答案 (每空2分)(1)正四面体形
(2)sp2 7NA
(3)A
(4)①CuCl ②×
解析 R元素基态原子中,电子占据的最高电子层符号为L,占据的最高能级上只有两个自旋方向相同的电子,推知R的原子序数是6,为C元素;工业上通过分离液态空气获得X单质,推知X是N或O,由于W的原子序数介于R和X之间,所以X只能是O元素,W是N元素;Y元素原子的最外层电子数与电子层数之积等于R、W、X三种元素的原子序数之和,所以Y是第3周期的氯元素;Z元素基态原子的最外电子层只有一个电子,其他电子层均已充满电子,则Z是Cu元素。
(1)根据上述分析可知,Y为Cl,氯原子的价电子对数为4+×(7+1-2×4)=4,没有孤电子对,故Cl的空间构型是正四面体形。
(2)结构简式为RX(WH2)2的化合物是CO(NH2)2,C原子采取sp2杂化;1个CO(NH2)2分子中含有σ键的个数为7,则1 mol CO(NH2)2分子中含有σ键的数目为7NA。
(3)在[Cu(NH3)4]SO4中,[Cu(NH3)4]2+与S之间形成离子键,Cu2+与NH3之间形成配位键,NH3中N原子与H原子之间形成极性键,故A正确;在[Cu(NH3)4]2+中Cu2+提供空轨道,N提供孤电子对,故B错误;[Cu(NH3)4]SO4的组成元素中第一电离能最大的是氮元素,故C错误。
(4)①Y、Z分别为Cl、Cu,根据晶胞结构可知,Cl在晶胞中占据的位置是8个顶点、6个面心,一个晶胞中含有8×+6×=4个Cl原子;Cu在晶胞内部,全部属于晶胞,一个晶胞中含有4个Cu原子,则该晶体的化学式为CuCl;②设棱长为a cm,该晶体的密度ρ g·cm-3== g·cm-3= g·cm-3,则a=,该晶胞类似于金刚石的晶胞,Cu和Cl最短的距离是体对角线长的,为× cm。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
