人教版 高中化学 选择性必修3 1.2研究有机化合物的一般方法(共50张PPT)
文档属性
| 名称 | 人教版 高中化学 选择性必修3 1.2研究有机化合物的一般方法(共50张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 21:04:48 | ||
图片预览







文档简介
(共50张PPT)
汇报人:XXX
XX月XX日
研究有机化合物的一般方法
人教版高中化学选择必修三
一、有机物的分离提纯
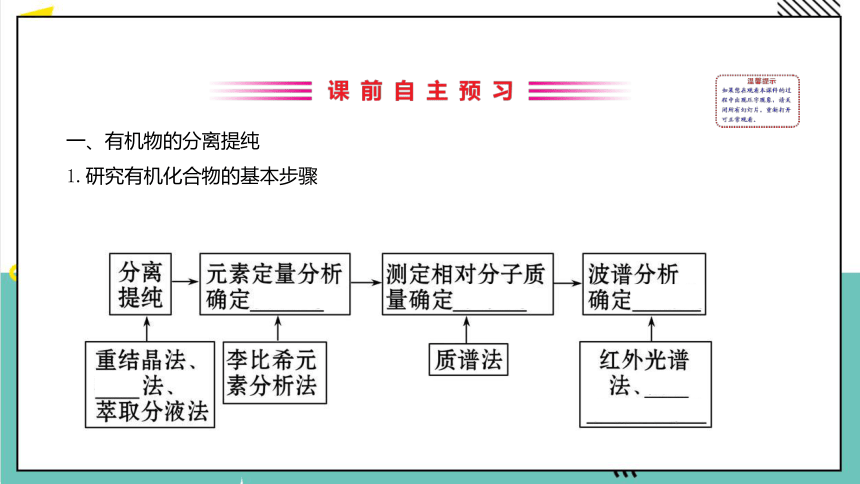
1.研究有机化合物的基本步骤
2.有机物的分离和提纯
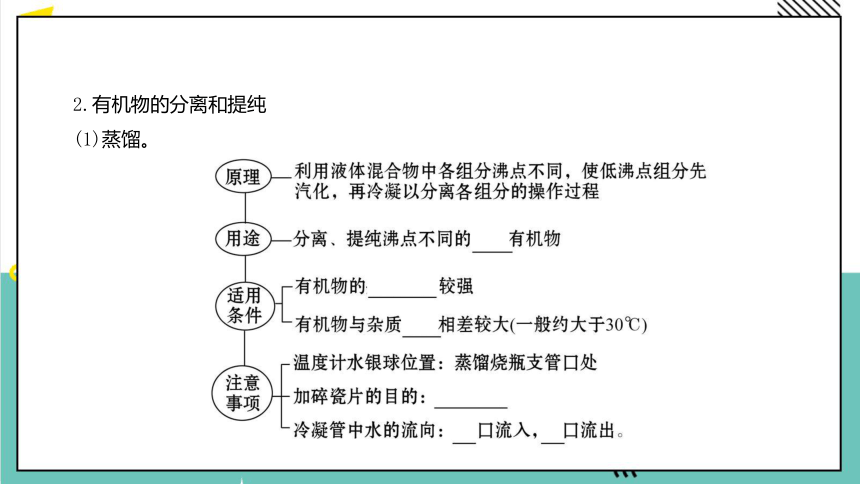
(1)蒸馏。
(2)重结晶。
①原理:利用溶质在溶剂中溶解度随温度变化不同,使
固体物质从溶液中以晶体状态析出的过程。
②用途:用于提纯_____物质。
固体
③溶剂的选择。
④装置与操作。
(3)萃取
①类型:
类型 原理
液—液萃取 利用有机物在两种_________的溶剂中的_______不
同,将有机物从一种溶剂转移到另一种溶剂的
过程。
固—液萃取 用_________从固体物质中溶解出有机物的过程。
互不相溶
溶解度
有机溶剂
②适用条件:
有机物与杂质在某种溶剂中的溶解度有较大差异。
③装置:
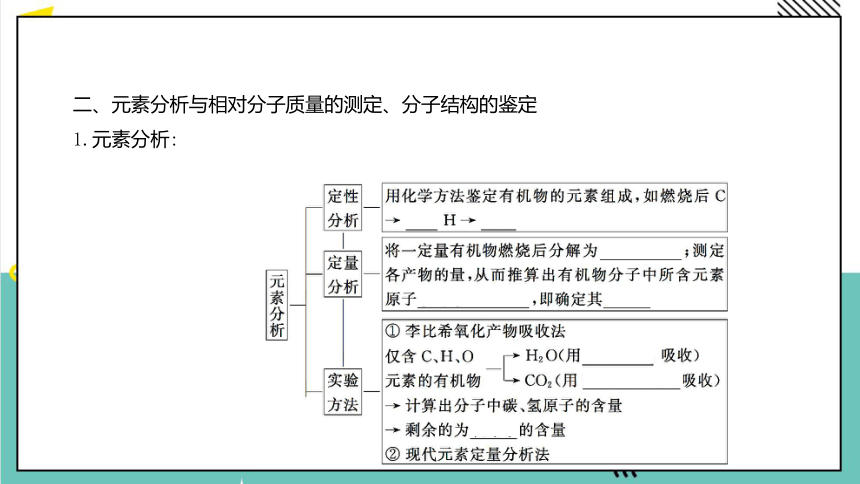
二、元素分析与相对分子质量的测定、分子结构的鉴定
1.元素分析:
2.相对分子质量的测定——质谱法:
(1)质荷比:指分子离子或碎片离子的_________与其
_____的比值。
(2)原理:质谱图中_______________即为该有机物的
相对分子质量。
相对质量
电荷
质荷比的最大值
(2)核磁共振氢谱。
①原理:处在不同化学环境中的氢原子在光谱图上出
现的_________,而且吸收峰的面积与_________成正比。
②作用:测定有机物分子中氢原子的_____和_________。
③分析:吸收峰数目=___________,吸收峰面积比=
_____________。
位置不同
氢原子数
类型
相对数目
氢原子种类
氢原子数目比
探究1 有机物的分离和提纯
【问题探究】
1.工业乙醇含水、甲醇等杂质,通过蒸馏可获得含95.6%的乙醇和 4.4%水的共沸混合物,如果要制得无水乙醇,你有什么方法
提示:要除去乙醇中的少量水,可加入生石灰与水反应生成Ca(OH)2,再用蒸馏的方法分离出纯净的乙醇,即先加入生石灰再蒸馏。
2.现拟分离乙酸乙酯、乙酸、乙醇的混合物,如图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法,在方框内填入所分离的有关物质的名称或结构。
提示:题目所给的三者为互溶的液体,CH3COOCH2CH3不溶于Na2CO3溶液,CH3COOH、CH3CH2OH均易溶,故可先用饱和Na2CO3溶液分离出CH3COOCH2CH3;此时CH3COOH转化为CH3COONa,然后利用蒸馏法得到CH3CH2OH,最后加入强酸将乙酸钠再转化为CH3COOH,蒸馏得到即可。
【探究总结】
有机物分离与提纯的常用方法
分离、提纯 的方法 目的 实例
分液 分离、提纯互不相溶的液体混合物 分离硝基苯与水
蒸馏 分离、提纯沸点相差较大的混合溶液 分离乙醛与乙醇
洗气 分离、提纯气体混合物 除去甲烷中的乙烯
分离、提纯 的方法 目的 实例
过滤 分离不溶性的固体和液体 分离硬脂酸与氯化钠
渗析 除去胶体中的小分子、离子 除去淀粉中的氯化钠、葡萄糖
盐析 胶体的分离 分离硬脂酸钠和甘油
【拓展提升】分离提纯物质的“四原则”
【探究训练】
1.现有三组混合液:(1)乙酸乙酯和乙酸钠;(2)乙醇和丁醇;(3)溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是 ( )
A.分液、萃取、蒸馏 B.萃取、分液、蒸馏
C.萃取、蒸馏、分液 D.分液、蒸馏、萃取
【解题指南】解答本题应注意以下两点:
(1)熟知常见物质的性质;
(2)明确物质分离、提纯的常用方法及其适用条件。
【解析】选D。乙酸乙酯不易溶于水,而乙酸钠易溶于水,可用分液法分离;乙醇和丁醇都易溶于水,但沸点相差较大,可用蒸馏法分离;溴化钠属于钠盐,易溶于水,而属于卤素单质的溴易溶于有机溶剂,两者可用萃取法分离。
2.选择下列实验方法分离物质,将分离、提纯方法的序号填在横线上。
A.萃取 B.升华 C.重结晶 D.分液 E.蒸馏 F.过滤 G.洗气
(1)________分离饱和食盐水与沙子的混合物;
(2)________从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
(3)________分离水和汽油的混合物;
(4)________分离CCl4(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物;
(5)________除去混在乙烷中的乙烯;
(6)________提取碘水中的碘。
【解析】沙子不溶于食盐水,采用过滤的方法即可分离;硝酸钾在水中的溶解度随温度升高明显增大而NaCl在水中的溶解度受温度影响不大,采用重结晶法然后过滤可将两者分离;水和汽油互不相溶,分层,可用分液法进行分离;CCl4和甲苯两种互溶的液体,沸点差大于30 ℃,可用蒸馏法分离;乙烯中含碳碳双键,可被溴水吸收,可用洗气的方法除去;碘在有机溶剂中溶解度大,可用萃取法提取。
答案:(1)F (2)CF (3)D (4)E (5)G (6)A
【补偿训练】
1.(2019·衡水高二检测)将CH3CHO(易溶于水,沸点为20.8 ℃的液体)和CH3COOH分离的正确方法是 ( )
A.加热蒸馏
B.加入Na2CO3后,通过萃取的方法分离
C.先加入烧碱溶液之后蒸出乙醛,再加入浓硫酸,蒸出乙酸
D.和Na反应后进行分离
【解析】选C。乙醛、乙酸均为低沸点物质,都易挥发,直接蒸馏得不到其纯净物质,分离前先将CH3COOH转化为沸点高的CH3COONa。
2.(2019·洛阳高二检测)下列实验中,所选装置不合理的是 ( )
A.粗盐提纯选①和②
B.用CCl4提取碘水中的碘,选③
C.用FeCl2溶液吸收Cl2,选⑤
D.分离Na2CO3溶液和CH3COOC2H5,选④
【解析】选D。Na2CO3溶液和CH3COOC2H5互不相溶,分离Na2CO3溶液和CH3COOC2H5应该用分液的方法,即应选用③。
3.下列实验中,所采取的分离方法与对应原理都正确的是 ( )
选项 目的 分离方法 原理
A 分离溶于水中的碘 乙醇萃取 碘在乙醇中的溶解度较大
B 分离乙酸乙酯和乙醇 分液 乙酸乙酯和乙醇的密度不同
C 除去KNO3固体中混杂的NaCl 重结晶 NaCl在水中的溶解度很大
D 除去丁醇中的乙醚 蒸馏 丁醇与乙醚的沸点相差较大
【解析】选D。乙醇与水、乙酸乙酯与乙醇互溶,A、B选项中的分离方法均错误;C选项选用重结晶法是利用KNO3的溶解度受温度变化的影响大,而NaCl的溶解度受温度变化的影响小,错误;蒸馏是利用各组分的沸点不同而采取的分离混合物的方法,D正确。
4.工业酒精是含水约4%的液态乙醇。向工业酒精中加入生石灰,会发生如下化学反应且生成物不溶于乙醇:
CaO+H2O====Ca(OH)2。
要在实验室中将工业酒精转化为无水酒精。请回答下列问题:
(1)下列做法中最不可取的是________(填写代号)。
A.加入过量的生石灰后过滤
B.加入过量的生石灰后蒸馏
C.加入过量的生石灰后分液
(2)在你选择的需要加热的实验方法中需用的玻璃仪器,除酒精灯以外,还有________;在该方法的实验步骤里,紧挨加热之前的操作是______________,
并且对此要注意的问题是________________。
(3)用酒精灯作热源,在加热的过程中要适时调整酒精灯的上下或左右位置,目的是_______________。
答案:(1)C
(2)蒸馏烧瓶、温度计、冷凝管、牛角管、锥形瓶 向冷凝管内通冷却水 使冷却水从冷凝管的下口进、上口出
(3)使蒸馏烧瓶内的支管口处保持恒温
【解析】(1)CaO和Ca(OH)2都是不溶于酒精、难挥发的固体,酒精是较易挥发的液体。
(2)实验方法是蒸馏,有关玻璃仪器,除酒精灯以外还有蒸馏烧瓶、温度计、冷凝管、牛角管和锥形瓶。在蒸馏操作中,为了使蒸馏出的蒸气及时得到冷却,要先向冷凝管内通冷却水,然后再加热。冷却水要从冷凝管的下口进、上口出。(3)做蒸馏的操作,要根据混合物组分沸点的情况,使蒸馏烧瓶内的支管口处保持恒温。温度的显示靠温度计,温度的升降可通过控制热源的强弱来实现。
探究2 元素分析与有机物分子式、结构式的确定
【问题探究】
1.有机物A蒸气的质量是相同状况下同体积乙醇蒸气的2倍。1.38 g A完全燃烧后,若将燃烧的产物通过碱石灰,碱石灰的质量增加3.06 g;若将燃烧的产物通过浓H2SO4,浓硫酸的质量增加1.08 g,试通过计算确定A的分子式。
提示:水的质量m(H2O)=1.08 g
CO2的质量m(CO2)=3.06 g-1.08 g=1.98 g
氢的质量m(H)=1.08 g× =0.12 g
碳的质量m(C)=1.98 g× =0.54 g
因m(H)+m(C)=0.12 g+0.54 g=0.66 g,0.66 g<1.38 g,
所以,该有机物中还含有O元素,其质量m(O)=1.38 g
-0.66 g=0.72 g。
因此该有机物分子中各元素原子数目比为:
N(C)∶N(H)∶N(O)=
=3∶8∶3。
则该有机物的最简式为C3H8O3,其式量为12×3+1×8+16×3=92。
有机物A的相对分子质量Mr=46×2=92,与最简式的式量相等,故A的最简式即为分子式。故该有机物的分子式为C3H8O3。
2.某有机物的红外光谱如图所示:
该有机物分子中有几种不同的化学键 它们分别是什么
提示:有三种不同的化学键,它们分别是C—H、O—H、C—O键。
3.分子式为C3H6O2的有机物,如果在PMR谱(质子核磁共振谱)上观察到的氢原子给出的峰有两种强度。一种强度比为3∶3,另一种强度比为3∶2∶1。请写出该有机物可能的结构简式。
提示:第一种峰强度比为3∶3,说明有2个—CH3,但
2个—CH3的性质不同,且连接方式有别,化合物的结
构简式为 第二种峰强度比为
3∶2∶1,说明结构中含有3种不同性质的氢,其个数
分别为3、2、1,有机物的结构简式为
4.乙醇(CH3CH2OH)和甲醚(CH3OCH3)的分子式都是C2H6O。如何鉴别这两种物质
提示:乙醇可以与Na反应放出H2,而甲醚不与Na反应,故可以用Na鉴别乙醇和甲醚;也可以用核磁共振氢谱法、红外光谱法进行鉴别。
②最简式法。
③商余法——确定烃的分子式
④化学方程式法。
利用有机反应中反应物、生成物之间“量”的关系求分子式的方法。在有机化学中,常利用有机物燃烧等方程式对分子式进行求解。常用的化学方程式有:
【探究总结】
确定有机物分子式的方法
①直接法。
有机物的密度(或相对密度)→摩尔质量→1 mol有机物中各原子的物质的量→分子式。
【拓展提升】有机物结构简式的确定
(1)根据价键规律确定。
某些有机物根据价键规律只存在一种结构,则直接根据分子式确定其结构简式。例如:C2H6,只能是CH3CH3。
(2)通过定性实验确定。
实验→有机物表现的性质及相关结论→官能团→确定结构
【探究训练】
1.(2019·淄博高二检测)某有机物在氧气中充分燃烧,生成的CO2和H2O的物质的量之比为1∶2,下列说法正确的是 ( )
A.分子中C、H、O个数之比为1∶2∶3
B.分子中C、H个数之比为1∶4
C.分子中一定含有氧原子
D.此有机物的最简式为CH4
【解析】选B。根据CO2和H2O的物质的量之比为1∶2,只能确定该有机物中C、H个数之比为1∶4,不能确定是否含有氧原子。
2.(2019·福州高二检测)如图是某有机物核磁共振氢谱图,则该有机物的结构简式是 ( )
A.CH3COOCH2CH3
B.CH3CH=CHCH3
C.CH3CH2CH3
D.CH3CHOHCH3
【解析】选A。由核磁共振氢谱图可知,该有机物中有三种类别不同的氢原子,且个数比为3∶3∶2,只有A项符合题意。
3.根据以下有关信息确定某有机物的组成:
(1)测定实验式:某含碳、氢、氧三种元素的有机物,经燃烧实验测得碳的质量分数为64.86%,氢的质量分数为13.51%,则其实验式是________。
(2)确定分子式:下图是该有机物的质谱图,则其相对分子质量为________,分子式为________。
答案:(1)C4H10O (2)74 C4H10O
【解析】(1)该有机物的分子中碳、氢、氧的原子个数比为n(C)∶n(H)∶n(O)=
=4∶10∶1,因此该有机物的实验式为C4H10O。
(2)根据质谱图中的质荷比最大的就是未知物的相对分子质量,该有机物的相对分子质量为74,因此该有机物的分子式为C4H10O。
【补偿训练】
1.(2019·镇江高二检测)如图所示是其有机物的核磁共振氢谱图,请你观察图谱,分析其可能是 ( )
A.CH3CH2CH2CH3
B.(CH3)2CHCH3
C.CH3CH2CH2OH
D.CH3CH2COOH
【解析】选C。从图看出有4组吸收峰,则有4种不同的氢原子,A.CH3CH2CH2CH3 只有2种氢原子,故A错误; B.(CH3)2CHCH3有三种氢原子,故B错误;C.CH3CH2CH2OH有四种氢原子,故C正确;D.CH3CH2COOH有三种氢原子,故D错误。
则有关该有机物的叙述正确的是 ( )
A.该有机物属于醚类
B.该有机物分子中共有5个碳原子
C.该有机物具有环状结构
D.该有机物分子中有四种化学环境不同的氢原子
【解析】选A。对称结构至少为2个,2个CH2的相对质量是28,2个CH3的相对质量是30,余基相对质量为
74-28-30=16,所以余基为O,其结构简式为CH3CH2OCH2CH3,属于醚类。
2.(2019·广州高二检测)某有机物的相对分子质量为74,其红外光谱图如下:
3.某含氧有机化合物可以作为无铅汽油的抗爆震剂,它的相对分子质量为88.0,含C的质量分数为68.2%,含H的质量分数为13.6%,红外光谱和核磁共振氢谱显示该分子中有4个甲基。请写出其结构简式________。
【解析】方法一:该有机物分子中:
N(C)= =5
N(H)= =12
N(O)= =1,故分子式为C5H12O。
再根据题意该分子中有4个甲基可得其结构简式
为
方法二:N(C)∶N(H)∶N(O)=
=5∶12∶1,则该有机物的最简式为C5H12O,其相对分子
质量为88.0,所以最简式就是分子式。
答案:
【知识图谱】
汇报人:XXX
XX月XX日
研究有机化合物的一般方法
人教版高中化学选择必修三
一、有机物的分离提纯
1.研究有机化合物的基本步骤
2.有机物的分离和提纯
(1)蒸馏。
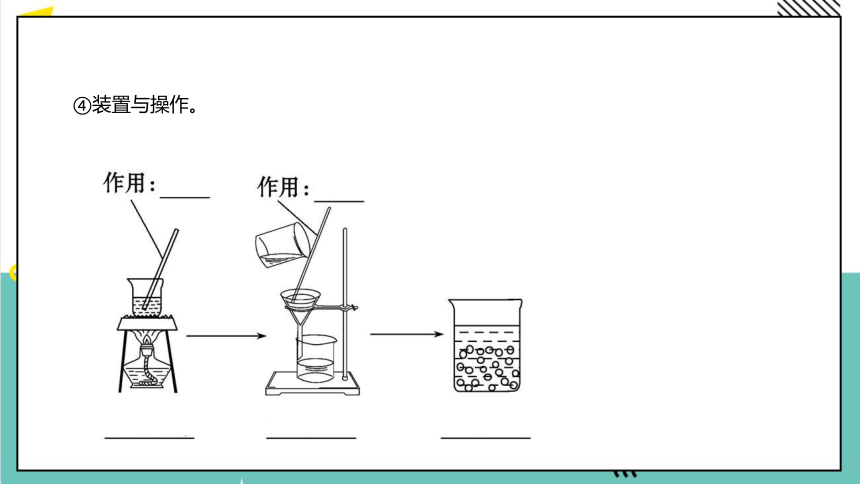
(2)重结晶。
①原理:利用溶质在溶剂中溶解度随温度变化不同,使
固体物质从溶液中以晶体状态析出的过程。
②用途:用于提纯_____物质。
固体
③溶剂的选择。
④装置与操作。
(3)萃取
①类型:
类型 原理
液—液萃取 利用有机物在两种_________的溶剂中的_______不
同,将有机物从一种溶剂转移到另一种溶剂的
过程。
固—液萃取 用_________从固体物质中溶解出有机物的过程。
互不相溶
溶解度
有机溶剂
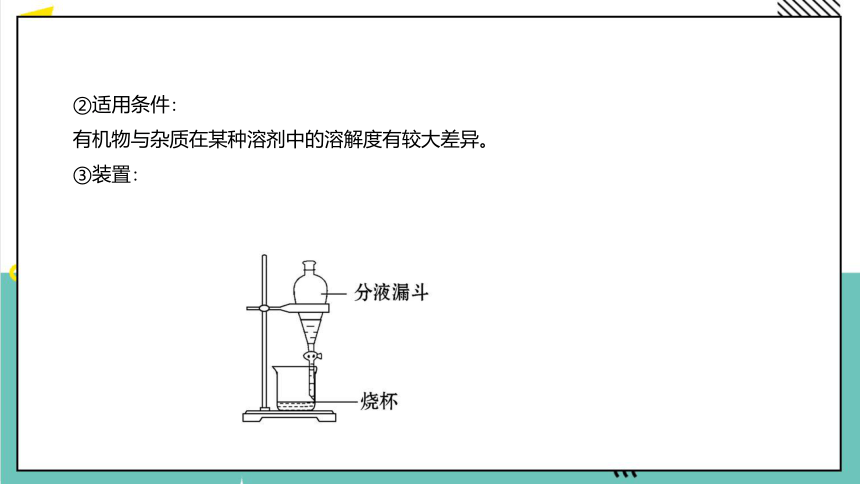
②适用条件:
有机物与杂质在某种溶剂中的溶解度有较大差异。
③装置:
二、元素分析与相对分子质量的测定、分子结构的鉴定
1.元素分析:
2.相对分子质量的测定——质谱法:
(1)质荷比:指分子离子或碎片离子的_________与其
_____的比值。
(2)原理:质谱图中_______________即为该有机物的
相对分子质量。
相对质量
电荷
质荷比的最大值
(2)核磁共振氢谱。
①原理:处在不同化学环境中的氢原子在光谱图上出
现的_________,而且吸收峰的面积与_________成正比。
②作用:测定有机物分子中氢原子的_____和_________。
③分析:吸收峰数目=___________,吸收峰面积比=
_____________。
位置不同
氢原子数
类型
相对数目
氢原子种类
氢原子数目比
探究1 有机物的分离和提纯
【问题探究】
1.工业乙醇含水、甲醇等杂质,通过蒸馏可获得含95.6%的乙醇和 4.4%水的共沸混合物,如果要制得无水乙醇,你有什么方法
提示:要除去乙醇中的少量水,可加入生石灰与水反应生成Ca(OH)2,再用蒸馏的方法分离出纯净的乙醇,即先加入生石灰再蒸馏。
2.现拟分离乙酸乙酯、乙酸、乙醇的混合物,如图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法,在方框内填入所分离的有关物质的名称或结构。
提示:题目所给的三者为互溶的液体,CH3COOCH2CH3不溶于Na2CO3溶液,CH3COOH、CH3CH2OH均易溶,故可先用饱和Na2CO3溶液分离出CH3COOCH2CH3;此时CH3COOH转化为CH3COONa,然后利用蒸馏法得到CH3CH2OH,最后加入强酸将乙酸钠再转化为CH3COOH,蒸馏得到即可。
【探究总结】
有机物分离与提纯的常用方法
分离、提纯 的方法 目的 实例
分液 分离、提纯互不相溶的液体混合物 分离硝基苯与水
蒸馏 分离、提纯沸点相差较大的混合溶液 分离乙醛与乙醇
洗气 分离、提纯气体混合物 除去甲烷中的乙烯
分离、提纯 的方法 目的 实例
过滤 分离不溶性的固体和液体 分离硬脂酸与氯化钠
渗析 除去胶体中的小分子、离子 除去淀粉中的氯化钠、葡萄糖
盐析 胶体的分离 分离硬脂酸钠和甘油
【拓展提升】分离提纯物质的“四原则”
【探究训练】
1.现有三组混合液:(1)乙酸乙酯和乙酸钠;(2)乙醇和丁醇;(3)溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是 ( )
A.分液、萃取、蒸馏 B.萃取、分液、蒸馏
C.萃取、蒸馏、分液 D.分液、蒸馏、萃取
【解题指南】解答本题应注意以下两点:
(1)熟知常见物质的性质;
(2)明确物质分离、提纯的常用方法及其适用条件。
【解析】选D。乙酸乙酯不易溶于水,而乙酸钠易溶于水,可用分液法分离;乙醇和丁醇都易溶于水,但沸点相差较大,可用蒸馏法分离;溴化钠属于钠盐,易溶于水,而属于卤素单质的溴易溶于有机溶剂,两者可用萃取法分离。
2.选择下列实验方法分离物质,将分离、提纯方法的序号填在横线上。
A.萃取 B.升华 C.重结晶 D.分液 E.蒸馏 F.过滤 G.洗气
(1)________分离饱和食盐水与沙子的混合物;
(2)________从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
(3)________分离水和汽油的混合物;
(4)________分离CCl4(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物;
(5)________除去混在乙烷中的乙烯;
(6)________提取碘水中的碘。
【解析】沙子不溶于食盐水,采用过滤的方法即可分离;硝酸钾在水中的溶解度随温度升高明显增大而NaCl在水中的溶解度受温度影响不大,采用重结晶法然后过滤可将两者分离;水和汽油互不相溶,分层,可用分液法进行分离;CCl4和甲苯两种互溶的液体,沸点差大于30 ℃,可用蒸馏法分离;乙烯中含碳碳双键,可被溴水吸收,可用洗气的方法除去;碘在有机溶剂中溶解度大,可用萃取法提取。
答案:(1)F (2)CF (3)D (4)E (5)G (6)A
【补偿训练】
1.(2019·衡水高二检测)将CH3CHO(易溶于水,沸点为20.8 ℃的液体)和CH3COOH分离的正确方法是 ( )
A.加热蒸馏
B.加入Na2CO3后,通过萃取的方法分离
C.先加入烧碱溶液之后蒸出乙醛,再加入浓硫酸,蒸出乙酸
D.和Na反应后进行分离
【解析】选C。乙醛、乙酸均为低沸点物质,都易挥发,直接蒸馏得不到其纯净物质,分离前先将CH3COOH转化为沸点高的CH3COONa。
2.(2019·洛阳高二检测)下列实验中,所选装置不合理的是 ( )
A.粗盐提纯选①和②
B.用CCl4提取碘水中的碘,选③
C.用FeCl2溶液吸收Cl2,选⑤
D.分离Na2CO3溶液和CH3COOC2H5,选④
【解析】选D。Na2CO3溶液和CH3COOC2H5互不相溶,分离Na2CO3溶液和CH3COOC2H5应该用分液的方法,即应选用③。
3.下列实验中,所采取的分离方法与对应原理都正确的是 ( )
选项 目的 分离方法 原理
A 分离溶于水中的碘 乙醇萃取 碘在乙醇中的溶解度较大
B 分离乙酸乙酯和乙醇 分液 乙酸乙酯和乙醇的密度不同
C 除去KNO3固体中混杂的NaCl 重结晶 NaCl在水中的溶解度很大
D 除去丁醇中的乙醚 蒸馏 丁醇与乙醚的沸点相差较大
【解析】选D。乙醇与水、乙酸乙酯与乙醇互溶,A、B选项中的分离方法均错误;C选项选用重结晶法是利用KNO3的溶解度受温度变化的影响大,而NaCl的溶解度受温度变化的影响小,错误;蒸馏是利用各组分的沸点不同而采取的分离混合物的方法,D正确。
4.工业酒精是含水约4%的液态乙醇。向工业酒精中加入生石灰,会发生如下化学反应且生成物不溶于乙醇:
CaO+H2O====Ca(OH)2。
要在实验室中将工业酒精转化为无水酒精。请回答下列问题:
(1)下列做法中最不可取的是________(填写代号)。
A.加入过量的生石灰后过滤
B.加入过量的生石灰后蒸馏
C.加入过量的生石灰后分液
(2)在你选择的需要加热的实验方法中需用的玻璃仪器,除酒精灯以外,还有________;在该方法的实验步骤里,紧挨加热之前的操作是______________,
并且对此要注意的问题是________________。
(3)用酒精灯作热源,在加热的过程中要适时调整酒精灯的上下或左右位置,目的是_______________。
答案:(1)C
(2)蒸馏烧瓶、温度计、冷凝管、牛角管、锥形瓶 向冷凝管内通冷却水 使冷却水从冷凝管的下口进、上口出
(3)使蒸馏烧瓶内的支管口处保持恒温
【解析】(1)CaO和Ca(OH)2都是不溶于酒精、难挥发的固体,酒精是较易挥发的液体。
(2)实验方法是蒸馏,有关玻璃仪器,除酒精灯以外还有蒸馏烧瓶、温度计、冷凝管、牛角管和锥形瓶。在蒸馏操作中,为了使蒸馏出的蒸气及时得到冷却,要先向冷凝管内通冷却水,然后再加热。冷却水要从冷凝管的下口进、上口出。(3)做蒸馏的操作,要根据混合物组分沸点的情况,使蒸馏烧瓶内的支管口处保持恒温。温度的显示靠温度计,温度的升降可通过控制热源的强弱来实现。
探究2 元素分析与有机物分子式、结构式的确定
【问题探究】
1.有机物A蒸气的质量是相同状况下同体积乙醇蒸气的2倍。1.38 g A完全燃烧后,若将燃烧的产物通过碱石灰,碱石灰的质量增加3.06 g;若将燃烧的产物通过浓H2SO4,浓硫酸的质量增加1.08 g,试通过计算确定A的分子式。
提示:水的质量m(H2O)=1.08 g
CO2的质量m(CO2)=3.06 g-1.08 g=1.98 g
氢的质量m(H)=1.08 g× =0.12 g
碳的质量m(C)=1.98 g× =0.54 g
因m(H)+m(C)=0.12 g+0.54 g=0.66 g,0.66 g<1.38 g,
所以,该有机物中还含有O元素,其质量m(O)=1.38 g
-0.66 g=0.72 g。
因此该有机物分子中各元素原子数目比为:
N(C)∶N(H)∶N(O)=
=3∶8∶3。
则该有机物的最简式为C3H8O3,其式量为12×3+1×8+16×3=92。
有机物A的相对分子质量Mr=46×2=92,与最简式的式量相等,故A的最简式即为分子式。故该有机物的分子式为C3H8O3。
2.某有机物的红外光谱如图所示:
该有机物分子中有几种不同的化学键 它们分别是什么
提示:有三种不同的化学键,它们分别是C—H、O—H、C—O键。
3.分子式为C3H6O2的有机物,如果在PMR谱(质子核磁共振谱)上观察到的氢原子给出的峰有两种强度。一种强度比为3∶3,另一种强度比为3∶2∶1。请写出该有机物可能的结构简式。
提示:第一种峰强度比为3∶3,说明有2个—CH3,但
2个—CH3的性质不同,且连接方式有别,化合物的结
构简式为 第二种峰强度比为
3∶2∶1,说明结构中含有3种不同性质的氢,其个数
分别为3、2、1,有机物的结构简式为
4.乙醇(CH3CH2OH)和甲醚(CH3OCH3)的分子式都是C2H6O。如何鉴别这两种物质
提示:乙醇可以与Na反应放出H2,而甲醚不与Na反应,故可以用Na鉴别乙醇和甲醚;也可以用核磁共振氢谱法、红外光谱法进行鉴别。
②最简式法。
③商余法——确定烃的分子式
④化学方程式法。
利用有机反应中反应物、生成物之间“量”的关系求分子式的方法。在有机化学中,常利用有机物燃烧等方程式对分子式进行求解。常用的化学方程式有:
【探究总结】
确定有机物分子式的方法
①直接法。
有机物的密度(或相对密度)→摩尔质量→1 mol有机物中各原子的物质的量→分子式。
【拓展提升】有机物结构简式的确定
(1)根据价键规律确定。
某些有机物根据价键规律只存在一种结构,则直接根据分子式确定其结构简式。例如:C2H6,只能是CH3CH3。
(2)通过定性实验确定。
实验→有机物表现的性质及相关结论→官能团→确定结构
【探究训练】
1.(2019·淄博高二检测)某有机物在氧气中充分燃烧,生成的CO2和H2O的物质的量之比为1∶2,下列说法正确的是 ( )
A.分子中C、H、O个数之比为1∶2∶3
B.分子中C、H个数之比为1∶4
C.分子中一定含有氧原子
D.此有机物的最简式为CH4
【解析】选B。根据CO2和H2O的物质的量之比为1∶2,只能确定该有机物中C、H个数之比为1∶4,不能确定是否含有氧原子。
2.(2019·福州高二检测)如图是某有机物核磁共振氢谱图,则该有机物的结构简式是 ( )
A.CH3COOCH2CH3
B.CH3CH=CHCH3
C.CH3CH2CH3
D.CH3CHOHCH3
【解析】选A。由核磁共振氢谱图可知,该有机物中有三种类别不同的氢原子,且个数比为3∶3∶2,只有A项符合题意。
3.根据以下有关信息确定某有机物的组成:
(1)测定实验式:某含碳、氢、氧三种元素的有机物,经燃烧实验测得碳的质量分数为64.86%,氢的质量分数为13.51%,则其实验式是________。
(2)确定分子式:下图是该有机物的质谱图,则其相对分子质量为________,分子式为________。
答案:(1)C4H10O (2)74 C4H10O
【解析】(1)该有机物的分子中碳、氢、氧的原子个数比为n(C)∶n(H)∶n(O)=
=4∶10∶1,因此该有机物的实验式为C4H10O。
(2)根据质谱图中的质荷比最大的就是未知物的相对分子质量,该有机物的相对分子质量为74,因此该有机物的分子式为C4H10O。
【补偿训练】
1.(2019·镇江高二检测)如图所示是其有机物的核磁共振氢谱图,请你观察图谱,分析其可能是 ( )
A.CH3CH2CH2CH3
B.(CH3)2CHCH3
C.CH3CH2CH2OH
D.CH3CH2COOH
【解析】选C。从图看出有4组吸收峰,则有4种不同的氢原子,A.CH3CH2CH2CH3 只有2种氢原子,故A错误; B.(CH3)2CHCH3有三种氢原子,故B错误;C.CH3CH2CH2OH有四种氢原子,故C正确;D.CH3CH2COOH有三种氢原子,故D错误。
则有关该有机物的叙述正确的是 ( )
A.该有机物属于醚类
B.该有机物分子中共有5个碳原子
C.该有机物具有环状结构
D.该有机物分子中有四种化学环境不同的氢原子
【解析】选A。对称结构至少为2个,2个CH2的相对质量是28,2个CH3的相对质量是30,余基相对质量为
74-28-30=16,所以余基为O,其结构简式为CH3CH2OCH2CH3,属于醚类。
2.(2019·广州高二检测)某有机物的相对分子质量为74,其红外光谱图如下:
3.某含氧有机化合物可以作为无铅汽油的抗爆震剂,它的相对分子质量为88.0,含C的质量分数为68.2%,含H的质量分数为13.6%,红外光谱和核磁共振氢谱显示该分子中有4个甲基。请写出其结构简式________。
【解析】方法一:该有机物分子中:
N(C)= =5
N(H)= =12
N(O)= =1,故分子式为C5H12O。
再根据题意该分子中有4个甲基可得其结构简式
为
方法二:N(C)∶N(H)∶N(O)=
=5∶12∶1,则该有机物的最简式为C5H12O,其相对分子
质量为88.0,所以最简式就是分子式。
答案:
【知识图谱】
