人教版 高中化学 选择性必修2 3.3.2 金属晶体与离子晶体(共54张PPT)
文档属性
| 名称 | 人教版 高中化学 选择性必修2 3.3.2 金属晶体与离子晶体(共54张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 131.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 21:07:06 | ||
图片预览








文档简介
(共54张PPT)
汇报人:XXX
XX月XX日
金属晶体与离子晶体
(第二课时)
人教版高中化学选择必修二
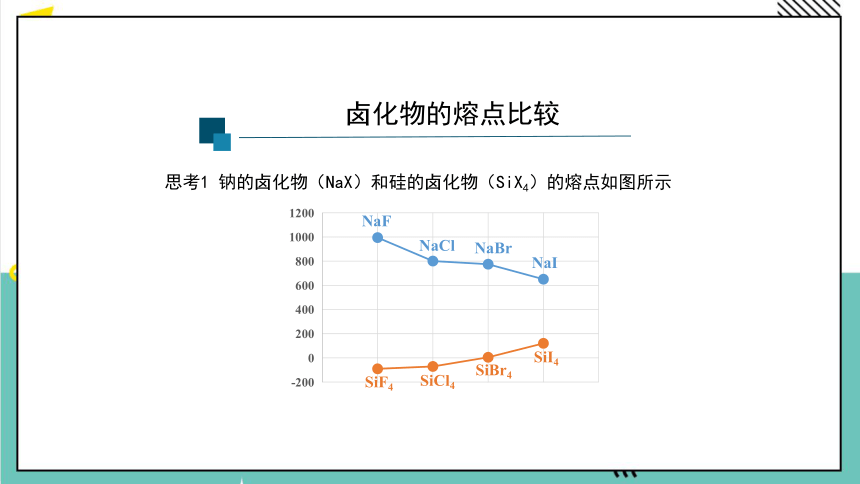
卤化物的熔点比较
NaF
NaCl
NaBr
NaI
思考1 钠的卤化物(NaX)和硅的卤化物(SiX4)的熔点如图所示
SiF4
SiCl4
SiBr4
SiI4
卤化物的熔点比较
思考1 钠的卤化物(NaX)和硅的卤化物(SiX4)的熔点如图所示
(1)判断晶体的类型。
(2)解释熔点变化的原因。
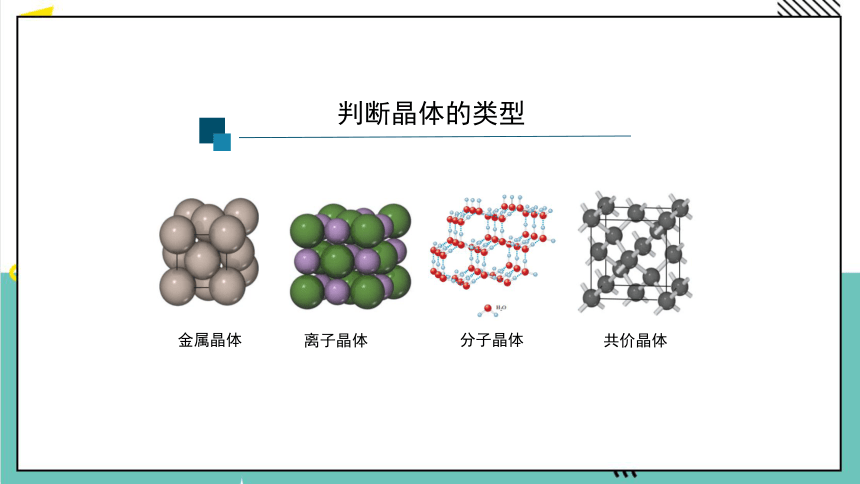
金属晶体
离子晶体
分子晶体
共价晶体
判断晶体的类型
判断晶体的类型
(1)从物质类别的角度
晶体类型 金属晶体 离子晶体 分子晶体 共价晶体
物质类别
典型例子
金属单质和合金
K、Cu、Mg
离子化合物
NaCl、CsCl
多数的非金属单质和共价化合物
干冰、冰、碘单质
少数的非金属单质和共价化合物
金刚石、SiO2
判断晶体的类型
(1)从物质类别的角度
晶体类型 金属晶体 离子晶体 分子晶体 共价晶体
物质类别
典型例子
金属单质和合金
K、Cu、Mg
离子化合物
NaCl、CsCl
多数的非金属单质和共价化合物
干冰、冰、碘单质
少数的非金属单质和共价化合物
金刚石、SiO2
晶体类型 离子晶体 分子晶体 共价晶体
熔点
熔化时需克 服的作用力
(2)从性质的角度
差异较大
离子键
较低
高
共价键
分子间作用力或氢键
判断晶体的类型
晶体类型 离子晶体 分子晶体 共价晶体
熔点
熔化时需克 服的作用力
(2)从性质的角度
差异较大
离子键
较低
高
共价键
分子间作用力或氢键
判断晶体的类型
晶体类型 离子晶体 分子晶体 共价晶体
熔点
熔化时需克 服的作用力
(2)从性质的角度
差异较大
离子键
较低
高
共价键
分子间作用力或氢键
判断晶体的类型
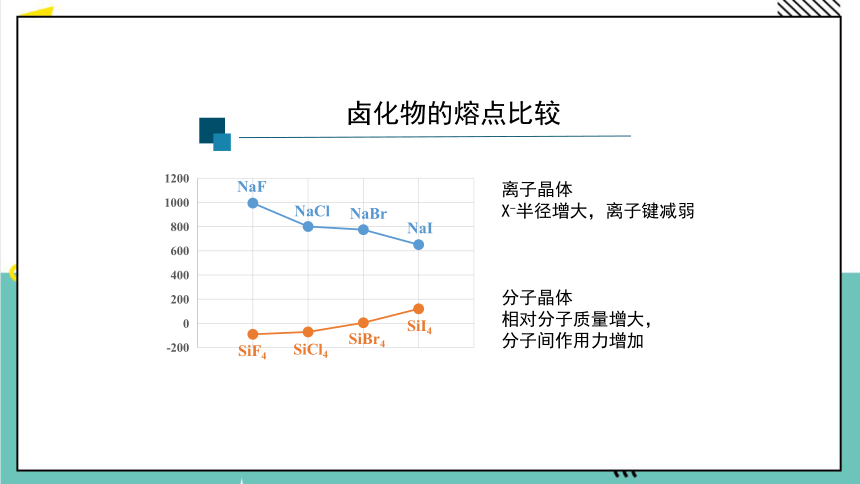
卤化物的熔点比较
离子晶体
X-半径增大,离子键减弱
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
分子晶体
相对分子质量增大,
分子间作用力增加
卤化物的熔点比较
离子晶体
X-半径增大,离子键减弱
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
分子晶体
相对分子质量增大,
分子间作用力增加
卤化物的熔点比较
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
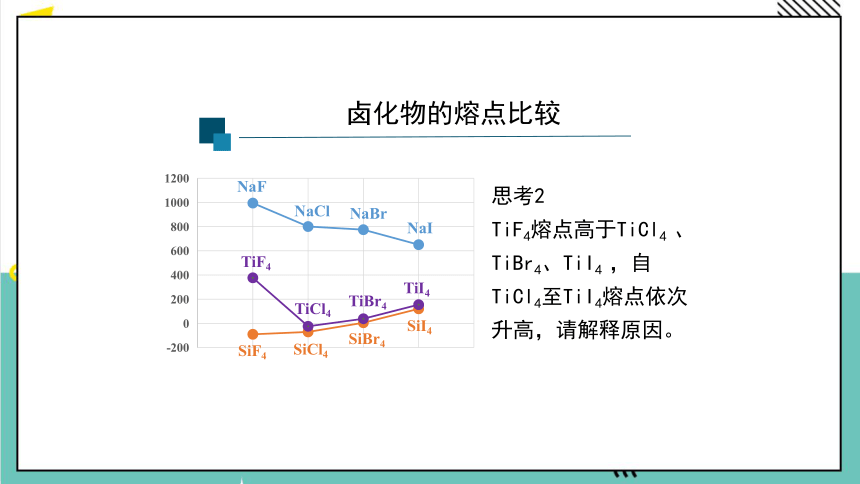
思考2
TiF4熔点高于TiCl4 、 TiBr4、TiI4 ,自TiCl4至TiI4熔点依次升高,请解释原因。
TiF4
TiCl4
TiBr4
TiI4
卤化物的熔点比较
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
思考2
TiF4熔点高于TiCl4 、 TiBr4、TiI4 ,自TiCl4至TiI4熔点依次升高,请解释原因。
TiF4
TiCl4
TiBr4
TiI4
卤化物的熔点比较
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
思考2
TiF4熔点高于TiCl4 、 TiBr4、TiI4 ,自TiCl4至TiI4熔点依次升高,请解释原因。
TiF4
TiCl4
TiBr4
TiI4
卤化物的熔点比较
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
TiF4
TiCl4
TiBr4
TiI4
(1)TiF4是离子化合物,熔点较高
(2) TiCl4 、 TiBr4、TiI4是共价化合物
事实上,大多数离子晶体中的化学键具有一定的共价键成分。
思考3 离子键的百分数和什么因素有关?
化合物 键型 离子键的百分数 电负性差值
CsCl 离子键 75% 3.16 ― 0.79 = 2.37
HCl 极性共价键 20% 3.16 ― 2.22 = 0.94
Cl2 非极性共价键 0 3.16 ― 3.16 = 0
思考3 离子键的百分数和什么因素有关?
化合物 键型 离子键的百分数 电负性差值
CsCl 离子键 75% 3.16 ― 0.79 = 2.37
HCl 极性共价键 20% 3.16 ― 2.22 = 0.94
Cl2 非极性共价键 0 3.16 ― 3.16 = 0
思考3 离子键的百分数和什么因素有关?
化合物 键型 离子键的百分数 电负性差值
CsCl 离子键 75% 3.16 ― 0.79 = 2.37
HCl 极性共价键 20% 3.16 ― 2.22 = 0.94
Cl2 非极性共价键 0 3.16 ― 3.16 = 0
电负性差值越大,离子键成分的百分数越高
钛的电负性 Ti 1.54 Ti 1.54 Ti 1.54 Ti
1.54
卤素的电负性 F 3.98 Cl 3.16 Br 2.96 I
2.66
电负性差值 2.44 1.62 1.42 1.12
查阅数据
钛的电负性 Ti 1.54 Ti 1.54 Ti 1.54 Ti
1.54
卤素的电负性 F 3.98 Cl 3.16 Br 2.96 I
2.66
电负性差值 2.44 1.62 1.42 1.12
查阅数据
Na2O
MgO
Al2O3
SiO2
P2O5
SO3
Cl2O7
Na2O
MgO
Al2O3
SiO2
P2O5
SO3
Cl2O7
过渡晶体
Na2O
MgO
Al2O3
SiO2
P2O5
SO3
Cl2O7
过渡晶体
离子晶体
分子晶体
共价晶体
Na2O
MgO
Al2O3
SiO2
P2O5
SO3
Cl2O7
过渡晶体
离子晶体
分子晶体
共价晶体
离子
晶体
离子
晶体
Na2O
MgO
Al2O3
SiO2
P2O5
SO3
Cl2O7
过渡晶体
离子晶体
分子晶体
共价晶体
离子
晶体
离子
晶体
分子
晶体
分子
晶体
共价
晶体
共价
晶体
分子
晶体
铝的冶炼
思考4 冶炼铝通常采用电解熔融Al2O3的方法,
为什么不电解熔融态AlCl3?
并判断AlCl3的晶体类型。
化合物 熔点/℃
AlCl3 192.6
Al2O3 2 054
资料1 氯化铝晶体的导电性随温度变化图
熔点
资料2 氯化铝处于熔融态时,以二聚体的Al2Cl6
的形式存在。
Al2Cl6的分子结构
资料1 氯化铝晶体的导电性随温度变化图
熔点
资料2 氯化铝处于熔融态时,以二聚体的Al2Cl6
的形式存在。
Al2Cl6的分子结构
资料1 氯化铝晶体的导电性随温度变化图
熔点
AlCl3
过渡晶体
NaCl
MgCl2
SiCl4
SF6
离子晶体
分子晶体
分子晶体
离子晶体
NaCl
Na—Mg—Al—Si—P—S—Cl2
MgCl2
AlCl3
SiCl4
SF6
离子晶体
分子晶体
金属晶体
NaCl
Na—Mg—Al—Si—P—S—Cl2
MgCl2
AlCl3
SiCl4
SF6
离子晶体
分子晶体
金属晶体
石墨的结构和性质
石墨的结构和性质
石墨晶体的二维平面结构
石墨的层状结构
思考5 分析石墨晶体的构成微粒及微粒间相互作用,
并解释石墨具有导电性和润滑性的原因。
石墨的层状结构
思考5 分析石墨晶体的构成微粒及微粒间相互作用,
并解释石墨具有导电性和润滑性的原因。
石墨的层状结构
思考5 分析石墨晶体的构成微粒及微粒间相互作用,
并解释石墨具有导电性和润滑性的原因。
石墨的层状结构
分子间作用力较弱,
层与层之间易于断开而滑动,
所以石墨具有润滑性
混合型晶体
在石墨晶体中既有共价键又带有金属键性质,而层间结合则依靠分子间作用力。所以这是一种十分典型的混合键型单质晶体。
四种典型晶体
金属晶体
离子晶体
分子晶体
共价晶体
四种典型晶体
金属晶体
离子晶体
分子晶体
共价晶体
晶体 大有可为
1. 钙钛矿太阳能电池
晶体 大有可为
1. 钙钛矿太阳能电池
钙钛矿的晶胞如图(a)所示,金属离子与氧离子间的作用力为_______, 化学式是______。
a
钙钛矿的晶胞如图(a)所示,金属离子与氧离子间的作用力为_______, 化学式是______。
离子键
O
123
Ca
Ti
1
81
CaTiO3
4
1
8
1
a
由Pb2+、I-和有机碱离子CH3NH 组成的一种立方钙钛矿结构的金属卤化物光电材料,其晶胞如图(b)所示,化学式是__________。
+
3
b
由Pb2+、I-和有机碱离子CH3NH 组成的一种立方钙钛矿结构的金属卤化物光电材料,其晶胞如图(b)所示,化学式是__________。
+
3
CH3NH3PbI3
I-
6 =3
CH3NH
Pb2+
8 =1
1
2
1
8
1
+
3
+
3
b
晶体 大有可为
2. 固体电解质
电解质是掺杂了Y2O3(Y为钇)的ZrO2 (Zr为锆)晶体,
它在高温下能传导O2-。
电解质
晶体 大有可为
2. 固体电解质
O2-空位
3.纳米晶
3.纳米晶
晶体
构成的微粒
微粒间相互作用
物质的性质
物质的聚集状态
汇报人:XXX
XX月XX日
金属晶体与离子晶体
(第二课时)
人教版高中化学选择必修二
卤化物的熔点比较
NaF
NaCl
NaBr
NaI
思考1 钠的卤化物(NaX)和硅的卤化物(SiX4)的熔点如图所示
SiF4
SiCl4
SiBr4
SiI4
卤化物的熔点比较
思考1 钠的卤化物(NaX)和硅的卤化物(SiX4)的熔点如图所示
(1)判断晶体的类型。
(2)解释熔点变化的原因。
金属晶体
离子晶体
分子晶体
共价晶体
判断晶体的类型
判断晶体的类型
(1)从物质类别的角度
晶体类型 金属晶体 离子晶体 分子晶体 共价晶体
物质类别
典型例子
金属单质和合金
K、Cu、Mg
离子化合物
NaCl、CsCl
多数的非金属单质和共价化合物
干冰、冰、碘单质
少数的非金属单质和共价化合物
金刚石、SiO2
判断晶体的类型
(1)从物质类别的角度
晶体类型 金属晶体 离子晶体 分子晶体 共价晶体
物质类别
典型例子
金属单质和合金
K、Cu、Mg
离子化合物
NaCl、CsCl
多数的非金属单质和共价化合物
干冰、冰、碘单质
少数的非金属单质和共价化合物
金刚石、SiO2
晶体类型 离子晶体 分子晶体 共价晶体
熔点
熔化时需克 服的作用力
(2)从性质的角度
差异较大
离子键
较低
高
共价键
分子间作用力或氢键
判断晶体的类型
晶体类型 离子晶体 分子晶体 共价晶体
熔点
熔化时需克 服的作用力
(2)从性质的角度
差异较大
离子键
较低
高
共价键
分子间作用力或氢键
判断晶体的类型
晶体类型 离子晶体 分子晶体 共价晶体
熔点
熔化时需克 服的作用力
(2)从性质的角度
差异较大
离子键
较低
高
共价键
分子间作用力或氢键
判断晶体的类型
卤化物的熔点比较
离子晶体
X-半径增大,离子键减弱
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
分子晶体
相对分子质量增大,
分子间作用力增加
卤化物的熔点比较
离子晶体
X-半径增大,离子键减弱
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
分子晶体
相对分子质量增大,
分子间作用力增加
卤化物的熔点比较
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
思考2
TiF4熔点高于TiCl4 、 TiBr4、TiI4 ,自TiCl4至TiI4熔点依次升高,请解释原因。
TiF4
TiCl4
TiBr4
TiI4
卤化物的熔点比较
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
思考2
TiF4熔点高于TiCl4 、 TiBr4、TiI4 ,自TiCl4至TiI4熔点依次升高,请解释原因。
TiF4
TiCl4
TiBr4
TiI4
卤化物的熔点比较
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
思考2
TiF4熔点高于TiCl4 、 TiBr4、TiI4 ,自TiCl4至TiI4熔点依次升高,请解释原因。
TiF4
TiCl4
TiBr4
TiI4
卤化物的熔点比较
NaF
NaCl
NaBr
NaI
SiF4
SiCl4
SiBr4
SiI4
TiF4
TiCl4
TiBr4
TiI4
(1)TiF4是离子化合物,熔点较高
(2) TiCl4 、 TiBr4、TiI4是共价化合物
事实上,大多数离子晶体中的化学键具有一定的共价键成分。
思考3 离子键的百分数和什么因素有关?
化合物 键型 离子键的百分数 电负性差值
CsCl 离子键 75% 3.16 ― 0.79 = 2.37
HCl 极性共价键 20% 3.16 ― 2.22 = 0.94
Cl2 非极性共价键 0 3.16 ― 3.16 = 0
思考3 离子键的百分数和什么因素有关?
化合物 键型 离子键的百分数 电负性差值
CsCl 离子键 75% 3.16 ― 0.79 = 2.37
HCl 极性共价键 20% 3.16 ― 2.22 = 0.94
Cl2 非极性共价键 0 3.16 ― 3.16 = 0
思考3 离子键的百分数和什么因素有关?
化合物 键型 离子键的百分数 电负性差值
CsCl 离子键 75% 3.16 ― 0.79 = 2.37
HCl 极性共价键 20% 3.16 ― 2.22 = 0.94
Cl2 非极性共价键 0 3.16 ― 3.16 = 0
电负性差值越大,离子键成分的百分数越高
钛的电负性 Ti 1.54 Ti 1.54 Ti 1.54 Ti
1.54
卤素的电负性 F 3.98 Cl 3.16 Br 2.96 I
2.66
电负性差值 2.44 1.62 1.42 1.12
查阅数据
钛的电负性 Ti 1.54 Ti 1.54 Ti 1.54 Ti
1.54
卤素的电负性 F 3.98 Cl 3.16 Br 2.96 I
2.66
电负性差值 2.44 1.62 1.42 1.12
查阅数据
Na2O
MgO
Al2O3
SiO2
P2O5
SO3
Cl2O7
Na2O
MgO
Al2O3
SiO2
P2O5
SO3
Cl2O7
过渡晶体
Na2O
MgO
Al2O3
SiO2
P2O5
SO3
Cl2O7
过渡晶体
离子晶体
分子晶体
共价晶体
Na2O
MgO
Al2O3
SiO2
P2O5
SO3
Cl2O7
过渡晶体
离子晶体
分子晶体
共价晶体
离子
晶体
离子
晶体
Na2O
MgO
Al2O3
SiO2
P2O5
SO3
Cl2O7
过渡晶体
离子晶体
分子晶体
共价晶体
离子
晶体
离子
晶体
分子
晶体
分子
晶体
共价
晶体
共价
晶体
分子
晶体
铝的冶炼
思考4 冶炼铝通常采用电解熔融Al2O3的方法,
为什么不电解熔融态AlCl3?
并判断AlCl3的晶体类型。
化合物 熔点/℃
AlCl3 192.6
Al2O3 2 054
资料1 氯化铝晶体的导电性随温度变化图
熔点
资料2 氯化铝处于熔融态时,以二聚体的Al2Cl6
的形式存在。
Al2Cl6的分子结构
资料1 氯化铝晶体的导电性随温度变化图
熔点
资料2 氯化铝处于熔融态时,以二聚体的Al2Cl6
的形式存在。
Al2Cl6的分子结构
资料1 氯化铝晶体的导电性随温度变化图
熔点
AlCl3
过渡晶体
NaCl
MgCl2
SiCl4
SF6
离子晶体
分子晶体
分子晶体
离子晶体
NaCl
Na—Mg—Al—Si—P—S—Cl2
MgCl2
AlCl3
SiCl4
SF6
离子晶体
分子晶体
金属晶体
NaCl
Na—Mg—Al—Si—P—S—Cl2
MgCl2
AlCl3
SiCl4
SF6
离子晶体
分子晶体
金属晶体
石墨的结构和性质
石墨的结构和性质
石墨晶体的二维平面结构
石墨的层状结构
思考5 分析石墨晶体的构成微粒及微粒间相互作用,
并解释石墨具有导电性和润滑性的原因。
石墨的层状结构
思考5 分析石墨晶体的构成微粒及微粒间相互作用,
并解释石墨具有导电性和润滑性的原因。
石墨的层状结构
思考5 分析石墨晶体的构成微粒及微粒间相互作用,
并解释石墨具有导电性和润滑性的原因。
石墨的层状结构
分子间作用力较弱,
层与层之间易于断开而滑动,
所以石墨具有润滑性
混合型晶体
在石墨晶体中既有共价键又带有金属键性质,而层间结合则依靠分子间作用力。所以这是一种十分典型的混合键型单质晶体。
四种典型晶体
金属晶体
离子晶体
分子晶体
共价晶体
四种典型晶体
金属晶体
离子晶体
分子晶体
共价晶体
晶体 大有可为
1. 钙钛矿太阳能电池
晶体 大有可为
1. 钙钛矿太阳能电池
钙钛矿的晶胞如图(a)所示,金属离子与氧离子间的作用力为_______, 化学式是______。
a
钙钛矿的晶胞如图(a)所示,金属离子与氧离子间的作用力为_______, 化学式是______。
离子键
O
123
Ca
Ti
1
81
CaTiO3
4
1
8
1
a
由Pb2+、I-和有机碱离子CH3NH 组成的一种立方钙钛矿结构的金属卤化物光电材料,其晶胞如图(b)所示,化学式是__________。
+
3
b
由Pb2+、I-和有机碱离子CH3NH 组成的一种立方钙钛矿结构的金属卤化物光电材料,其晶胞如图(b)所示,化学式是__________。
+
3
CH3NH3PbI3
I-
6 =3
CH3NH
Pb2+
8 =1
1
2
1
8
1
+
3
+
3
b
晶体 大有可为
2. 固体电解质
电解质是掺杂了Y2O3(Y为钇)的ZrO2 (Zr为锆)晶体,
它在高温下能传导O2-。
电解质
晶体 大有可为
2. 固体电解质
O2-空位
3.纳米晶
3.纳米晶
晶体
构成的微粒
微粒间相互作用
物质的性质
物质的聚集状态
