4.1.2 化学电源 课件(共17张PPT) 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.1.2 化学电源 课件(共17张PPT) 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 5.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 15:20:28 | ||
图片预览





文档简介
(共17张PPT)
第四章 ·化学反应与电能
第一节 原电池
第2课时 化学电源
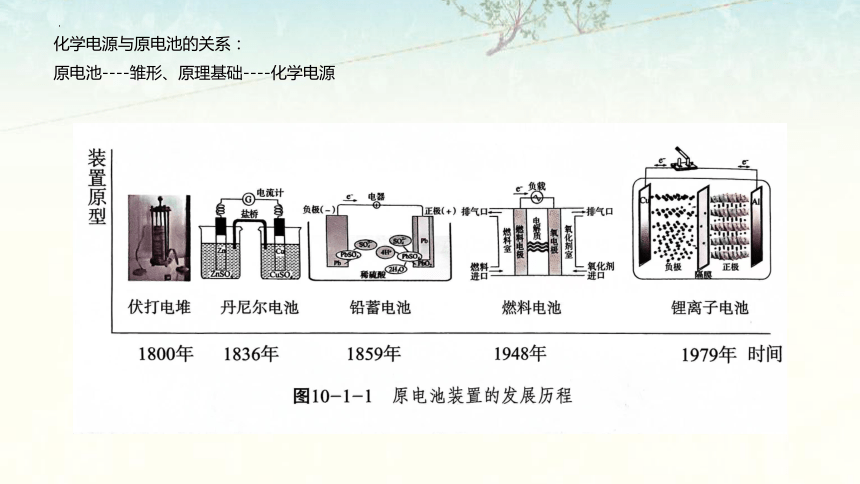
化学电源与原电池的关系:
原电池----雏形、原理基础----化学电源
用途广泛的各种化学电池
银锌电池
干电池
铅酸电池
镍氢电池
燃料电池
锂离子电池
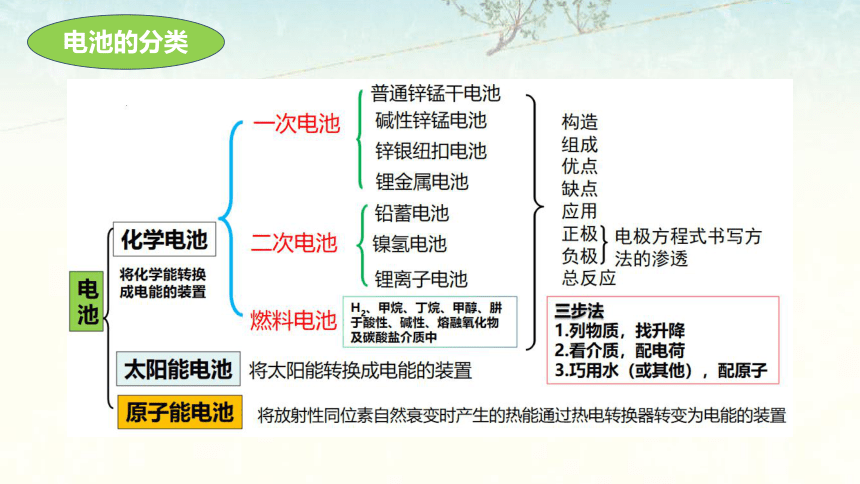
电池的分类
1、普通锌锰电池
一、一次电池(干电池) 放电后不可充电的电池,反应不可逆。
锌筒
石墨棒
MnO2和C
普通锌-锰干电池的结构
NH4Cl、ZnCl2 和 H2O等
总反应:Zn+2MnO2+2NH4+=Zn2++ 2MnO(OH)+2NH3+H2O
负极: Zn - 2e- = Zn2+
正极:2MnO2+2NH4++2e- =2MnO(OH)+ 2NH3
2、碱性锌锰电池
一、一次电池(干电池) 放电后不可充电的电池,反应不可逆。
负极:Zn+2OH--2e-=Zn(OH)2
正极:2MnO2+2H2O+2e-=2MnO(OH)+2OH-
总反应:Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH)
负极:Zn+2OH--2e-=Zn(OH)2
正极:Ag2O+H2O+2e-=2Ag+2OH-
总反应式:Zn+Ag2O+H2O=2Ag+Zn(OH)2
3、锌银电池
一、一次电池(干电池) 放电后不可充电的电池,反应不可逆。
Zn为负极,Ag2O为正极,KOH为电解质溶液
4、锂亚硫酰氯(Li/SOCl2)电池
一、一次电池(干电池) 放电后不可充电的电池,反应不可逆。
(锂金属电池)
Li - SOCl 2 电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是 LiAlCl 4 - SOCl 2 。电池的总反应可表示为 8Li + 3SOCl 2 ===6LiCl + Li 2 SO 3 + 2S 。
(1) 负极材料为 __锂__ ,电极反应为 _8Li - 8e - ===8Li + ________________ 。
(2) 正极的电极反应为 _____3SOCl 2 + 8e - ===2S + + 6Cl -+
必须在 无水、无氧 的条件下组装锂金属电池 ,
原因是构成电池的主要成份 Li 能和氧气或水反应, SOCl 2 也与水反应。
二、二次电池(充电电池或蓄电池)
1、铅蓄电池
放电后可以再充电使活性物质获得再生:铅蓄电池、锂离子电池……
化学能
电能
放电
充电
工作机制
(1)放电时---原电池(化学能 电能)
负极反应: Pb + SO42- -2e-=PbSO4
正极反应: PbO2 + 4H+ + SO42- + 2e-=PbSO4 + 2H2O
总反应: Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O
(2)充电时---电解池(电能 化学能)
总反应:Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O
放电
充电
2、锂离子电池/LiPF6的碳酸酯溶液
二、二次电池(充电电池或蓄电池)
负极:LixCy - xe- = xLi++Cy
正极:Li1-xCoO2 +xLi+ + xe-= LiCoO2
总反应式:LixCy+ Li1-xCoO2 LiCoO2+Cy
放电
充电
三、燃料电池
可供选择的燃料很多,如:氢气、烃类、肼、甲醇、氨、煤气等液态或气态的燃料。
A.酸性条件下工作原理:H2 、O2 、H2SO4 溶液
正极: O2+4H++4e-=2H2O
负极:
总反应: 2H2 + O2=2H2O
B.碱性条件下工作原理:H2 、O2 、KOH溶液
正极:O2+4e-+2H2O=4OH-
负极:2H2- 4e-+4OH-=4H2O
总反应: 2H2 + O2=2H2O
(1)氢氧燃料电池:
2H2- 4e-=4H+
(2)其他燃料电池:
例如:甲烷燃料电池(电解质溶液可以是硫酸、KOH溶液、熔融K2CO3、熔融氧化物电解质)
甲烷、空气、KOH溶液燃料电池书写方法与步骤:
确定电极和反应物、产物
标化合价,定得失电子数目
根据电解质性质和电荷守恒配平
配平H2O等其他物质系数、检查
谢谢大家
第四章 ·化学反应与电能
第一节 原电池
第2课时 化学电源
化学电源与原电池的关系:
原电池----雏形、原理基础----化学电源
用途广泛的各种化学电池
银锌电池
干电池
铅酸电池
镍氢电池
燃料电池
锂离子电池
电池的分类
1、普通锌锰电池
一、一次电池(干电池) 放电后不可充电的电池,反应不可逆。
锌筒
石墨棒
MnO2和C
普通锌-锰干电池的结构
NH4Cl、ZnCl2 和 H2O等
总反应:Zn+2MnO2+2NH4+=Zn2++ 2MnO(OH)+2NH3+H2O
负极: Zn - 2e- = Zn2+
正极:2MnO2+2NH4++2e- =2MnO(OH)+ 2NH3
2、碱性锌锰电池
一、一次电池(干电池) 放电后不可充电的电池,反应不可逆。
负极:Zn+2OH--2e-=Zn(OH)2
正极:2MnO2+2H2O+2e-=2MnO(OH)+2OH-
总反应:Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH)
负极:Zn+2OH--2e-=Zn(OH)2
正极:Ag2O+H2O+2e-=2Ag+2OH-
总反应式:Zn+Ag2O+H2O=2Ag+Zn(OH)2
3、锌银电池
一、一次电池(干电池) 放电后不可充电的电池,反应不可逆。
Zn为负极,Ag2O为正极,KOH为电解质溶液
4、锂亚硫酰氯(Li/SOCl2)电池
一、一次电池(干电池) 放电后不可充电的电池,反应不可逆。
(锂金属电池)
Li - SOCl 2 电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是 LiAlCl 4 - SOCl 2 。电池的总反应可表示为 8Li + 3SOCl 2 ===6LiCl + Li 2 SO 3 + 2S 。
(1) 负极材料为 __锂__ ,电极反应为 _8Li - 8e - ===8Li + ________________ 。
(2) 正极的电极反应为 _____3SOCl 2 + 8e - ===2S + + 6Cl -+
必须在 无水、无氧 的条件下组装锂金属电池 ,
原因是构成电池的主要成份 Li 能和氧气或水反应, SOCl 2 也与水反应。
二、二次电池(充电电池或蓄电池)
1、铅蓄电池
放电后可以再充电使活性物质获得再生:铅蓄电池、锂离子电池……
化学能
电能
放电
充电
工作机制
(1)放电时---原电池(化学能 电能)
负极反应: Pb + SO42- -2e-=PbSO4
正极反应: PbO2 + 4H+ + SO42- + 2e-=PbSO4 + 2H2O
总反应: Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O
(2)充电时---电解池(电能 化学能)
总反应:Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O
放电
充电
2、锂离子电池/LiPF6的碳酸酯溶液
二、二次电池(充电电池或蓄电池)
负极:LixCy - xe- = xLi++Cy
正极:Li1-xCoO2 +xLi+ + xe-= LiCoO2
总反应式:LixCy+ Li1-xCoO2 LiCoO2+Cy
放电
充电
三、燃料电池
可供选择的燃料很多,如:氢气、烃类、肼、甲醇、氨、煤气等液态或气态的燃料。
A.酸性条件下工作原理:H2 、O2 、H2SO4 溶液
正极: O2+4H++4e-=2H2O
负极:
总反应: 2H2 + O2=2H2O
B.碱性条件下工作原理:H2 、O2 、KOH溶液
正极:O2+4e-+2H2O=4OH-
负极:2H2- 4e-+4OH-=4H2O
总反应: 2H2 + O2=2H2O
(1)氢氧燃料电池:
2H2- 4e-=4H+
(2)其他燃料电池:
例如:甲烷燃料电池(电解质溶液可以是硫酸、KOH溶液、熔融K2CO3、熔融氧化物电解质)
甲烷、空气、KOH溶液燃料电池书写方法与步骤:
确定电极和反应物、产物
标化合价,定得失电子数目
根据电解质性质和电荷守恒配平
配平H2O等其他物质系数、检查
谢谢大家
