河南省周口市郸城县2023-2024学年高一上学期期中考试化学试卷(含答案)
文档属性
| 名称 | 河南省周口市郸城县2023-2024学年高一上学期期中考试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 534.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 14:13:55 | ||
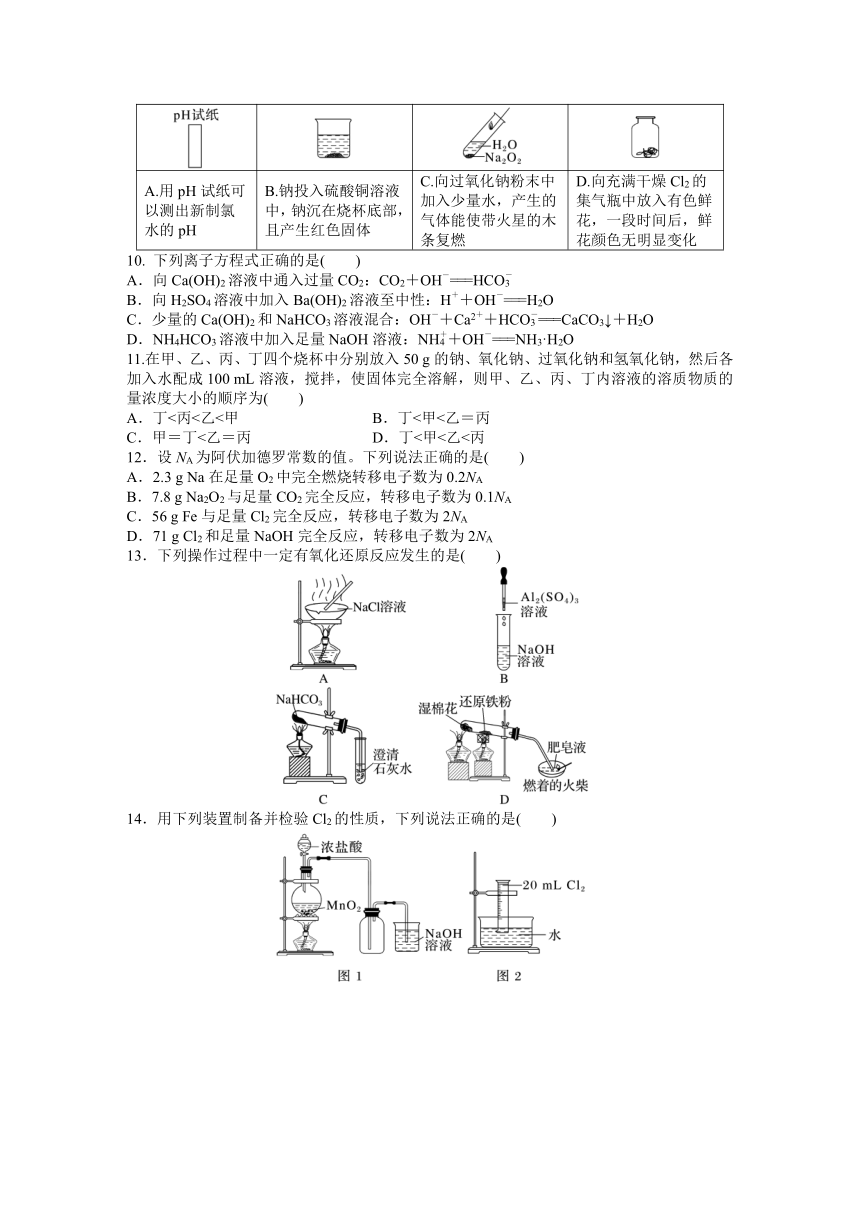
图片预览


文档简介
郸城县2023-2024学年高一上学期期中考试
化学试卷
一、选择题(共15小题,第小题4分,共60分)
1.分类是一种重要的学习方法。物质的分类如图所示,下列说法中正确的是( )
A.图甲所示的分类方法属于树状分类法
B.酸性氧化物一定是非金属氧化物
C.Fe(OH)3胶体属于碱
D.图甲中“……”包含混合物
2.下列物质中能导电同时又属于电解质的是( )
A.Na2SO4溶液 B.熔融NaNO3
C.氨水 D.液态氯化氢
3.下列化学事故处理方法正确的是( )
A.酒精灯着火时可用水扑灭
B.有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,向高处撤离
C.不慎将碱液溅到眼中,应立即用硫酸溶液冲洗,边洗边眨眼睛
D.金属钠通常保存在煤油中,着火时可以用水和二氧化碳灭火
4.三种物质间只通过一步反应就能实现如箭头所指方向的转化,下列符合要求的组合是( )
A.①② B.①③
C.②③ D.①②③
5.下列物质中,摩尔质量最大的是( )
A.10 mL H2O B.0.8 mol H2SO4
C.54 g Al D.1 g CaCO3
6.下列钠及其化合物的性质与用途具有对应关系的是( )
A.Na有还原性,可用于制造高压钠灯
B.Na2O2有漂白性,可用作呼吸面具的供氧剂
C.Na2CO3溶液有碱性,可用于治疗胃酸过多
D.NaHCO3受热易分解,可用于焙制糕点
7.下列颜色变化与氧化还原反应无关的是( )
A.湿润的红色布条遇氯气褪色
B.棕黄色氯化铁饱和溶液滴入沸水中变红褐色
C.紫红色酸性高锰酸钾溶液中通入HCl气体后褪色
D.淡黄色过氧化钠固体露置于空气中逐渐变为白色
8.某固体仅由一种元素组成,其密度为5 g·cm-3。用X射线研究该固体的结果表明:在棱长为1×10-7 cm的立方体中含有20个原子,则此元素的相对原子质量最接近( )
A.32 B.65 C.140 D.150
9.下列实验操作对应的现象符合事实的是( )
A.用pH试纸可以测出新制氯水的pH B.钠投入硫酸铜溶液中,钠沉在烧杯底部,且产生红色固体 C.向过氧化钠粉末中加入少量水,产生的气体能使带火星的木条复燃 D.向充满干燥Cl2的集气瓶中放入有色鲜花,一段时间后,鲜花颜色无明显变化
10. 下列离子方程式正确的是( )
A.向Ca(OH)2溶液中通入过量CO2:CO2+OH-===HCO
B.向H2SO4溶液中加入Ba(OH)2溶液至中性:H++OH-===H2O
C.少量的Ca(OH)2和NaHCO3溶液混合:OH-+Ca2++HCO===CaCO3↓+H2O
D.NH4HCO3溶液中加入足量NaOH溶液:NH+OH-===NH3·H2O
11.在甲、乙、丙、丁四个烧杯中分别放入50 g的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入水配成100 mL溶液,搅拌,使固体完全溶解,则甲、乙、丙、丁内溶液的溶质物质的量浓度大小的顺序为( )
A.丁<丙<乙<甲 B.丁<甲<乙=丙
C.甲=丁<乙=丙 D.丁<甲<乙<丙
12.设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.2.3 g Na在足量O2中完全燃烧转移电子数为0.2NA
B.7.8 g Na2O2与足量CO2完全反应,转移电子数为0.1NA
C.56 g Fe与足量Cl2完全反应,转移电子数为2NA
D.71 g Cl2和足量NaOH完全反应,转移电子数为2NA
13.下列操作过程中一定有氧化还原反应发生的是( )
14.用下列装置制备并检验Cl2的性质,下列说法正确的是( )
A.图1:实验室制氯气,即使MnO2过量,盐酸也不能全部反应完
B.图2:充分光照后,溶液充满量筒
C.图3:生成蓝色的烟,若在集气瓶中加入少量水,所得溶液呈绿色
D.图4:干燥的有色布条不褪色,湿润的有色布条能褪色,说明Cl2有漂白性
15.今有一混合物水溶液,只可能含有以下离子中的若干种:K+、Ca2+、SO、NO、CO,现取200 mL溶液向其中加入BaCl2溶液后,得干燥沉淀8.6 g,经足量盐酸洗涤、干燥后,沉淀质量为4.66 g。根据上述实验,以下推断不正确的是
A.溶液中c(CO)=0.1 mol L-1
B.溶液中c(K+)≥0.4 mol L-1
C.溶液中一定没有Ca2+,可能存在NO
D.溶液中一定存在CO、SO,K+是否存在,要进行焰色试验
二、非选择题(共3小题,40分)
16.(13分)Ⅰ.现有下列物质:①固体氢氧化钡,②石墨棒,③纯醋酸,④液态氯化氢,⑤硫酸氢钾固体,⑥熔融氯化钠,⑦酒精(C2H5OH),⑧碳酸钠粉末。请用序号回答下列问题:
(1)以上物质中能导电的是__________________。
(2)以上物质中属于电解质的是__________________。
(3)以上物质中属于非电解质的是__________。
Ⅱ.高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止刻蚀液与下层(砷化镓)反应。
(4)(4分)已知:Ga和Al最外层电子数相同,As和N最外层电子数相同。在H2O2与上层GaAs的反应中,As元素的化合价变为+5价,则该反应的氧化剂与还原剂的物质的量之比为____________。
(5)(3分)配平下列化学方程式
________Cu+________HNO3(稀)===______Cu(NO3)2+______NO↑+_____H2O。
17.(12分)(2022·浙江北斗联盟高一上期中) 如图所示物质之间的转化,已知:A是金属单质,且焰色试验为黄色,Y是非金属单质,且呈黄绿色,X为常见温室气体。按要求回答下列问题:
(1)D的化学式:__________________。
(2)A→B反应的离子方程式:___________________________________________________
____________________________________________________________________________。
(3)C在Y中燃烧的实验现象:__________________________________________________
___________________________________________________________________________。
(4)(4分)下列说法正确的是________(填字母)。
a.D、E两种溶液,可以滴加氢氧化钙溶液鉴别,也可以滴加氯化钙溶液鉴别
b.A在Y中加热反应,有黄色火焰产生
c.若G是A在空气中加热生成的,则在一定条件下G能转化为B,但不能转化为D
d.将A投入到E的溶液中,也会有D生成
(5)(3分)C与Y反应后的混合气体通入200 mL 2.0 mol L-1的NaOH溶液中,NaOH恰好完全反应,产物中存在YO-(与消毒液有效成分相同的阴离子),其物质的量为0.1 mol,则C与Y的物质的量之比为______。
18.(15分)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
回答下列问题:
(1)(2分)盛放MnO2粉末的仪器名称是____________,a中的试剂为____________。
(2)b中采用的加热方式是____________,c中反应的离子方程式是____________________,
采用冰水浴冷却的目的是____________________。
(3)(3分)d的作用是____________,可选用试剂________(填字母)。
A.Na2S B.NaCl
C.Ca(OH)2 D.H2SO4
(4)(2分)反应结束后,取出b中试管,经冷却结晶,____________,____________,干燥,得到KClO3晶体。
(5)(2分)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显____________色。可知该条件下KClO3的氧化能力____________(填“大于”或“小于”)NaClO。
参考答案
1.答案 A
解析 由题干信息可知,图甲所示的分类方法属于树状分类法,A正确;酸性氧化物不一定是非金属氧化物,如Mn2O7是金属氧化物,属于酸性氧化物,B错误;Fe(OH)3胶体是混合物,而酸、碱、盐均属于纯净物,属于化合物,故Fe(OH)3胶体不属于碱,C错误;化合物是指含有两种或两种以上元素的纯净物,故图甲中“……”不包含混合物,D错误。
2.答案 B
解析 Na2SO4溶液是混合物,不属于电解质,故A不符合题意;硝酸钠是电解质,熔融硝酸钠能电离出自由移动的钠离子和硝酸根离子,能导电,故B符合题意;氨水是混合物,不属于电解质,故C不符合题意;氯化氢是共价化合物,属于电解质,液态氯化氢不能电离出自由移动的离子,不能导电,故D不符合题意。
3.答案 B
解析 酒精的密度小于水的密度,酒精燃烧时,用水灭火时不但不能灭火,而且能扩大燃烧面积,应该用湿抹布盖灭,A错误;肥皂水呈弱碱性,可以吸收氯气,氯气密度比空气大,氯气泄漏时人应该往高处走,故有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,向高处撤离,B正确;不慎将碱液溅到眼中,应该用大量的水冲洗,边洗边眨眼睛,硫酸具有腐蚀性,不能用硫酸溶液冲洗,C错误;钠与空气中的水蒸气、O2极易反应而变质,密度比煤油大,故金属钠通常保存在煤油中,由于钠与过氧化钠均可与水和二氧化碳反应,且有H2和O2生成,故金属钠着火时不可以用水和二氧化碳灭火,D错误。
4.答案 D
5.答案 D
解析 摩尔质量以g·mol-1为单位时,在数值上等于其相对原子质量或相对分子质量,与其质量或体积的大小无关。H2O的摩尔质量为18 g·mol-1,H2SO4的摩尔质量为98 g·mol-1,Al的摩尔质量为27 g·mol-1,CaCO3的摩尔质量为100 g·mol-1。
6.答案 D
解析 高压钠灯发出的黄光射程远,透雾力强,将钠应用于电光源上,与还原性无关,A错误;Na2O2与水或二氧化碳反应均能生成氧气,故可用作呼吸面具的供氧剂,与漂白性无关,B错误;Na2CO3溶液有碱性,但碱性较强,不宜用于治疗胃酸过多,C错误;NaHCO3受热易分解产生气体,可用于焙制糕点 ,对应关系正确,D正确。
7.答案 B
解析 氯气与水反应生成盐酸和次氯酸,其反应的化学方程式为Cl2+H2O===HCl+HClO,生成的次氯酸具有强氧化性,能使红色布条褪色,该反应为氧化还原反应,颜色变化与氧化还原反应有关,A不符合题意;Fe3+在水溶液中呈棕黄色,FeCl3饱和溶液滴入沸水中,Fe3+与H2O反应生成红褐色的氢氧化铁胶体,其反应的离子方程式为Fe3++3H2OFe(OH)3(胶体)+3H+,该反应不是氧化还原反应,颜色变化与氧化还原反应无关,B符合题意;酸性KMnO4溶液具有强氧化性,HCl具有还原性,可以被酸性KMnO4溶液氧化,从而使紫色褪色,该反应为氧化还原反应,颜色变化与氧化还原反应有关,C不符合题意;Na2O2固体露置于空气中,易与空气中的水蒸气和二氧化碳反应,其反应的化学方程式为2Na2O2+2H2O===4NaOH+O2↑,2Na2O2+2CO2===2Na2CO3+O2,NaOH也易与二氧化碳反应,其反应的化学方程式为2NaOH+CO2===Na2CO3+H2O,Na2CO3是白色粉末,所以淡黄色逐渐变为白色,该过程存在氧化还原反应,颜色变化与氧化还原反应有关,D不符合题意。
8.答案 D
解析 20个原子的质量为5×(1×10-7)3g=5×10-21g,所以一个原子的质量为2.5×10-22g,则1 mol该原子的质量为6.02×1023×2.5×10-22 g=150.5 g,摩尔质量为150.5 g·mol-1。
9. 答案 C
解析 新制氯水中含HClO,具有漂白性,会漂白pH试纸,应选pH计测定新制氯水的pH,A错误;钠投入硫酸铜溶液中,由于Na的密度小于水,会浮在水面上,Na先和水反应生成NaOH和氢气,NaOH再和硫酸铜发生复分解反应生成Cu(OH)2蓝色沉淀,B错误;过氧化钠和水反应生成氢氧化钠和氧气,氧气能使带火星的木条复燃,C正确;鲜花中含有水分,氯气和水反应生成HClO,HClO具有漂白性,所以鲜花褪色,D错误。
10. 答案 A
解析 向Ca(OH)2溶液中通入过量CO2,生成碳酸氢钙,氢氧化钙是强电解质,拆成离子的形式,碳酸氢钙是盐,也是强电解质并且能溶于水,要拆成离子的形式,其离子方程式是CO2+OH-===HCO,故A正确;向H2SO4溶液中加入Ba(OH)2溶液至中性,生成硫酸钡沉淀和水,离子方程式是2H++SO+Ba2++2OH-===BaSO4↓+2H2O,故B错误;少量的Ca(OH)2和NaHCO3溶液混合生成碳酸钙、碳酸钠和水,离子方程式是Ca2++2OH-+2HCO===CaCO3↓+CO+2H2O,故C错误;NH4HCO3溶液中加入足量NaOH溶液反应生成一水合氨、碳酸钠和水,离子方程式为NH+HCO+2OH-===NH3·H2O+CO+H2O,故D错误。
11. 答案 A
解析 先计算各物质的物质的量,再根据钠原子守恒计算溶质NaOH的物质的量,溶液体积均为0.1 L,结合c=计算比较。钠、氧化钠、过氧化钠和氢氧化钠的质量均为50 g。则:50 g钠的物质的量n== mol,则反应后生成的NaOH的物质的量也为 mol;
50 g氧化钠中含有钠离子的物质的量n=×2= mol,则反应后生成的NaOH的物质的量也为 mol;50 g过氧化钠中含有钠离子的物质的量为n=×2= mol,则反应后生成的NaOH的物质的量为 mol;50 g氢氧化钠的物质的量n== mol。c=,由于溶液体积相等,溶于水后溶液中NaOH的物质的量越大,浓度越大,则溶液的溶质物质的量浓度大小的顺序为丁<丙<乙<甲。
12.答案 B
解析 2.3 g Na的物质的量为0.1 mol,Na在O2中完全燃烧的反应为2Na+O2Na2O2,转移电子数为0.1 mol×NA mol-1=0.1NA,A错误;7.8 g Na2O2的物质的量为0.1 mol,Na2O2与CO2发生的反应为2Na2O2+2CO2===2Na2CO3+O2,对应的关系式为2Na2O2~2e-,转移电子数为0.1 mol×NA mol-1=0.1NA, B正确;56 g Fe的物质的量为1 mol,与足量Cl2完全反应生成FeCl3,则转移电子数为1 mol×3×NA mol-1=3NA,C错误;71 g Cl2的物质的量为1 mol,Cl2与足量NaOH反应生成NaCl、NaClO和H2O,对应的关系式为Cl2~e-,1 mol Cl2参与反应转移电子数为NA,D错误。
13.答案 D
14.答案 A
解析 二氧化锰和浓盐酸在加热条件下发生氧化还原反应生成氯气,但稀盐酸与二氧化锰不反应,当盐酸浓度降低时,反应停止,则盐酸不能完全消耗,故A正确;图2中涉及反应有Cl2+H2O=== HCl+HClO,2HClO2HCl+O2↑,2Cl2~O2,所以溶液达到量筒的一半,故B错误;氯气与铜反应生成棕黄色的烟,加水后溶液呈蓝色,故C错误;湿润的有色布条能褪色,是由于发生:Cl2+H2O===HCl+HClO,HClO具有漂白性,而干燥的氯气没有漂白性,故D错误。
15.答案 D
解析 今有一混合物水溶液,只可能含有以下离子中的若干种:K+、Ca2+、SO、NO、CO,现取200 mL溶液向其中加入BaCl2溶液后,得干燥沉淀8.6 g,沉淀可能为硫酸钡或碳酸钡或两者都有,排除钙离子存在,经足量盐酸洗涤、干燥后,沉淀质量为4.66 g,说明生成硫酸钡沉淀为4.66 g,硫酸钡物质的量为0.02 mol,另外还有碳酸钡沉淀质量为8.6 g-4.66 g=3.94 g,碳酸钡物质的量为0.02 mol。根据前面分析含有碳酸根物质的量为0.02 mol,溶液体积为200 mL,则溶液中c(CO)=0.1 mol L-1,故A正确;根据溶液中含有硫酸根和碳酸根,排除钙离子存在,根据溶液呈电中性,因此溶液中一定含有钾离子,可能存在NO,根据电荷守恒,钾离子物质的量大于等于0.08 mol,则溶液中c(K+)≥0.4 mol L-1,故B正确;根据分析溶液中一定没有Ca2+,可能存在NO,故C正确;溶液中一定存在K+,故D错误。
16. (1)②⑥ (2)①③④⑤⑥⑧ (3)⑦ (4)4∶1 (5)3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
解析 (1)能导电的物质通常为金属、石墨、可溶性电解质的水溶液、碱或盐的熔融物,则以上物质中能导电的是②石墨棒、⑥熔融氯化钠,故选②⑥。(2)电解质通常为酸、碱、盐、金属氧化物、卤化氢和水,以上物质中,①固体氢氧化钡、③纯醋酸、④液态氯化氢、⑤硫酸氢钾固体、⑥熔融氯化钠、⑧碳酸钠粉末属于电解质,故选①③④⑤⑥⑧。(3)以上物质中,⑦酒精(C2H5OH)属于非电解质。(4)在H2O2与上层GaAs的反应中,As元素的化合价变为+5价,则As由-3价升高为+5价,失去8e-,H2O2中的O元素由-1价降低为-2价,1个H2O2得到2e-,依据得失电子守恒,该反应的氧化剂(H2O2)与还原剂(GaAs)的物质的量之比为4∶1。(5)在反应中,Cu作还原剂,化合价由0价升高到+2价,失去2e-,NO为还原产物,N元素化合价由+5价降为+2价,得到3e-,依据得失电子总数相等,调整Cu的化学计量数为3,NO的化学计量数为2,再依据元素守恒,便可确定其他物质的化学计量数,从而得出配平的化学方程式为3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O。
17. (1)Na2CO3 (2)2Na+2H2O===2Na++2OH-+H2↑ (3)安静燃烧,产生苍白色火焰,瓶口有白雾 (4)bd (5)1∶2
解析 已知:A是金属单质,且焰色试验为黄色,则A为Na,Y是非金属单质,且呈黄绿色,则Y为Cl2,X为常见温室气体,则X为CO2。Na与水反应生成氢氧化钠和氢气,氢气和氯气反应生成氯化氢,氢氧化钠和二氧化碳反应生成碳酸钠,碳酸钠、水和二氧化碳反应生成碳酸氢钠,碳酸氢钠和氢氧化钠反应生成碳酸钠。(1)根据分析可知D为碳酸钠,其化学式为Na2CO3。(2)A→B是钠和水反应生成氢氧化钠和氢气,其反应的离子方程式为2Na+2H2O===2Na++2OH-+H2↑。(3)C在Y中燃烧即氢气在氯气中燃烧生成氯化氢,其实验现象为安静燃烧,产生苍白色火焰,瓶口有白雾。(4)D(碳酸钠)、E(碳酸氢钠)两种溶液,两者滴加氢氧化钙溶液,都生成白色沉淀,不能鉴别,故a错误;A在Y中加热反应,有黄色火焰产生,生成白烟,故b正确;若G是A在空气中加热生成的,则G为过氧化钠,过氧化钠和水反应生成氢氧化钠(B)和氧气,过氧化钠和二氧化碳反应生成碳酸钠(D)和氧气,故c错误;将A投入到E的溶液中,Na先与碳酸氢钠溶液中水反应生成氢氧化钠,氢氧化钠再和碳酸氢钠反应生成碳酸钠,故d正确。(5)C与Y反应后的混合气体通入200 mL 2.0 mol L-1的NaOH溶液中,NaOH恰好完全反应,产物中存在YO-(与消毒液有效成分相同的阴离子),其物质的量为0.1 mol,根据Cl2+2NaOH===NaCl+NaClO+H2O,则说明氯气物质的量为0.1 mol,消耗氢氧化钠物质的量为0.2 mol,而200 mL 2.0 mol L-1的NaOH溶液中NaOH物质的量为0.4 mol,则还有0.2 mol NaOH用于与HCl反应,则HCl物质的量为0.2 mol,生成0.2 mol HCl需要0.1 mol H2和0.1 mol Cl2,则C与Y的物质的量之比为0.1 mol∶(0.1 mol+0.1 mol)=1∶2。
18.答案 (1)圆底烧瓶 饱和食盐水 (2)水浴加热 Cl2+2OH-===ClO-+Cl-+H2O 避免生成NaClO3 (3)吸收尾气(Cl2) AC (4)过滤 少量(冷)水洗涤 (5)紫 小于
解析 本实验目的是制备KClO3和NaClO,并探究其氧化还原性质;首先利用浓盐酸和MnO2粉末共热制取氯气,生成的氯气中混有HCl气体,可在装置a中盛放饱和食盐水,将HCl气体除去;之后氯气与KOH溶液在水浴加热的条件发生反应制备KClO3,再与NaOH溶液在冰水浴中反应制备NaClO;氯气有毒会污染空气,所以需要d装置吸收未反应的氯气。(1)根据盛放MnO2粉末的仪器结构可知该仪器为圆底烧瓶;a中盛放饱和食盐水除去氯气中混有的HCl气体。(2)根据装置图可知盛有KOH溶液的试管放在盛有水的大烧杯中加热,该加热方式为水浴加热;c中氯气在NaOH溶液中发生歧化反应生成氯化钠、次氯酸钠和水,结合元素守恒可得离子方程式为Cl2+2OH-===ClO-+Cl-+H2O;根据氯气与KOH溶液的反应可知,加热条件下氯气可以和强碱溶液反应生成氯酸盐,所以冰水浴的目的是避免生成NaClO3。(3)氯气有毒,所以d装置的作用是吸收尾气(Cl2);Na2S可以将氯气还原成氯离子,可以吸收氯气,故A选;氯气在NaCl溶液中溶解度很小,无法吸收氯气,故B不选;氯气可以与Ca(OH)2悬浊液反应生成氯化钙、次氯酸钙和水,故C选;氯气与硫酸不反应,且硫酸溶液中存在大量氢离子会降低氯气的溶解度,故D不选。(4)b中试管为KClO3和KCl的混合溶液,KClO3的溶解度受温度影响更大,所以将试管b中混合溶液冷却结晶、过滤、少量(冷)水洗涤、干燥,得到KClO3晶体。(5)1号试管溶液颜色不变,2号试管溶液变为棕色,说明1号试管中氯酸钾没有将碘离子氧化,2号试管中次氯酸钠将碘离子氧化成碘单质,即该条件下KClO3的氧化能力小于NaClO;碘单质更易溶于CCl4,所以加入CCl4振荡,静置后CCl4层显紫色。
化学试卷
一、选择题(共15小题,第小题4分,共60分)
1.分类是一种重要的学习方法。物质的分类如图所示,下列说法中正确的是( )
A.图甲所示的分类方法属于树状分类法
B.酸性氧化物一定是非金属氧化物
C.Fe(OH)3胶体属于碱
D.图甲中“……”包含混合物
2.下列物质中能导电同时又属于电解质的是( )
A.Na2SO4溶液 B.熔融NaNO3
C.氨水 D.液态氯化氢
3.下列化学事故处理方法正确的是( )
A.酒精灯着火时可用水扑灭
B.有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,向高处撤离
C.不慎将碱液溅到眼中,应立即用硫酸溶液冲洗,边洗边眨眼睛
D.金属钠通常保存在煤油中,着火时可以用水和二氧化碳灭火
4.三种物质间只通过一步反应就能实现如箭头所指方向的转化,下列符合要求的组合是( )
A.①② B.①③
C.②③ D.①②③
5.下列物质中,摩尔质量最大的是( )
A.10 mL H2O B.0.8 mol H2SO4
C.54 g Al D.1 g CaCO3
6.下列钠及其化合物的性质与用途具有对应关系的是( )
A.Na有还原性,可用于制造高压钠灯
B.Na2O2有漂白性,可用作呼吸面具的供氧剂
C.Na2CO3溶液有碱性,可用于治疗胃酸过多
D.NaHCO3受热易分解,可用于焙制糕点
7.下列颜色变化与氧化还原反应无关的是( )
A.湿润的红色布条遇氯气褪色
B.棕黄色氯化铁饱和溶液滴入沸水中变红褐色
C.紫红色酸性高锰酸钾溶液中通入HCl气体后褪色
D.淡黄色过氧化钠固体露置于空气中逐渐变为白色
8.某固体仅由一种元素组成,其密度为5 g·cm-3。用X射线研究该固体的结果表明:在棱长为1×10-7 cm的立方体中含有20个原子,则此元素的相对原子质量最接近( )
A.32 B.65 C.140 D.150
9.下列实验操作对应的现象符合事实的是( )
A.用pH试纸可以测出新制氯水的pH B.钠投入硫酸铜溶液中,钠沉在烧杯底部,且产生红色固体 C.向过氧化钠粉末中加入少量水,产生的气体能使带火星的木条复燃 D.向充满干燥Cl2的集气瓶中放入有色鲜花,一段时间后,鲜花颜色无明显变化
10. 下列离子方程式正确的是( )
A.向Ca(OH)2溶液中通入过量CO2:CO2+OH-===HCO
B.向H2SO4溶液中加入Ba(OH)2溶液至中性:H++OH-===H2O
C.少量的Ca(OH)2和NaHCO3溶液混合:OH-+Ca2++HCO===CaCO3↓+H2O
D.NH4HCO3溶液中加入足量NaOH溶液:NH+OH-===NH3·H2O
11.在甲、乙、丙、丁四个烧杯中分别放入50 g的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入水配成100 mL溶液,搅拌,使固体完全溶解,则甲、乙、丙、丁内溶液的溶质物质的量浓度大小的顺序为( )
A.丁<丙<乙<甲 B.丁<甲<乙=丙
C.甲=丁<乙=丙 D.丁<甲<乙<丙
12.设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.2.3 g Na在足量O2中完全燃烧转移电子数为0.2NA
B.7.8 g Na2O2与足量CO2完全反应,转移电子数为0.1NA
C.56 g Fe与足量Cl2完全反应,转移电子数为2NA
D.71 g Cl2和足量NaOH完全反应,转移电子数为2NA
13.下列操作过程中一定有氧化还原反应发生的是( )
14.用下列装置制备并检验Cl2的性质,下列说法正确的是( )
A.图1:实验室制氯气,即使MnO2过量,盐酸也不能全部反应完
B.图2:充分光照后,溶液充满量筒
C.图3:生成蓝色的烟,若在集气瓶中加入少量水,所得溶液呈绿色
D.图4:干燥的有色布条不褪色,湿润的有色布条能褪色,说明Cl2有漂白性
15.今有一混合物水溶液,只可能含有以下离子中的若干种:K+、Ca2+、SO、NO、CO,现取200 mL溶液向其中加入BaCl2溶液后,得干燥沉淀8.6 g,经足量盐酸洗涤、干燥后,沉淀质量为4.66 g。根据上述实验,以下推断不正确的是
A.溶液中c(CO)=0.1 mol L-1
B.溶液中c(K+)≥0.4 mol L-1
C.溶液中一定没有Ca2+,可能存在NO
D.溶液中一定存在CO、SO,K+是否存在,要进行焰色试验
二、非选择题(共3小题,40分)
16.(13分)Ⅰ.现有下列物质:①固体氢氧化钡,②石墨棒,③纯醋酸,④液态氯化氢,⑤硫酸氢钾固体,⑥熔融氯化钠,⑦酒精(C2H5OH),⑧碳酸钠粉末。请用序号回答下列问题:
(1)以上物质中能导电的是__________________。
(2)以上物质中属于电解质的是__________________。
(3)以上物质中属于非电解质的是__________。
Ⅱ.高纯AlAs(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止刻蚀液与下层(砷化镓)反应。
(4)(4分)已知:Ga和Al最外层电子数相同,As和N最外层电子数相同。在H2O2与上层GaAs的反应中,As元素的化合价变为+5价,则该反应的氧化剂与还原剂的物质的量之比为____________。
(5)(3分)配平下列化学方程式
________Cu+________HNO3(稀)===______Cu(NO3)2+______NO↑+_____H2O。
17.(12分)(2022·浙江北斗联盟高一上期中) 如图所示物质之间的转化,已知:A是金属单质,且焰色试验为黄色,Y是非金属单质,且呈黄绿色,X为常见温室气体。按要求回答下列问题:
(1)D的化学式:__________________。
(2)A→B反应的离子方程式:___________________________________________________
____________________________________________________________________________。
(3)C在Y中燃烧的实验现象:__________________________________________________
___________________________________________________________________________。
(4)(4分)下列说法正确的是________(填字母)。
a.D、E两种溶液,可以滴加氢氧化钙溶液鉴别,也可以滴加氯化钙溶液鉴别
b.A在Y中加热反应,有黄色火焰产生
c.若G是A在空气中加热生成的,则在一定条件下G能转化为B,但不能转化为D
d.将A投入到E的溶液中,也会有D生成
(5)(3分)C与Y反应后的混合气体通入200 mL 2.0 mol L-1的NaOH溶液中,NaOH恰好完全反应,产物中存在YO-(与消毒液有效成分相同的阴离子),其物质的量为0.1 mol,则C与Y的物质的量之比为______。
18.(15分)氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
回答下列问题:
(1)(2分)盛放MnO2粉末的仪器名称是____________,a中的试剂为____________。
(2)b中采用的加热方式是____________,c中反应的离子方程式是____________________,
采用冰水浴冷却的目的是____________________。
(3)(3分)d的作用是____________,可选用试剂________(填字母)。
A.Na2S B.NaCl
C.Ca(OH)2 D.H2SO4
(4)(2分)反应结束后,取出b中试管,经冷却结晶,____________,____________,干燥,得到KClO3晶体。
(5)(2分)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显____________色。可知该条件下KClO3的氧化能力____________(填“大于”或“小于”)NaClO。
参考答案
1.答案 A
解析 由题干信息可知,图甲所示的分类方法属于树状分类法,A正确;酸性氧化物不一定是非金属氧化物,如Mn2O7是金属氧化物,属于酸性氧化物,B错误;Fe(OH)3胶体是混合物,而酸、碱、盐均属于纯净物,属于化合物,故Fe(OH)3胶体不属于碱,C错误;化合物是指含有两种或两种以上元素的纯净物,故图甲中“……”不包含混合物,D错误。
2.答案 B
解析 Na2SO4溶液是混合物,不属于电解质,故A不符合题意;硝酸钠是电解质,熔融硝酸钠能电离出自由移动的钠离子和硝酸根离子,能导电,故B符合题意;氨水是混合物,不属于电解质,故C不符合题意;氯化氢是共价化合物,属于电解质,液态氯化氢不能电离出自由移动的离子,不能导电,故D不符合题意。
3.答案 B
解析 酒精的密度小于水的密度,酒精燃烧时,用水灭火时不但不能灭火,而且能扩大燃烧面积,应该用湿抹布盖灭,A错误;肥皂水呈弱碱性,可以吸收氯气,氯气密度比空气大,氯气泄漏时人应该往高处走,故有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,向高处撤离,B正确;不慎将碱液溅到眼中,应该用大量的水冲洗,边洗边眨眼睛,硫酸具有腐蚀性,不能用硫酸溶液冲洗,C错误;钠与空气中的水蒸气、O2极易反应而变质,密度比煤油大,故金属钠通常保存在煤油中,由于钠与过氧化钠均可与水和二氧化碳反应,且有H2和O2生成,故金属钠着火时不可以用水和二氧化碳灭火,D错误。
4.答案 D
5.答案 D
解析 摩尔质量以g·mol-1为单位时,在数值上等于其相对原子质量或相对分子质量,与其质量或体积的大小无关。H2O的摩尔质量为18 g·mol-1,H2SO4的摩尔质量为98 g·mol-1,Al的摩尔质量为27 g·mol-1,CaCO3的摩尔质量为100 g·mol-1。
6.答案 D
解析 高压钠灯发出的黄光射程远,透雾力强,将钠应用于电光源上,与还原性无关,A错误;Na2O2与水或二氧化碳反应均能生成氧气,故可用作呼吸面具的供氧剂,与漂白性无关,B错误;Na2CO3溶液有碱性,但碱性较强,不宜用于治疗胃酸过多,C错误;NaHCO3受热易分解产生气体,可用于焙制糕点 ,对应关系正确,D正确。
7.答案 B
解析 氯气与水反应生成盐酸和次氯酸,其反应的化学方程式为Cl2+H2O===HCl+HClO,生成的次氯酸具有强氧化性,能使红色布条褪色,该反应为氧化还原反应,颜色变化与氧化还原反应有关,A不符合题意;Fe3+在水溶液中呈棕黄色,FeCl3饱和溶液滴入沸水中,Fe3+与H2O反应生成红褐色的氢氧化铁胶体,其反应的离子方程式为Fe3++3H2OFe(OH)3(胶体)+3H+,该反应不是氧化还原反应,颜色变化与氧化还原反应无关,B符合题意;酸性KMnO4溶液具有强氧化性,HCl具有还原性,可以被酸性KMnO4溶液氧化,从而使紫色褪色,该反应为氧化还原反应,颜色变化与氧化还原反应有关,C不符合题意;Na2O2固体露置于空气中,易与空气中的水蒸气和二氧化碳反应,其反应的化学方程式为2Na2O2+2H2O===4NaOH+O2↑,2Na2O2+2CO2===2Na2CO3+O2,NaOH也易与二氧化碳反应,其反应的化学方程式为2NaOH+CO2===Na2CO3+H2O,Na2CO3是白色粉末,所以淡黄色逐渐变为白色,该过程存在氧化还原反应,颜色变化与氧化还原反应有关,D不符合题意。
8.答案 D
解析 20个原子的质量为5×(1×10-7)3g=5×10-21g,所以一个原子的质量为2.5×10-22g,则1 mol该原子的质量为6.02×1023×2.5×10-22 g=150.5 g,摩尔质量为150.5 g·mol-1。
9. 答案 C
解析 新制氯水中含HClO,具有漂白性,会漂白pH试纸,应选pH计测定新制氯水的pH,A错误;钠投入硫酸铜溶液中,由于Na的密度小于水,会浮在水面上,Na先和水反应生成NaOH和氢气,NaOH再和硫酸铜发生复分解反应生成Cu(OH)2蓝色沉淀,B错误;过氧化钠和水反应生成氢氧化钠和氧气,氧气能使带火星的木条复燃,C正确;鲜花中含有水分,氯气和水反应生成HClO,HClO具有漂白性,所以鲜花褪色,D错误。
10. 答案 A
解析 向Ca(OH)2溶液中通入过量CO2,生成碳酸氢钙,氢氧化钙是强电解质,拆成离子的形式,碳酸氢钙是盐,也是强电解质并且能溶于水,要拆成离子的形式,其离子方程式是CO2+OH-===HCO,故A正确;向H2SO4溶液中加入Ba(OH)2溶液至中性,生成硫酸钡沉淀和水,离子方程式是2H++SO+Ba2++2OH-===BaSO4↓+2H2O,故B错误;少量的Ca(OH)2和NaHCO3溶液混合生成碳酸钙、碳酸钠和水,离子方程式是Ca2++2OH-+2HCO===CaCO3↓+CO+2H2O,故C错误;NH4HCO3溶液中加入足量NaOH溶液反应生成一水合氨、碳酸钠和水,离子方程式为NH+HCO+2OH-===NH3·H2O+CO+H2O,故D错误。
11. 答案 A
解析 先计算各物质的物质的量,再根据钠原子守恒计算溶质NaOH的物质的量,溶液体积均为0.1 L,结合c=计算比较。钠、氧化钠、过氧化钠和氢氧化钠的质量均为50 g。则:50 g钠的物质的量n== mol,则反应后生成的NaOH的物质的量也为 mol;
50 g氧化钠中含有钠离子的物质的量n=×2= mol,则反应后生成的NaOH的物质的量也为 mol;50 g过氧化钠中含有钠离子的物质的量为n=×2= mol,则反应后生成的NaOH的物质的量为 mol;50 g氢氧化钠的物质的量n== mol。c=,由于溶液体积相等,溶于水后溶液中NaOH的物质的量越大,浓度越大,则溶液的溶质物质的量浓度大小的顺序为丁<丙<乙<甲。
12.答案 B
解析 2.3 g Na的物质的量为0.1 mol,Na在O2中完全燃烧的反应为2Na+O2Na2O2,转移电子数为0.1 mol×NA mol-1=0.1NA,A错误;7.8 g Na2O2的物质的量为0.1 mol,Na2O2与CO2发生的反应为2Na2O2+2CO2===2Na2CO3+O2,对应的关系式为2Na2O2~2e-,转移电子数为0.1 mol×NA mol-1=0.1NA, B正确;56 g Fe的物质的量为1 mol,与足量Cl2完全反应生成FeCl3,则转移电子数为1 mol×3×NA mol-1=3NA,C错误;71 g Cl2的物质的量为1 mol,Cl2与足量NaOH反应生成NaCl、NaClO和H2O,对应的关系式为Cl2~e-,1 mol Cl2参与反应转移电子数为NA,D错误。
13.答案 D
14.答案 A
解析 二氧化锰和浓盐酸在加热条件下发生氧化还原反应生成氯气,但稀盐酸与二氧化锰不反应,当盐酸浓度降低时,反应停止,则盐酸不能完全消耗,故A正确;图2中涉及反应有Cl2+H2O=== HCl+HClO,2HClO2HCl+O2↑,2Cl2~O2,所以溶液达到量筒的一半,故B错误;氯气与铜反应生成棕黄色的烟,加水后溶液呈蓝色,故C错误;湿润的有色布条能褪色,是由于发生:Cl2+H2O===HCl+HClO,HClO具有漂白性,而干燥的氯气没有漂白性,故D错误。
15.答案 D
解析 今有一混合物水溶液,只可能含有以下离子中的若干种:K+、Ca2+、SO、NO、CO,现取200 mL溶液向其中加入BaCl2溶液后,得干燥沉淀8.6 g,沉淀可能为硫酸钡或碳酸钡或两者都有,排除钙离子存在,经足量盐酸洗涤、干燥后,沉淀质量为4.66 g,说明生成硫酸钡沉淀为4.66 g,硫酸钡物质的量为0.02 mol,另外还有碳酸钡沉淀质量为8.6 g-4.66 g=3.94 g,碳酸钡物质的量为0.02 mol。根据前面分析含有碳酸根物质的量为0.02 mol,溶液体积为200 mL,则溶液中c(CO)=0.1 mol L-1,故A正确;根据溶液中含有硫酸根和碳酸根,排除钙离子存在,根据溶液呈电中性,因此溶液中一定含有钾离子,可能存在NO,根据电荷守恒,钾离子物质的量大于等于0.08 mol,则溶液中c(K+)≥0.4 mol L-1,故B正确;根据分析溶液中一定没有Ca2+,可能存在NO,故C正确;溶液中一定存在K+,故D错误。
16. (1)②⑥ (2)①③④⑤⑥⑧ (3)⑦ (4)4∶1 (5)3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
解析 (1)能导电的物质通常为金属、石墨、可溶性电解质的水溶液、碱或盐的熔融物,则以上物质中能导电的是②石墨棒、⑥熔融氯化钠,故选②⑥。(2)电解质通常为酸、碱、盐、金属氧化物、卤化氢和水,以上物质中,①固体氢氧化钡、③纯醋酸、④液态氯化氢、⑤硫酸氢钾固体、⑥熔融氯化钠、⑧碳酸钠粉末属于电解质,故选①③④⑤⑥⑧。(3)以上物质中,⑦酒精(C2H5OH)属于非电解质。(4)在H2O2与上层GaAs的反应中,As元素的化合价变为+5价,则As由-3价升高为+5价,失去8e-,H2O2中的O元素由-1价降低为-2价,1个H2O2得到2e-,依据得失电子守恒,该反应的氧化剂(H2O2)与还原剂(GaAs)的物质的量之比为4∶1。(5)在反应中,Cu作还原剂,化合价由0价升高到+2价,失去2e-,NO为还原产物,N元素化合价由+5价降为+2价,得到3e-,依据得失电子总数相等,调整Cu的化学计量数为3,NO的化学计量数为2,再依据元素守恒,便可确定其他物质的化学计量数,从而得出配平的化学方程式为3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O。
17. (1)Na2CO3 (2)2Na+2H2O===2Na++2OH-+H2↑ (3)安静燃烧,产生苍白色火焰,瓶口有白雾 (4)bd (5)1∶2
解析 已知:A是金属单质,且焰色试验为黄色,则A为Na,Y是非金属单质,且呈黄绿色,则Y为Cl2,X为常见温室气体,则X为CO2。Na与水反应生成氢氧化钠和氢气,氢气和氯气反应生成氯化氢,氢氧化钠和二氧化碳反应生成碳酸钠,碳酸钠、水和二氧化碳反应生成碳酸氢钠,碳酸氢钠和氢氧化钠反应生成碳酸钠。(1)根据分析可知D为碳酸钠,其化学式为Na2CO3。(2)A→B是钠和水反应生成氢氧化钠和氢气,其反应的离子方程式为2Na+2H2O===2Na++2OH-+H2↑。(3)C在Y中燃烧即氢气在氯气中燃烧生成氯化氢,其实验现象为安静燃烧,产生苍白色火焰,瓶口有白雾。(4)D(碳酸钠)、E(碳酸氢钠)两种溶液,两者滴加氢氧化钙溶液,都生成白色沉淀,不能鉴别,故a错误;A在Y中加热反应,有黄色火焰产生,生成白烟,故b正确;若G是A在空气中加热生成的,则G为过氧化钠,过氧化钠和水反应生成氢氧化钠(B)和氧气,过氧化钠和二氧化碳反应生成碳酸钠(D)和氧气,故c错误;将A投入到E的溶液中,Na先与碳酸氢钠溶液中水反应生成氢氧化钠,氢氧化钠再和碳酸氢钠反应生成碳酸钠,故d正确。(5)C与Y反应后的混合气体通入200 mL 2.0 mol L-1的NaOH溶液中,NaOH恰好完全反应,产物中存在YO-(与消毒液有效成分相同的阴离子),其物质的量为0.1 mol,根据Cl2+2NaOH===NaCl+NaClO+H2O,则说明氯气物质的量为0.1 mol,消耗氢氧化钠物质的量为0.2 mol,而200 mL 2.0 mol L-1的NaOH溶液中NaOH物质的量为0.4 mol,则还有0.2 mol NaOH用于与HCl反应,则HCl物质的量为0.2 mol,生成0.2 mol HCl需要0.1 mol H2和0.1 mol Cl2,则C与Y的物质的量之比为0.1 mol∶(0.1 mol+0.1 mol)=1∶2。
18.答案 (1)圆底烧瓶 饱和食盐水 (2)水浴加热 Cl2+2OH-===ClO-+Cl-+H2O 避免生成NaClO3 (3)吸收尾气(Cl2) AC (4)过滤 少量(冷)水洗涤 (5)紫 小于
解析 本实验目的是制备KClO3和NaClO,并探究其氧化还原性质;首先利用浓盐酸和MnO2粉末共热制取氯气,生成的氯气中混有HCl气体,可在装置a中盛放饱和食盐水,将HCl气体除去;之后氯气与KOH溶液在水浴加热的条件发生反应制备KClO3,再与NaOH溶液在冰水浴中反应制备NaClO;氯气有毒会污染空气,所以需要d装置吸收未反应的氯气。(1)根据盛放MnO2粉末的仪器结构可知该仪器为圆底烧瓶;a中盛放饱和食盐水除去氯气中混有的HCl气体。(2)根据装置图可知盛有KOH溶液的试管放在盛有水的大烧杯中加热,该加热方式为水浴加热;c中氯气在NaOH溶液中发生歧化反应生成氯化钠、次氯酸钠和水,结合元素守恒可得离子方程式为Cl2+2OH-===ClO-+Cl-+H2O;根据氯气与KOH溶液的反应可知,加热条件下氯气可以和强碱溶液反应生成氯酸盐,所以冰水浴的目的是避免生成NaClO3。(3)氯气有毒,所以d装置的作用是吸收尾气(Cl2);Na2S可以将氯气还原成氯离子,可以吸收氯气,故A选;氯气在NaCl溶液中溶解度很小,无法吸收氯气,故B不选;氯气可以与Ca(OH)2悬浊液反应生成氯化钙、次氯酸钙和水,故C选;氯气与硫酸不反应,且硫酸溶液中存在大量氢离子会降低氯气的溶解度,故D不选。(4)b中试管为KClO3和KCl的混合溶液,KClO3的溶解度受温度影响更大,所以将试管b中混合溶液冷却结晶、过滤、少量(冷)水洗涤、干燥,得到KClO3晶体。(5)1号试管溶液颜色不变,2号试管溶液变为棕色,说明1号试管中氯酸钾没有将碘离子氧化,2号试管中次氯酸钠将碘离子氧化成碘单质,即该条件下KClO3的氧化能力小于NaClO;碘单质更易溶于CCl4,所以加入CCl4振荡,静置后CCl4层显紫色。
同课章节目录
