3.1 铁及其化合物 同步练习(含解析)2023-2024学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 3.1 铁及其化合物 同步练习(含解析)2023-2024学年上学期高一化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 148.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 16:39:34 | ||
图片预览




文档简介
3.1 铁及其化合物 同步练习
一、单选题
1.铁及其化合物是中学化学中重要的物质。下列有关铁及其化合物说法正确的是( )
A.被腐蚀的铁制品属于可回收垃圾
B.不能通过物理方法将铁粉和铝粉分离
C.铁锈的主要成分是
D.指南针中因含有而可以指定方位
2.向溶液中滴入几滴KSCN溶液,出现的现象为
A.红色沉淀 B.棕黄色溶液 C.红色溶液 D.浅绿色溶液
3.世界上有名的“鬼谷”马沃山谷,每当下雨电闪雷鸣时,山谷中就会传出战场厮杀的声音,甚至还有人影。但是天晴之后,山谷中就不会出现这种现象。经过相关人员研究发现是山谷中存在大量的磁铁矿导致了这种异常现象的产生,磁铁的主要成分是
A. B. C. D.
4.能由单质直接化合得到的化合物是( )
A.NO2 B.FeCl2 C.FeCl3 D.CuS
5.下列有关物质颜色,正确的组合是( )
①FeSO4 7H2O 棕黄色 ②Fe2O3 红棕色 ③Fe(OH)2 白色
④ Fe3O4 黑色 ⑤CuSO4 5H2O 白色 ⑥HCl 无色
A.①②③④
B.②③④⑥
C.②③④⑤
D.①②④⑥
6.下列有关铁及其化合物说法错误的是( )
A.将饱和氯化铁溶液滴入沸水中继续煮沸,可制得氢氧化铁胶体
B.FeCl2既有氧化性又有还原性
C.铁与硫酸铜溶液反应后滴加KSCN溶液,溶液变红
D.生铁和钢都是铁的合金,其中生铁的含碳量高于钢
7.在含有FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的NaOH溶液,在空气中充分搅拌,反应后再加入过量的稀盐酸,溶液中离子数目减少的是( )
A.Na+ B.Fe3+ C.Fe2+ D.Al3+
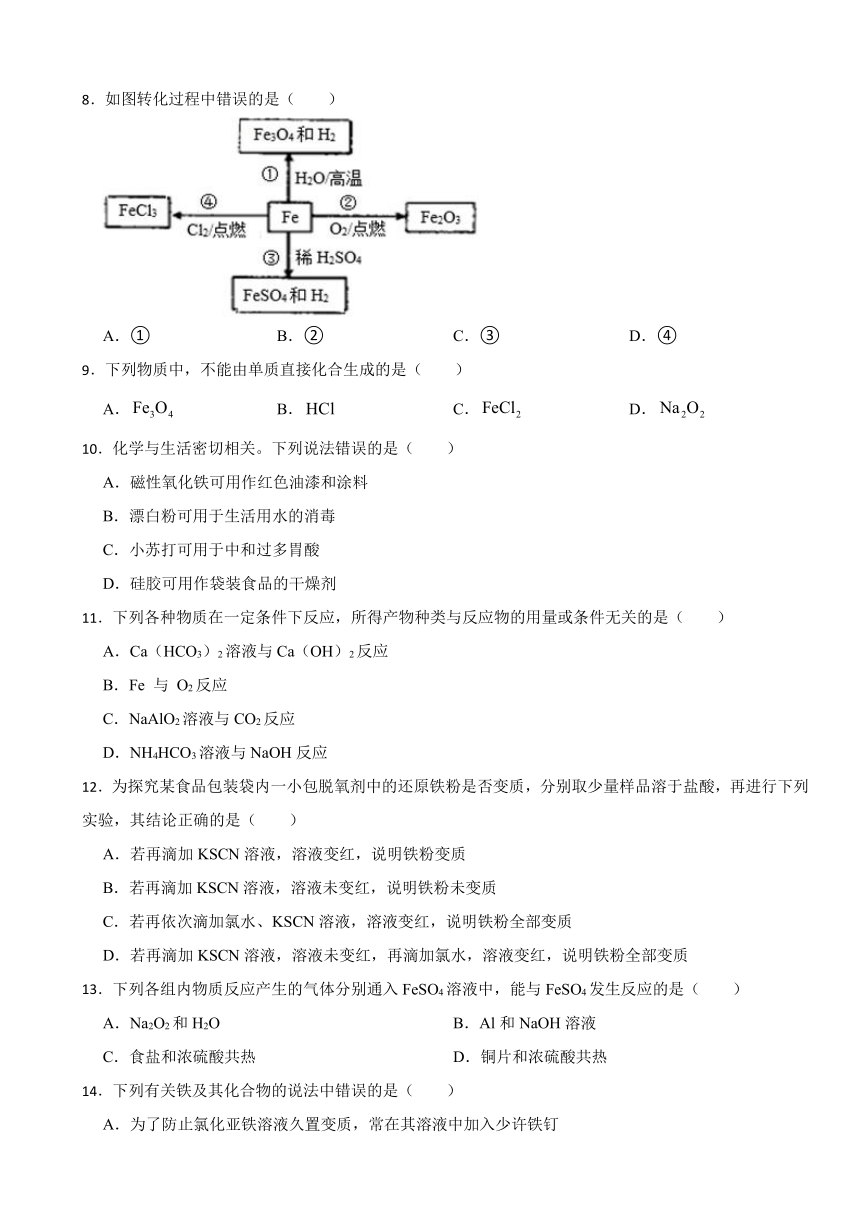
8.如图转化过程中错误的是( )
A.① B.② C.③ D.④
9.下列物质中,不能由单质直接化合生成的是( )
A. B. C. D.
10.化学与生活密切相关。下列说法错误的是( )
A.磁性氧化铁可用作红色油漆和涂料
B.漂白粉可用于生活用水的消毒
C.小苏打可用于中和过多胃酸
D.硅胶可用作袋装食品的干燥剂
11.下列各种物质在一定条件下反应,所得产物种类与反应物的用量或条件无关的是( )
A.Ca(HCO3)2溶液与Ca(OH)2反应
B.Fe 与 O2反应
C.NaAlO2溶液与CO2反应
D.NH4HCO3溶液与NaOH反应
12.为探究某食品包装袋内一小包脱氧剂中的还原铁粉是否变质,分别取少量样品溶于盐酸,再进行下列实验,其结论正确的是( )
A.若再滴加KSCN溶液,溶液变红,说明铁粉变质
B.若再滴加KSCN溶液,溶液未变红,说明铁粉未变质
C.若再依次滴加氯水、KSCN溶液,溶液变红,说明铁粉全部变质
D.若再滴加KSCN溶液,溶液未变红,再滴加氯水,溶液变红,说明铁粉全部变质
13.下列各组内物质反应产生的气体分别通入FeSO4溶液中,能与FeSO4发生反应的是( )
A.Na2O2和H2O B.Al和NaOH溶液
C.食盐和浓硫酸共热 D.铜片和浓硫酸共热
14.下列有关铁及其化合物的说法中错误的是( )
A.为了防止氯化亚铁溶液久置变质,常在其溶液中加入少许铁钉
B.将饱和FeCl3溶液滴入沸水中,能形成胶体
C.新制的氢氧化亚铁沉淀露置在空气中最终会变为红褐色
D.除去FeCl3溶液中的FeCl2杂质可以向溶液中加铁粉,然后过滤
15.为了防止FeSO4被氧化而变质,实验室在配制FeSO4溶液时,常在溶液中加入少量的( )
A.铜粉 B.铁粉 C.锌粉 D.Fe2(SO4)
16.运用所学知识,找出金属钠与金属铁的共同性质,下列说法正确的是( )
A.都能从硫酸铜溶液中置换出铜
B.都是银白色的金属,质软
C.常温下,都能与水反应生成氢气
D.一定条件下,都能与氧气反应
二、综合题
17.量取8.0 mL 5.0 mol·L-1 H2SO4溶液,加蒸馏水稀释至100 mL,取两份稀释后的H2SO4溶液各25 mL,分别加入等质量的Zn和Fe,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)。请计算:
(1)稀释后H2SO4溶液的物质的量浓度为 mol·L-1。
(2)加入Fe的质量至少有 g。
18.电子工业中常用覆铜板为基础材料制作印刷电路板,工业上利用溶液作为“腐蚀液”将覆铜板上不想要的铜腐蚀,同时还可以从腐蚀废液(主要含、和)中回收铜,并重新获得溶液。废液处理流程如下:
请回答下列问题。
(1)操作的名称为 。
(2)溶液腐蚀铜板的离子方程式为 。
(3)试剂为 (填化学式)。沉淀为 (填化学式)。从氧化还原反应的角度分析,试剂是 剂。
(4)为了检验腐蚀废液中是否含有,可将腐蚀废液取样然后滴加 (填化学式)溶液。
(5)查阅资料可知能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,请写出反应的离子方程式 。但是检验腐蚀废液中是否含有,不能用酸性高锰酸钾溶液进行检验,原因是 。
(6)向溶液中加入溶液的实验现象为 。
19.某酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对废液进行处理(所加试剂均稍过量),以回收金属,保护环境。
请回答:
(1)沉淀a中含有的单质是 ;
(2)沉淀b的化学式是 ;
(3)沉淀c的化学式是 ;
(4)溶液A与H2O2溶液在酸性条件下反应的离子方程式是 。
20.高三一年的化学复习,学生要抓住两方面,一方面是教材,另一方面是历年的高考真题。每年的高考题,在教材中几乎都能找到影子,所以同学们一定要紧紧抓住教材,根据《必修一》第三章和第四章的内容回答下列问题:
(1)实验3-1是取用钠单质的实验,用品有小刀, 、 、培养皿。
(2)铁是人类应用最广泛,铁的氧化物有三种,其中Fe3O4是一种具有 的黑色晶体,俗称磁性氧化铁.Fe2O3的用途 (举一例)。
(3)氢氧化铝其有两性,写出氢氧化铝分别溶于强酸和强碱的离子方程式 。
(4)在抗震救灾中要用到大量漂白粉和漂白液杀菌消毒,漂白粉的制取过程如下:通过煅烧石灰石得到生石灰,生石灰溶于水得石灰乳,在向石灰乳中通入氯气反应得漂白粉,有关的反应化学方程式为:CaCO3 CaO+CO2↑ 、 。
21.同学们在实验室里用废铁屑(含少量铜)制取FeCl3·6H2O的流程如下。
请回答下列问题。
(1)固体中加入过量稀盐酸时的现象是 。
(2)溶液中通入Cl2时发生反应的化学方程式是 ,反应中Cl2表现出的性质是 ,此处的Cl2也可以用 代替(填序号)。
A.H2O2 B.SO2 C.浓硫酸
(3)上述流程中由浓缩后的溶液获取FeCl3·6H2O的操作包括 、过滤、洗涤。
(4)用FeCl3溶液制备Fe2O3,可向FeCl3溶液中滴加足量 ,然后过滤、洗涤、 ,即可得到Fe2O3。
(5)FeCl3溶液能用作印制电路铜板的腐蚀液,FeCl3溶液与铜反应的离子方程式是 ,反应一段时间后,取少量腐蚀液,向其中滴加 ,观察到 ,证明腐蚀液中任含Fe3+。此时腐蚀液中的金属阳离子是 。
答案解析部分
1.【答案】A
【解析】【解答】A.金属可以回收再利用,因此被腐蚀的铁制品属于可回收垃圾,故A符合题意;
B.铁能被磁铁吸引,因此可以通过物理方法将铁粉和铝粉分离,故B不符合题意;
C.铁锈的主要成分是,故C不符合题意;
D.指南针中因含有而可以指定方位,故D不符合题意。
故答案为:A。
【分析】A.被腐蚀的铁制品可回收重新加工;
B.铁能被磁铁吸引,而Al不能;
C.钢铁在潮湿的空气中发生电化腐蚀而生锈,铁锈的主要成分是;
D.具有磁性。
2.【答案】C
【解析】【解答】氯化铁溶液中滴入几滴KSCN溶液,发生Fe3++3SCN-Fe(SCN)3,溶液显红色,故C符合题意;
故答案为:C。
【分析】铁离子遇KSCN溶液变红色。
3.【答案】C
【解析】【解答】 磁铁的主要成分是四氧化三铁,化学式为,故C正确;
故答案为:C。
【分析】 磁铁的主要成分是四氧化三铁。
4.【答案】C
【解析】【解答】A.氮气与氧气放电条件下反应生成NO,故A不选;
B. 铁与氯气点燃条件下反应生成氯化铁,不生成氯化亚铁,故B不选;
C. 铁与氯气点燃条件下反应生成氯化铁,
D. 铜与硫反应生成Cu2S,故D不选。
故答案为:C
【分析】铁与氯气点燃条件下反应生成氯化铁,据此分析。
5.【答案】B
【解析】【解答】①FeSO4 7H2O为浅绿色,不是棕黄色,①不符合题意;
②Fe2O3为红棕色固体,②符合题意;
③Fe(OH)2为白色絮状沉淀,③符合题意;
④Fe3O4为黑色晶体,④符合题意;
⑤CuSO4 5H2O为蓝色晶体,不是白色,⑤不符合题意;
⑥HCl为无色气体,⑥符合题意;
综上,正确的组合是②③④⑥,B符合题意;
故答案为:B
【分析】根据各物质的颜色分析即可。
6.【答案】C
【解析】【解答】A.制备Fe(OH)3胶体的操作为:加热烧杯中的水至沸腾,向沸水滴加几滴饱和氯化铁溶液,继续煮沸至溶液呈红褐色,即停止加热,得到氢氧化铁胶体,A项不符合题意;
B.FeCl2中Fe呈+2价,为中间价态,因此FeCl2既有氧化性又有还原性,B项不符合题意;
C.铁与硫酸铜溶液反应的方程式为: ,反应后的溶液中无Fe3+,滴加KSCN溶液,溶液不会变红,C项符合题意;
D.生铁和钢都是碳铁合金,生铁中碳的含量高于钢中碳的含量,D项不符合题意;
故答案为:C。
【分析】硫氰酸钾主要是检验铁离子,但是铁和硫酸铜溶液反应不会查产生铁离子,主要形成的是亚铁离子,其他均正确
7.【答案】C
【解析】【解答】A、向溶液中加入NaOH,溶液中钠离子增多,A不符合题意;
B、氢氧化钠分别与FeCl3、FeCl2、AlCl3反应的方程式为:FeCl3+3NaOH=Fe(OH)3↓+3NaCl,
FeCl2+2NaOH=Fe(OH)2↓+2NaCl,AlCl3+3NaOH=Al(OH)3↓+3NaCl,
Al(OH)3+NaOH=NaAlO2+2H2O,从方程式看出分别生成氢氧化铁沉淀、氢氧化亚铁沉淀、偏铝酸钠,而偏铝酸钠与过量的盐酸反应生成铝离子,铝离子数目没有变化。生成氢氧化亚铁与空气中氧气反应全部生成氢氧化铁,反应为4Fe(OH)2+2H2O+O2=4Fe(OH)3,然后再加入过量的盐酸,氢氧化铁与盐酸反应生成氯化铁,三价铁离子数目增多,二价铁离子减少,故B不符合题意;
C、根据以上分析可知C符合题意;
D、根据以上分析可知D不符合题意;
故答案为:C
【分析】 Fe2+ 由于被氧化,最终转化为 Fe3+ 。
8.【答案】B
【解析】【解答】A.反应①中,Fe与高温水蒸气发生反应3Fe+4H2O(g) Fe3O4+4H2 ,A不符合题意;
B.反应②中,Fe与O2在点燃条件下发生反应3Fe+2O2 Fe3O4,B符合题意;
C.反应③中,Fe与稀硫酸发生反应Fe+H2SO4=FeSO4+H2↑,C不符合题意;
D.反应④中,Fe与Cl2在点燃条件下发生反应3Cl2 +2Fe 2FeCl3,D不符合题意;
故答案为:B。
【分析】①铁与水蒸气在高温下反应生成Fe3O4和H2;
②铁在氧气中点燃生成Fe3O4;
③铁与稀硫酸反应生成FeSO4和H2;
④铁在氯气中点燃生成FeCl3;
9.【答案】C
10.【答案】A
【解析】【解答】A.氧化铁可用作红色油漆和涂料,A符合题意;
B.漂白粉中含有的次氯酸钙具有杀菌消毒能力,可用于生活用水的消毒,B不符合题意;
C.小苏打能够与胃液(主要成分为盐酸)反应,胃液酸性减弱,可用于未患有胃溃疡的胃酸过多病人的治疗,C不符合题意;
D.硅胶是一种高活性吸附材料,具有很强的吸水性,可用作袋装食品的干燥剂,D不符合题意;
故答案为:A。
【分析】磁性氧化铁具有磁性且是黑色,不是红色,氧化铁可以做油漆染料
11.【答案】A
【解析】【解答】解:A.Ca(HCO3)2溶液与Ca(OH)2反应生成碳酸钙和水,所得产物种类与反应物的用量或条件无关,故A选;
B.缓慢氧化生成氧化铁,点燃生成四氧化三铁,与反应条件有关,故B不选;
C.二氧化碳少量反应生成碳酸钠和氢氧化铝,二氧化碳过量反应生成氢氧化铝和碳酸氢钠,反应产物与二氧化碳量有关,故C不选;
D.NH4HCO3溶液与NaOH反应,所得产物种类与反应物的用量有关,故D不选;
故选:A.
【分析】A.与其它条件无关,二者反应生成碳酸钙和水;
B.缓慢氧化生成氧化铁,点燃生成四氧化三铁;
C.二氧化碳少量反应生成碳酸钠和氢氧化铝,二氧化碳过量反应生成氢氧化铝和碳酸氢钠;
D.氢氧化钠少量,只反应碳酸氢根离子,氢氧化钠过量,碳酸氢根离子、氨根离子都反应.
12.【答案】A
【解析】【解答】A、若再滴加KSCN溶液,溶液变红,说明溶液中含有铁离子,可以确定还原铁粉被氧化变质,A符合题意;
B、若再滴加KSCN溶液,溶液未变红,说明溶液中无铁离子,但还原铁粉有可能被氧化为亚铁离子,B不符合题意;
C、氯水具有强氧化性,可以把亚铁离子氧化为铁离子,亚铁离子来源可能是铁与盐酸反应,故不能确定是部分氧化还是全部氧化还是没有被氧化,C不符合题意;
D、若再滴加KSCN溶液,溶液未变红,再滴加氯水,溶液变红,说明溶液中不含铁离子,含有亚铁离子,亚铁离子来源可能是铁与盐酸反应,D不符合题意;
故答案为:A
【分析】还原铁粉的主要作用是除去氧气,若变质,则铁转化为Fe3+,根据Fe3+的检验进行分析。
13.【答案】A
【解析】【解答】解:A. 过氧化钠和水反应生成氧气,氧气能将硫酸亚铁氧化成硫酸铁,故A符合题意;
B. 铝和氢氧化钠溶液反应生成氢气,氢气与硫酸亚铁溶液不反应,故B不符合题意;
C. 食盐和浓硫酸加热反应生成氯化氢气体,氯化氢气体不与硫酸亚铁发生反应,故C不符合题意;
D. 铜和浓硫酸加热反应生成二氧化硫气体,二氧化硫具有还原性和氧化性,但氧化性弱于铁离子,所以二氧化硫不能和硫酸亚铁发生反应,故D不符合题意;
故答案为:A。
【分析】A. 过氧化钠和水反应生成氧气,氧气具有氧化性,Fe2+有还原性,被氧气氧化成Fe3+
B、C中产生的 氢气和氯化氢气体具有还原性,Fe2+也是还原性,不反应
D.二氧化硫的氧化性<Fe3+
14.【答案】D
【解析】【解答】A. 亚铁离子在空气中易被氧化为三价铁离子,加铁钉可以防止氯化亚铁溶液的变质,故A不符合题意;
B. 制备氢氧化铁胶体的方法是将饱和FeCl3溶液滴入沸水中,搅拌到红褐色即可,故B不符合题意;
C. 新制的氢氧化亚铁沉淀露置在空气中迅速变成灰绿色,最终会变为红褐色的氢氧化铁,故C不符合题意;
D. 除去FeCl3溶液中的FeCl2杂质可以向溶液中滴加氯水,将氯化亚铁氧化为氯化铁,故D符合题意。
【分析】A.氯化铁可与铁反应生成氯化亚铁;
B.饱和FeCl3溶液滴入沸水中制备氢氧化铁胶体,是利用氯化铁水解加热促进生成;
C.新制的氢氧化亚铁沉淀露置在空气中最终会变为红褐色的氢氧化铁;
D. 氯化铁可与铁反应生成氯化亚铁。
15.【答案】B
【解析】【解答】FeSO4中Fe为+2价,所以极易被氧化为+3价,加入铁粉后,会与+3价的铁反应使之成为亚铁离子后,融入到FeSO4溶液中,这样便有效地减少FeSO4的损失。
故答案为:B
【分析】Fe2+不稳定,易被空气中的氧气氧化成Fe3+,为防止其氧化变质,可加入具有还原性的物质,同时不能引入新的杂质。据此判断选项。
16.【答案】D
【解析】【解答】A.金属钠先与水反应生成氢氧化钠和氢气,氢氧化钠和硫酸铜反应生成氢氧化铜,钠不能从硫酸铜溶液中置换出铜,故A不符合题意;
B.钠质软,金属铁具有一定硬度,故B不符合题意;
C.常温下,钠能和水反应生成氢氧化钠和氢气,铁与水不反应,故C不符合题意;
D.常温下,钠与氧气反应生成氧化钠;点燃条件下,铁能与氧气反应生成四氧化三铁,故D符合题意;
故答案为:D。
【分析】依据金属钠和金属铁的理化性质分析解答。
17.【答案】(1)0.40
(2)0.65
【解析】【解答】(1)H2SO4溶液各25mL,分别加入等质量的Zn和Fe,生成的氢气的体积相同,由于Fe的摩尔质量比Zn的小,所以Fe与硫酸反应时Fe过量,其反应方程式为:Fe+H2SO4=FeSO4+H2↑,由图象可知生成的氢气为n(H2)= = =0.01mol,则n(H2SO4)=n(H2)=0.01mol,c(H2SO4)= = =0.40mol/L,故答案为:0.40;(2)Zn与硫酸反应时锌完全反应,反应方程式为Zn+H2SO4=ZnSO4+H2↑,则n(Zn)=0.01mol,m(Zn)=nM=0.01mol×65g/mol=0.65g,Zn和Fe的质量相同,所以Fe的质量为0.65g,故答案为:0.65。
【分析】本题要注意稀硫酸和铁、锌反应的过程,两条曲线,前者为锌,后者为铁;
(1)根据稀释定律c浓·V浓=c稀·V稀可以进行计算;
(2)产生的氢气量相同,根据氢气的物质的量,结合化学方程式进行计算,根据物质的量之比等于化学计量数之比可以求出铁的物质的量,转化为质量即可。
18.【答案】(1)过滤
(2)2Fe3++Cu=2Fe2++Cu2+
(3)Fe;Fe和Cu;氯气
(4)KSCN
(5);氯离子也能被酸性高锰酸钾氧化,而使其褪色
(6)先生成白色沉淀、后迅速变为灰绿色,最好变为红褐色
【解析】【解答】(1)根据出来了沉淀和滤液判断,操作I的名称是:过滤。
(2)根据电子和电荷守恒配平得离子方程式为:2Fe3++Cu=2Fe2++Cu2+。
(3)根据杂质离子铜离子,所需离子是三价铁离子,故应加入的试剂a是:Fe,沉淀A为:Fe和Cu。试剂c是将二价铁氧化为三价铁,且不引入杂质,故c为:氯气。
(4)检验三价铁用KSCN,生成产物溶液显血红色。
(5)根据电荷、原子、电子守恒进行书写离子方程式为:
,由于酸性高锰酸钾具有强氧化性,能将氯离子氧化,故不能用酸性高锰酸钾进行检验。
(6)向氯化亚铁加入氢氧化钠会发生反应:FeCl2+2NaOH=Fe(OH)2+2NaCl,
4Fe(OH)2+O2+2H2O=4Fe(OH)3。故现象是:生成白色沉淀、后迅速变为灰绿色,最好变为红褐色。
【分析】(1)得到沉淀和滤液,可以判断是过滤操作
(3)有分析可知,最终要得到氯化铁和铜单子,故加入过量的铁粉,置换出铜,同时Fe3+被还原为Fe2+,最后为得到Fe3+,加入氯气或者过氧化氢进行氧化
(4)检验三价铁选择硫氰化钾即可
(5)能够是高锰酸钾褪色的还有可能是溶液中的氯离子
(6)先生成氢氧化亚铁,再被空气中的氧气氧化,变成氢氧化铁
19.【答案】(1)Cu、Fe
(2)Fe(OH)3
(3)BaCO3
(4)2Fe2++H2O2+2H+=2Fe3++2H2O
【解析】【解答】(1)由以上分析可知沉淀a中含有的单质是Fe、Cu;
(2)由以上分析可知红褐色沉淀为Fe(OH)3↓;
(3)由分析可知沉淀c为BaCO3;
(4)氧化时加入H2O2溶液与二价铁离子发生氧化还原反应,反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O;
故答案为:(1)Fe、Cu;(2)Fe(OH)3;(3)BaCO3;(4)2Fe2++2H++H2O2=2Fe3++2H2O。
【分析】酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,加入铁屑,可置换出铜,沉淀a为Fe、Cu,溶液A含有Fe2+、Ba2+,然后在溶液A中加入过氧化氢、氢氧化钠生成的红褐色沉淀为Fe(OH)3↓,溶液B含有Na+、Ba2+,加入碳酸钠溶液,可生成沉淀c为BaCO3,溶液C含有的阳离子主要为Na+。据此分析作答。
20.【答案】(1)镊子;滤纸
(2)磁性;炼铁‘涂料、红色油漆等(只要正确就给分)
(3)Al2O3+6H+=2Al3++3H2O;Al2O3 + 2OH-=2 AlO2-+2H2O
(4)CaO + H2O=Ca(OH)2;2Ca(OH)2 + 2Cl2 =Ca(ClO)2 + CaCl2 + 2H2O
【解析】【解答】(1)钠保存在煤油中,硬度较小,取用钠单质的实验,用品有小刀,镊子,滤纸,培养皿。(2)Fe3O4是一种具有磁性的黑色晶体,俗称磁性氧化铁.Fe2O3的用途有炼铁涂料、红色油漆等。(3)氢氧化铝具有两性,分别溶于强酸和强碱的离子方程式为Al2O3+6H+=2Al3++3H2O、Al2O3 + 2OH-=2 AlO2-+2H2O。(4)煅烧石灰石得到生石灰:CaCO3 CaO+CO2↑,生石灰溶于水得石灰乳:CaO+H2O=Ca(OH)2,向石灰乳中通入氯气反应得漂白粉:2Ca(OH)2 +2Cl2=Ca(ClO)2+CaCl2+2H2O。
【分析】(1)钠单质密度小,性质活泼,所以应该保存在煤油中;
(2)四氧化三铁俗称磁铁矿;氧化铁俗称赤铁矿,可以用来做涂料、油漆等;
(3)氢氧化铝属于两性氢氧化物,既可以溶于碱也可以溶于酸;
(4)制取漂白粉的反应是氢氧化钙和氯气发生氧化还原反应得到次氯酸钙、氯化钙和水。
21.【答案】(1)固体部分溶解,溶液变为浅绿色,有气泡产生
(2)2FeCl2+Cl2=2FeCl3;氧化性;A
(3)降温结晶
(4)NaOH;溶液加热灼烧
(5)2Fe3++Cu =2Fe2++Cu2+KSCN;溶液;溶液变为红色;Fe3+、Fe2+、Cu2+
【解析】【解答】(1)根据金属活动顺序表,铁和盐酸反应,铜不与盐酸反应,发生反应:Fe+2H+=Fe2++H2↑,因此现象是固体部分溶解,溶液变为浅绿色,有气泡产生;
(2)利用氯气的氧化性,把Fe2+氧化成Fe3+,因此反应方程方式为2FeCl2+Cl2=2FeCl3;氯气的化合价降低,氯气作氧化剂,表现氧化性,A、H2O2具有强氧化性,能把Fe2+氧化成Fe3+,可以,故正确;B、SO2不能把Fe2+氧化成Fe3+,故错误;D、虽然浓硫酸具有强氧化性,能把Fe2+氧化成Fe3+,但引入SO42-,故错误;
(3)产物带有结晶水,因此采用蒸发浓缩、冷却结晶、过滤方法得到FeCl3·6H2O;
(4)需要先把FeCl3转化成Fe(OH)3,然后再让Fe(OH)3分解成Fe2O3,因此先加入足量的NaOH或氨水等,然后2Fe(OH)3 Fe2O3+3H2O;
(5)利用铜和Fe3+发生反应,即离子反应式Cu+2Fe3+=Cu2++2Fe2+;检验Fe3+一般采用KSCN溶液,如果溶液变红,说明含有Fe3+,根据离子反应方程式,溶液中还含有金属阳离子是Fe2+和Cu2+。
【分析】根据铁单质与酸的反应、亚铁离子和铁离子之间的相互转化等进行分析即可。
一、单选题
1.铁及其化合物是中学化学中重要的物质。下列有关铁及其化合物说法正确的是( )
A.被腐蚀的铁制品属于可回收垃圾
B.不能通过物理方法将铁粉和铝粉分离
C.铁锈的主要成分是
D.指南针中因含有而可以指定方位
2.向溶液中滴入几滴KSCN溶液,出现的现象为
A.红色沉淀 B.棕黄色溶液 C.红色溶液 D.浅绿色溶液
3.世界上有名的“鬼谷”马沃山谷,每当下雨电闪雷鸣时,山谷中就会传出战场厮杀的声音,甚至还有人影。但是天晴之后,山谷中就不会出现这种现象。经过相关人员研究发现是山谷中存在大量的磁铁矿导致了这种异常现象的产生,磁铁的主要成分是
A. B. C. D.
4.能由单质直接化合得到的化合物是( )
A.NO2 B.FeCl2 C.FeCl3 D.CuS
5.下列有关物质颜色,正确的组合是( )
①FeSO4 7H2O 棕黄色 ②Fe2O3 红棕色 ③Fe(OH)2 白色
④ Fe3O4 黑色 ⑤CuSO4 5H2O 白色 ⑥HCl 无色
A.①②③④
B.②③④⑥
C.②③④⑤
D.①②④⑥
6.下列有关铁及其化合物说法错误的是( )
A.将饱和氯化铁溶液滴入沸水中继续煮沸,可制得氢氧化铁胶体
B.FeCl2既有氧化性又有还原性
C.铁与硫酸铜溶液反应后滴加KSCN溶液,溶液变红
D.生铁和钢都是铁的合金,其中生铁的含碳量高于钢
7.在含有FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的NaOH溶液,在空气中充分搅拌,反应后再加入过量的稀盐酸,溶液中离子数目减少的是( )
A.Na+ B.Fe3+ C.Fe2+ D.Al3+
8.如图转化过程中错误的是( )
A.① B.② C.③ D.④
9.下列物质中,不能由单质直接化合生成的是( )
A. B. C. D.
10.化学与生活密切相关。下列说法错误的是( )
A.磁性氧化铁可用作红色油漆和涂料
B.漂白粉可用于生活用水的消毒
C.小苏打可用于中和过多胃酸
D.硅胶可用作袋装食品的干燥剂
11.下列各种物质在一定条件下反应,所得产物种类与反应物的用量或条件无关的是( )
A.Ca(HCO3)2溶液与Ca(OH)2反应
B.Fe 与 O2反应
C.NaAlO2溶液与CO2反应
D.NH4HCO3溶液与NaOH反应
12.为探究某食品包装袋内一小包脱氧剂中的还原铁粉是否变质,分别取少量样品溶于盐酸,再进行下列实验,其结论正确的是( )
A.若再滴加KSCN溶液,溶液变红,说明铁粉变质
B.若再滴加KSCN溶液,溶液未变红,说明铁粉未变质
C.若再依次滴加氯水、KSCN溶液,溶液变红,说明铁粉全部变质
D.若再滴加KSCN溶液,溶液未变红,再滴加氯水,溶液变红,说明铁粉全部变质
13.下列各组内物质反应产生的气体分别通入FeSO4溶液中,能与FeSO4发生反应的是( )
A.Na2O2和H2O B.Al和NaOH溶液
C.食盐和浓硫酸共热 D.铜片和浓硫酸共热
14.下列有关铁及其化合物的说法中错误的是( )
A.为了防止氯化亚铁溶液久置变质,常在其溶液中加入少许铁钉
B.将饱和FeCl3溶液滴入沸水中,能形成胶体
C.新制的氢氧化亚铁沉淀露置在空气中最终会变为红褐色
D.除去FeCl3溶液中的FeCl2杂质可以向溶液中加铁粉,然后过滤
15.为了防止FeSO4被氧化而变质,实验室在配制FeSO4溶液时,常在溶液中加入少量的( )
A.铜粉 B.铁粉 C.锌粉 D.Fe2(SO4)
16.运用所学知识,找出金属钠与金属铁的共同性质,下列说法正确的是( )
A.都能从硫酸铜溶液中置换出铜
B.都是银白色的金属,质软
C.常温下,都能与水反应生成氢气
D.一定条件下,都能与氧气反应
二、综合题
17.量取8.0 mL 5.0 mol·L-1 H2SO4溶液,加蒸馏水稀释至100 mL,取两份稀释后的H2SO4溶液各25 mL,分别加入等质量的Zn和Fe,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)。请计算:
(1)稀释后H2SO4溶液的物质的量浓度为 mol·L-1。
(2)加入Fe的质量至少有 g。
18.电子工业中常用覆铜板为基础材料制作印刷电路板,工业上利用溶液作为“腐蚀液”将覆铜板上不想要的铜腐蚀,同时还可以从腐蚀废液(主要含、和)中回收铜,并重新获得溶液。废液处理流程如下:
请回答下列问题。
(1)操作的名称为 。
(2)溶液腐蚀铜板的离子方程式为 。
(3)试剂为 (填化学式)。沉淀为 (填化学式)。从氧化还原反应的角度分析,试剂是 剂。
(4)为了检验腐蚀废液中是否含有,可将腐蚀废液取样然后滴加 (填化学式)溶液。
(5)查阅资料可知能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,请写出反应的离子方程式 。但是检验腐蚀废液中是否含有,不能用酸性高锰酸钾溶液进行检验,原因是 。
(6)向溶液中加入溶液的实验现象为 。
19.某酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对废液进行处理(所加试剂均稍过量),以回收金属,保护环境。
请回答:
(1)沉淀a中含有的单质是 ;
(2)沉淀b的化学式是 ;
(3)沉淀c的化学式是 ;
(4)溶液A与H2O2溶液在酸性条件下反应的离子方程式是 。
20.高三一年的化学复习,学生要抓住两方面,一方面是教材,另一方面是历年的高考真题。每年的高考题,在教材中几乎都能找到影子,所以同学们一定要紧紧抓住教材,根据《必修一》第三章和第四章的内容回答下列问题:
(1)实验3-1是取用钠单质的实验,用品有小刀, 、 、培养皿。
(2)铁是人类应用最广泛,铁的氧化物有三种,其中Fe3O4是一种具有 的黑色晶体,俗称磁性氧化铁.Fe2O3的用途 (举一例)。
(3)氢氧化铝其有两性,写出氢氧化铝分别溶于强酸和强碱的离子方程式 。
(4)在抗震救灾中要用到大量漂白粉和漂白液杀菌消毒,漂白粉的制取过程如下:通过煅烧石灰石得到生石灰,生石灰溶于水得石灰乳,在向石灰乳中通入氯气反应得漂白粉,有关的反应化学方程式为:CaCO3 CaO+CO2↑ 、 。
21.同学们在实验室里用废铁屑(含少量铜)制取FeCl3·6H2O的流程如下。
请回答下列问题。
(1)固体中加入过量稀盐酸时的现象是 。
(2)溶液中通入Cl2时发生反应的化学方程式是 ,反应中Cl2表现出的性质是 ,此处的Cl2也可以用 代替(填序号)。
A.H2O2 B.SO2 C.浓硫酸
(3)上述流程中由浓缩后的溶液获取FeCl3·6H2O的操作包括 、过滤、洗涤。
(4)用FeCl3溶液制备Fe2O3,可向FeCl3溶液中滴加足量 ,然后过滤、洗涤、 ,即可得到Fe2O3。
(5)FeCl3溶液能用作印制电路铜板的腐蚀液,FeCl3溶液与铜反应的离子方程式是 ,反应一段时间后,取少量腐蚀液,向其中滴加 ,观察到 ,证明腐蚀液中任含Fe3+。此时腐蚀液中的金属阳离子是 。
答案解析部分
1.【答案】A
【解析】【解答】A.金属可以回收再利用,因此被腐蚀的铁制品属于可回收垃圾,故A符合题意;
B.铁能被磁铁吸引,因此可以通过物理方法将铁粉和铝粉分离,故B不符合题意;
C.铁锈的主要成分是,故C不符合题意;
D.指南针中因含有而可以指定方位,故D不符合题意。
故答案为:A。
【分析】A.被腐蚀的铁制品可回收重新加工;
B.铁能被磁铁吸引,而Al不能;
C.钢铁在潮湿的空气中发生电化腐蚀而生锈,铁锈的主要成分是;
D.具有磁性。
2.【答案】C
【解析】【解答】氯化铁溶液中滴入几滴KSCN溶液,发生Fe3++3SCN-Fe(SCN)3,溶液显红色,故C符合题意;
故答案为:C。
【分析】铁离子遇KSCN溶液变红色。
3.【答案】C
【解析】【解答】 磁铁的主要成分是四氧化三铁,化学式为,故C正确;
故答案为:C。
【分析】 磁铁的主要成分是四氧化三铁。
4.【答案】C
【解析】【解答】A.氮气与氧气放电条件下反应生成NO,故A不选;
B. 铁与氯气点燃条件下反应生成氯化铁,不生成氯化亚铁,故B不选;
C. 铁与氯气点燃条件下反应生成氯化铁,
D. 铜与硫反应生成Cu2S,故D不选。
故答案为:C
【分析】铁与氯气点燃条件下反应生成氯化铁,据此分析。
5.【答案】B
【解析】【解答】①FeSO4 7H2O为浅绿色,不是棕黄色,①不符合题意;
②Fe2O3为红棕色固体,②符合题意;
③Fe(OH)2为白色絮状沉淀,③符合题意;
④Fe3O4为黑色晶体,④符合题意;
⑤CuSO4 5H2O为蓝色晶体,不是白色,⑤不符合题意;
⑥HCl为无色气体,⑥符合题意;
综上,正确的组合是②③④⑥,B符合题意;
故答案为:B
【分析】根据各物质的颜色分析即可。
6.【答案】C
【解析】【解答】A.制备Fe(OH)3胶体的操作为:加热烧杯中的水至沸腾,向沸水滴加几滴饱和氯化铁溶液,继续煮沸至溶液呈红褐色,即停止加热,得到氢氧化铁胶体,A项不符合题意;
B.FeCl2中Fe呈+2价,为中间价态,因此FeCl2既有氧化性又有还原性,B项不符合题意;
C.铁与硫酸铜溶液反应的方程式为: ,反应后的溶液中无Fe3+,滴加KSCN溶液,溶液不会变红,C项符合题意;
D.生铁和钢都是碳铁合金,生铁中碳的含量高于钢中碳的含量,D项不符合题意;
故答案为:C。
【分析】硫氰酸钾主要是检验铁离子,但是铁和硫酸铜溶液反应不会查产生铁离子,主要形成的是亚铁离子,其他均正确
7.【答案】C
【解析】【解答】A、向溶液中加入NaOH,溶液中钠离子增多,A不符合题意;
B、氢氧化钠分别与FeCl3、FeCl2、AlCl3反应的方程式为:FeCl3+3NaOH=Fe(OH)3↓+3NaCl,
FeCl2+2NaOH=Fe(OH)2↓+2NaCl,AlCl3+3NaOH=Al(OH)3↓+3NaCl,
Al(OH)3+NaOH=NaAlO2+2H2O,从方程式看出分别生成氢氧化铁沉淀、氢氧化亚铁沉淀、偏铝酸钠,而偏铝酸钠与过量的盐酸反应生成铝离子,铝离子数目没有变化。生成氢氧化亚铁与空气中氧气反应全部生成氢氧化铁,反应为4Fe(OH)2+2H2O+O2=4Fe(OH)3,然后再加入过量的盐酸,氢氧化铁与盐酸反应生成氯化铁,三价铁离子数目增多,二价铁离子减少,故B不符合题意;
C、根据以上分析可知C符合题意;
D、根据以上分析可知D不符合题意;
故答案为:C
【分析】 Fe2+ 由于被氧化,最终转化为 Fe3+ 。
8.【答案】B
【解析】【解答】A.反应①中,Fe与高温水蒸气发生反应3Fe+4H2O(g) Fe3O4+4H2 ,A不符合题意;
B.反应②中,Fe与O2在点燃条件下发生反应3Fe+2O2 Fe3O4,B符合题意;
C.反应③中,Fe与稀硫酸发生反应Fe+H2SO4=FeSO4+H2↑,C不符合题意;
D.反应④中,Fe与Cl2在点燃条件下发生反应3Cl2 +2Fe 2FeCl3,D不符合题意;
故答案为:B。
【分析】①铁与水蒸气在高温下反应生成Fe3O4和H2;
②铁在氧气中点燃生成Fe3O4;
③铁与稀硫酸反应生成FeSO4和H2;
④铁在氯气中点燃生成FeCl3;
9.【答案】C
10.【答案】A
【解析】【解答】A.氧化铁可用作红色油漆和涂料,A符合题意;
B.漂白粉中含有的次氯酸钙具有杀菌消毒能力,可用于生活用水的消毒,B不符合题意;
C.小苏打能够与胃液(主要成分为盐酸)反应,胃液酸性减弱,可用于未患有胃溃疡的胃酸过多病人的治疗,C不符合题意;
D.硅胶是一种高活性吸附材料,具有很强的吸水性,可用作袋装食品的干燥剂,D不符合题意;
故答案为:A。
【分析】磁性氧化铁具有磁性且是黑色,不是红色,氧化铁可以做油漆染料
11.【答案】A
【解析】【解答】解:A.Ca(HCO3)2溶液与Ca(OH)2反应生成碳酸钙和水,所得产物种类与反应物的用量或条件无关,故A选;
B.缓慢氧化生成氧化铁,点燃生成四氧化三铁,与反应条件有关,故B不选;
C.二氧化碳少量反应生成碳酸钠和氢氧化铝,二氧化碳过量反应生成氢氧化铝和碳酸氢钠,反应产物与二氧化碳量有关,故C不选;
D.NH4HCO3溶液与NaOH反应,所得产物种类与反应物的用量有关,故D不选;
故选:A.
【分析】A.与其它条件无关,二者反应生成碳酸钙和水;
B.缓慢氧化生成氧化铁,点燃生成四氧化三铁;
C.二氧化碳少量反应生成碳酸钠和氢氧化铝,二氧化碳过量反应生成氢氧化铝和碳酸氢钠;
D.氢氧化钠少量,只反应碳酸氢根离子,氢氧化钠过量,碳酸氢根离子、氨根离子都反应.
12.【答案】A
【解析】【解答】A、若再滴加KSCN溶液,溶液变红,说明溶液中含有铁离子,可以确定还原铁粉被氧化变质,A符合题意;
B、若再滴加KSCN溶液,溶液未变红,说明溶液中无铁离子,但还原铁粉有可能被氧化为亚铁离子,B不符合题意;
C、氯水具有强氧化性,可以把亚铁离子氧化为铁离子,亚铁离子来源可能是铁与盐酸反应,故不能确定是部分氧化还是全部氧化还是没有被氧化,C不符合题意;
D、若再滴加KSCN溶液,溶液未变红,再滴加氯水,溶液变红,说明溶液中不含铁离子,含有亚铁离子,亚铁离子来源可能是铁与盐酸反应,D不符合题意;
故答案为:A
【分析】还原铁粉的主要作用是除去氧气,若变质,则铁转化为Fe3+,根据Fe3+的检验进行分析。
13.【答案】A
【解析】【解答】解:A. 过氧化钠和水反应生成氧气,氧气能将硫酸亚铁氧化成硫酸铁,故A符合题意;
B. 铝和氢氧化钠溶液反应生成氢气,氢气与硫酸亚铁溶液不反应,故B不符合题意;
C. 食盐和浓硫酸加热反应生成氯化氢气体,氯化氢气体不与硫酸亚铁发生反应,故C不符合题意;
D. 铜和浓硫酸加热反应生成二氧化硫气体,二氧化硫具有还原性和氧化性,但氧化性弱于铁离子,所以二氧化硫不能和硫酸亚铁发生反应,故D不符合题意;
故答案为:A。
【分析】A. 过氧化钠和水反应生成氧气,氧气具有氧化性,Fe2+有还原性,被氧气氧化成Fe3+
B、C中产生的 氢气和氯化氢气体具有还原性,Fe2+也是还原性,不反应
D.二氧化硫的氧化性<Fe3+
14.【答案】D
【解析】【解答】A. 亚铁离子在空气中易被氧化为三价铁离子,加铁钉可以防止氯化亚铁溶液的变质,故A不符合题意;
B. 制备氢氧化铁胶体的方法是将饱和FeCl3溶液滴入沸水中,搅拌到红褐色即可,故B不符合题意;
C. 新制的氢氧化亚铁沉淀露置在空气中迅速变成灰绿色,最终会变为红褐色的氢氧化铁,故C不符合题意;
D. 除去FeCl3溶液中的FeCl2杂质可以向溶液中滴加氯水,将氯化亚铁氧化为氯化铁,故D符合题意。
【分析】A.氯化铁可与铁反应生成氯化亚铁;
B.饱和FeCl3溶液滴入沸水中制备氢氧化铁胶体,是利用氯化铁水解加热促进生成;
C.新制的氢氧化亚铁沉淀露置在空气中最终会变为红褐色的氢氧化铁;
D. 氯化铁可与铁反应生成氯化亚铁。
15.【答案】B
【解析】【解答】FeSO4中Fe为+2价,所以极易被氧化为+3价,加入铁粉后,会与+3价的铁反应使之成为亚铁离子后,融入到FeSO4溶液中,这样便有效地减少FeSO4的损失。
故答案为:B
【分析】Fe2+不稳定,易被空气中的氧气氧化成Fe3+,为防止其氧化变质,可加入具有还原性的物质,同时不能引入新的杂质。据此判断选项。
16.【答案】D
【解析】【解答】A.金属钠先与水反应生成氢氧化钠和氢气,氢氧化钠和硫酸铜反应生成氢氧化铜,钠不能从硫酸铜溶液中置换出铜,故A不符合题意;
B.钠质软,金属铁具有一定硬度,故B不符合题意;
C.常温下,钠能和水反应生成氢氧化钠和氢气,铁与水不反应,故C不符合题意;
D.常温下,钠与氧气反应生成氧化钠;点燃条件下,铁能与氧气反应生成四氧化三铁,故D符合题意;
故答案为:D。
【分析】依据金属钠和金属铁的理化性质分析解答。
17.【答案】(1)0.40
(2)0.65
【解析】【解答】(1)H2SO4溶液各25mL,分别加入等质量的Zn和Fe,生成的氢气的体积相同,由于Fe的摩尔质量比Zn的小,所以Fe与硫酸反应时Fe过量,其反应方程式为:Fe+H2SO4=FeSO4+H2↑,由图象可知生成的氢气为n(H2)= = =0.01mol,则n(H2SO4)=n(H2)=0.01mol,c(H2SO4)= = =0.40mol/L,故答案为:0.40;(2)Zn与硫酸反应时锌完全反应,反应方程式为Zn+H2SO4=ZnSO4+H2↑,则n(Zn)=0.01mol,m(Zn)=nM=0.01mol×65g/mol=0.65g,Zn和Fe的质量相同,所以Fe的质量为0.65g,故答案为:0.65。
【分析】本题要注意稀硫酸和铁、锌反应的过程,两条曲线,前者为锌,后者为铁;
(1)根据稀释定律c浓·V浓=c稀·V稀可以进行计算;
(2)产生的氢气量相同,根据氢气的物质的量,结合化学方程式进行计算,根据物质的量之比等于化学计量数之比可以求出铁的物质的量,转化为质量即可。
18.【答案】(1)过滤
(2)2Fe3++Cu=2Fe2++Cu2+
(3)Fe;Fe和Cu;氯气
(4)KSCN
(5);氯离子也能被酸性高锰酸钾氧化,而使其褪色
(6)先生成白色沉淀、后迅速变为灰绿色,最好变为红褐色
【解析】【解答】(1)根据出来了沉淀和滤液判断,操作I的名称是:过滤。
(2)根据电子和电荷守恒配平得离子方程式为:2Fe3++Cu=2Fe2++Cu2+。
(3)根据杂质离子铜离子,所需离子是三价铁离子,故应加入的试剂a是:Fe,沉淀A为:Fe和Cu。试剂c是将二价铁氧化为三价铁,且不引入杂质,故c为:氯气。
(4)检验三价铁用KSCN,生成产物溶液显血红色。
(5)根据电荷、原子、电子守恒进行书写离子方程式为:
,由于酸性高锰酸钾具有强氧化性,能将氯离子氧化,故不能用酸性高锰酸钾进行检验。
(6)向氯化亚铁加入氢氧化钠会发生反应:FeCl2+2NaOH=Fe(OH)2+2NaCl,
4Fe(OH)2+O2+2H2O=4Fe(OH)3。故现象是:生成白色沉淀、后迅速变为灰绿色,最好变为红褐色。
【分析】(1)得到沉淀和滤液,可以判断是过滤操作
(3)有分析可知,最终要得到氯化铁和铜单子,故加入过量的铁粉,置换出铜,同时Fe3+被还原为Fe2+,最后为得到Fe3+,加入氯气或者过氧化氢进行氧化
(4)检验三价铁选择硫氰化钾即可
(5)能够是高锰酸钾褪色的还有可能是溶液中的氯离子
(6)先生成氢氧化亚铁,再被空气中的氧气氧化,变成氢氧化铁
19.【答案】(1)Cu、Fe
(2)Fe(OH)3
(3)BaCO3
(4)2Fe2++H2O2+2H+=2Fe3++2H2O
【解析】【解答】(1)由以上分析可知沉淀a中含有的单质是Fe、Cu;
(2)由以上分析可知红褐色沉淀为Fe(OH)3↓;
(3)由分析可知沉淀c为BaCO3;
(4)氧化时加入H2O2溶液与二价铁离子发生氧化还原反应,反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O;
故答案为:(1)Fe、Cu;(2)Fe(OH)3;(3)BaCO3;(4)2Fe2++2H++H2O2=2Fe3++2H2O。
【分析】酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,加入铁屑,可置换出铜,沉淀a为Fe、Cu,溶液A含有Fe2+、Ba2+,然后在溶液A中加入过氧化氢、氢氧化钠生成的红褐色沉淀为Fe(OH)3↓,溶液B含有Na+、Ba2+,加入碳酸钠溶液,可生成沉淀c为BaCO3,溶液C含有的阳离子主要为Na+。据此分析作答。
20.【答案】(1)镊子;滤纸
(2)磁性;炼铁‘涂料、红色油漆等(只要正确就给分)
(3)Al2O3+6H+=2Al3++3H2O;Al2O3 + 2OH-=2 AlO2-+2H2O
(4)CaO + H2O=Ca(OH)2;2Ca(OH)2 + 2Cl2 =Ca(ClO)2 + CaCl2 + 2H2O
【解析】【解答】(1)钠保存在煤油中,硬度较小,取用钠单质的实验,用品有小刀,镊子,滤纸,培养皿。(2)Fe3O4是一种具有磁性的黑色晶体,俗称磁性氧化铁.Fe2O3的用途有炼铁涂料、红色油漆等。(3)氢氧化铝具有两性,分别溶于强酸和强碱的离子方程式为Al2O3+6H+=2Al3++3H2O、Al2O3 + 2OH-=2 AlO2-+2H2O。(4)煅烧石灰石得到生石灰:CaCO3 CaO+CO2↑,生石灰溶于水得石灰乳:CaO+H2O=Ca(OH)2,向石灰乳中通入氯气反应得漂白粉:2Ca(OH)2 +2Cl2=Ca(ClO)2+CaCl2+2H2O。
【分析】(1)钠单质密度小,性质活泼,所以应该保存在煤油中;
(2)四氧化三铁俗称磁铁矿;氧化铁俗称赤铁矿,可以用来做涂料、油漆等;
(3)氢氧化铝属于两性氢氧化物,既可以溶于碱也可以溶于酸;
(4)制取漂白粉的反应是氢氧化钙和氯气发生氧化还原反应得到次氯酸钙、氯化钙和水。
21.【答案】(1)固体部分溶解,溶液变为浅绿色,有气泡产生
(2)2FeCl2+Cl2=2FeCl3;氧化性;A
(3)降温结晶
(4)NaOH;溶液加热灼烧
(5)2Fe3++Cu =2Fe2++Cu2+KSCN;溶液;溶液变为红色;Fe3+、Fe2+、Cu2+
【解析】【解答】(1)根据金属活动顺序表,铁和盐酸反应,铜不与盐酸反应,发生反应:Fe+2H+=Fe2++H2↑,因此现象是固体部分溶解,溶液变为浅绿色,有气泡产生;
(2)利用氯气的氧化性,把Fe2+氧化成Fe3+,因此反应方程方式为2FeCl2+Cl2=2FeCl3;氯气的化合价降低,氯气作氧化剂,表现氧化性,A、H2O2具有强氧化性,能把Fe2+氧化成Fe3+,可以,故正确;B、SO2不能把Fe2+氧化成Fe3+,故错误;D、虽然浓硫酸具有强氧化性,能把Fe2+氧化成Fe3+,但引入SO42-,故错误;
(3)产物带有结晶水,因此采用蒸发浓缩、冷却结晶、过滤方法得到FeCl3·6H2O;
(4)需要先把FeCl3转化成Fe(OH)3,然后再让Fe(OH)3分解成Fe2O3,因此先加入足量的NaOH或氨水等,然后2Fe(OH)3 Fe2O3+3H2O;
(5)利用铜和Fe3+发生反应,即离子反应式Cu+2Fe3+=Cu2++2Fe2+;检验Fe3+一般采用KSCN溶液,如果溶液变红,说明含有Fe3+,根据离子反应方程式,溶液中还含有金属阳离子是Fe2+和Cu2+。
【分析】根据铁单质与酸的反应、亚铁离子和铁离子之间的相互转化等进行分析即可。
