1.2 离子反应 同步练习(含解析)2023-2024学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 1.2 离子反应 同步练习(含解析)2023-2024学年上学期高一化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 219.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 16:40:58 | ||
图片预览




文档简介
1.2 离子反应 同步练习
一、单选题
1.下列离子方程式,书写正确的是( )
A.H2S 2H++S2 B.KHCO3 K++H++CO32-
C.Cu(OH)2 Cu2++2OH D.HClO=H++ClO
2.下列说法对应的离子方程式合理的是
A.泡沫灭火器的工作原理:
B.溶液中加入足量溶液:
C.与反应:
D.铅蓄电池放电时正极的电极反应式:
3.下列实验的反应原理用离子方程式表示正确的是( )
A.室温下,测得氯化铵溶液pH<7,证明一水合氨是碱:NH4++2H2O═NH3 H2O+H3O+
B.用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑
C.用碳酸氢钠溶液检验水杨酸中的羧基: +2HCO3﹣→ +2H2O+2CO2↑
D.用高锰酸钾标准溶液滴定草酸:2MnO4﹣+16H++5C2O42﹣═2Mn2++10CO2↑+8H2O
4.下列电离方程式的书写,正确的是( )
A.2Na++SO42-= Na2SO4 B.H2SO4= 2H+ + SO42-
C.CuCl2= Cu2+ + Cl― D.NaHCO3= Na+ + H+ + CO32-
5.下列各组离子在常温下一定能大量共存的是( )
A.pH=0的无色溶液中:Cl﹣、Na+、SO 、Fe2+
B.在 =1012的溶液中:NH 、NO 、K+、Cl﹣
C.加入铝粉能放出H2的溶液中:Mg2+、NH 、NO 、Cl﹣
D.含有大量Fe3+的溶液中:Al3+、SCN﹣、Br﹣、Na+
6.下列物质的水溶液能导电,但属于非电解质的是( )
A.HNO3 B.NaOH C.NH4NO3 D.CO2
7.下列各组选项按电解质、非电解质、单质和混合物顺序排列的一组是( )
A.NaCl、乙醇、铁、空气 B.蔗糖、CuSO4、氮气、胆矾
C.HCl、SO2、石墨、液氯 D.KCl、盐酸、氧气、石灰水
8.下列离子方程式书写正确的是( )
A.钠与水反应:
B.硫化氢气体通入氯水中:
C.硫酸和氢氧化钡溶液混合:
D.铁与稀硫酸反应:
9.下列反应的离子方程式正确的是( )
A.铁粉与氯化铁溶液反应:Fe+Fe3+=2Fe2+
B.用稀盐酸除去铁表面的铁锈:Fe2O3+6H+=2Fe3++3H2O
C.用大理石与稀盐酸反应制备二氧化碳:+2H+=H2O+CO2↑
D.稀硫酸与氢氧化钡溶液反应:H+++Ba2++OH-=BaSO4↓+H2O
10.下列各组离子在指定溶液中一定能大量共存的是( )
①pH=0的溶液:Na+、C2O42﹣、MnO4﹣、SO42﹣
②pH=11的溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣、S2﹣、SO32﹣
③水电离的H+浓度为10﹣12mol L﹣1的溶液中:Cl﹣、CO32﹣、NO3﹣、NH4+、SO32﹣
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl﹣、K+、SO42﹣
⑤使石蕊变红的溶液中:Fe2+、MnO4﹣、NO3﹣、Na+、SO42﹣
⑥中性溶液中:Fe3+、Al3+、NO3﹣、I﹣、Cl﹣、S2﹣.
A.①②⑤ B.①③⑥ C.②④ D.①②④
11.下列电解质在水溶液中和熔化状态下均能导电的是 ( )
A.硫酸 B.碳酸钙 C.氢氧化钠 D.氧化镁
12.能正确表示下列反应的离子方程式为
A.将等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液等体积混合: +Ba2++OH-=BaCO3↓ +H2O
B.氯气溶于水:Cl2+H2O=2H+ + Cl-+ClO-
C.向氢氧化亚铁中加入足量的稀硝酸: Fe(OH)2 +2H+=Fe2+ +2H2O
D.用铝粉和NaOH溶液反应制取少量H2:Al+2OH-=+H2↑
13.在无色酸性溶液中能大量共存的一组离子是( )
A.、、、 B.、、、
C.、、、 D.、、、
14.溶质都为1mol的NaHCO3溶液和Ba(OH)2溶液混合,能完整表示该反应的离子方程式是( )
A.CO32﹣+Ba2+=BaCO3
B.HCO3﹣+OH﹣→H2O+CO32﹣
C.HCO3﹣+Ba2++OH﹣→H2O+BaCO3
D.2HCO3﹣+Ba2++OH﹣=BaCO3+2H2O+CO32﹣
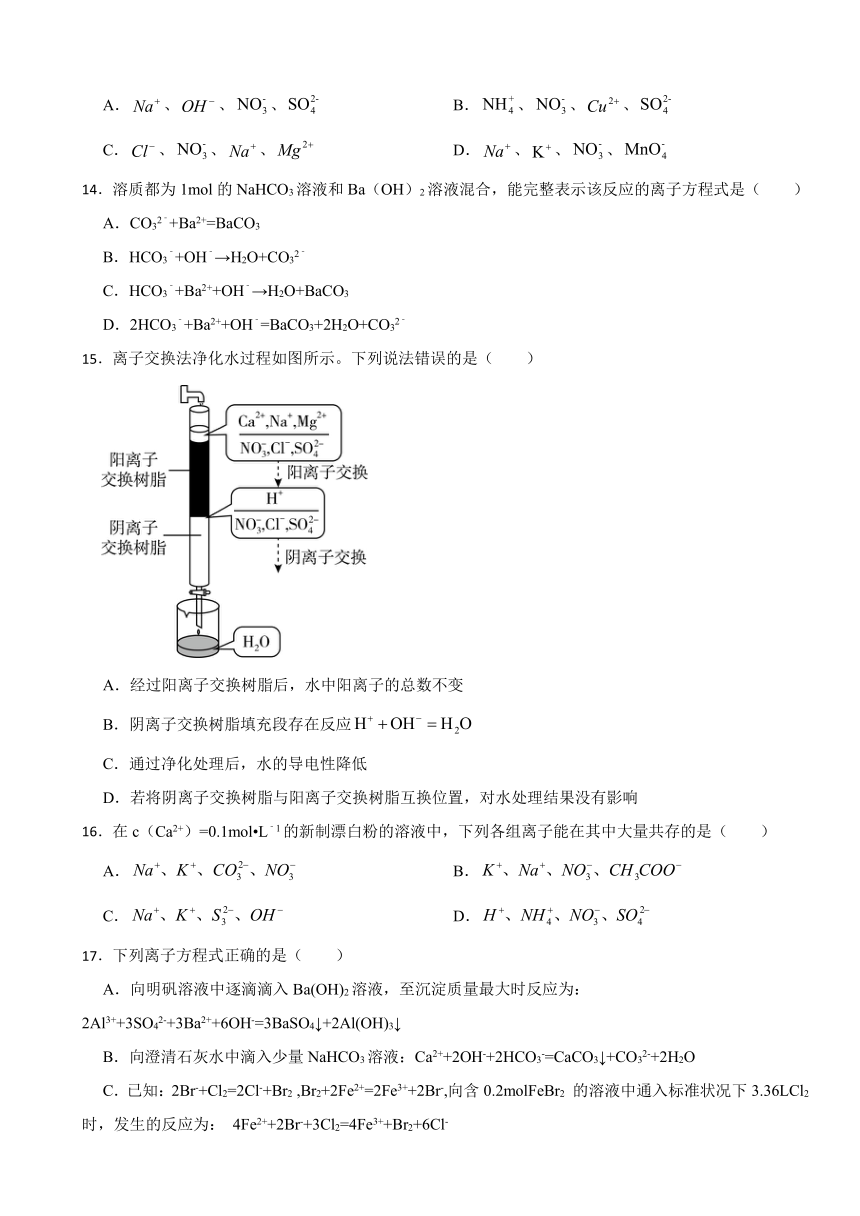
15.离子交换法净化水过程如图所示。下列说法错误的是( )
A.经过阳离子交换树脂后,水中阳离子的总数不变
B.阴离子交换树脂填充段存在反应
C.通过净化处理后,水的导电性降低
D.若将阴离子交换树脂与阳离子交换树脂互换位置,对水处理结果没有影响
16.在c(Ca2+)=0.1mol L﹣1的新制漂白粉的溶液中,下列各组离子能在其中大量共存的是( )
A. B.
C. D.
17.下列离子方程式正确的是( )
A.向明矾溶液中逐滴滴入Ba(OH)2溶液,至沉淀质量最大时反应为:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓
B.向澄清石灰水中滴入少量NaHCO3溶液:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
C.已知:2Br-+Cl2=2Cl-+Br2 ,Br2+2Fe2+=2Fe3++2Br-,向含0.2molFeBr2 的溶液中通入标准状况下3.36LCl2时,发生的反应为: 4Fe2++2Br-+3Cl2=4Fe3++Br2+6Cl-
D.向NaHSO4中滴入Ba(OH)2溶液至恰好显中性:H+ +SO42- + Ba2++OH-= H2O +BaSO4↓
18.下列解释事实的离子方程式正确的是( )
A.铜丝溶于浓硝酸生成绿色溶液:3Cu+8H++2NO3-==3Cu2++2NO↑+4H2O
B.稀硫酸与Ba(OH)2溶液混合出现浑浊:H++OH-+ Ba2++SO42- =BaSO4↓+H2O
C.澄清石灰水中加入过量小苏打溶液出现浑浊:Ca2++ 2HCO3-+2OH-= CaCO3↓+CO32-+ 2H2O
D.在AlCl3溶液中加入过量氨水出现浑浊:Al3++3OH-= Al(OH)3↓
二、综合题
19.写出下列物质的电离方程式:
(1)NaHSO4溶于水
(2)H2S的电离 .
20.现有下列六种物质:①液态HCl ②NaHCO3③NaCl溶液 ④CO2⑤Al2(SO4)3
⑥Ba(OH)2
(1)上述物质中的两种物质在水溶液中发生反应,离子方程式为:H++OH﹣═H2O,该反应的化学方程式为.
(2)⑤在水中的电离方程式为 ,
(3)胃液中含有盐酸,胃酸过多的人可服用适量的②能治疗胃酸过多,请写出其反应的离子方程式: ;
(4)向⑥的溶液中通入④,请写出反应的离子方程式
(5)③的溶液若含少量Ca2+,可向溶液中加入过量的 (填试剂名称),过滤后再加足量稀盐酸,最后蒸发结晶得到纯净的NaCl晶体.
21.以下为中学化学中常见的几种物质;①;②熔融NaCl;③固体;①;⑤;⑥75%的酒精⑦溶液;⑧NaOH溶液;⑨稀盐酸;⑩Fe。回答下列问题:
(1)上述物质中属于电解质的有 (填序号,下同);属于单质的有 ;上述条件下能导电的有 。
(2)写出溶液和⑧反应的离子方程式: 。
(3)某同学将NaCl、、NaOH划分为一类,该同学的分类依据为____(填字母)。
A.酸 B.碱 C.钠盐 D.含钠化合物
(4)与两者性质部分相似,根据与澄清石灰水反应的化学方程式,写出少量与澄清石灰水反应的化学方程式: 。
(5)碱式碳酸铜[]可以看作是和按照1:1的比例组成的混合型化合物,写出它与足量盐酸反应的化学方程式: 。
22.按要求写出方程式.
(1)氧化镁与稀盐酸反应(写出离子方程式)
(2)氢氧化钠溶液和醋酸溶液反应(写出离子方程式)
(3)Fe2(SO4)3(写出电离方程式)
(4)CO32﹣+2H+═CO2↑+H2O(写出对应的化学方程式) .
23.现有下列八种物质:①NaOH溶液 ②铁丝 ③液态HCl④熔融氯化钠 ⑤硫酸钠固体⑥CO2⑦酒精⑧生石灰.
(1)上述物质中,可导电的是 (填序号,下同).
(2)上述物质中,属于非电解质的是 .
(3)上述物质中,属于电解质但不导电的是 .
答案解析部分
1.【答案】C
【解析】【解答】A.H2S属于二元弱酸,分步电离,H2S HS-+H+, HS- H++S2-,A不符合题意;
B.KHCO3属于强电解质,完全电离,但是HCO3-属于弱酸根离子,部分电离,KHCO3= K++HCO3-,HCO3- H++CO32-,B不符合题意;
C.Cu(OH)2属于弱碱,可逆电离,一步写出:Cu(OH)2 Cu2++2OH-,C符合题意;
D.HClO属于弱酸,可逆电离,HClO H++ClO-,D不符合题意;
故答案为:C
【分析】此题是对电离方程式书写的考查,根据电离方程式的书写进行分析即可。
2.【答案】B
【解析】【解答】A.泡沫灭火器中的主要成分为硫酸铝和碳酸氢钠,故离子方程式中应为碳酸氢根离子不是碳酸根离子,A项不符合题意;
B.碳酸氢钠和足量的氢氧化钡反应生成氢氧化钠和碳酸钡沉淀,离子方程式符合题意,B项符合题意;
C.过氧化钠和水反应过程中水中的氧原子到氢氧化钠中,C项不符合题意;
D.铅蓄电池中的正极反应式为,D项不符合题意。
故答案为:B。
【分析】A、泡沫灭火器中使用的是碳酸氢钠,电离出碳酸氢根离子;
B、碳酸氢钠和氢氧化钡反应,氢氧化钡过量时,没有生成碳酸钠;
C、过氧化钠和水的反应,氧气中的氧原子来自于过氧化钠;
D、铅蓄电池的正极为二氧化铅得到电子,结合硫酸根离子和氢离子生成硫酸铅和水。
3.【答案】B
【解析】【解答】A.盐类水解是可逆反应,应该写可逆号,离子方程式为:NH4++2H2O NH3 H2O+H3O+,故A错误;
B.Al和NaOH溶液反应生成偏铝酸钠和氢气,Mg不反应,离子方程式为2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑,故B正确;
C.羧基能和碳酸氢钠反应,但酚羟基和碳酸氢钠不反应,离子方程式为 +HCO3﹣→ +H2O+CO2↑,故C错误;
D.弱电解质写化学式,离子方程式为2MnO4﹣+6H++5H2C2O4═2Mn2++10CO2↑+8H2O,故D错误;
故选B.
【分析】A.盐类水解是可逆反应;B.Al和NaOH溶液反应生成偏铝酸钠和氢气,Mg不反应;C.羧基能和碳酸氢钠反应,但酚羟基和碳酸氢钠不反应;D.弱电解质写化学式.本题主要考查离子方程式的书写,解答此题关键是明确物质之间反应、物质性质及离子方程式书写规则,涉及盐类水解、氧化还原反应等知识点,易错选项是C,注意羧基能和碳酸氢盐反应但酚羟基不能和碳酸氢盐反应,但羧基、酚羟基都能和碳酸钠反应,题目难度不大.
4.【答案】B
【解析】【解答】A.Na2SO4在水中的电离方程式为:Na2SO4=2Na++SO42-,A不符合题意;
B.H2SO4是强酸,在水中完全电离,其电离方程式为:H2SO4=2H++SO42-,B符合题意;
C.CuCl2是可溶性盐,在水中完全电离,其电离方程式为:CuCl2=Cu2++2Cl-,C不符合题意;
D.NaHCO3是可溶性盐,在水中完全电离,其电离方程式为:NaHCO3=Na++HCO3-,D不符合题意;
故答案为:B
【分析】A、Na2SO4在水中电离产生Na+和SO42-;
B、H2SO4在水中完全电离,产生H+和SO42-;
C、CuCl2在水中完全电离产生Cu2+和Cl-;
D、NaHCO3在水中完全电离,产生Na+和HCO3-;
5.【答案】B
【解析】【解答】解:A、该溶液为酸性无色溶液,Fe2+为有色离子,不满足溶液无色的要求,故A错误;
B、该溶液为酸性溶液,NH 、NO 、K+、Cl﹣离子之间不反应,也不与氢离子反应,在溶液中能够大量共存,故B正确;
C、该溶液为酸性或者碱性溶液,Mg2+、NH 能够与氢氧根离子反应,在溶液中不能大量共存,酸性溶液中NO 、Al反应不生成氢气,故C错误;
D、Fe3+能够与SCN﹣离子反应生成硫氰化铁,在溶液中不能大量共存,故D错误;
故选B.
【分析】A、pH=0的无色溶液为酸性溶液,且不存在有色离子,亚铁离子为有色离子;
B、在 =1012的溶液为酸性溶液,四种离子之间不反应,能够共存;
C、加入铝粉能放出H2的溶液为酸性或者碱性溶液,镁离子、铵离子能够与氢氧根离子反应;
D、铁离子能够与硫氰根离子反应生成络合物硫氰化铁.
6.【答案】D
【解析】【解答】解:A.HNO3溶于水后发生电离,水溶液导电,是电解质,故A错误;
B.NaOH溶于水后发生电离,水溶液导电,是电解质,故B错误;
C.NH4NO3溶于水后发生电离,水溶液导电,是电解质,故B错误;
D.CO2溶于水生成碳酸,碳酸发生电离,水溶液导电,碳酸是电解质,CO2是非电解质,故D正确;
故选D.
【分析】水溶液导电的原因是水溶液中含有自由移动的阴阳离子,电解质是指在水溶液或熔化状态下能导电的化合物,而非电解质是指在水溶液和熔化状态下都不能导电的化合物,据此进行判断.
7.【答案】A
【解析】【解答】A.NaCl是电解质,乙醇是非电解质,铁是金属单质,空气是混合物,故A符合题意;
B.蔗糖是非电解质,CuSO4是电解质,氮气是非金属单质,胆矾是纯净物,故B不符合题意;
C.HCl是电解质,SO2是非电解质,石墨是非金属单质、液氯是纯净物,故C不符合题意;
D.KCl是电解质,盐酸是混化合物,既不是电解质也不是非电解质,氧气是非金属单质,石灰水是氢氧化钙溶液,是混合物,故D不符合题意;
故答案为:A。
【分析】此题是对物质分类的考查,结合电解质、非电解质、单质和混合物的定义分析即可。电解质是指在水溶液或熔融状态下能导电的化合物;非电解质是指在水溶液和熔融状态下都不能导电的化合物;单质是指只由一种元素组成的纯净物;混合物是指由多种物质混合而成。
8.【答案】B
【解析】【解答】A.Na与H2O反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑,A不符合题意;
B.该反应的离子方程式为H2S+Cl2=2H++2Cl-+S↓,B符合题意;
C.H2SO4与Ba(OH)2反应的离子方程式为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,C不符合题意;
D.Fe与稀硫酸反应的离子方程式为Fe+2H+=Fe2++H2↑,D不符合题意;
故答案为:B
【分析】A、Na与H2O反应生成H2和可溶性NaOH;
B、氯水中的Cl2具有氧化性,能将H2S氧化成S;
C、H2SO4与Ba(OH)2反应生成BaSO4沉淀和H2O;
D、Fe与稀硫酸反应生成可溶性FeSO4和H2;
9.【答案】B
【解析】【解答】A.铁粉与氯化铁溶液反应的离子方程式为:Fe+2Fe3+=3Fe2+,故A不符合题意;
B.用稀盐酸除去铁表面的铁锈:Fe2O3+6H+=2Fe3++3H2O,符合离子方程式的书写规则,故B符合题意;
C.大理石为难溶盐,书写离子方程式时不能拆开写,应为:CaCO3+2H+=Ca2++H2O+CO2↑,故C不符合题意;
D.稀硫酸与氢氧化钡溶液反应的离子方程式为2H+++Ba2++2OH-=BaSO4↓+2H2O,故D不符合题意;
故答案为:B。
【分析】A.该方程式电荷不守恒;
C.碳酸钙为固体,应保留化学式;
D.氢氧化钡电离产生的钡离子和氢氧根离子数目之比为1:2。
10.【答案】C
【解析】【解答】解:①pH=0的溶液呈酸性,C2O42﹣、MnO4﹣在酸性条件下发生氧化还原反应而不能大量共存,故错误;②pH=11的溶液呈碱性,这几种离子之间不反应且和氢氧根离子不反应,所以能大量共存,故正确;③水电离的H+浓度为10﹣12mol L﹣1的溶液呈酸性或碱性,酸性条件下,CO32﹣、SO32﹣不能大量共存,故错误;④加入Mg能放出H2的溶液呈酸性,这几种离子之间不反应且和氢离子不反应,所以能大量共存,故正确;⑤使石蕊变红的溶液呈酸性,酸性条件下,Fe2+和MnO4﹣、NO3﹣发生氧化还原反应而不能大量共存,故错误;⑥中性溶液中Fe3+生成氢氧化铁而不能大量共存,故错误;
故选C.
【分析】①pH=0的溶液呈酸性,强氧化性物质和强还原性离子不能共存;②pH=11的溶液呈碱性,离子之间不反应的能大量共存;③水电离的H+浓度为10﹣12mol L﹣1的溶液呈酸性或碱性,离子之间不反应的能大量共存;④加入Mg能放出H2的溶液呈强酸性,离子之间不反应且和氢离子不反应的能大量共存;⑤使石蕊变红的溶液呈酸性,离子之间不反应的能大量共存;⑥中性溶液中,离子之间不反应的能大量共存.
11.【答案】C
【解析】【分析】答案C
A.硫酸是共价化合物,液态时不电离 B.碳酸钙高温分解 C.氢氧化钠在水溶液中和熔化状态下均能导电 D.氧化镁在水中反应生成Mg (OH)2。
12.【答案】A
【解析】【解答】A.等物质的量的NaHCO3与Ba(OH)2反应的离子方程式为:+Ba2++OH-=BaCO3↓ +H2O,A符合题意;
B.氯气溶于水的离子方程式为:Cl2+H2O=H+ + Cl-+HClO,B不符合题意;
C.向氢氧化亚铁中加入足量的稀硝酸发生氧化还原反应,反应的离子方程式为:,C不符合题意;
D.用铝粉和NaOH溶液反应制取少量H2的离子方程式为:,D不符合题意;
故答案为:A。
【分析】A.等体积物质的量浓度的NaHCO3和Ba(OH)2两溶液混合生成BaCO3和H2O;
B.HClO为弱酸,应保留化学式;
C.稀硝酸将亚铁离子氧化为铁离子;
D.该方程式电荷不守恒,正确的离子方程式为。
13.【答案】C
【解析】【解答】A.酸性溶液中含有大量氢离子,H+不能与共存,A不符合题意;
B.为蓝色,与无色溶液相悖,B不符合题意;
C.、、、均无色,且与H+不反应,可以大量共存,C符合题意;
D.为紫色,与无色溶液相悖,D不符合题意;
故答案为:C。
【分析】无色酸性溶液中含有大量氢离子,且不存在有色离子。
14.【答案】C
【解析】【解答】解:溶质都为1mol的NaHCO3溶液和Ba(OH)2溶液混合,氢氧根离子过量,反应生成碳酸钡、NaOH和水,反应的离子方程式为HCO3﹣+Ba2++OH﹣=H2O+BaCO3,
故选C.
【分析】NaHCO3和Ba(OH)2的相等,氢氧根离子过量,反应生成碳酸钡沉淀、氢氧化钠和水,据此书写离子方程式.
15.【答案】A
【解析】【解答】A.Na+、Ca2+、Mg2+等阳离子被H+代替,根据电荷守恒可知,经过阳离子交换树脂后,水中阳离子总数增加,A项符合题意;
B.溶液中的阳离子被H+代替、阴离子被OH-代替,阴离子树脂填充段存在反应:,B项不符合题意;
C.通过净化处理后,溶液中离子的浓度降低,水的导电性降低,C项不符合题意;
D.若将阴离子交换树脂与阳离子交换树脂互换位置,经阴离子交换膜后,Mg2+与OH-生成了沉淀,溶液中离子为Ca2+、Na+、OH-,再经阳离子交换膜,H+代替Ca2+、Na+,故对水处理结果没有影响,D项不符合题意;
故答案为:A。
【分析】A、结合电荷守恒进行判断;
B、氢离子和氢氧根结合生成水;
C、净化后离子浓度降低,导电性减弱;
D、最终都是将离子阻挡,没有实际影响。
16.【答案】B
【解析】【解答】解:A.Ca2+、CO32﹣结合生成沉淀,不能大量共存,故A错误;
B.新制漂白粉的溶液含Ca2+、ClO﹣、Cl﹣,该组离子之间均不反应,可大量共存,故B正确;
C.ClO﹣、S2﹣发生氧化还原反应,不能大量共存,故C错误;
D.Ca2+、SO42﹣反应生成沉淀,不能大量共存,故D错误;
故选B.
【分析】新制漂白粉的溶液含Ca2+、ClO﹣、Cl﹣,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
17.【答案】C
【解析】【解答】A.滴加过程中产生沉淀最大值,则SO42-完全沉淀,故反应的离子方程式为:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O,选项错误,A不符合题意;
B.NaHCO3少量,则完全反应,故该反应的离子方程式为:Ca2++OH-+HCO3-=CaCO3↓+H2O,选项错误,B不符合题意;
C.3.36LCl2的物质的量为0.15mol,通入FeBr2溶液中,先与Fe2+反应,过量的Cl2再与Br-反应,参与反应的Cl2、Fe2+和Br-的物质的量分别为:0.15mol、0.2mol、0.1mol,故可得该反应的离子方程式为:4Fe2++2Br-+3Cl2=4Fe3++Br2+6Cl-,选项正确,C符合题意;
D.反应后溶液显中性,则参与反应的H+和OH-的系数比为2:2,故该反应的离子方程式为:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓,选项错误,D不符合题意;
故答案为:C
【分析】A.明矾为KAl(SO4)2,滴加过程中产生沉淀最大值,则SO42-完全沉淀;
B.NaHCO3少量,则完全反应,据此写出反应的离子方程式;
C.由于还原性:Fe2+>Br-,故往FeBr2溶液中通入氯气后,氯气先与Fe2+反应;
D.反应后溶液显中性,则参与反应的H+和OH-的系数比为2:2
18.【答案】C
【解析】【解答】A. 铜丝溶于浓硝酸生成绿色的硝酸铜浓溶液和二氧化氮,A不符合题意;
B. 稀硫酸与Ba(OH)2溶液混合出现浑浊,反应的离子方程式为2H++2OH-+ Ba2++SO42- =BaSO4↓+2H2O,B不符合题意;
C. 澄清石灰水中加入过量小苏打溶液出现浑浊,生成碳酸钙沉淀,离子方程式为Ca2++ 2HCO3-+2OH-= CaCO3↓+CO32-+ 2H2O,C符合题意;
D. 氨水是弱碱,用化学式表示,D不符合题意;
故答案为:C。
【分析】本题考查了离子方程式的书写。解此题的关键要注意生成武是否写错、反应物离子的个数、弱酸弱碱要用化学式表示。
19.【答案】(1)NaHSO4=Na++H++SO
(2)H2S H++HS﹣HS﹣ H++S2﹣
【解析】【解答】(1)NaHSO4是强酸强碱酸式盐,属强电解质,完全电离,电离出Na+、H+、SO 离子,故答案为:NaHSO4=Na++H++SO (2)H2S是二元弱酸,属弱电解质,分两步电离,第一步电离出氢离子和硫氢根离子,第二步电离:硫氢根离子电离出硫离子和氢离子,故答案为:H2S H++HS﹣,HS﹣ H++S2﹣
【分析】先判断电解质的类型及电离出的阴阳离子,根据电解质的类型判断写可逆号还是等号;如果是多元弱电解质,要分步电离.
20.【答案】(1)Ba(OH)2+2HCl=BaCl2+2H2O
(2)Al2(SO4)3=2Al3++SO42﹣
(3)HCO3﹣+H+═H2O+CO2↑
(4)Ba2++2OH﹣+CO2═H2O+BaCO3↓
(5)碳酸钠溶液
【解析】【解答】解:(1)H++OH﹣═H2O,表示强酸或者强酸的酸式盐与可溶性强碱反应生成可溶性盐和水,可以表示氢氧化钡与盐酸反应,化学方程式:Ba(OH)2+2HCl=BaCl2+2H2O;
故答案为:Ba(OH)2+2HCl=BaCl2+2H2O;(2)硫酸铝为强电解质,完全电离,电离方程式:Al2(SO4)3=2Al3++SO42﹣;
故答案为:Al2(SO4)3=2Al3++SO42﹣;(3)盐酸与碳酸氢钠反应生成氯化钠和水、二氧化碳,离子方程式:HCO3﹣+H+═H2O+CO2↑;
故答案为:HCO3﹣+H+═H2O+CO2↑;(4)氢氧化钡与二氧化碳反应生成碳酸钡和水,离子方程式:Ba2++2OH﹣+CO2═H2O+BaCO3↓;
故答案为:Ba2++2OH﹣+CO2═H2O+BaCO3↓;(5)碳酸根离子能够与钙离子反应生成碳酸钙,过量的碳酸钠与盐酸反应生成氯化钠和水、二氧化碳,所以可以用碳酸钠溶液除去氯化钠溶液中的钙离子;
故答案为:碳酸钠溶液.
【分析】(1)H++OH﹣═H2O,表示强酸或者强酸的酸式盐与可溶性强碱反应生成可溶性盐和水;(2)硫酸铝为强电解质,完全电离;(3)盐酸与碳酸氢钠反应生成氯化钠和水、二氧化碳;(4)氢氧化钡与二氧化碳反应生成碳酸钡和水;(5)碳酸根离子能够与钙离子反应生成碳酸钙,过量的碳酸钠与盐酸反应生成氯化钠和水、二氧化碳.
21.【答案】(1)②③⑤;①⑩;②⑦⑧⑨⑩
(2)
(3)D
(4)
(5)
【解析】【解答】(1)电解质是溶于水或在熔融状态下能够导电的化合物;非电解质是溶于水或在熔融状态下不能够导电的化合物;溶液导电的原因是存在自由移动的离子,金属导电的原因是存在自由移动的电子;
①属于单质,不能导电;②熔融NaCl为熔融盐,属于电解质,能导电;③固体,属于电解质,不能导电;①属于非电解质,不能导电;⑤属于电解质,不能导电;;⑥75%的酒精属于混合物,不导电;⑦溶液属于混合物,导电;⑧NaOH溶液属于混合物,导电;⑨稀盐酸属于混合物,导电;⑩Fe属于金属单质,能导电。
故属于电解质的有②③⑤;属于单质的有①⑩;上述条件下能导电的有②⑦⑧⑨⑩;
(2)溶液和⑧反应生成氢氧化铜沉淀和硫酸钠,;
(3)NaCl、、NaOH分别是含钠盐、含钠盐、含钠碱,故都属于含钠化合物,选D;
(4)少量与澄清石灰水反应生成亚硫酸钙沉淀和水,;
(5)碱式碳酸铜[]可以看作是和按照1:1的比例组成的混合型化合物,则它与足量盐酸反应生成氯化铜、水、二氧化碳,。
【分析】(1)电解质是指在水溶液中或熔融状态下能导电的化合物;单质是只由一种元素组成的纯净物;含有自由移动的离子或电子的物质能导电;
(2)硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠;
(3)NaCl、、NaOH均是含有钠元素的化合物;
(4)少量与澄清石灰水反应生成亚硫酸钙沉淀和水;、
(5)碱式碳酸铜与足量盐酸反应生成氯化铜、水、二氧化碳。
22.【答案】(1)MgO+2H+=H2O+Cu2+
(2)CH3COOH+OH﹣=CH3COO﹣+H2O
(3)F e2(SO4)3=2Fe3++2SO42﹣
(4)Na2CO3+2HCl═CO2↑+H2O+2NaCl
【解析】【解答】解:(1)氧化镁与稀盐酸反应生成氯化镁和水,离子方程式:MgO+2H+=H2O+Cu2+;
故答案为:MgO+2H+=H2O+Cu2+;(2)氢氧化钠溶液和醋酸溶液反应生成醋酸钠和水,离子方程式:CH3COOH+OH﹣=CH3COO﹣+H2O;
故答案为:CH3COOH+OH﹣=CH3COO﹣+H2O;(3)Fe2(SO4)3为强电解质完全电离,电离方程式:Fe2(SO4)3=2Fe3++2SO42﹣;
故答案为:Fe2(SO4)3=2Fe3++2SO42﹣;(4)CO32﹣+2H+═CO2↑+H2O可表示碳酸钠和盐酸的反应,化学方程式:Na2CO3+2HCl═CO2↑+H2O+2NaCl;
故答案为:Na2CO3+2HCl═CO2↑+H2O+2NaCl;
【分析】(1)氧化镁与稀盐酸反应生成氯化镁和水;(2)氢氧化钠溶液和醋酸溶液反应生成醋酸钠和水;(3)Fe2(SO4)3为强电解质完全电离;(4)CO32﹣+2H+═CO2↑+H2O表示可溶性碳酸盐与强酸反应生成二氧化碳和水、可溶性盐;
23.【答案】(1)①②④
(2)⑥⑦
(3)③⑤⑧
【解析】【解答】解:①NaOH溶液,能导电,属于混合物,既不是电解质也不是非电解质;②铁丝能导电,属于金属单质,既不是电解质也不是非电解质;③液态HCl不能导电,溶于水能导电,属于电解质;④熔融氯化钠,电离出自由移动的离子能导电属于电解质;⑤硫酸钠固体不能导电,溶于水或熔融状态下能导电,属于电解质;⑥CO2本身不能电离,属于非电解质,其水溶液能导电的原因是二氧化碳溶于谁生成的碳酸导电;⑦酒精不能导电,属于非电解质;⑧生石灰不能导电,溶于水形成电解质导电或熔融状态下能导电,属于电解质;(1)上述物质中,可导电的是①②④,故答案为:①②④;(2)上述物质中,属于非电解质的是⑥⑦,故答案为:⑥⑦;(3)上述物质中,属于电解质但不导电的是③⑤⑧,
故答案为:③⑤⑧.
【分析】存在自由移动的带电微粒即可导电;在水溶液中或熔化状态下能导电的化合物属于电解质;在水溶液中和熔化状态下都不能导电的化合物属于非电解质.
一、单选题
1.下列离子方程式,书写正确的是( )
A.H2S 2H++S2 B.KHCO3 K++H++CO32-
C.Cu(OH)2 Cu2++2OH D.HClO=H++ClO
2.下列说法对应的离子方程式合理的是
A.泡沫灭火器的工作原理:
B.溶液中加入足量溶液:
C.与反应:
D.铅蓄电池放电时正极的电极反应式:
3.下列实验的反应原理用离子方程式表示正确的是( )
A.室温下,测得氯化铵溶液pH<7,证明一水合氨是碱:NH4++2H2O═NH3 H2O+H3O+
B.用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑
C.用碳酸氢钠溶液检验水杨酸中的羧基: +2HCO3﹣→ +2H2O+2CO2↑
D.用高锰酸钾标准溶液滴定草酸:2MnO4﹣+16H++5C2O42﹣═2Mn2++10CO2↑+8H2O
4.下列电离方程式的书写,正确的是( )
A.2Na++SO42-= Na2SO4 B.H2SO4= 2H+ + SO42-
C.CuCl2= Cu2+ + Cl― D.NaHCO3= Na+ + H+ + CO32-
5.下列各组离子在常温下一定能大量共存的是( )
A.pH=0的无色溶液中:Cl﹣、Na+、SO 、Fe2+
B.在 =1012的溶液中:NH 、NO 、K+、Cl﹣
C.加入铝粉能放出H2的溶液中:Mg2+、NH 、NO 、Cl﹣
D.含有大量Fe3+的溶液中:Al3+、SCN﹣、Br﹣、Na+
6.下列物质的水溶液能导电,但属于非电解质的是( )
A.HNO3 B.NaOH C.NH4NO3 D.CO2
7.下列各组选项按电解质、非电解质、单质和混合物顺序排列的一组是( )
A.NaCl、乙醇、铁、空气 B.蔗糖、CuSO4、氮气、胆矾
C.HCl、SO2、石墨、液氯 D.KCl、盐酸、氧气、石灰水
8.下列离子方程式书写正确的是( )
A.钠与水反应:
B.硫化氢气体通入氯水中:
C.硫酸和氢氧化钡溶液混合:
D.铁与稀硫酸反应:
9.下列反应的离子方程式正确的是( )
A.铁粉与氯化铁溶液反应:Fe+Fe3+=2Fe2+
B.用稀盐酸除去铁表面的铁锈:Fe2O3+6H+=2Fe3++3H2O
C.用大理石与稀盐酸反应制备二氧化碳:+2H+=H2O+CO2↑
D.稀硫酸与氢氧化钡溶液反应:H+++Ba2++OH-=BaSO4↓+H2O
10.下列各组离子在指定溶液中一定能大量共存的是( )
①pH=0的溶液:Na+、C2O42﹣、MnO4﹣、SO42﹣
②pH=11的溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣、S2﹣、SO32﹣
③水电离的H+浓度为10﹣12mol L﹣1的溶液中:Cl﹣、CO32﹣、NO3﹣、NH4+、SO32﹣
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl﹣、K+、SO42﹣
⑤使石蕊变红的溶液中:Fe2+、MnO4﹣、NO3﹣、Na+、SO42﹣
⑥中性溶液中:Fe3+、Al3+、NO3﹣、I﹣、Cl﹣、S2﹣.
A.①②⑤ B.①③⑥ C.②④ D.①②④
11.下列电解质在水溶液中和熔化状态下均能导电的是 ( )
A.硫酸 B.碳酸钙 C.氢氧化钠 D.氧化镁
12.能正确表示下列反应的离子方程式为
A.将等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液等体积混合: +Ba2++OH-=BaCO3↓ +H2O
B.氯气溶于水:Cl2+H2O=2H+ + Cl-+ClO-
C.向氢氧化亚铁中加入足量的稀硝酸: Fe(OH)2 +2H+=Fe2+ +2H2O
D.用铝粉和NaOH溶液反应制取少量H2:Al+2OH-=+H2↑
13.在无色酸性溶液中能大量共存的一组离子是( )
A.、、、 B.、、、
C.、、、 D.、、、
14.溶质都为1mol的NaHCO3溶液和Ba(OH)2溶液混合,能完整表示该反应的离子方程式是( )
A.CO32﹣+Ba2+=BaCO3
B.HCO3﹣+OH﹣→H2O+CO32﹣
C.HCO3﹣+Ba2++OH﹣→H2O+BaCO3
D.2HCO3﹣+Ba2++OH﹣=BaCO3+2H2O+CO32﹣
15.离子交换法净化水过程如图所示。下列说法错误的是( )
A.经过阳离子交换树脂后,水中阳离子的总数不变
B.阴离子交换树脂填充段存在反应
C.通过净化处理后,水的导电性降低
D.若将阴离子交换树脂与阳离子交换树脂互换位置,对水处理结果没有影响
16.在c(Ca2+)=0.1mol L﹣1的新制漂白粉的溶液中,下列各组离子能在其中大量共存的是( )
A. B.
C. D.
17.下列离子方程式正确的是( )
A.向明矾溶液中逐滴滴入Ba(OH)2溶液,至沉淀质量最大时反应为:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓
B.向澄清石灰水中滴入少量NaHCO3溶液:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
C.已知:2Br-+Cl2=2Cl-+Br2 ,Br2+2Fe2+=2Fe3++2Br-,向含0.2molFeBr2 的溶液中通入标准状况下3.36LCl2时,发生的反应为: 4Fe2++2Br-+3Cl2=4Fe3++Br2+6Cl-
D.向NaHSO4中滴入Ba(OH)2溶液至恰好显中性:H+ +SO42- + Ba2++OH-= H2O +BaSO4↓
18.下列解释事实的离子方程式正确的是( )
A.铜丝溶于浓硝酸生成绿色溶液:3Cu+8H++2NO3-==3Cu2++2NO↑+4H2O
B.稀硫酸与Ba(OH)2溶液混合出现浑浊:H++OH-+ Ba2++SO42- =BaSO4↓+H2O
C.澄清石灰水中加入过量小苏打溶液出现浑浊:Ca2++ 2HCO3-+2OH-= CaCO3↓+CO32-+ 2H2O
D.在AlCl3溶液中加入过量氨水出现浑浊:Al3++3OH-= Al(OH)3↓
二、综合题
19.写出下列物质的电离方程式:
(1)NaHSO4溶于水
(2)H2S的电离 .
20.现有下列六种物质:①液态HCl ②NaHCO3③NaCl溶液 ④CO2⑤Al2(SO4)3
⑥Ba(OH)2
(1)上述物质中的两种物质在水溶液中发生反应,离子方程式为:H++OH﹣═H2O,该反应的化学方程式为.
(2)⑤在水中的电离方程式为 ,
(3)胃液中含有盐酸,胃酸过多的人可服用适量的②能治疗胃酸过多,请写出其反应的离子方程式: ;
(4)向⑥的溶液中通入④,请写出反应的离子方程式
(5)③的溶液若含少量Ca2+,可向溶液中加入过量的 (填试剂名称),过滤后再加足量稀盐酸,最后蒸发结晶得到纯净的NaCl晶体.
21.以下为中学化学中常见的几种物质;①;②熔融NaCl;③固体;①;⑤;⑥75%的酒精⑦溶液;⑧NaOH溶液;⑨稀盐酸;⑩Fe。回答下列问题:
(1)上述物质中属于电解质的有 (填序号,下同);属于单质的有 ;上述条件下能导电的有 。
(2)写出溶液和⑧反应的离子方程式: 。
(3)某同学将NaCl、、NaOH划分为一类,该同学的分类依据为____(填字母)。
A.酸 B.碱 C.钠盐 D.含钠化合物
(4)与两者性质部分相似,根据与澄清石灰水反应的化学方程式,写出少量与澄清石灰水反应的化学方程式: 。
(5)碱式碳酸铜[]可以看作是和按照1:1的比例组成的混合型化合物,写出它与足量盐酸反应的化学方程式: 。
22.按要求写出方程式.
(1)氧化镁与稀盐酸反应(写出离子方程式)
(2)氢氧化钠溶液和醋酸溶液反应(写出离子方程式)
(3)Fe2(SO4)3(写出电离方程式)
(4)CO32﹣+2H+═CO2↑+H2O(写出对应的化学方程式) .
23.现有下列八种物质:①NaOH溶液 ②铁丝 ③液态HCl④熔融氯化钠 ⑤硫酸钠固体⑥CO2⑦酒精⑧生石灰.
(1)上述物质中,可导电的是 (填序号,下同).
(2)上述物质中,属于非电解质的是 .
(3)上述物质中,属于电解质但不导电的是 .
答案解析部分
1.【答案】C
【解析】【解答】A.H2S属于二元弱酸,分步电离,H2S HS-+H+, HS- H++S2-,A不符合题意;
B.KHCO3属于强电解质,完全电离,但是HCO3-属于弱酸根离子,部分电离,KHCO3= K++HCO3-,HCO3- H++CO32-,B不符合题意;
C.Cu(OH)2属于弱碱,可逆电离,一步写出:Cu(OH)2 Cu2++2OH-,C符合题意;
D.HClO属于弱酸,可逆电离,HClO H++ClO-,D不符合题意;
故答案为:C
【分析】此题是对电离方程式书写的考查,根据电离方程式的书写进行分析即可。
2.【答案】B
【解析】【解答】A.泡沫灭火器中的主要成分为硫酸铝和碳酸氢钠,故离子方程式中应为碳酸氢根离子不是碳酸根离子,A项不符合题意;
B.碳酸氢钠和足量的氢氧化钡反应生成氢氧化钠和碳酸钡沉淀,离子方程式符合题意,B项符合题意;
C.过氧化钠和水反应过程中水中的氧原子到氢氧化钠中,C项不符合题意;
D.铅蓄电池中的正极反应式为,D项不符合题意。
故答案为:B。
【分析】A、泡沫灭火器中使用的是碳酸氢钠,电离出碳酸氢根离子;
B、碳酸氢钠和氢氧化钡反应,氢氧化钡过量时,没有生成碳酸钠;
C、过氧化钠和水的反应,氧气中的氧原子来自于过氧化钠;
D、铅蓄电池的正极为二氧化铅得到电子,结合硫酸根离子和氢离子生成硫酸铅和水。
3.【答案】B
【解析】【解答】A.盐类水解是可逆反应,应该写可逆号,离子方程式为:NH4++2H2O NH3 H2O+H3O+,故A错误;
B.Al和NaOH溶液反应生成偏铝酸钠和氢气,Mg不反应,离子方程式为2Al+2OH﹣+2H2O═2AlO2﹣+3H2↑,故B正确;
C.羧基能和碳酸氢钠反应,但酚羟基和碳酸氢钠不反应,离子方程式为 +HCO3﹣→ +H2O+CO2↑,故C错误;
D.弱电解质写化学式,离子方程式为2MnO4﹣+6H++5H2C2O4═2Mn2++10CO2↑+8H2O,故D错误;
故选B.
【分析】A.盐类水解是可逆反应;B.Al和NaOH溶液反应生成偏铝酸钠和氢气,Mg不反应;C.羧基能和碳酸氢钠反应,但酚羟基和碳酸氢钠不反应;D.弱电解质写化学式.本题主要考查离子方程式的书写,解答此题关键是明确物质之间反应、物质性质及离子方程式书写规则,涉及盐类水解、氧化还原反应等知识点,易错选项是C,注意羧基能和碳酸氢盐反应但酚羟基不能和碳酸氢盐反应,但羧基、酚羟基都能和碳酸钠反应,题目难度不大.
4.【答案】B
【解析】【解答】A.Na2SO4在水中的电离方程式为:Na2SO4=2Na++SO42-,A不符合题意;
B.H2SO4是强酸,在水中完全电离,其电离方程式为:H2SO4=2H++SO42-,B符合题意;
C.CuCl2是可溶性盐,在水中完全电离,其电离方程式为:CuCl2=Cu2++2Cl-,C不符合题意;
D.NaHCO3是可溶性盐,在水中完全电离,其电离方程式为:NaHCO3=Na++HCO3-,D不符合题意;
故答案为:B
【分析】A、Na2SO4在水中电离产生Na+和SO42-;
B、H2SO4在水中完全电离,产生H+和SO42-;
C、CuCl2在水中完全电离产生Cu2+和Cl-;
D、NaHCO3在水中完全电离,产生Na+和HCO3-;
5.【答案】B
【解析】【解答】解:A、该溶液为酸性无色溶液,Fe2+为有色离子,不满足溶液无色的要求,故A错误;
B、该溶液为酸性溶液,NH 、NO 、K+、Cl﹣离子之间不反应,也不与氢离子反应,在溶液中能够大量共存,故B正确;
C、该溶液为酸性或者碱性溶液,Mg2+、NH 能够与氢氧根离子反应,在溶液中不能大量共存,酸性溶液中NO 、Al反应不生成氢气,故C错误;
D、Fe3+能够与SCN﹣离子反应生成硫氰化铁,在溶液中不能大量共存,故D错误;
故选B.
【分析】A、pH=0的无色溶液为酸性溶液,且不存在有色离子,亚铁离子为有色离子;
B、在 =1012的溶液为酸性溶液,四种离子之间不反应,能够共存;
C、加入铝粉能放出H2的溶液为酸性或者碱性溶液,镁离子、铵离子能够与氢氧根离子反应;
D、铁离子能够与硫氰根离子反应生成络合物硫氰化铁.
6.【答案】D
【解析】【解答】解:A.HNO3溶于水后发生电离,水溶液导电,是电解质,故A错误;
B.NaOH溶于水后发生电离,水溶液导电,是电解质,故B错误;
C.NH4NO3溶于水后发生电离,水溶液导电,是电解质,故B错误;
D.CO2溶于水生成碳酸,碳酸发生电离,水溶液导电,碳酸是电解质,CO2是非电解质,故D正确;
故选D.
【分析】水溶液导电的原因是水溶液中含有自由移动的阴阳离子,电解质是指在水溶液或熔化状态下能导电的化合物,而非电解质是指在水溶液和熔化状态下都不能导电的化合物,据此进行判断.
7.【答案】A
【解析】【解答】A.NaCl是电解质,乙醇是非电解质,铁是金属单质,空气是混合物,故A符合题意;
B.蔗糖是非电解质,CuSO4是电解质,氮气是非金属单质,胆矾是纯净物,故B不符合题意;
C.HCl是电解质,SO2是非电解质,石墨是非金属单质、液氯是纯净物,故C不符合题意;
D.KCl是电解质,盐酸是混化合物,既不是电解质也不是非电解质,氧气是非金属单质,石灰水是氢氧化钙溶液,是混合物,故D不符合题意;
故答案为:A。
【分析】此题是对物质分类的考查,结合电解质、非电解质、单质和混合物的定义分析即可。电解质是指在水溶液或熔融状态下能导电的化合物;非电解质是指在水溶液和熔融状态下都不能导电的化合物;单质是指只由一种元素组成的纯净物;混合物是指由多种物质混合而成。
8.【答案】B
【解析】【解答】A.Na与H2O反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑,A不符合题意;
B.该反应的离子方程式为H2S+Cl2=2H++2Cl-+S↓,B符合题意;
C.H2SO4与Ba(OH)2反应的离子方程式为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,C不符合题意;
D.Fe与稀硫酸反应的离子方程式为Fe+2H+=Fe2++H2↑,D不符合题意;
故答案为:B
【分析】A、Na与H2O反应生成H2和可溶性NaOH;
B、氯水中的Cl2具有氧化性,能将H2S氧化成S;
C、H2SO4与Ba(OH)2反应生成BaSO4沉淀和H2O;
D、Fe与稀硫酸反应生成可溶性FeSO4和H2;
9.【答案】B
【解析】【解答】A.铁粉与氯化铁溶液反应的离子方程式为:Fe+2Fe3+=3Fe2+,故A不符合题意;
B.用稀盐酸除去铁表面的铁锈:Fe2O3+6H+=2Fe3++3H2O,符合离子方程式的书写规则,故B符合题意;
C.大理石为难溶盐,书写离子方程式时不能拆开写,应为:CaCO3+2H+=Ca2++H2O+CO2↑,故C不符合题意;
D.稀硫酸与氢氧化钡溶液反应的离子方程式为2H+++Ba2++2OH-=BaSO4↓+2H2O,故D不符合题意;
故答案为:B。
【分析】A.该方程式电荷不守恒;
C.碳酸钙为固体,应保留化学式;
D.氢氧化钡电离产生的钡离子和氢氧根离子数目之比为1:2。
10.【答案】C
【解析】【解答】解:①pH=0的溶液呈酸性,C2O42﹣、MnO4﹣在酸性条件下发生氧化还原反应而不能大量共存,故错误;②pH=11的溶液呈碱性,这几种离子之间不反应且和氢氧根离子不反应,所以能大量共存,故正确;③水电离的H+浓度为10﹣12mol L﹣1的溶液呈酸性或碱性,酸性条件下,CO32﹣、SO32﹣不能大量共存,故错误;④加入Mg能放出H2的溶液呈酸性,这几种离子之间不反应且和氢离子不反应,所以能大量共存,故正确;⑤使石蕊变红的溶液呈酸性,酸性条件下,Fe2+和MnO4﹣、NO3﹣发生氧化还原反应而不能大量共存,故错误;⑥中性溶液中Fe3+生成氢氧化铁而不能大量共存,故错误;
故选C.
【分析】①pH=0的溶液呈酸性,强氧化性物质和强还原性离子不能共存;②pH=11的溶液呈碱性,离子之间不反应的能大量共存;③水电离的H+浓度为10﹣12mol L﹣1的溶液呈酸性或碱性,离子之间不反应的能大量共存;④加入Mg能放出H2的溶液呈强酸性,离子之间不反应且和氢离子不反应的能大量共存;⑤使石蕊变红的溶液呈酸性,离子之间不反应的能大量共存;⑥中性溶液中,离子之间不反应的能大量共存.
11.【答案】C
【解析】【分析】答案C
A.硫酸是共价化合物,液态时不电离 B.碳酸钙高温分解 C.氢氧化钠在水溶液中和熔化状态下均能导电 D.氧化镁在水中反应生成Mg (OH)2。
12.【答案】A
【解析】【解答】A.等物质的量的NaHCO3与Ba(OH)2反应的离子方程式为:+Ba2++OH-=BaCO3↓ +H2O,A符合题意;
B.氯气溶于水的离子方程式为:Cl2+H2O=H+ + Cl-+HClO,B不符合题意;
C.向氢氧化亚铁中加入足量的稀硝酸发生氧化还原反应,反应的离子方程式为:,C不符合题意;
D.用铝粉和NaOH溶液反应制取少量H2的离子方程式为:,D不符合题意;
故答案为:A。
【分析】A.等体积物质的量浓度的NaHCO3和Ba(OH)2两溶液混合生成BaCO3和H2O;
B.HClO为弱酸,应保留化学式;
C.稀硝酸将亚铁离子氧化为铁离子;
D.该方程式电荷不守恒,正确的离子方程式为。
13.【答案】C
【解析】【解答】A.酸性溶液中含有大量氢离子,H+不能与共存,A不符合题意;
B.为蓝色,与无色溶液相悖,B不符合题意;
C.、、、均无色,且与H+不反应,可以大量共存,C符合题意;
D.为紫色,与无色溶液相悖,D不符合题意;
故答案为:C。
【分析】无色酸性溶液中含有大量氢离子,且不存在有色离子。
14.【答案】C
【解析】【解答】解:溶质都为1mol的NaHCO3溶液和Ba(OH)2溶液混合,氢氧根离子过量,反应生成碳酸钡、NaOH和水,反应的离子方程式为HCO3﹣+Ba2++OH﹣=H2O+BaCO3,
故选C.
【分析】NaHCO3和Ba(OH)2的相等,氢氧根离子过量,反应生成碳酸钡沉淀、氢氧化钠和水,据此书写离子方程式.
15.【答案】A
【解析】【解答】A.Na+、Ca2+、Mg2+等阳离子被H+代替,根据电荷守恒可知,经过阳离子交换树脂后,水中阳离子总数增加,A项符合题意;
B.溶液中的阳离子被H+代替、阴离子被OH-代替,阴离子树脂填充段存在反应:,B项不符合题意;
C.通过净化处理后,溶液中离子的浓度降低,水的导电性降低,C项不符合题意;
D.若将阴离子交换树脂与阳离子交换树脂互换位置,经阴离子交换膜后,Mg2+与OH-生成了沉淀,溶液中离子为Ca2+、Na+、OH-,再经阳离子交换膜,H+代替Ca2+、Na+,故对水处理结果没有影响,D项不符合题意;
故答案为:A。
【分析】A、结合电荷守恒进行判断;
B、氢离子和氢氧根结合生成水;
C、净化后离子浓度降低,导电性减弱;
D、最终都是将离子阻挡,没有实际影响。
16.【答案】B
【解析】【解答】解:A.Ca2+、CO32﹣结合生成沉淀,不能大量共存,故A错误;
B.新制漂白粉的溶液含Ca2+、ClO﹣、Cl﹣,该组离子之间均不反应,可大量共存,故B正确;
C.ClO﹣、S2﹣发生氧化还原反应,不能大量共存,故C错误;
D.Ca2+、SO42﹣反应生成沉淀,不能大量共存,故D错误;
故选B.
【分析】新制漂白粉的溶液含Ca2+、ClO﹣、Cl﹣,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
17.【答案】C
【解析】【解答】A.滴加过程中产生沉淀最大值,则SO42-完全沉淀,故反应的离子方程式为:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O,选项错误,A不符合题意;
B.NaHCO3少量,则完全反应,故该反应的离子方程式为:Ca2++OH-+HCO3-=CaCO3↓+H2O,选项错误,B不符合题意;
C.3.36LCl2的物质的量为0.15mol,通入FeBr2溶液中,先与Fe2+反应,过量的Cl2再与Br-反应,参与反应的Cl2、Fe2+和Br-的物质的量分别为:0.15mol、0.2mol、0.1mol,故可得该反应的离子方程式为:4Fe2++2Br-+3Cl2=4Fe3++Br2+6Cl-,选项正确,C符合题意;
D.反应后溶液显中性,则参与反应的H+和OH-的系数比为2:2,故该反应的离子方程式为:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓,选项错误,D不符合题意;
故答案为:C
【分析】A.明矾为KAl(SO4)2,滴加过程中产生沉淀最大值,则SO42-完全沉淀;
B.NaHCO3少量,则完全反应,据此写出反应的离子方程式;
C.由于还原性:Fe2+>Br-,故往FeBr2溶液中通入氯气后,氯气先与Fe2+反应;
D.反应后溶液显中性,则参与反应的H+和OH-的系数比为2:2
18.【答案】C
【解析】【解答】A. 铜丝溶于浓硝酸生成绿色的硝酸铜浓溶液和二氧化氮,A不符合题意;
B. 稀硫酸与Ba(OH)2溶液混合出现浑浊,反应的离子方程式为2H++2OH-+ Ba2++SO42- =BaSO4↓+2H2O,B不符合题意;
C. 澄清石灰水中加入过量小苏打溶液出现浑浊,生成碳酸钙沉淀,离子方程式为Ca2++ 2HCO3-+2OH-= CaCO3↓+CO32-+ 2H2O,C符合题意;
D. 氨水是弱碱,用化学式表示,D不符合题意;
故答案为:C。
【分析】本题考查了离子方程式的书写。解此题的关键要注意生成武是否写错、反应物离子的个数、弱酸弱碱要用化学式表示。
19.【答案】(1)NaHSO4=Na++H++SO
(2)H2S H++HS﹣HS﹣ H++S2﹣
【解析】【解答】(1)NaHSO4是强酸强碱酸式盐,属强电解质,完全电离,电离出Na+、H+、SO 离子,故答案为:NaHSO4=Na++H++SO (2)H2S是二元弱酸,属弱电解质,分两步电离,第一步电离出氢离子和硫氢根离子,第二步电离:硫氢根离子电离出硫离子和氢离子,故答案为:H2S H++HS﹣,HS﹣ H++S2﹣
【分析】先判断电解质的类型及电离出的阴阳离子,根据电解质的类型判断写可逆号还是等号;如果是多元弱电解质,要分步电离.
20.【答案】(1)Ba(OH)2+2HCl=BaCl2+2H2O
(2)Al2(SO4)3=2Al3++SO42﹣
(3)HCO3﹣+H+═H2O+CO2↑
(4)Ba2++2OH﹣+CO2═H2O+BaCO3↓
(5)碳酸钠溶液
【解析】【解答】解:(1)H++OH﹣═H2O,表示强酸或者强酸的酸式盐与可溶性强碱反应生成可溶性盐和水,可以表示氢氧化钡与盐酸反应,化学方程式:Ba(OH)2+2HCl=BaCl2+2H2O;
故答案为:Ba(OH)2+2HCl=BaCl2+2H2O;(2)硫酸铝为强电解质,完全电离,电离方程式:Al2(SO4)3=2Al3++SO42﹣;
故答案为:Al2(SO4)3=2Al3++SO42﹣;(3)盐酸与碳酸氢钠反应生成氯化钠和水、二氧化碳,离子方程式:HCO3﹣+H+═H2O+CO2↑;
故答案为:HCO3﹣+H+═H2O+CO2↑;(4)氢氧化钡与二氧化碳反应生成碳酸钡和水,离子方程式:Ba2++2OH﹣+CO2═H2O+BaCO3↓;
故答案为:Ba2++2OH﹣+CO2═H2O+BaCO3↓;(5)碳酸根离子能够与钙离子反应生成碳酸钙,过量的碳酸钠与盐酸反应生成氯化钠和水、二氧化碳,所以可以用碳酸钠溶液除去氯化钠溶液中的钙离子;
故答案为:碳酸钠溶液.
【分析】(1)H++OH﹣═H2O,表示强酸或者强酸的酸式盐与可溶性强碱反应生成可溶性盐和水;(2)硫酸铝为强电解质,完全电离;(3)盐酸与碳酸氢钠反应生成氯化钠和水、二氧化碳;(4)氢氧化钡与二氧化碳反应生成碳酸钡和水;(5)碳酸根离子能够与钙离子反应生成碳酸钙,过量的碳酸钠与盐酸反应生成氯化钠和水、二氧化碳.
21.【答案】(1)②③⑤;①⑩;②⑦⑧⑨⑩
(2)
(3)D
(4)
(5)
【解析】【解答】(1)电解质是溶于水或在熔融状态下能够导电的化合物;非电解质是溶于水或在熔融状态下不能够导电的化合物;溶液导电的原因是存在自由移动的离子,金属导电的原因是存在自由移动的电子;
①属于单质,不能导电;②熔融NaCl为熔融盐,属于电解质,能导电;③固体,属于电解质,不能导电;①属于非电解质,不能导电;⑤属于电解质,不能导电;;⑥75%的酒精属于混合物,不导电;⑦溶液属于混合物,导电;⑧NaOH溶液属于混合物,导电;⑨稀盐酸属于混合物,导电;⑩Fe属于金属单质,能导电。
故属于电解质的有②③⑤;属于单质的有①⑩;上述条件下能导电的有②⑦⑧⑨⑩;
(2)溶液和⑧反应生成氢氧化铜沉淀和硫酸钠,;
(3)NaCl、、NaOH分别是含钠盐、含钠盐、含钠碱,故都属于含钠化合物,选D;
(4)少量与澄清石灰水反应生成亚硫酸钙沉淀和水,;
(5)碱式碳酸铜[]可以看作是和按照1:1的比例组成的混合型化合物,则它与足量盐酸反应生成氯化铜、水、二氧化碳,。
【分析】(1)电解质是指在水溶液中或熔融状态下能导电的化合物;单质是只由一种元素组成的纯净物;含有自由移动的离子或电子的物质能导电;
(2)硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠;
(3)NaCl、、NaOH均是含有钠元素的化合物;
(4)少量与澄清石灰水反应生成亚硫酸钙沉淀和水;、
(5)碱式碳酸铜与足量盐酸反应生成氯化铜、水、二氧化碳。
22.【答案】(1)MgO+2H+=H2O+Cu2+
(2)CH3COOH+OH﹣=CH3COO﹣+H2O
(3)F e2(SO4)3=2Fe3++2SO42﹣
(4)Na2CO3+2HCl═CO2↑+H2O+2NaCl
【解析】【解答】解:(1)氧化镁与稀盐酸反应生成氯化镁和水,离子方程式:MgO+2H+=H2O+Cu2+;
故答案为:MgO+2H+=H2O+Cu2+;(2)氢氧化钠溶液和醋酸溶液反应生成醋酸钠和水,离子方程式:CH3COOH+OH﹣=CH3COO﹣+H2O;
故答案为:CH3COOH+OH﹣=CH3COO﹣+H2O;(3)Fe2(SO4)3为强电解质完全电离,电离方程式:Fe2(SO4)3=2Fe3++2SO42﹣;
故答案为:Fe2(SO4)3=2Fe3++2SO42﹣;(4)CO32﹣+2H+═CO2↑+H2O可表示碳酸钠和盐酸的反应,化学方程式:Na2CO3+2HCl═CO2↑+H2O+2NaCl;
故答案为:Na2CO3+2HCl═CO2↑+H2O+2NaCl;
【分析】(1)氧化镁与稀盐酸反应生成氯化镁和水;(2)氢氧化钠溶液和醋酸溶液反应生成醋酸钠和水;(3)Fe2(SO4)3为强电解质完全电离;(4)CO32﹣+2H+═CO2↑+H2O表示可溶性碳酸盐与强酸反应生成二氧化碳和水、可溶性盐;
23.【答案】(1)①②④
(2)⑥⑦
(3)③⑤⑧
【解析】【解答】解:①NaOH溶液,能导电,属于混合物,既不是电解质也不是非电解质;②铁丝能导电,属于金属单质,既不是电解质也不是非电解质;③液态HCl不能导电,溶于水能导电,属于电解质;④熔融氯化钠,电离出自由移动的离子能导电属于电解质;⑤硫酸钠固体不能导电,溶于水或熔融状态下能导电,属于电解质;⑥CO2本身不能电离,属于非电解质,其水溶液能导电的原因是二氧化碳溶于谁生成的碳酸导电;⑦酒精不能导电,属于非电解质;⑧生石灰不能导电,溶于水形成电解质导电或熔融状态下能导电,属于电解质;(1)上述物质中,可导电的是①②④,故答案为:①②④;(2)上述物质中,属于非电解质的是⑥⑦,故答案为:⑥⑦;(3)上述物质中,属于电解质但不导电的是③⑤⑧,
故答案为:③⑤⑧.
【分析】存在自由移动的带电微粒即可导电;在水溶液中或熔化状态下能导电的化合物属于电解质;在水溶液中和熔化状态下都不能导电的化合物属于非电解质.
