第12章盐检测题(含解析) 2023-2024学年九年级化学京改版(2013)下册
文档属性
| 名称 | 第12章盐检测题(含解析) 2023-2024学年九年级化学京改版(2013)下册 |  | |
| 格式 | docx | ||
| 文件大小 | 621.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 20:55:54 | ||
图片预览



文档简介
第12章 盐 检测题
一、单选题
1.下列离子组在强酸性和强碱性溶液中都能大量共存的是
A.Ca2+,Cu2+,,Cl- B.Na+,Mg2+,,Cl-
C.Na+,K+,, D.K+,Ba2+,Cl-,
2.下列实验现象记录描述正确的是
A.红磷在氧气中燃烧发出耀眼的白光,并产生大量的白雾
B.细铁丝在氧气中燃烧火星四射,生成四氧化三铁黑色固体
C.鸡蛋清中加入浓硝酸,产生白色沉淀
D.向氢氧化钠溶液中滴加氯化铁溶液,产生红褐色沉淀
3.下列与洗涤有关的做法不合理的是
A.用洗洁精洗去餐具上的油污
B.用汽油洗去沾在衣服上的油渍
C.用白醋洗去水壶中的水垢(水垢的主要成分是碳酸钙和氢氧化镁)
D.用纯碱溶液洗去铁制品表面的铁锈
4.下列反应中属于置换反应的是
A. B.
C. D.
5.下列有关叙述、对应的方程式,所属基本反应类型都正确的是
A.工业上制取生石灰 CaCO3CO2↑+CaO 分解反应
B.小苏打治疗胃酸过多 NaHCO3+HCl=NaCl+H2O+CO2↑ 中和反应
C.点燃酒精灯:C2H5OH+O22CO2+3H2O 氧化反应
D.高炉炼铁:3CO+Fe2O34Fe+3CO2 置换反应
6.化学方程式书写正确的是
A.SO2+2NaOH=Na2SO4+H2O B.Fe2O3+H2SO4=FeSO4+H2O
C.2H2O22H2O+O2↑ D.KNO3+NaCl=KCl+NaNO3
7.下列实验方案合理的是( )
A.分离Cu和Ag固体混合物:加入适量的AgNO3溶液,过滤
B.制取少量FeCl2溶液:将适量的稀盐酸和Fe2O3混合,充分反应
C.鉴别木炭粉、Fe粉、CuO粉末:取样,分别加入稀盐酸,观察现象
D.除去NaOH溶液中的Na2CO3:加入过量的Ca(OH)2溶液,过滤
8.下列实验方案设计中,可行的是( )
A.除去氯化钠固体中的少量碳酸钠--加入过量稀盐酸,充分反应后,蒸发
B.检验二氧化碳气体中含有少量的一氧化碳--将混合气体依次通过灼热的氧化铁和澄清石灰水,观察澄清石灰水的变化
C.分离碳酸钠和氢氧化钠的混合物--加水溶解、过滤
D.验证锌、铁、铜的金属活动性顺序--将铁丝和铜丝分别浸入硫酸锌溶液中
9.已知某溶液中的溶质可能是HCl、K2CO3、H2SO4、CuCl2、NaCl溶液中的一种或几种,向该混合液中逐滴加入Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液的体积关系如图所示。下列说法中不正确的是
A.该混合液中一定不含有H2SO4
B.该混合液中一定有HCl和CuCl2,一定没有K2CO3
C.F点溶液中的溶质一定有两种
D.恰好完全反应时,消耗Ba(OH)2的质量为68.4g
10.从化学学科角度判断,下列关于盐的说法正确的是
A.就是食盐 B.一定有咸味 C.是一类化合物 D.一定含有金属离子
11.下列实验中能达到目的的是
A.分离二氧化锰和氯化钠固体:将混合物加入足量水中充分溶解后过滤
B.除去氢氧化钠中的少量碳酸钠:加入适量的氢氧化钙溶液后过滤
C.制备 FeCl3 溶液:将 FeO 与足量盐酸充分反应后过滤
D.鉴别硝酸铵和硫酸铵:取样加熟石灰研磨,观察是否产生刺激性气味
12.在给定条件下,下列物质能够直接转化成功的是
A.Cu片和稀H2SO4作用制备CuSO4溶液
B.S在O2中点燃制备SO3气体
C.CaCO3高温分解制备CaO固体
D.Fe和盐酸反应制备FeCl3溶液
13.在给定条件下,下列选项所示的物质间转化能一步实现的是
A.
B.
C.
D.
二、填空题
14.现有H、O、S、Cl、Na五种元素,请选用其中的元素写出符合下列要求的物质各一种(用化学式表示)
(1)常见的酸 ;(2)盐 。(3)碱 。
15.用化学用语表示:
①2个氮原子 ;②硫酸铁中的阳离子 。
③厨房里用的发酵粉的主要成分是 ;④不含金属元素的碱 。
16.化学就在我们身边。从 ①金刚石 ②氮气 ③钛合金 ④碳酸氢钠 四种物质中,选择适当的物质填空(填序号)。
(1)用于制造人造骨的是 ;
(2)用来裁玻璃的是 ;
(3)用于保护气的是 ;
(4)用于治疗胃酸过多的是 。
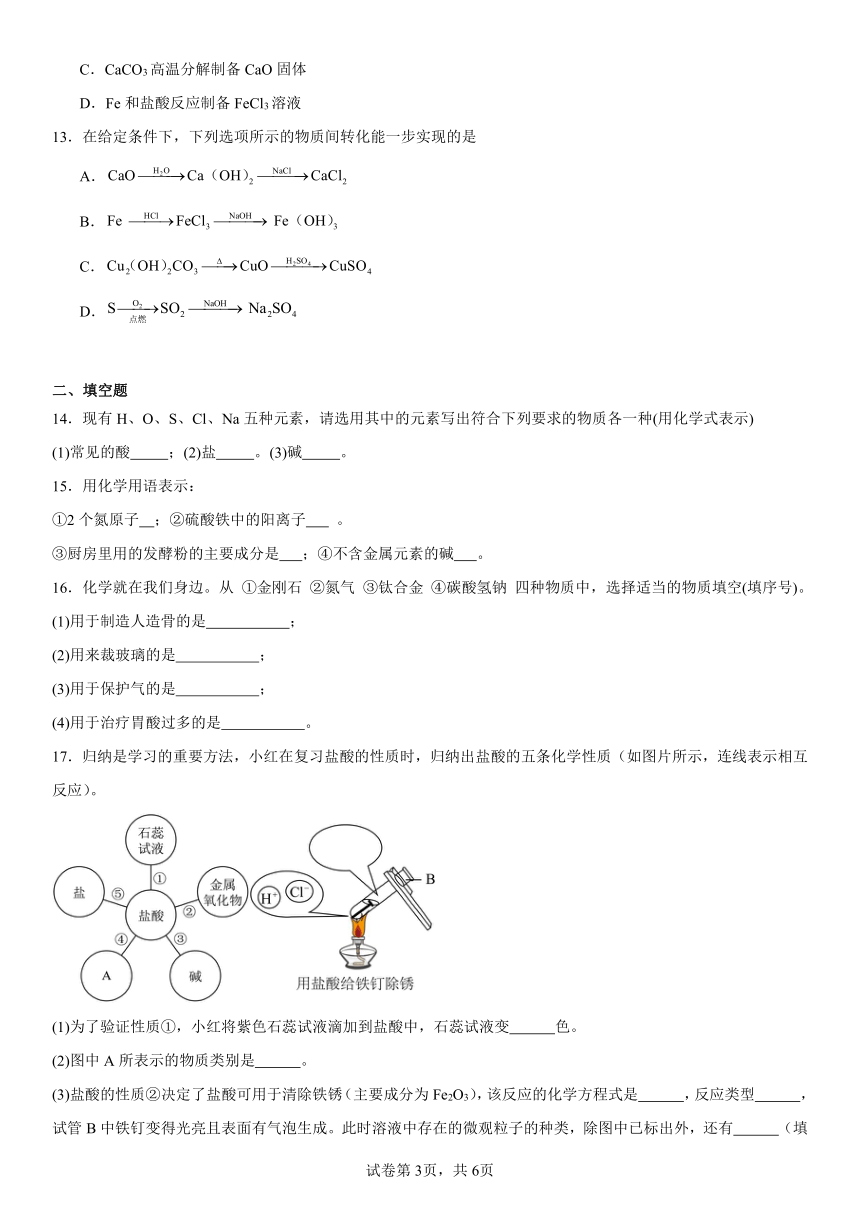
17.归纳是学习的重要方法,小红在复习盐酸的性质时,归纳出盐酸的五条化学性质(如图片所示,连线表示相互反应)。
(1)为了验证性质①,小红将紫色石蕊试液滴加到盐酸中,石蕊试液变 色。
(2)图中A所表示的物质类别是 。
(3)盐酸的性质②决定了盐酸可用于清除铁锈(主要成分为Fe2O3),该反应的化学方程式是 ,反应类型 ,试管B中铁钉变得光亮且表面有气泡生成。此时溶液中存在的微观粒子的种类,除图中已标出外,还有 (填离子符号)。
(4)为了验证性质⑤,可选用的物质是 。(填一种物质化学式即可)
18.请用线段将物质的化学式与物质类别之间连接起来。
19.小迪的社会实践中喜欢收集各种颜色的矿石,他收集了下列石样品。
A.铝土矿(Al2O3) B.孔雀石Cu2(OH)2CO3
C.菱铁矿(FeCO3) D.石英石(SiO2)
(1)菱铁矿的主要成分FeCO3读作 。
(2)从物质分类角度来看,以上矿石主要成分属于氧化物的为 (填字母选项)。
(3)盐的种类很多;其中孔雀石主要成分Cu2(OH)2CO3, 请写出与盐酸反应的化学方程式 混盐一般是由一种阳离子 与两种酸根离子构成的盐,已知漂白粉中有一种混盐CaOCl2, CaOCl2中的一种酸根离子 是次氯酸根离子(ClO-),则另一种酸根离子为 。(填离子符号)小明同学通过百度搜索:在加热条件下分解硝酸铜固体,可以同时得到氧气和二氧化氮这两种气体,且气体的体积比为1:4 (空气中氧气和氮气的体积比大约1:4, 氧气不与二氧化氮反应)。用集气瓶收集满此混合气体,用带火星的木条检验,发现带火星的木条复燃,由此可得出 。
(4)工业上用电解熔融的Al2O,的方法制取金属Al,同时生成另一种单质。写出该反应的化学方程式 。
三、实验题
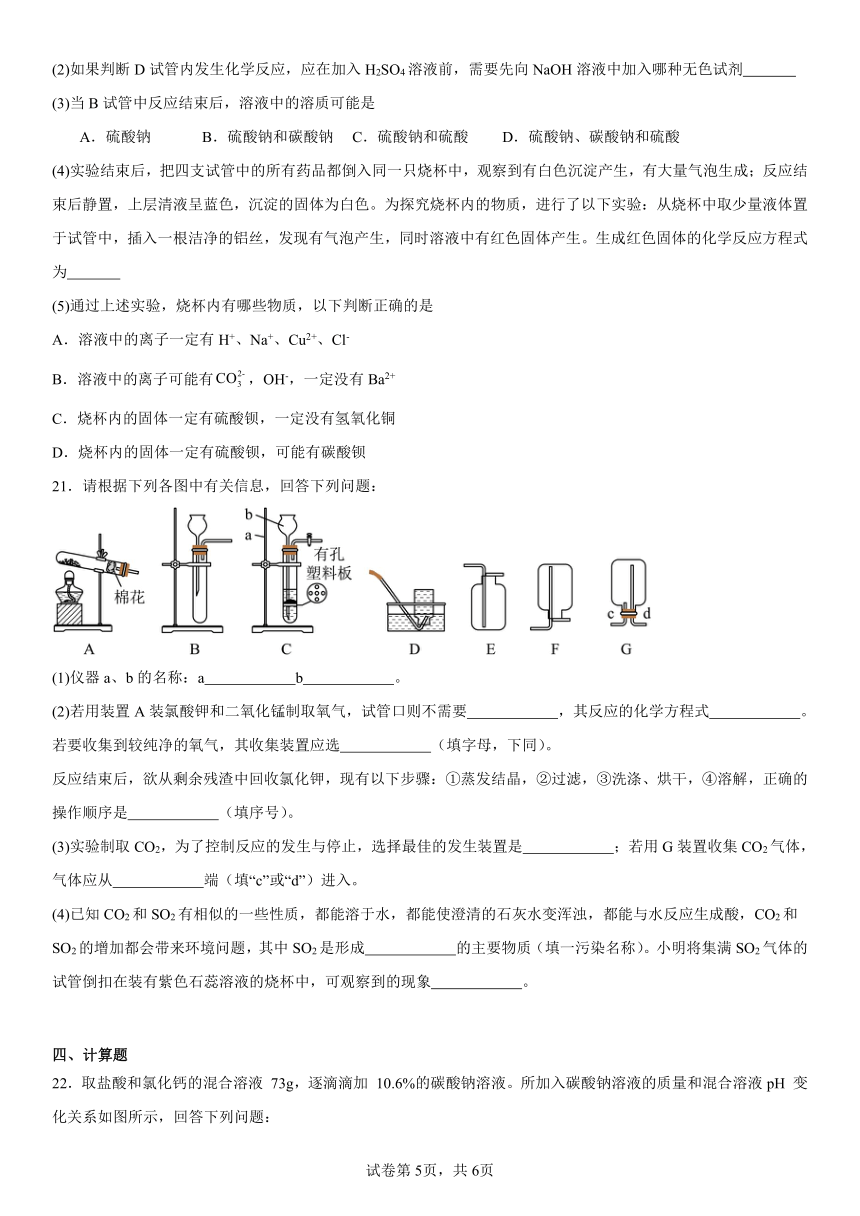
20.如图是某化学小组探究酸、碱、盐之间能否发生反应时进行的四个实验:
(1)试管A中观察到的实验现象为 。
(2)如果判断D试管内发生化学反应,应在加入H2SO4溶液前,需要先向NaOH溶液中加入哪种无色试剂
(3)当B试管中反应结束后,溶液中的溶质可能是
A.硫酸钠 B.硫酸钠和碳酸钠 C.硫酸钠和硫酸 D.硫酸钠、碳酸钠和硫酸
(4)实验结束后,把四支试管中的所有药品都倒入同一只烧杯中,观察到有白色沉淀产生,有大量气泡生成;反应结束后静置,上层清液呈蓝色,沉淀的固体为白色。为探究烧杯内的物质,进行了以下实验:从烧杯中取少量液体置于试管中,插入一根洁净的铝丝,发现有气泡产生,同时溶液中有红色固体产生。生成红色固体的化学反应方程式为
(5)通过上述实验,烧杯内有哪些物质,以下判断正确的是
A.溶液中的离子一定有H+、Na+、Cu2+、Cl-
B.溶液中的离子可能有,OH-,一定没有Ba2+
C.烧杯内的固体一定有硫酸钡,一定没有氢氧化铜
D.烧杯内的固体一定有硫酸钡,可能有碳酸钡
21.请根据下列各图中有关信息,回答下列问题:
(1)仪器a、b的名称:a b 。
(2)若用装置A装氯酸钾和二氧化锰制取氧气,试管口则不需要 ,其反应的化学方程式 。若要收集到较纯净的氧气,其收集装置应选 (填字母,下同)。
反应结束后,欲从剩余残渣中回收氯化钾,现有以下步骤:①蒸发结晶,②过滤,③洗涤、烘干,④溶解,正确的操作顺序是 (填序号)。
(3)实验制取CO2,为了控制反应的发生与停止,选择最佳的发生装置是 ;若用G装置收集CO2气体,气体应从 端(填“c”或“d”)进入。
(4)已知CO2和SO2有相似的一些性质,都能溶于水,都能使澄清的石灰水变浑浊,都能与水反应生成酸,CO2和SO2的增加都会带来环境问题,其中SO2是形成 的主要物质(填一污染名称)。小明将集满SO2气体的试管倒扣在装有紫色石蕊溶液的烧杯中,可观察到的现象 。
四、计算题
22.取盐酸和氯化钙的混合溶液 73g,逐滴滴加 10.6%的碳酸钠溶液。所加入碳酸钠溶液的质量和混合溶液pH 变化关系如图所示,回答下列问题:
(1)BC 段反应的化学方程式为: 。
(2)计算原混合溶液中盐酸的质量分数(写出计算过程)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A、铜离子在强碱性溶液中会生成氢氧化铜沉淀,故不能在碱性溶液中存在,不符合题意;
B、镁离子在强碱性溶液中会生成氢氧化镁沉淀,故不能在碱性溶液中存在,不符合题意;
C、碳酸根离子在强酸性溶液中会生成二氧化碳和水,故不能在酸性溶液中存在,不符合题意;
D、该选项中的四个离子在酸性和碱性溶液中都不会生成气体、沉淀和水,故可以大量共存,符合题意。
故选D。
2.D
【详解】A、红磷在氧气中燃烧,产生大量白烟,不是白雾,不符合题意;
B、细铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体,生成四氧化三铁是实验结论,不是实验现象,不符合题意;
C、鸡蛋清中加入浓硝酸,蛋白质发生变性,生成黄色沉淀,不符合题意;
D、向氢氧化钠溶液中加入氯化铁溶液,氯化铁与氢氧化钠反应生成氢氧化铁和氯化钠,产生红褐色沉淀,符合题意。
故选D。
3.D
【详解】A、用洗洁精具有乳化作用,可洗去餐具上的油污,故A正确;
B、用汽油能溶解油渍,则洗去沾在衣服上的油渍,故B正确;
C、用白醋洗去水壶中的水垢(水垢的主要成分是碳酸钙和氢氧化镁),白醋可以和碳酸钙和氢氧化镁反应,而除去水垢,故C正确;
D、用纯碱溶液不能洗去铁制品表面的铁锈,铁锈和纯碱不反应,故D不正确。故选D。
4.A
【详解】A、反应物是一种单质和一种化合物,生成物是另一种单质和另一种化合物,属于置换反应,故A符合题意;
B、反应物有四种,生成物只有一种,属于化合反应,故B不符合题意;
C、反应物是两种化合物,相互交换成分生成了另外两种化合物,属于复分解反应,故C不符合题意;
D、反应物有一种,生成物有三种,属于分解反应,故D不符合题意。
故选A。
5.A
【详解】A、工业上制取生石灰,是碳酸钙高温煅烧生成氧化钙和二氧化碳,该反应的化学方程式为:,该反应符合“一变多”的特点,属于分解反应,符合题意;
B、小苏打是碳酸氢钠的俗称,碳酸氢钠和稀盐酸反应生成氯化钠、二氧化碳和水,可用于治疗胃酸过多,该反应的化学方程式为:,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,属于复分解反应,不符合题意;
C、酒精燃烧生成二氧化碳和水,该反应的化学方程式为:,不属于基本反应类型,不符合题意;
D、高炉炼铁是一氧化碳和氧化铁在高温下反应生成铁和二氧化碳,该反应的化学方程式为:,不属于基本反应类型,不符合题意。
故选A。
6.C
【详解】A、氢氧化钠和二氧化硫反应生成亚硫酸钠和水,该反应的化学方程式为:,不符合题意;
B、氧化铁和硫酸反应生成硫酸铁和水,该反应的化学方程式为:,不符合题意;
C、过氧化氢在二氧化锰的催化下分解为水和氧气,该反应的化学方程式为:,符合题意;
D、硝酸钾和氯化钠相互交换成分不能形成沉淀、气体和水,不能反应,不符合题意。
故选C。
7.C
【详解】A、铜和硝酸银反应生成硝酸铜和银,不能达到分离的目的,该选项实验方案不合理;
B、稀盐酸和氧化铁反应生成氯化铁和水,该选项实验方案不正确;
C、取样,分别加入稀盐酸,无明显变化的是木炭粉,产生气泡,溶液由无色变成浅绿色的是铁,固体溶解,溶液由无色变蓝色的是氧化铜,该选项实验方案正确;
D、氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,除去碳酸钠带入过量的氢氧化钙,该选项实验方案不正确。
故选:C。
8.A
【详解】A、加入过量稀盐酸,稀盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,蒸发后氯化氢挥发,最终得到氯化钠,该选项可行;
B、即使气体中不含有一氧化碳,通过澄清石灰水也变浑浊,这是因为气体中含有二氧化碳,该选项不可行;
C、碳酸钠和氢氧化钠都易溶于水,该方法不能分离碳酸钠和氢氧化钠,该选项不可行;
D、将铁丝和铜丝分别浸入硫酸锌溶液中,都无明显现象,说明锌最活泼,不能说明铁和铜的活泼性,该选项不可行。
故选A。
9.C
【详解】A、氢氧化钡能够与硫酸反应生成不溶于酸的硫酸钡沉淀和水,由图可知,刚加入氢氧化钡溶液后并没有生成沉淀,所以该混合液中一定不含有H2SO4,选项正确;
B、由A可知,该混合液中一定不含有H2SO4,由图可知,刚加入氢氧化钡溶液后并没有生成沉淀,即氢氧化钡与稀盐酸反应生成氯化钡和水,所以混合溶液中含有稀盐酸,碳酸钾能够与稀盐酸反应,在同一溶液中不能共存,所以混合溶液中不含碳酸钾,氢氧化钡与氯化铜反应生成氢氧化铜沉淀和氯化钡,所以该混合液中一定有HCl和CuCl2,一定没有K2CO3,选项正确;
C、氢氧化钡与稀盐酸反应生成氯化钡和水,氢氧化钡与氯化铜反应生成氢氧化铜沉淀和氯化钡,混合溶液中可能含有氯化钠,所以F点溶液中的溶质可能有两种,选项错误;
D、设生成9.8g沉淀消耗的氢氧化钡的质量为x
=
x=17.1g
由图可知,恰好完全反应时,消耗氢氧化钡的质量=17.1g×=68.4g,选项正确,故选C。
10.C
【详解】A、盐是由金属离子(或铵根离子)与酸根离子构成的化合物,不单单指食盐,不符合题意;
B、盐不一定有咸味,如碳酸钠不具有咸味,不符合题意;
C、盐是由金属离子(或铵根离子)与酸根离子构成的一类化合物,符合题意;
D、盐中不一定含有金属离子,如氯化铵由铵根离子和氯离子构成,不符合题意。
故选C。
11.A
【详解】A、二氧化锰难溶于水,氯化钠易溶于水,可用溶解过滤的方法分离。正确。
B、碳酸钠与氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,反应后过滤滤渣为碳酸钙。为得到氢氧化钠还要将滤液蒸发结晶。错误。
C、将FeO与足量盐酸充分反应得到的是氯化亚铁,不是氯化铁。错误。
D、加熟石灰研磨,硝酸铵和硫酸铵均产生刺激性气味气体,不能区分。错误。
故选A。
12.C
【详解】A、Cu位于金属活动顺序表氢的后面,铜不能与稀硫酸反应,故A错误;
B、S在O2中点燃可制备SO2气体,故B错误;
C、CaCO3高温分解生成CaO和CO2,故C正确;
D、Fe和盐酸反应生成FeCl2和氢气,故D错误;
故C正确。
13.C
【详解】A、氢氧化钙不能和氯化钠反应生成氯化钙,不能一步实现转化,故A选项不符合题意;
B、铁和稀盐酸只能生成氯化亚铁,不能生成氯化铁,不能一步实现转化,故B选项不符合题意;
C、该选项所示的两个转化均能一步实现,故C选项符合题意;
D、二氧化硫只能和氢氧化钠反应生成亚硫酸钠,不能直接生成硫酸钠,不能一步实现转化,故D选项不符合题意。
故选C。
【点睛】本题主要考查物质的转化,根据物质的性质及题中转化关系进行分析解答。
14. HCl或H2SO4或H2SO3 NaCl或NaSO4 NaOH
【详解】(1)酸由氢离子和酸根离子或氯离子构成,常见的酸HCl或H2SO4或H2SO3;(2)盐由金属离子或铵根离子和酸和离子或氯离子构成,NaCl或NaSO4。(3)碱由金属离子或铵根离子和氢氧根离子构成,NaOH。
故答案:(1) HCl或H2SO4或H2SO3 (2) NaCl或NaSO4 (3) NaOH
15. :2N Fe3+ NaHCO3 NH3 H2O
【详解】①2个氮原子就是在氮元素符号的前面加上数字2,故填:2N;
②硫酸铁中的阳离子是铁离子,故填:Fe3+。
③厨房里用的发酵粉的主要成分是碳酸氢钠,故填:NaHCO3;
④不含金属元素的碱是氨水,故填:NH3 H2O。
16. ③ ① ② ④
【详解】(1)钛合金与人体具有很好的相容性,所以可用于制造人造骨;故填:③;
(2)金刚石是天然存在的硬度最大的物质,可用来裁玻璃;故填:①;
(3)氮气常温下化学性质稳定,氮气可以作焊接金属保护气;故填:②;
(4)小苏打是碳酸氢钠,有弱碱性,胃酸的主要成分是盐酸,二者能反应生成氯化钠、水和二氧化碳气体,所以能治疗胃酸过多;故填:④。
17.(1)红
(2)金属单质
(3) 复分解反应 、
(4)Na2CO3
【详解】(1)石蕊遇酸性溶液会变红色,所以将紫色石蕊试液滴加到盐酸溶液中,溶液变红。
(2)综合分析酸的化学性质可知:除去盐酸能与指示剂、金属氧化物、碱、盐反应外还能与金属单质发生反应,故图中A所表示的物质类别是金属单质。
(3)铁锈的主要成分是氧化铁,与盐酸反应时会生成氯化铁与水,化学方程式为,反应特征:反应前后,化合价不变,化合物交换成分,属于复分解反应,铁钉表面变得光亮说明铁钉表面的氧化铁与盐酸反应,所以溶液中有盐酸、氯化铁,有气泡产生,说明铁与盐酸反应生成氯化亚铁和氢气,因此还有氯化亚铁,因此溶液中还含有的离子为铁离子和亚铁离子,离子符号:、。
(4)验证盐酸与盐反应的性质,可以选用Na2CO3,两者可以发生反应生成氯化钠、水和二氧化碳气体。
18.
【分析】单质是由一种元素组成的纯净物,氧化物是由两种元素组成并且一种元素是氧元素的化合物,电离时生成的阳离子都是氢离子的化合物是酸,电离时生成的阴离子都是氢氧根离子的化合物是碱,由金属离子和酸根离子组成的化合物属于盐,据此分析.
【详解】氧化铝属于氧化物,硝酸属于酸,氢氧化钡属于碱,碳酸钾属于盐,铂属于金属单质.
19.(1)碳酸亚铁
(2)AD
(3) Cl- 二氧化氮具有助燃性
(4)
【分析】(1)
FeCO3中,铁元素的化合价为+2价,所以该物质读作碳酸亚铁。
(2)
Al2O3和SiO2均是由两种元素组成的,且其中一种元素是氧元素的化合物,均属于氧化物;故填:AD。
(3)
Cu2(OH)2CO3与稀盐酸反应生成氯化铜、二氧化碳和水,化学方程式为:;
每个钙离子带两个单位的正电荷,则CaOCl2中的一种酸根离子是次氯酸根离子(ClO-),则另一种酸根离子为氯离子,其符号为Cl-;
在加热条件下分解硝酸铜固体,可以同时得到氧气和二氧化氮这两种气体,且气体的体积比为1:4(空气中氧气和氮气的体积比大约1:4,氧气不与二氧化氮反应)。用集气瓶收集满此混合气体,用带火星的木条检验,发现带火星的木条复燃,由此可得出二氧化氮具有助燃性;
(4)
在通电的条件下,氧化铝分解为铝和氧气,化学方程式为:。
20.(1)产生蓝色沉淀
(2)酚酞/无色酚酞
(3)ABC
(4)2Al+3CuSO4=Al2(SO4)3+ 3Cu(或2Al+3CuCl2=2AlCl3+3Cu)
(5)AC
【解析】(1)
硫酸铜与氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,所以试管A中观察到的实验现象为产生蓝色沉淀,故填:产生蓝色沉淀;
(2)
无色酚酞遇碱性溶液变红,在中性或酸性不变色,向滴加了酚酞的氢氧化钠溶液中滴加稀硫酸,溶液由红色变成无色,说明氢氧化钠与硫酸发生了反应,故填:酚酞或无色酚酞;
(3)
B试管中碳酸钠与硫酸反应生成硫酸钠、水和二氧化碳,若恰好完全反应,则溶液中的溶质为硫酸钠;若碳酸钠过量,则溶液中的溶质为硫酸钠和碳酸钠;若硫酸过量,则溶液中的溶质为硫酸钠和硫酸,故选ABC;
(4)
实验结束后,把四支试管中的所有药品都倒入同一只烧杯中,反应结束后静置,上层清液呈蓝色,沉淀的固体为白色。向溶液中插入一根洁净的铝丝,发现有气泡产生,说明酸过量,同时溶液中有红色固体产生,说明溶液中一定含有铜离子、氢离子、钠离子、氯离子(钠离子、氯离子不会转化气体或沉淀),可能有含有钡离子、硫酸根离子(钡离子与硫酸根离子能生成硫酸钡沉淀),一定没有碳酸根离子、氢氧根离子(碳酸根离子、氢氧根离子与氢离子不能共存),由以上分析可知,铝与硫酸铜或氯化铜反应生成硫酸铝(或氯化铝)和铜,反应的化学方程式为2Al+3CuSO4=Al2(SO4)3+ 3Cu(或2Al+3CuCl2=2AlCl3+3Cu),故填:2Al+3CuSO4=Al2(SO4)3+ 3Cu(或2Al+3CuCl2=2AlCl3+3Cu);
(5)
A、由分析可知,溶液中的离子一定有H+、Na+、Cu2+、Cl-,选项说法正确;
B、由分析可知,溶液中含有氢离子,一定没有碳酸根离子和氢氧根离子,硫酸根离子与钡离子生成硫酸钡沉淀,可能含有钡离子,选项说法不正确;
C、硫酸钡沉淀不溶于酸,所以烧杯内的固体一定有硫酸钡;氢氧化铜能与氢离子不能共存,所以一定没有氢氧化铜,选项说法正确;
D、碳酸钡能溶于酸,所以烧杯内的固体一定没有碳酸钡,选项说法不正确。
故选AC。
21.(1) 铁架台 长颈漏斗
(2) 塞一团棉花 D ④②①
(3) C c
(4) 酸雨 试管内液面上升,溶液变红
【详解】(1)由图可知,仪器a为铁架台;仪器b为长颈漏斗;
(2)若用氯酸钾和二氧化锰制取氧气,A装置试管口不需要塞一团棉花;
氯酸钾在二氧化锰的催化下受热分解生成氯化钾和氧气,该反应的化学方程式为:;
氧气不易溶于水,密度比空气大,可用排水法或向上排空气法收集,排水法收集的氧气比较纯净,故收集装置可选D;
反应结束后,残渣中含氯化钾和二氧化锰,氯化钾溶于水,二氧化锰难溶于水,故欲从剩余残渣中回收氯化钾,可溶解、过滤,蒸发得到氯化钾,故顺序是:④②①;
(3)实验室通常用石灰石(或大理石)与稀盐酸反应制取二氧化碳,属于固液不加热反应,为了控制反应的发生和停止,发生装置应选C,C装置可将固体置于多孔塑料板上,关闭弹簧夹,通过长颈漏斗添加稀盐酸,固液接触,生成气体,装置内压强增大,将稀盐酸压入长颈漏斗中,固液分离,反应停止,打开活塞,气体导出,固液接触,反应开始;
若用G装置收集CO2气体,二氧化碳的密度比空气大,气体应从c端通入;
(4)二氧化硫能与水反应生成亚硫酸,导致酸雨的发生;
将集满SO2气体的试管倒扣在装有紫色石蕊溶液的烧杯中,二氧化硫能与水反应生成亚硫酸,亚硫酸显酸性,能使紫色石蕊试液变红,由于消耗了二氧化硫,装置内气体减少,压强减小,故试管内液面上升,故现象是:试管内液面上升,溶液变红。
22.(1)CaCl2+Na2CO3=CaCO3 ↓+2NaCl
(2)解:设原混合溶液中盐酸的质量为 x,则
解得x=1.46g
则原混合溶液中盐酸的质量分数为
答:原混合溶液中盐酸的质量分数为2%。
【详解】(1)向盐酸和氯化钙的混合溶液中加入碳酸钠,碳酸钠能与盐酸反应生成氯化钠、水和二氧化碳,反应过程中盐酸不断减小,则pH增大,当与盐酸恰好反应时,溶液中的溶质为氯化钙和氯化钠,则溶液显中性,pH=7,然后碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,反应过程中溶液pH不变,完全反应后,由于碳酸钠溶液显碱性,则溶液pH又增加。则BC 段发生的反应为氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,反应的化学方程式为。
(2)见答案。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列离子组在强酸性和强碱性溶液中都能大量共存的是
A.Ca2+,Cu2+,,Cl- B.Na+,Mg2+,,Cl-
C.Na+,K+,, D.K+,Ba2+,Cl-,
2.下列实验现象记录描述正确的是
A.红磷在氧气中燃烧发出耀眼的白光,并产生大量的白雾
B.细铁丝在氧气中燃烧火星四射,生成四氧化三铁黑色固体
C.鸡蛋清中加入浓硝酸,产生白色沉淀
D.向氢氧化钠溶液中滴加氯化铁溶液,产生红褐色沉淀
3.下列与洗涤有关的做法不合理的是
A.用洗洁精洗去餐具上的油污
B.用汽油洗去沾在衣服上的油渍
C.用白醋洗去水壶中的水垢(水垢的主要成分是碳酸钙和氢氧化镁)
D.用纯碱溶液洗去铁制品表面的铁锈
4.下列反应中属于置换反应的是
A. B.
C. D.
5.下列有关叙述、对应的方程式,所属基本反应类型都正确的是
A.工业上制取生石灰 CaCO3CO2↑+CaO 分解反应
B.小苏打治疗胃酸过多 NaHCO3+HCl=NaCl+H2O+CO2↑ 中和反应
C.点燃酒精灯:C2H5OH+O22CO2+3H2O 氧化反应
D.高炉炼铁:3CO+Fe2O34Fe+3CO2 置换反应
6.化学方程式书写正确的是
A.SO2+2NaOH=Na2SO4+H2O B.Fe2O3+H2SO4=FeSO4+H2O
C.2H2O22H2O+O2↑ D.KNO3+NaCl=KCl+NaNO3
7.下列实验方案合理的是( )
A.分离Cu和Ag固体混合物:加入适量的AgNO3溶液,过滤
B.制取少量FeCl2溶液:将适量的稀盐酸和Fe2O3混合,充分反应
C.鉴别木炭粉、Fe粉、CuO粉末:取样,分别加入稀盐酸,观察现象
D.除去NaOH溶液中的Na2CO3:加入过量的Ca(OH)2溶液,过滤
8.下列实验方案设计中,可行的是( )
A.除去氯化钠固体中的少量碳酸钠--加入过量稀盐酸,充分反应后,蒸发
B.检验二氧化碳气体中含有少量的一氧化碳--将混合气体依次通过灼热的氧化铁和澄清石灰水,观察澄清石灰水的变化
C.分离碳酸钠和氢氧化钠的混合物--加水溶解、过滤
D.验证锌、铁、铜的金属活动性顺序--将铁丝和铜丝分别浸入硫酸锌溶液中
9.已知某溶液中的溶质可能是HCl、K2CO3、H2SO4、CuCl2、NaCl溶液中的一种或几种,向该混合液中逐滴加入Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液的体积关系如图所示。下列说法中不正确的是
A.该混合液中一定不含有H2SO4
B.该混合液中一定有HCl和CuCl2,一定没有K2CO3
C.F点溶液中的溶质一定有两种
D.恰好完全反应时,消耗Ba(OH)2的质量为68.4g
10.从化学学科角度判断,下列关于盐的说法正确的是
A.就是食盐 B.一定有咸味 C.是一类化合物 D.一定含有金属离子
11.下列实验中能达到目的的是
A.分离二氧化锰和氯化钠固体:将混合物加入足量水中充分溶解后过滤
B.除去氢氧化钠中的少量碳酸钠:加入适量的氢氧化钙溶液后过滤
C.制备 FeCl3 溶液:将 FeO 与足量盐酸充分反应后过滤
D.鉴别硝酸铵和硫酸铵:取样加熟石灰研磨,观察是否产生刺激性气味
12.在给定条件下,下列物质能够直接转化成功的是
A.Cu片和稀H2SO4作用制备CuSO4溶液
B.S在O2中点燃制备SO3气体
C.CaCO3高温分解制备CaO固体
D.Fe和盐酸反应制备FeCl3溶液
13.在给定条件下,下列选项所示的物质间转化能一步实现的是
A.
B.
C.
D.
二、填空题
14.现有H、O、S、Cl、Na五种元素,请选用其中的元素写出符合下列要求的物质各一种(用化学式表示)
(1)常见的酸 ;(2)盐 。(3)碱 。
15.用化学用语表示:
①2个氮原子 ;②硫酸铁中的阳离子 。
③厨房里用的发酵粉的主要成分是 ;④不含金属元素的碱 。
16.化学就在我们身边。从 ①金刚石 ②氮气 ③钛合金 ④碳酸氢钠 四种物质中,选择适当的物质填空(填序号)。
(1)用于制造人造骨的是 ;
(2)用来裁玻璃的是 ;
(3)用于保护气的是 ;
(4)用于治疗胃酸过多的是 。
17.归纳是学习的重要方法,小红在复习盐酸的性质时,归纳出盐酸的五条化学性质(如图片所示,连线表示相互反应)。
(1)为了验证性质①,小红将紫色石蕊试液滴加到盐酸中,石蕊试液变 色。
(2)图中A所表示的物质类别是 。
(3)盐酸的性质②决定了盐酸可用于清除铁锈(主要成分为Fe2O3),该反应的化学方程式是 ,反应类型 ,试管B中铁钉变得光亮且表面有气泡生成。此时溶液中存在的微观粒子的种类,除图中已标出外,还有 (填离子符号)。
(4)为了验证性质⑤,可选用的物质是 。(填一种物质化学式即可)
18.请用线段将物质的化学式与物质类别之间连接起来。
19.小迪的社会实践中喜欢收集各种颜色的矿石,他收集了下列石样品。
A.铝土矿(Al2O3) B.孔雀石Cu2(OH)2CO3
C.菱铁矿(FeCO3) D.石英石(SiO2)
(1)菱铁矿的主要成分FeCO3读作 。
(2)从物质分类角度来看,以上矿石主要成分属于氧化物的为 (填字母选项)。
(3)盐的种类很多;其中孔雀石主要成分Cu2(OH)2CO3, 请写出与盐酸反应的化学方程式 混盐一般是由一种阳离子 与两种酸根离子构成的盐,已知漂白粉中有一种混盐CaOCl2, CaOCl2中的一种酸根离子 是次氯酸根离子(ClO-),则另一种酸根离子为 。(填离子符号)小明同学通过百度搜索:在加热条件下分解硝酸铜固体,可以同时得到氧气和二氧化氮这两种气体,且气体的体积比为1:4 (空气中氧气和氮气的体积比大约1:4, 氧气不与二氧化氮反应)。用集气瓶收集满此混合气体,用带火星的木条检验,发现带火星的木条复燃,由此可得出 。
(4)工业上用电解熔融的Al2O,的方法制取金属Al,同时生成另一种单质。写出该反应的化学方程式 。
三、实验题
20.如图是某化学小组探究酸、碱、盐之间能否发生反应时进行的四个实验:
(1)试管A中观察到的实验现象为 。
(2)如果判断D试管内发生化学反应,应在加入H2SO4溶液前,需要先向NaOH溶液中加入哪种无色试剂
(3)当B试管中反应结束后,溶液中的溶质可能是
A.硫酸钠 B.硫酸钠和碳酸钠 C.硫酸钠和硫酸 D.硫酸钠、碳酸钠和硫酸
(4)实验结束后,把四支试管中的所有药品都倒入同一只烧杯中,观察到有白色沉淀产生,有大量气泡生成;反应结束后静置,上层清液呈蓝色,沉淀的固体为白色。为探究烧杯内的物质,进行了以下实验:从烧杯中取少量液体置于试管中,插入一根洁净的铝丝,发现有气泡产生,同时溶液中有红色固体产生。生成红色固体的化学反应方程式为
(5)通过上述实验,烧杯内有哪些物质,以下判断正确的是
A.溶液中的离子一定有H+、Na+、Cu2+、Cl-
B.溶液中的离子可能有,OH-,一定没有Ba2+
C.烧杯内的固体一定有硫酸钡,一定没有氢氧化铜
D.烧杯内的固体一定有硫酸钡,可能有碳酸钡
21.请根据下列各图中有关信息,回答下列问题:
(1)仪器a、b的名称:a b 。
(2)若用装置A装氯酸钾和二氧化锰制取氧气,试管口则不需要 ,其反应的化学方程式 。若要收集到较纯净的氧气,其收集装置应选 (填字母,下同)。
反应结束后,欲从剩余残渣中回收氯化钾,现有以下步骤:①蒸发结晶,②过滤,③洗涤、烘干,④溶解,正确的操作顺序是 (填序号)。
(3)实验制取CO2,为了控制反应的发生与停止,选择最佳的发生装置是 ;若用G装置收集CO2气体,气体应从 端(填“c”或“d”)进入。
(4)已知CO2和SO2有相似的一些性质,都能溶于水,都能使澄清的石灰水变浑浊,都能与水反应生成酸,CO2和SO2的增加都会带来环境问题,其中SO2是形成 的主要物质(填一污染名称)。小明将集满SO2气体的试管倒扣在装有紫色石蕊溶液的烧杯中,可观察到的现象 。
四、计算题
22.取盐酸和氯化钙的混合溶液 73g,逐滴滴加 10.6%的碳酸钠溶液。所加入碳酸钠溶液的质量和混合溶液pH 变化关系如图所示,回答下列问题:
(1)BC 段反应的化学方程式为: 。
(2)计算原混合溶液中盐酸的质量分数(写出计算过程)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A、铜离子在强碱性溶液中会生成氢氧化铜沉淀,故不能在碱性溶液中存在,不符合题意;
B、镁离子在强碱性溶液中会生成氢氧化镁沉淀,故不能在碱性溶液中存在,不符合题意;
C、碳酸根离子在强酸性溶液中会生成二氧化碳和水,故不能在酸性溶液中存在,不符合题意;
D、该选项中的四个离子在酸性和碱性溶液中都不会生成气体、沉淀和水,故可以大量共存,符合题意。
故选D。
2.D
【详解】A、红磷在氧气中燃烧,产生大量白烟,不是白雾,不符合题意;
B、细铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体,生成四氧化三铁是实验结论,不是实验现象,不符合题意;
C、鸡蛋清中加入浓硝酸,蛋白质发生变性,生成黄色沉淀,不符合题意;
D、向氢氧化钠溶液中加入氯化铁溶液,氯化铁与氢氧化钠反应生成氢氧化铁和氯化钠,产生红褐色沉淀,符合题意。
故选D。
3.D
【详解】A、用洗洁精具有乳化作用,可洗去餐具上的油污,故A正确;
B、用汽油能溶解油渍,则洗去沾在衣服上的油渍,故B正确;
C、用白醋洗去水壶中的水垢(水垢的主要成分是碳酸钙和氢氧化镁),白醋可以和碳酸钙和氢氧化镁反应,而除去水垢,故C正确;
D、用纯碱溶液不能洗去铁制品表面的铁锈,铁锈和纯碱不反应,故D不正确。故选D。
4.A
【详解】A、反应物是一种单质和一种化合物,生成物是另一种单质和另一种化合物,属于置换反应,故A符合题意;
B、反应物有四种,生成物只有一种,属于化合反应,故B不符合题意;
C、反应物是两种化合物,相互交换成分生成了另外两种化合物,属于复分解反应,故C不符合题意;
D、反应物有一种,生成物有三种,属于分解反应,故D不符合题意。
故选A。
5.A
【详解】A、工业上制取生石灰,是碳酸钙高温煅烧生成氧化钙和二氧化碳,该反应的化学方程式为:,该反应符合“一变多”的特点,属于分解反应,符合题意;
B、小苏打是碳酸氢钠的俗称,碳酸氢钠和稀盐酸反应生成氯化钠、二氧化碳和水,可用于治疗胃酸过多,该反应的化学方程式为:,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,属于复分解反应,不符合题意;
C、酒精燃烧生成二氧化碳和水,该反应的化学方程式为:,不属于基本反应类型,不符合题意;
D、高炉炼铁是一氧化碳和氧化铁在高温下反应生成铁和二氧化碳,该反应的化学方程式为:,不属于基本反应类型,不符合题意。
故选A。
6.C
【详解】A、氢氧化钠和二氧化硫反应生成亚硫酸钠和水,该反应的化学方程式为:,不符合题意;
B、氧化铁和硫酸反应生成硫酸铁和水,该反应的化学方程式为:,不符合题意;
C、过氧化氢在二氧化锰的催化下分解为水和氧气,该反应的化学方程式为:,符合题意;
D、硝酸钾和氯化钠相互交换成分不能形成沉淀、气体和水,不能反应,不符合题意。
故选C。
7.C
【详解】A、铜和硝酸银反应生成硝酸铜和银,不能达到分离的目的,该选项实验方案不合理;
B、稀盐酸和氧化铁反应生成氯化铁和水,该选项实验方案不正确;
C、取样,分别加入稀盐酸,无明显变化的是木炭粉,产生气泡,溶液由无色变成浅绿色的是铁,固体溶解,溶液由无色变蓝色的是氧化铜,该选项实验方案正确;
D、氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,除去碳酸钠带入过量的氢氧化钙,该选项实验方案不正确。
故选:C。
8.A
【详解】A、加入过量稀盐酸,稀盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,蒸发后氯化氢挥发,最终得到氯化钠,该选项可行;
B、即使气体中不含有一氧化碳,通过澄清石灰水也变浑浊,这是因为气体中含有二氧化碳,该选项不可行;
C、碳酸钠和氢氧化钠都易溶于水,该方法不能分离碳酸钠和氢氧化钠,该选项不可行;
D、将铁丝和铜丝分别浸入硫酸锌溶液中,都无明显现象,说明锌最活泼,不能说明铁和铜的活泼性,该选项不可行。
故选A。
9.C
【详解】A、氢氧化钡能够与硫酸反应生成不溶于酸的硫酸钡沉淀和水,由图可知,刚加入氢氧化钡溶液后并没有生成沉淀,所以该混合液中一定不含有H2SO4,选项正确;
B、由A可知,该混合液中一定不含有H2SO4,由图可知,刚加入氢氧化钡溶液后并没有生成沉淀,即氢氧化钡与稀盐酸反应生成氯化钡和水,所以混合溶液中含有稀盐酸,碳酸钾能够与稀盐酸反应,在同一溶液中不能共存,所以混合溶液中不含碳酸钾,氢氧化钡与氯化铜反应生成氢氧化铜沉淀和氯化钡,所以该混合液中一定有HCl和CuCl2,一定没有K2CO3,选项正确;
C、氢氧化钡与稀盐酸反应生成氯化钡和水,氢氧化钡与氯化铜反应生成氢氧化铜沉淀和氯化钡,混合溶液中可能含有氯化钠,所以F点溶液中的溶质可能有两种,选项错误;
D、设生成9.8g沉淀消耗的氢氧化钡的质量为x
=
x=17.1g
由图可知,恰好完全反应时,消耗氢氧化钡的质量=17.1g×=68.4g,选项正确,故选C。
10.C
【详解】A、盐是由金属离子(或铵根离子)与酸根离子构成的化合物,不单单指食盐,不符合题意;
B、盐不一定有咸味,如碳酸钠不具有咸味,不符合题意;
C、盐是由金属离子(或铵根离子)与酸根离子构成的一类化合物,符合题意;
D、盐中不一定含有金属离子,如氯化铵由铵根离子和氯离子构成,不符合题意。
故选C。
11.A
【详解】A、二氧化锰难溶于水,氯化钠易溶于水,可用溶解过滤的方法分离。正确。
B、碳酸钠与氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,反应后过滤滤渣为碳酸钙。为得到氢氧化钠还要将滤液蒸发结晶。错误。
C、将FeO与足量盐酸充分反应得到的是氯化亚铁,不是氯化铁。错误。
D、加熟石灰研磨,硝酸铵和硫酸铵均产生刺激性气味气体,不能区分。错误。
故选A。
12.C
【详解】A、Cu位于金属活动顺序表氢的后面,铜不能与稀硫酸反应,故A错误;
B、S在O2中点燃可制备SO2气体,故B错误;
C、CaCO3高温分解生成CaO和CO2,故C正确;
D、Fe和盐酸反应生成FeCl2和氢气,故D错误;
故C正确。
13.C
【详解】A、氢氧化钙不能和氯化钠反应生成氯化钙,不能一步实现转化,故A选项不符合题意;
B、铁和稀盐酸只能生成氯化亚铁,不能生成氯化铁,不能一步实现转化,故B选项不符合题意;
C、该选项所示的两个转化均能一步实现,故C选项符合题意;
D、二氧化硫只能和氢氧化钠反应生成亚硫酸钠,不能直接生成硫酸钠,不能一步实现转化,故D选项不符合题意。
故选C。
【点睛】本题主要考查物质的转化,根据物质的性质及题中转化关系进行分析解答。
14. HCl或H2SO4或H2SO3 NaCl或NaSO4 NaOH
【详解】(1)酸由氢离子和酸根离子或氯离子构成,常见的酸HCl或H2SO4或H2SO3;(2)盐由金属离子或铵根离子和酸和离子或氯离子构成,NaCl或NaSO4。(3)碱由金属离子或铵根离子和氢氧根离子构成,NaOH。
故答案:(1) HCl或H2SO4或H2SO3 (2) NaCl或NaSO4 (3) NaOH
15. :2N Fe3+ NaHCO3 NH3 H2O
【详解】①2个氮原子就是在氮元素符号的前面加上数字2,故填:2N;
②硫酸铁中的阳离子是铁离子,故填:Fe3+。
③厨房里用的发酵粉的主要成分是碳酸氢钠,故填:NaHCO3;
④不含金属元素的碱是氨水,故填:NH3 H2O。
16. ③ ① ② ④
【详解】(1)钛合金与人体具有很好的相容性,所以可用于制造人造骨;故填:③;
(2)金刚石是天然存在的硬度最大的物质,可用来裁玻璃;故填:①;
(3)氮气常温下化学性质稳定,氮气可以作焊接金属保护气;故填:②;
(4)小苏打是碳酸氢钠,有弱碱性,胃酸的主要成分是盐酸,二者能反应生成氯化钠、水和二氧化碳气体,所以能治疗胃酸过多;故填:④。
17.(1)红
(2)金属单质
(3) 复分解反应 、
(4)Na2CO3
【详解】(1)石蕊遇酸性溶液会变红色,所以将紫色石蕊试液滴加到盐酸溶液中,溶液变红。
(2)综合分析酸的化学性质可知:除去盐酸能与指示剂、金属氧化物、碱、盐反应外还能与金属单质发生反应,故图中A所表示的物质类别是金属单质。
(3)铁锈的主要成分是氧化铁,与盐酸反应时会生成氯化铁与水,化学方程式为,反应特征:反应前后,化合价不变,化合物交换成分,属于复分解反应,铁钉表面变得光亮说明铁钉表面的氧化铁与盐酸反应,所以溶液中有盐酸、氯化铁,有气泡产生,说明铁与盐酸反应生成氯化亚铁和氢气,因此还有氯化亚铁,因此溶液中还含有的离子为铁离子和亚铁离子,离子符号:、。
(4)验证盐酸与盐反应的性质,可以选用Na2CO3,两者可以发生反应生成氯化钠、水和二氧化碳气体。
18.
【分析】单质是由一种元素组成的纯净物,氧化物是由两种元素组成并且一种元素是氧元素的化合物,电离时生成的阳离子都是氢离子的化合物是酸,电离时生成的阴离子都是氢氧根离子的化合物是碱,由金属离子和酸根离子组成的化合物属于盐,据此分析.
【详解】氧化铝属于氧化物,硝酸属于酸,氢氧化钡属于碱,碳酸钾属于盐,铂属于金属单质.
19.(1)碳酸亚铁
(2)AD
(3) Cl- 二氧化氮具有助燃性
(4)
【分析】(1)
FeCO3中,铁元素的化合价为+2价,所以该物质读作碳酸亚铁。
(2)
Al2O3和SiO2均是由两种元素组成的,且其中一种元素是氧元素的化合物,均属于氧化物;故填:AD。
(3)
Cu2(OH)2CO3与稀盐酸反应生成氯化铜、二氧化碳和水,化学方程式为:;
每个钙离子带两个单位的正电荷,则CaOCl2中的一种酸根离子是次氯酸根离子(ClO-),则另一种酸根离子为氯离子,其符号为Cl-;
在加热条件下分解硝酸铜固体,可以同时得到氧气和二氧化氮这两种气体,且气体的体积比为1:4(空气中氧气和氮气的体积比大约1:4,氧气不与二氧化氮反应)。用集气瓶收集满此混合气体,用带火星的木条检验,发现带火星的木条复燃,由此可得出二氧化氮具有助燃性;
(4)
在通电的条件下,氧化铝分解为铝和氧气,化学方程式为:。
20.(1)产生蓝色沉淀
(2)酚酞/无色酚酞
(3)ABC
(4)2Al+3CuSO4=Al2(SO4)3+ 3Cu(或2Al+3CuCl2=2AlCl3+3Cu)
(5)AC
【解析】(1)
硫酸铜与氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,所以试管A中观察到的实验现象为产生蓝色沉淀,故填:产生蓝色沉淀;
(2)
无色酚酞遇碱性溶液变红,在中性或酸性不变色,向滴加了酚酞的氢氧化钠溶液中滴加稀硫酸,溶液由红色变成无色,说明氢氧化钠与硫酸发生了反应,故填:酚酞或无色酚酞;
(3)
B试管中碳酸钠与硫酸反应生成硫酸钠、水和二氧化碳,若恰好完全反应,则溶液中的溶质为硫酸钠;若碳酸钠过量,则溶液中的溶质为硫酸钠和碳酸钠;若硫酸过量,则溶液中的溶质为硫酸钠和硫酸,故选ABC;
(4)
实验结束后,把四支试管中的所有药品都倒入同一只烧杯中,反应结束后静置,上层清液呈蓝色,沉淀的固体为白色。向溶液中插入一根洁净的铝丝,发现有气泡产生,说明酸过量,同时溶液中有红色固体产生,说明溶液中一定含有铜离子、氢离子、钠离子、氯离子(钠离子、氯离子不会转化气体或沉淀),可能有含有钡离子、硫酸根离子(钡离子与硫酸根离子能生成硫酸钡沉淀),一定没有碳酸根离子、氢氧根离子(碳酸根离子、氢氧根离子与氢离子不能共存),由以上分析可知,铝与硫酸铜或氯化铜反应生成硫酸铝(或氯化铝)和铜,反应的化学方程式为2Al+3CuSO4=Al2(SO4)3+ 3Cu(或2Al+3CuCl2=2AlCl3+3Cu),故填:2Al+3CuSO4=Al2(SO4)3+ 3Cu(或2Al+3CuCl2=2AlCl3+3Cu);
(5)
A、由分析可知,溶液中的离子一定有H+、Na+、Cu2+、Cl-,选项说法正确;
B、由分析可知,溶液中含有氢离子,一定没有碳酸根离子和氢氧根离子,硫酸根离子与钡离子生成硫酸钡沉淀,可能含有钡离子,选项说法不正确;
C、硫酸钡沉淀不溶于酸,所以烧杯内的固体一定有硫酸钡;氢氧化铜能与氢离子不能共存,所以一定没有氢氧化铜,选项说法正确;
D、碳酸钡能溶于酸,所以烧杯内的固体一定没有碳酸钡,选项说法不正确。
故选AC。
21.(1) 铁架台 长颈漏斗
(2) 塞一团棉花 D ④②①
(3) C c
(4) 酸雨 试管内液面上升,溶液变红
【详解】(1)由图可知,仪器a为铁架台;仪器b为长颈漏斗;
(2)若用氯酸钾和二氧化锰制取氧气,A装置试管口不需要塞一团棉花;
氯酸钾在二氧化锰的催化下受热分解生成氯化钾和氧气,该反应的化学方程式为:;
氧气不易溶于水,密度比空气大,可用排水法或向上排空气法收集,排水法收集的氧气比较纯净,故收集装置可选D;
反应结束后,残渣中含氯化钾和二氧化锰,氯化钾溶于水,二氧化锰难溶于水,故欲从剩余残渣中回收氯化钾,可溶解、过滤,蒸发得到氯化钾,故顺序是:④②①;
(3)实验室通常用石灰石(或大理石)与稀盐酸反应制取二氧化碳,属于固液不加热反应,为了控制反应的发生和停止,发生装置应选C,C装置可将固体置于多孔塑料板上,关闭弹簧夹,通过长颈漏斗添加稀盐酸,固液接触,生成气体,装置内压强增大,将稀盐酸压入长颈漏斗中,固液分离,反应停止,打开活塞,气体导出,固液接触,反应开始;
若用G装置收集CO2气体,二氧化碳的密度比空气大,气体应从c端通入;
(4)二氧化硫能与水反应生成亚硫酸,导致酸雨的发生;
将集满SO2气体的试管倒扣在装有紫色石蕊溶液的烧杯中,二氧化硫能与水反应生成亚硫酸,亚硫酸显酸性,能使紫色石蕊试液变红,由于消耗了二氧化硫,装置内气体减少,压强减小,故试管内液面上升,故现象是:试管内液面上升,溶液变红。
22.(1)CaCl2+Na2CO3=CaCO3 ↓+2NaCl
(2)解:设原混合溶液中盐酸的质量为 x,则
解得x=1.46g
则原混合溶液中盐酸的质量分数为
答:原混合溶液中盐酸的质量分数为2%。
【详解】(1)向盐酸和氯化钙的混合溶液中加入碳酸钠,碳酸钠能与盐酸反应生成氯化钠、水和二氧化碳,反应过程中盐酸不断减小,则pH增大,当与盐酸恰好反应时,溶液中的溶质为氯化钙和氯化钠,则溶液显中性,pH=7,然后碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,反应过程中溶液pH不变,完全反应后,由于碳酸钠溶液显碱性,则溶液pH又增加。则BC 段发生的反应为氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,反应的化学方程式为。
(2)见答案。
答案第1页,共2页
答案第1页,共2页
