第八章常见的酸、碱、盐练习题(含解析) 2023-2024学年科粤版(2012)九年级化学下册
文档属性
| 名称 | 第八章常见的酸、碱、盐练习题(含解析) 2023-2024学年科粤版(2012)九年级化学下册 |  | |
| 格式 | docx | ||
| 文件大小 | 220.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 20:52:04 | ||
图片预览




文档简介
第八章 常见的酸、碱、盐 练习题
一、单选题
1.部分变质的生石灰样品(杂质不含与变质后的物质组成相同的元素,不溶于水且不参加反应)20g,与200g7.3%的稀盐酸恰好完全反应得到213g溶液,此样品中氢元素的质量分数为
A.0.1% B.0.5% C.1% D.2%
2.下列物质的用途主要是由其化学性质决定的是( )
A.用干冰作制冷剂 B.用金刚石切割大理石
C.生石灰用作干燥剂 D.钢丝用作导线
3.下列物质溶于水会导致溶液温度降低的是
A.NaOH B.浓硫酸 C.NaCl D.NH4NO3
4.棉花地里的棉花因为缺乏某种化学肥料叶片发黄,我们应该施用的化学肥料是
A.KCl B.NH4NO3 C.Ca3(PO4)2 D.K2CO3
5.下列实验现象描述正确的是
A.打开盛有浓盐酸的试剂瓶盖,瓶口出现白雾
B.硫在氧气中燃烧,发出明亮的蓝紫色火焰,生成有刺激性气味的二氧化硫气体
C.红磷在空气中燃烧,产生大量白雾
D.铁在空气中剧烈燃烧,火星四射,生成红色固体
6.依题意书写化学方程式,对应的化学方程式书写正确的是( )
A.电解水发生的化学反应: 2H2O2H2↑ + O2 ↑
B.生石灰和稀盐酸反应 Ca(OH)2+2HCl=CaCl2+2H2O
C.验证铜的活动性比银强: Cu+2AgCl=CuCl2+2Ag
D.用活性炭代替木炭在氧气中燃烧: C+O2CO2
7.下列有关水的说法正确的是
A.冰水共存物属于混合物
B.水是由氢元素和氧元素组成的氧化物
C.水与乙醇可以配制成饱和溶液
D.有水生成的反应一定是中和反应
8.现有和组成的混合物,在该混合物中加入一定溶质质量分数的稀盐酸,恰好完全反应,得到二氧化碳的质量为。下列说法正确的是
A.混合物中和的质量比一定是
B.所加稀盐酸的溶质质量分数可能是
C.充分反应后,所得溶液的质量
D.和以任何比例混合,生成二氧化碳的总质量均为
9.“结构决定性质,性质决定用途”,是学习化学的重要思想方法。下列说法正确的是( )
①CO和CO2分子构成不同,所以化学性质不同。
②金刚石和石墨的碳原子的排列方式不同,所以性质差异很大。
③纯碱和烧碱都能使酚酞溶液变红,所以他们都属于碱。
④氮气常温下化学性质稳定,所以可以用来制氮肥。
⑤熟石灰能与酸发生中和反应,所以可用于改良酸性土壤。
A.①②④ B.①②⑤ C.①②③ D.①⑤
10.下列说法正确的是
A.含有氢元素的化合物一定是酸
B.有盐和水生成的反应一定是中和反应
C.能使酚酞溶液变红的溶液一定显碱性
D.两种化合物反应生成另外两种化合物的反应一定是复分解反应
11.下列各组离子在水中能大量共存的是
A.K+、、OH- B.H+、Na+、
C.H+、、OH- D.、、OH-
12.在无色溶液中,下列各组物质能大量共存的是
A.氯化钠、氢氧化钙、稀盐酸
B.硝酸钾、氯化亚铁、氢氧化钠
C.硝酸钠、氢氧化钾、氯化钡
D.碳酸氢钠、氢氧化钾、稀硫酸
二、填空题
13.化学兴趣小组的同学用下图装置进行以下实验。
若广口瓶中收集满 CO2 气体后,关闭 K1、K2,分液漏斗中加入 NaOH 溶液,右侧导气管伸入盛有澄清石灰水的烧杯中。打开分液漏斗的活塞,注入足量 NaOH 溶液,关闭分液漏斗的活塞,一段时间后,打开 K2,观察到的实验现象是 。写出该实验过程中,发生反应的化学方程式 。
14.“生活无大事,处处有化学”,日常生活中的下列做法:
①夏季蚊虫叮咬后,涂抹肥皂液可缓解痛苦
②人的体液为弱碱性,多吃碱性食物有益健康
③胃酸过多的人,可饮用苏打水保健
④家庭煤气泄漏,立即开油烟机排气
以上做法中,正确的是 (填序号),列举一错误做法并说明理由 。
15.请从氧气、水、尿素、磷酸二氢铵中选择适当的物质,用化学式填空:人体含量最多的物质是 ;属于复合肥的是 。
16.小红家是农场种粮大户,小红经常利用所学知识帮父母解决实际问题。
(1)今春山西地区普遍低温,小红建议适当增加下列化肥中 (填字母序号)的施用量,以增强作物的抗寒能力。
A NH4Cl B K2SO4 C Ca(H2PO4)2
(2)她用pH试纸测得自家土壤浸出液的pH为5,土壤呈 (填“酸性”或“碱性”)。
(3)白菜适合在pH为6.5~7.0的环境中生长,故应在 土壤中种植。
17.用化学用语填空:
(1)2个氢分子 。
(2)硝酸根离子 。
(3)保持二氧化碳化学性质的最小粒子是 。
(4)表示氯化锌中锌元素的化合价 。
(5)可用来改良酸性土壤的碱 。
18.2022 年“世界水日”的主题为“珍惜地下水,珍视隐藏的资源”。
(1)自来水厂的净化过程中加入 吸附色素和异味。
(2)下列做法能实现爱护水资源的是___________(填序号)。
A.淘米水浇花 B.禁止使用化肥和农药
C.农业上滴灌改为漫灌 D.工业废水达标后排放
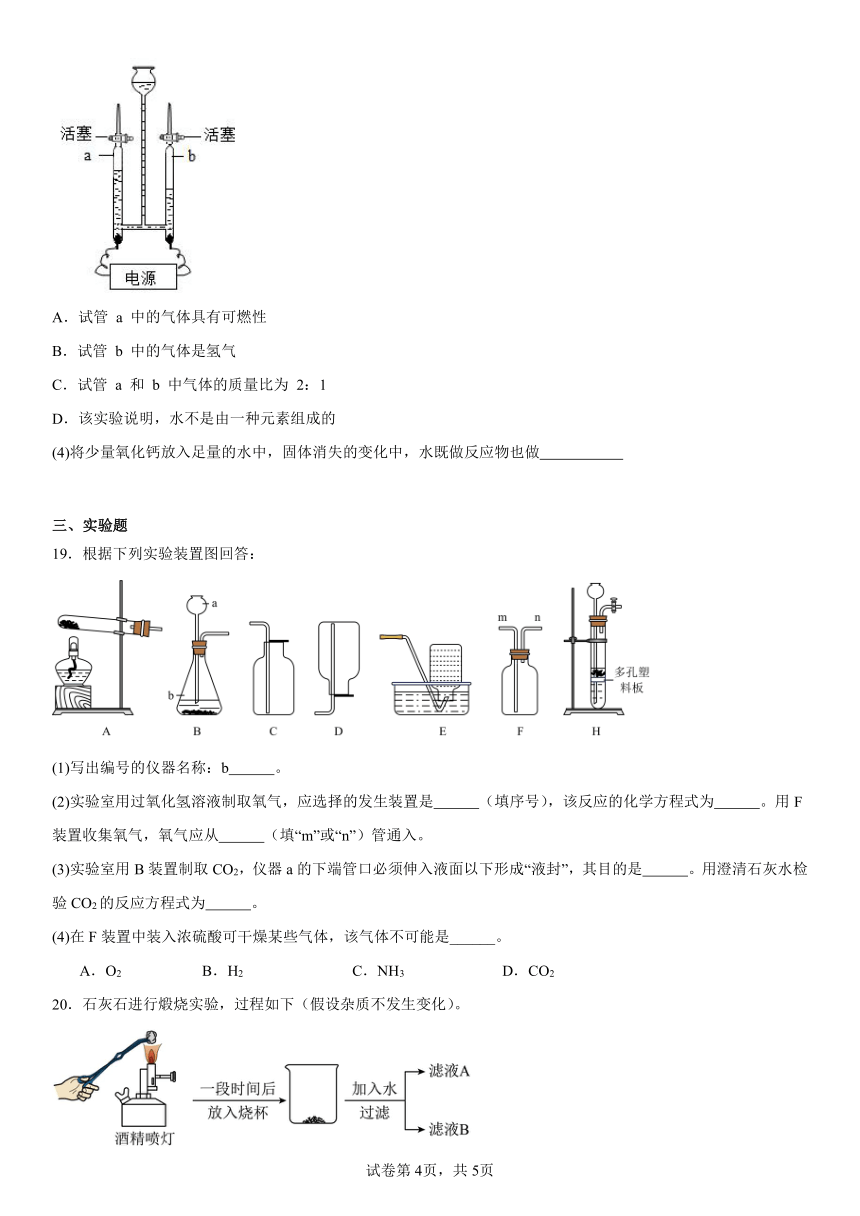
(3)用如图所示的装置进行电解水实验,下列说法正确的是___________(填序号)。
A.试管 a 中的气体具有可燃性
B.试管 b 中的气体是氢气
C.试管 a 和 b 中气体的质量比为 2:1
D.该实验说明,水不是由一种元素组成的
(4)将少量氧化钙放入足量的水中,固体消失的变化中,水既做反应物也做
三、实验题
19.根据下列实验装置图回答:
(1)写出编号的仪器名称:b 。
(2)实验室用过氧化氢溶液制取氧气,应选择的发生装置是 (填序号),该反应的化学方程式为 。用F装置收集氧气,氧气应从 (填“m”或“n”)管通入。
(3)实验室用B装置制取CO2,仪器a的下端管口必须伸入液面以下形成“液封”,其目的是 。用澄清石灰水检验CO2的反应方程式为 。
(4)在F装置中装入浓硫酸可干燥某些气体,该气体不可能是______。
A.O2 B.H2 C.NH3 D.CO2
20.石灰石进行煅烧实验,过程如下(假设杂质不发生变化)。
① 煅烧石灰石的化学方程式为 ;
② 利用滤液A或滤渣B设计方案证明石灰石分解情况。
实验操作 判断依据 结论
石灰石已分解
石灰石完全分解
四、计算题
21.为测定氯化钠和氯化镁固体混合物中氯化镁的质量分数。某同学取固体混合物38.0g,向其中加入105.6g水,使其完全溶解配制成混合溶液。将100g一定溶质质量分数的氢氧化钠溶液滴入到上述混合溶液中,生成沉淀的质量与滴入氢氧化钠溶液的质量关系如图所示。
请计算:
(1)图中a的值为 。
(2)恰好完全反应时,所得不饱和溶液中溶质的质量分数(写出计算过程,结果精确到0.1%)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】生石灰变质是与空气中的水、二氧化碳反应生成氢氧化钙、碳酸钙,部分仍为氧化钙,生石灰样品质量为20g,与200g7.3%的稀盐酸恰好完全反应得到213g溶液,则杂质和二氧化碳的质量和为20g+200g-213g=7g,氢氧化钙可以看成CaO·H2O,碳酸钙可以看成CaO·CO2,那么整个反应可看成CaO+2HCl=CaCl2+ H2O,设参与反应氧化钙的质量为x,则有
则样品中相当于水的质量为20g-11.2g-7g=1.8g,则氢元素的质量为1.8g××100%=0.2g,则样品中氢元素的质量分数为×100%=1%;
故选C。
2.C
【分析】物质在化学变化中表现出来的性质叫化学性质,如可燃性、助燃性、氧化性、还原性、酸碱性、稳定性等;物质不需要发生化学变化就表现出来的性质,叫物理性质;物理性质经常表现为:颜色、状态、气味、密度、硬度、熔点、沸点、导电性、导热性、溶解性、挥发性、吸附性等。
【详解】A、用干冰作制冷剂是利用干冰吸热升华,不需要通过化学变化表现出来,属于物理性质;故选项错误,不符合题意。
B、用金刚石切割大理石是利用金刚石的硬度大,不需要通过化学变化表现出来,属于物理性质,故选项错误,不符合题意。
C、生石灰用作干燥剂,是因为氧化钙能和水反应生成氢氧化钙,需要通过化学变化表现出来,属于物质的化学性质,故选项正确,符合题意。
D、铜用作导线,是因为铜具有导电性,不需要通过化学变化表现出来,属于物质的物理性质,故选项错误,不符合题意。
故选:C。
3.D
【详解】A、氢氧化钠溶于水放出热量,溶液温度升高。
B、浓硫酸溶于水放出热量,溶液温度升高。
C、氯化钠溶于水几乎不吸热放热,溶液温度几乎不变。
D、硝酸铵溶于水吸收热量,溶液温度降低。
故选D。
4.B
【分析】植物缺氮元素会叶片发黄。
【详解】A、KCl中含有钾元素,属于钾肥,该选项不符合题意;
B、NH4NO3中含有氮元素,属于氮肥,该选项符合题意;
C、Ca3(PO4)2中含有磷元素,属于磷肥,该选项不符合题意;
D、K2CO3中含有钾元素,属于钾肥,该选项不符合题意。
故选B。
5.A
【详解】A、浓盐酸具有挥发性,打开盛有浓盐酸的试剂瓶盖,瓶口出现白雾,故选项说法正确;
B、硫在氧气中燃烧,发出明亮的蓝紫色火焰,生成有刺激性气味的二氧化硫气体属于结论,故选项说法错误;
C、磷在氧气中烧,产生大量的白烟,而不是白雾,故选项说法错误;
D、铁在空气中不能燃烧,故选项说法错误。
故选:A。
6.D
【详解】A、电解是一个过程,水分解的条件是通电。电解水时生成了氢气和氧气,化学方程式为2H2O2H2↑ + O2 ↑,故A错误;
B、生石灰是氧化钙的俗称,生石灰和稀盐酸反应的化学方程式为:,故B错误;
C、由于AgCl不溶于水,铜与AgCl不能发生化学反应,不可用于验证铜的活动性比银强,故C错误;
D、木炭和活性炭的主要成分都是碳,用活性炭代替在氧气中燃烧生成二氧化碳,反应的化学方程式为: C+O2CO2,故D正确。故选D。
7.B
【详解】A、冰是固态的水,冰水共存物只有一种物质水,属于纯净物,错误;
B、氧化物是由氧元素和另一种元素组成的化合物。水是由氢元素和氧元素组成的氧化物,正确;
C、水与乙醇可以以任意比互溶,无法配置成饱和溶液,错误;
D、中和反应是酸和碱反应生成盐和水的反应,但有水生成的反应不一定是中和反应,如氢氧化钠和二氧化碳反应生成盐碳酸钠和水,不是中和反应,错误;
故选B。
8.D
【详解】A、由MgCO3、NaHCO3和稀盐酸反应的化学方程式、,可知,每84份质量的碳酸镁和稀盐酸完全反应生成44份质量的二氧化碳,每84份质量的碳酸氢钠和稀盐酸完全反应生成44份质量的二氧化碳,则混合物中MgCO3和NaHCO3的质量比不一定是1: 1,故选项说法错误;
B、假设8.4g固体全部是碳酸镁,设所加稀盐酸的溶质质量分数为x。
x= 7.3%
假设8.4g固体全部是碳酸氢钠,设所加稀盐酸的溶质质量分数为y。
y= 3.65%
则所加稀盐酸的溶质质量分数在3.65%到7.3%之间,不可能是7.3%,故选项说法错误;
C、由题中数据可知,充分反应后,所得溶液的质量=8.4g+ 100g -4.4g=104.0g,故选项说法错误;
D、由MgCO3、NaHCO3和稀盐酸反应的化学方程式、,可知,每84份质量的碳酸镁和稀盐酸完全反应生成44份质量的二氧化碳,每84份质量的碳酸氢钠和稀盐酸完全反应生成44份质量的二氧化碳,则混合物中MgCO3和NaHCO3以任何比例混合,生成二氧化碳的总质量均为4.4g,故选项说法正确。
故选D。
9.B
【详解】①组成CO和CO2的元素相同,但它们的分子构成不同,不同种的分子性质不同,则它们的化学性质不同,故①正确;
②金刚石和石墨中碳原子排列方式不同,所以它们的物理性质差异很大,故②正确;
③纯碱是碳酸钠的俗称,是由钠离子与碳酸根离子构成的化合物,属于盐,故③错误;
④氮气含有氮元素,所以可用来制氮肥;氮气的化学性质稳定,所以可用来做保护气,故④错误;
⑤熟石灰能与酸发生中和反应,所以可用于改良酸性土壤,故⑤正确。说法正确的是①②⑤。故选B。
10.C
【详解】A、酸是指在电离时产生的阳离子全部是氢离子的化合物,含有氢元素的化合物不一定是酸,如H2O、NaHCO3等,故选项错误;
B、中和反应生成盐和水,生成盐和水的反应不一定是中和反应,如CO2+2NaOH═Na2CO3+H2O,故选项错误;
C、酚酞溶液遇酸性溶液不变色,遇碱性溶液变红,能使酚酞溶液变红的溶液一定显碱性,故选项正确;
D、两种化合物反应生成另外两种化合物的反应不一定是复分解反应,如CO2+2NaOH═Na2CO3+H2O,故选项错误。故选C。
【点睛】酚酞溶液遇酸性溶液不变色,遇碱性溶液变红,能使酚酞溶液变红的溶液一定显碱性。
11.A
【详解】A、三种离子在水中不能形成沉淀、气体和水,该组离子在水中能大量共存,故A正确;
B、氢离子和碳酸氢根离子反应生成二氧化碳和水,不能大量共存,故B错误;
C、氢离子和氢氧根离子反应生成水,不能大量共存,故C错误;
D、铵根离子和氢氧根离子反应生成氨气,不能大量共存,故D错误;
故选A。
12.C
【详解】A、氢氧化钙、稀盐酸在溶液中能相互交换成分生成氯化钙和水,不能大量共存,不符合题意;
B、氯化亚铁、氢氧化钠在溶液中能相互交换成分生成氢氧化亚铁沉淀和氯化钠,不能大量共存,不符合题意;
C、三种物质在溶液中相互交换成分不能生成沉淀、气体、水,能在无色溶液中大量共存,符合题意;
D、碳酸氢钠、稀硫酸在溶液中相互交换成分生成硫酸钠、水和二氧化碳,氢氧化钾和硫酸反应生成硫酸钾和水,不能大量共存,不符合题意。故选C。
【点睛】判断物质在溶液中能否共存,主要看溶液中的各物质之间能否发生反应生成沉淀、气体、水。
13. 烧杯中的澄清石灰水倒吸入广口瓶中,且广口瓶中溶液变浑浊 2NaOH + CO2 = Na2CO3 + H2O,Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
【详解】广口瓶中收集满 CO2 气体后,关闭 K1、K2,分液漏斗中加入 NaOH 溶液,右侧导气管伸入盛有澄清石灰水的烧杯中。打开分液漏斗的活塞,注入足量 NaOH 溶液,关闭分液漏斗的活塞,氢氧化钠溶液和二氧化碳反应生成碳酸钠和水,使瓶内气体减少,压强变小;一段时间后,打开 K2,烧杯内的澄清石灰水到流入广口瓶内;碳酸钠和氢氧化钙反应生成碳酸钙沉淀和和氢氧化钠,观察到的实验现象是澄清石灰水变浑浊。该实验过程中,发生反应的化学方程式2NaOH + CO2 = Na2CO3 + H2O,Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。
14. ①②③ ④,这样做可能会引起爆炸
【详解】①夏季蚊虫叮咬后,涂抹肥皂液可缓解痛苦,因为肥皂液能和蚊虫叮咬皮肤时释放的蚁酸反应降低酸性,方法正确;②人的体液为弱碱性,多吃碱性食物有益健康,方法正确;③胃酸过多的人,可饮用苏打水保健,因为苏打水呈碱性,可和胃液中的酸反应,方法正确;④家庭煤气泄漏,立即开油烟机排气,产生的火花可能会引起爆炸,方法错误。
15. H2O NH4H2PO4
【详解】人体中含量最多的物质是水,其化学式为:H2O;氮、磷、钾三种元素中至少含有两种的化肥是复合肥,磷酸二氢铵含N、P两种营养元素,属于复合肥,其化学式为:NH4H2PO4。
16. C 酸性 酸性
【详解】(1)磷肥具有抗寒抗旱能力,氮、磷、钾这三种元素中只含有氮元素的是氮肥;只含有钾元素的是钾肥,只含有磷元素的是磷肥;含有两种或两种以上元素的化肥是复合肥,C属于磷肥。故选C;
(2)用pH试纸测得自家土壤浸出液的pH为5,说明显酸性;
(3)pH小于7呈酸性,pH范围为6.5-7.0,则白菜适合在酸性环境中种植。
17. 2H2 NO CO2 Ca(OH)2
【分析】离子的表示要在对应微粒的右上方标出离子所带的电荷,元素化合价要标在对应元素的正上方,由分子构成的物质物质符号用分子符号(化学式)表示,表示微粒的个数在微粒前面加对应数字;
【详解】(1)1个氢分子中含有2个氢原子,2个氢分子2H2。
(2)1个硝酸根离子带一个单位负电荷,NO。
(3)保持二氧化碳化学性质的最小粒子是二氧化碳分子CO2。
(4)氯化锌中锌元素的化合价为+2价,。
(5)可用来改良酸性土壤的碱为氢氧化钙Ca(OH)2。
18.(1)活性炭
(2)AD
(3)BD
(4)溶剂
【详解】(1)自来水厂的净化过程中加入活性炭吸附色素和异味;
(2)A、淘米水浇花可以节约水资源,能实现爱护水资源,符合题意;
B、禁止使用化肥和农药,目前农业生产会受影响,要合理使用,不符合题意;
C、农业上滴灌改为漫灌,会消耗大量水资源,不能实现爱护水资源,不符合题意;
D、工业废水达标后排放,不会造成水体污染,有利于保护水资源,符合题意。
故选AD;
(3)A、电解水正极生成氧气,负极生成氢气,氢气和氧气的体积比为2:1,试管a中的气体体积较小是氧气,具有助燃性,没有可燃性,错误;
B、试管b中的气体比试管a中的气体多,试管b中的气体是氢气,正确;
C、根据化学方程式可知,反应生成的氧气和氢气质量为8:1,试管a和b中气体的质量比为8:1,错误;
D、电解水时,负极产生氢气,正极产生氧气,氢气是由氢元素组成,氧气是由氧元素组成,化学变化中元素的种类不变,该实验说明水是由氢元素和氧元素组成的,水不是由一种元素组成的,正确。
故选BD;
(4)将少量氧化钙放入足量的水中,固体消失的变化中,水与氧化钙反应生成氢氧化钙,最后形成氢氧化钙溶液,水既做反应物也做溶剂。
19.(1)锥形瓶
(2) B m
(3) 防止气体从长颈漏斗逸出
(4)C
【详解】(1)根据图示可知b是锥形瓶;
(2)实验室用过氧化氢溶液制取氧气,反应物是固液,条件是常温,故应选固液常温型发生装置即装置B,过氧化氢溶液在二氧化锰作催化剂的条件下生成水和氧气,化学方程式为 ;用F装置收集氧气,氧气密度比空气略大,处于空气底层,故氧气应从长导管通入,即m管口通入;
(3)仪器a的下端管口如果不伸入液面以下形成“液封”,产生的气体会从仪器a中逸出;用澄清石灰水检验CO2的原理是氢氧化钙与二氧化碳反应生成碳酸钙沉淀和水,反应方程式为: CO2+Ca(OH)2=CaCO3↓+H2O ;
(4)浓硫酸显酸性,可以干燥中性或酸性气体,不能干燥碱性气体如:氨气( NH3 ),故选:C。
20. CaCO3 CaO+CO2↑ 取滤液A少量于试管中,滴加酚酞(或通入二氧化碳) 变红(变浑浊) 取滤渣B少量于试管中,滴加足量盐酸 无气泡
【详解】根据所学知识和题中信息知, ① 煅烧石灰石的化学方程式为CaCO3 CaO+CO2↑。
② 利用滤液A或滤渣B设计方案证明石灰石分解情况。
实验操作 判断依据 结论
取滤液A少量于试管中,滴加酚酞(或通入二氧化碳) 变红(变浑浊),氧化钙与水反应生成氢氧化钙,具有碱性,可使酚酞变红 ﹙氢氧化钙与二氧化碳反应生成碳酸钙沉淀,可使石灰水变浑浊﹚ 石灰石已分解
取滤渣B少量于试管中,滴加足量盐酸 无气泡 石灰石完全分解
点睛∶氧化钙与水反应生成氢氧化钙,具有碱性,可使酚酞变红。
21.(1)8.7
(2)解:设氯化镁的质量为x,生成的氯化钠的质量为y,则有
溶液中氯化钠质量为38.0g-19.0g+23.4g=42.4g,溶液质量为38.0g+105.6g+80.0g-11.6g=212g,
恰好完全反应时,所得不饱和溶液中溶质的质量分数为×100%=20.0%;
答:恰好完全反应时,所得不饱和溶液中溶质的质量分数为20.0%。
【详解】(1)由图中信息可知,20g氢氧化钠溶液完全反应生成2.9g沉淀,加入氢氧化钠溶液60g以后仍然产生沉淀,说明加入60g氢氧化钠溶液时,氢氧化钠完全反应,生成氢氧化镁质量是2.9g ×=8.7g,故填:8.7;
(2)见答案。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.部分变质的生石灰样品(杂质不含与变质后的物质组成相同的元素,不溶于水且不参加反应)20g,与200g7.3%的稀盐酸恰好完全反应得到213g溶液,此样品中氢元素的质量分数为
A.0.1% B.0.5% C.1% D.2%
2.下列物质的用途主要是由其化学性质决定的是( )
A.用干冰作制冷剂 B.用金刚石切割大理石
C.生石灰用作干燥剂 D.钢丝用作导线
3.下列物质溶于水会导致溶液温度降低的是
A.NaOH B.浓硫酸 C.NaCl D.NH4NO3
4.棉花地里的棉花因为缺乏某种化学肥料叶片发黄,我们应该施用的化学肥料是
A.KCl B.NH4NO3 C.Ca3(PO4)2 D.K2CO3
5.下列实验现象描述正确的是
A.打开盛有浓盐酸的试剂瓶盖,瓶口出现白雾
B.硫在氧气中燃烧,发出明亮的蓝紫色火焰,生成有刺激性气味的二氧化硫气体
C.红磷在空气中燃烧,产生大量白雾
D.铁在空气中剧烈燃烧,火星四射,生成红色固体
6.依题意书写化学方程式,对应的化学方程式书写正确的是( )
A.电解水发生的化学反应: 2H2O2H2↑ + O2 ↑
B.生石灰和稀盐酸反应 Ca(OH)2+2HCl=CaCl2+2H2O
C.验证铜的活动性比银强: Cu+2AgCl=CuCl2+2Ag
D.用活性炭代替木炭在氧气中燃烧: C+O2CO2
7.下列有关水的说法正确的是
A.冰水共存物属于混合物
B.水是由氢元素和氧元素组成的氧化物
C.水与乙醇可以配制成饱和溶液
D.有水生成的反应一定是中和反应
8.现有和组成的混合物,在该混合物中加入一定溶质质量分数的稀盐酸,恰好完全反应,得到二氧化碳的质量为。下列说法正确的是
A.混合物中和的质量比一定是
B.所加稀盐酸的溶质质量分数可能是
C.充分反应后,所得溶液的质量
D.和以任何比例混合,生成二氧化碳的总质量均为
9.“结构决定性质,性质决定用途”,是学习化学的重要思想方法。下列说法正确的是( )
①CO和CO2分子构成不同,所以化学性质不同。
②金刚石和石墨的碳原子的排列方式不同,所以性质差异很大。
③纯碱和烧碱都能使酚酞溶液变红,所以他们都属于碱。
④氮气常温下化学性质稳定,所以可以用来制氮肥。
⑤熟石灰能与酸发生中和反应,所以可用于改良酸性土壤。
A.①②④ B.①②⑤ C.①②③ D.①⑤
10.下列说法正确的是
A.含有氢元素的化合物一定是酸
B.有盐和水生成的反应一定是中和反应
C.能使酚酞溶液变红的溶液一定显碱性
D.两种化合物反应生成另外两种化合物的反应一定是复分解反应
11.下列各组离子在水中能大量共存的是
A.K+、、OH- B.H+、Na+、
C.H+、、OH- D.、、OH-
12.在无色溶液中,下列各组物质能大量共存的是
A.氯化钠、氢氧化钙、稀盐酸
B.硝酸钾、氯化亚铁、氢氧化钠
C.硝酸钠、氢氧化钾、氯化钡
D.碳酸氢钠、氢氧化钾、稀硫酸
二、填空题
13.化学兴趣小组的同学用下图装置进行以下实验。
若广口瓶中收集满 CO2 气体后,关闭 K1、K2,分液漏斗中加入 NaOH 溶液,右侧导气管伸入盛有澄清石灰水的烧杯中。打开分液漏斗的活塞,注入足量 NaOH 溶液,关闭分液漏斗的活塞,一段时间后,打开 K2,观察到的实验现象是 。写出该实验过程中,发生反应的化学方程式 。
14.“生活无大事,处处有化学”,日常生活中的下列做法:
①夏季蚊虫叮咬后,涂抹肥皂液可缓解痛苦
②人的体液为弱碱性,多吃碱性食物有益健康
③胃酸过多的人,可饮用苏打水保健
④家庭煤气泄漏,立即开油烟机排气
以上做法中,正确的是 (填序号),列举一错误做法并说明理由 。
15.请从氧气、水、尿素、磷酸二氢铵中选择适当的物质,用化学式填空:人体含量最多的物质是 ;属于复合肥的是 。
16.小红家是农场种粮大户,小红经常利用所学知识帮父母解决实际问题。
(1)今春山西地区普遍低温,小红建议适当增加下列化肥中 (填字母序号)的施用量,以增强作物的抗寒能力。
A NH4Cl B K2SO4 C Ca(H2PO4)2
(2)她用pH试纸测得自家土壤浸出液的pH为5,土壤呈 (填“酸性”或“碱性”)。
(3)白菜适合在pH为6.5~7.0的环境中生长,故应在 土壤中种植。
17.用化学用语填空:
(1)2个氢分子 。
(2)硝酸根离子 。
(3)保持二氧化碳化学性质的最小粒子是 。
(4)表示氯化锌中锌元素的化合价 。
(5)可用来改良酸性土壤的碱 。
18.2022 年“世界水日”的主题为“珍惜地下水,珍视隐藏的资源”。
(1)自来水厂的净化过程中加入 吸附色素和异味。
(2)下列做法能实现爱护水资源的是___________(填序号)。
A.淘米水浇花 B.禁止使用化肥和农药
C.农业上滴灌改为漫灌 D.工业废水达标后排放
(3)用如图所示的装置进行电解水实验,下列说法正确的是___________(填序号)。
A.试管 a 中的气体具有可燃性
B.试管 b 中的气体是氢气
C.试管 a 和 b 中气体的质量比为 2:1
D.该实验说明,水不是由一种元素组成的
(4)将少量氧化钙放入足量的水中,固体消失的变化中,水既做反应物也做
三、实验题
19.根据下列实验装置图回答:
(1)写出编号的仪器名称:b 。
(2)实验室用过氧化氢溶液制取氧气,应选择的发生装置是 (填序号),该反应的化学方程式为 。用F装置收集氧气,氧气应从 (填“m”或“n”)管通入。
(3)实验室用B装置制取CO2,仪器a的下端管口必须伸入液面以下形成“液封”,其目的是 。用澄清石灰水检验CO2的反应方程式为 。
(4)在F装置中装入浓硫酸可干燥某些气体,该气体不可能是______。
A.O2 B.H2 C.NH3 D.CO2
20.石灰石进行煅烧实验,过程如下(假设杂质不发生变化)。
① 煅烧石灰石的化学方程式为 ;
② 利用滤液A或滤渣B设计方案证明石灰石分解情况。
实验操作 判断依据 结论
石灰石已分解
石灰石完全分解
四、计算题
21.为测定氯化钠和氯化镁固体混合物中氯化镁的质量分数。某同学取固体混合物38.0g,向其中加入105.6g水,使其完全溶解配制成混合溶液。将100g一定溶质质量分数的氢氧化钠溶液滴入到上述混合溶液中,生成沉淀的质量与滴入氢氧化钠溶液的质量关系如图所示。
请计算:
(1)图中a的值为 。
(2)恰好完全反应时,所得不饱和溶液中溶质的质量分数(写出计算过程,结果精确到0.1%)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】生石灰变质是与空气中的水、二氧化碳反应生成氢氧化钙、碳酸钙,部分仍为氧化钙,生石灰样品质量为20g,与200g7.3%的稀盐酸恰好完全反应得到213g溶液,则杂质和二氧化碳的质量和为20g+200g-213g=7g,氢氧化钙可以看成CaO·H2O,碳酸钙可以看成CaO·CO2,那么整个反应可看成CaO+2HCl=CaCl2+ H2O,设参与反应氧化钙的质量为x,则有
则样品中相当于水的质量为20g-11.2g-7g=1.8g,则氢元素的质量为1.8g××100%=0.2g,则样品中氢元素的质量分数为×100%=1%;
故选C。
2.C
【分析】物质在化学变化中表现出来的性质叫化学性质,如可燃性、助燃性、氧化性、还原性、酸碱性、稳定性等;物质不需要发生化学变化就表现出来的性质,叫物理性质;物理性质经常表现为:颜色、状态、气味、密度、硬度、熔点、沸点、导电性、导热性、溶解性、挥发性、吸附性等。
【详解】A、用干冰作制冷剂是利用干冰吸热升华,不需要通过化学变化表现出来,属于物理性质;故选项错误,不符合题意。
B、用金刚石切割大理石是利用金刚石的硬度大,不需要通过化学变化表现出来,属于物理性质,故选项错误,不符合题意。
C、生石灰用作干燥剂,是因为氧化钙能和水反应生成氢氧化钙,需要通过化学变化表现出来,属于物质的化学性质,故选项正确,符合题意。
D、铜用作导线,是因为铜具有导电性,不需要通过化学变化表现出来,属于物质的物理性质,故选项错误,不符合题意。
故选:C。
3.D
【详解】A、氢氧化钠溶于水放出热量,溶液温度升高。
B、浓硫酸溶于水放出热量,溶液温度升高。
C、氯化钠溶于水几乎不吸热放热,溶液温度几乎不变。
D、硝酸铵溶于水吸收热量,溶液温度降低。
故选D。
4.B
【分析】植物缺氮元素会叶片发黄。
【详解】A、KCl中含有钾元素,属于钾肥,该选项不符合题意;
B、NH4NO3中含有氮元素,属于氮肥,该选项符合题意;
C、Ca3(PO4)2中含有磷元素,属于磷肥,该选项不符合题意;
D、K2CO3中含有钾元素,属于钾肥,该选项不符合题意。
故选B。
5.A
【详解】A、浓盐酸具有挥发性,打开盛有浓盐酸的试剂瓶盖,瓶口出现白雾,故选项说法正确;
B、硫在氧气中燃烧,发出明亮的蓝紫色火焰,生成有刺激性气味的二氧化硫气体属于结论,故选项说法错误;
C、磷在氧气中烧,产生大量的白烟,而不是白雾,故选项说法错误;
D、铁在空气中不能燃烧,故选项说法错误。
故选:A。
6.D
【详解】A、电解是一个过程,水分解的条件是通电。电解水时生成了氢气和氧气,化学方程式为2H2O2H2↑ + O2 ↑,故A错误;
B、生石灰是氧化钙的俗称,生石灰和稀盐酸反应的化学方程式为:,故B错误;
C、由于AgCl不溶于水,铜与AgCl不能发生化学反应,不可用于验证铜的活动性比银强,故C错误;
D、木炭和活性炭的主要成分都是碳,用活性炭代替在氧气中燃烧生成二氧化碳,反应的化学方程式为: C+O2CO2,故D正确。故选D。
7.B
【详解】A、冰是固态的水,冰水共存物只有一种物质水,属于纯净物,错误;
B、氧化物是由氧元素和另一种元素组成的化合物。水是由氢元素和氧元素组成的氧化物,正确;
C、水与乙醇可以以任意比互溶,无法配置成饱和溶液,错误;
D、中和反应是酸和碱反应生成盐和水的反应,但有水生成的反应不一定是中和反应,如氢氧化钠和二氧化碳反应生成盐碳酸钠和水,不是中和反应,错误;
故选B。
8.D
【详解】A、由MgCO3、NaHCO3和稀盐酸反应的化学方程式、,可知,每84份质量的碳酸镁和稀盐酸完全反应生成44份质量的二氧化碳,每84份质量的碳酸氢钠和稀盐酸完全反应生成44份质量的二氧化碳,则混合物中MgCO3和NaHCO3的质量比不一定是1: 1,故选项说法错误;
B、假设8.4g固体全部是碳酸镁,设所加稀盐酸的溶质质量分数为x。
x= 7.3%
假设8.4g固体全部是碳酸氢钠,设所加稀盐酸的溶质质量分数为y。
y= 3.65%
则所加稀盐酸的溶质质量分数在3.65%到7.3%之间,不可能是7.3%,故选项说法错误;
C、由题中数据可知,充分反应后,所得溶液的质量=8.4g+ 100g -4.4g=104.0g,故选项说法错误;
D、由MgCO3、NaHCO3和稀盐酸反应的化学方程式、,可知,每84份质量的碳酸镁和稀盐酸完全反应生成44份质量的二氧化碳,每84份质量的碳酸氢钠和稀盐酸完全反应生成44份质量的二氧化碳,则混合物中MgCO3和NaHCO3以任何比例混合,生成二氧化碳的总质量均为4.4g,故选项说法正确。
故选D。
9.B
【详解】①组成CO和CO2的元素相同,但它们的分子构成不同,不同种的分子性质不同,则它们的化学性质不同,故①正确;
②金刚石和石墨中碳原子排列方式不同,所以它们的物理性质差异很大,故②正确;
③纯碱是碳酸钠的俗称,是由钠离子与碳酸根离子构成的化合物,属于盐,故③错误;
④氮气含有氮元素,所以可用来制氮肥;氮气的化学性质稳定,所以可用来做保护气,故④错误;
⑤熟石灰能与酸发生中和反应,所以可用于改良酸性土壤,故⑤正确。说法正确的是①②⑤。故选B。
10.C
【详解】A、酸是指在电离时产生的阳离子全部是氢离子的化合物,含有氢元素的化合物不一定是酸,如H2O、NaHCO3等,故选项错误;
B、中和反应生成盐和水,生成盐和水的反应不一定是中和反应,如CO2+2NaOH═Na2CO3+H2O,故选项错误;
C、酚酞溶液遇酸性溶液不变色,遇碱性溶液变红,能使酚酞溶液变红的溶液一定显碱性,故选项正确;
D、两种化合物反应生成另外两种化合物的反应不一定是复分解反应,如CO2+2NaOH═Na2CO3+H2O,故选项错误。故选C。
【点睛】酚酞溶液遇酸性溶液不变色,遇碱性溶液变红,能使酚酞溶液变红的溶液一定显碱性。
11.A
【详解】A、三种离子在水中不能形成沉淀、气体和水,该组离子在水中能大量共存,故A正确;
B、氢离子和碳酸氢根离子反应生成二氧化碳和水,不能大量共存,故B错误;
C、氢离子和氢氧根离子反应生成水,不能大量共存,故C错误;
D、铵根离子和氢氧根离子反应生成氨气,不能大量共存,故D错误;
故选A。
12.C
【详解】A、氢氧化钙、稀盐酸在溶液中能相互交换成分生成氯化钙和水,不能大量共存,不符合题意;
B、氯化亚铁、氢氧化钠在溶液中能相互交换成分生成氢氧化亚铁沉淀和氯化钠,不能大量共存,不符合题意;
C、三种物质在溶液中相互交换成分不能生成沉淀、气体、水,能在无色溶液中大量共存,符合题意;
D、碳酸氢钠、稀硫酸在溶液中相互交换成分生成硫酸钠、水和二氧化碳,氢氧化钾和硫酸反应生成硫酸钾和水,不能大量共存,不符合题意。故选C。
【点睛】判断物质在溶液中能否共存,主要看溶液中的各物质之间能否发生反应生成沉淀、气体、水。
13. 烧杯中的澄清石灰水倒吸入广口瓶中,且广口瓶中溶液变浑浊 2NaOH + CO2 = Na2CO3 + H2O,Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
【详解】广口瓶中收集满 CO2 气体后,关闭 K1、K2,分液漏斗中加入 NaOH 溶液,右侧导气管伸入盛有澄清石灰水的烧杯中。打开分液漏斗的活塞,注入足量 NaOH 溶液,关闭分液漏斗的活塞,氢氧化钠溶液和二氧化碳反应生成碳酸钠和水,使瓶内气体减少,压强变小;一段时间后,打开 K2,烧杯内的澄清石灰水到流入广口瓶内;碳酸钠和氢氧化钙反应生成碳酸钙沉淀和和氢氧化钠,观察到的实验现象是澄清石灰水变浑浊。该实验过程中,发生反应的化学方程式2NaOH + CO2 = Na2CO3 + H2O,Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。
14. ①②③ ④,这样做可能会引起爆炸
【详解】①夏季蚊虫叮咬后,涂抹肥皂液可缓解痛苦,因为肥皂液能和蚊虫叮咬皮肤时释放的蚁酸反应降低酸性,方法正确;②人的体液为弱碱性,多吃碱性食物有益健康,方法正确;③胃酸过多的人,可饮用苏打水保健,因为苏打水呈碱性,可和胃液中的酸反应,方法正确;④家庭煤气泄漏,立即开油烟机排气,产生的火花可能会引起爆炸,方法错误。
15. H2O NH4H2PO4
【详解】人体中含量最多的物质是水,其化学式为:H2O;氮、磷、钾三种元素中至少含有两种的化肥是复合肥,磷酸二氢铵含N、P两种营养元素,属于复合肥,其化学式为:NH4H2PO4。
16. C 酸性 酸性
【详解】(1)磷肥具有抗寒抗旱能力,氮、磷、钾这三种元素中只含有氮元素的是氮肥;只含有钾元素的是钾肥,只含有磷元素的是磷肥;含有两种或两种以上元素的化肥是复合肥,C属于磷肥。故选C;
(2)用pH试纸测得自家土壤浸出液的pH为5,说明显酸性;
(3)pH小于7呈酸性,pH范围为6.5-7.0,则白菜适合在酸性环境中种植。
17. 2H2 NO CO2 Ca(OH)2
【分析】离子的表示要在对应微粒的右上方标出离子所带的电荷,元素化合价要标在对应元素的正上方,由分子构成的物质物质符号用分子符号(化学式)表示,表示微粒的个数在微粒前面加对应数字;
【详解】(1)1个氢分子中含有2个氢原子,2个氢分子2H2。
(2)1个硝酸根离子带一个单位负电荷,NO。
(3)保持二氧化碳化学性质的最小粒子是二氧化碳分子CO2。
(4)氯化锌中锌元素的化合价为+2价,。
(5)可用来改良酸性土壤的碱为氢氧化钙Ca(OH)2。
18.(1)活性炭
(2)AD
(3)BD
(4)溶剂
【详解】(1)自来水厂的净化过程中加入活性炭吸附色素和异味;
(2)A、淘米水浇花可以节约水资源,能实现爱护水资源,符合题意;
B、禁止使用化肥和农药,目前农业生产会受影响,要合理使用,不符合题意;
C、农业上滴灌改为漫灌,会消耗大量水资源,不能实现爱护水资源,不符合题意;
D、工业废水达标后排放,不会造成水体污染,有利于保护水资源,符合题意。
故选AD;
(3)A、电解水正极生成氧气,负极生成氢气,氢气和氧气的体积比为2:1,试管a中的气体体积较小是氧气,具有助燃性,没有可燃性,错误;
B、试管b中的气体比试管a中的气体多,试管b中的气体是氢气,正确;
C、根据化学方程式可知,反应生成的氧气和氢气质量为8:1,试管a和b中气体的质量比为8:1,错误;
D、电解水时,负极产生氢气,正极产生氧气,氢气是由氢元素组成,氧气是由氧元素组成,化学变化中元素的种类不变,该实验说明水是由氢元素和氧元素组成的,水不是由一种元素组成的,正确。
故选BD;
(4)将少量氧化钙放入足量的水中,固体消失的变化中,水与氧化钙反应生成氢氧化钙,最后形成氢氧化钙溶液,水既做反应物也做溶剂。
19.(1)锥形瓶
(2) B m
(3) 防止气体从长颈漏斗逸出
(4)C
【详解】(1)根据图示可知b是锥形瓶;
(2)实验室用过氧化氢溶液制取氧气,反应物是固液,条件是常温,故应选固液常温型发生装置即装置B,过氧化氢溶液在二氧化锰作催化剂的条件下生成水和氧气,化学方程式为 ;用F装置收集氧气,氧气密度比空气略大,处于空气底层,故氧气应从长导管通入,即m管口通入;
(3)仪器a的下端管口如果不伸入液面以下形成“液封”,产生的气体会从仪器a中逸出;用澄清石灰水检验CO2的原理是氢氧化钙与二氧化碳反应生成碳酸钙沉淀和水,反应方程式为: CO2+Ca(OH)2=CaCO3↓+H2O ;
(4)浓硫酸显酸性,可以干燥中性或酸性气体,不能干燥碱性气体如:氨气( NH3 ),故选:C。
20. CaCO3 CaO+CO2↑ 取滤液A少量于试管中,滴加酚酞(或通入二氧化碳) 变红(变浑浊) 取滤渣B少量于试管中,滴加足量盐酸 无气泡
【详解】根据所学知识和题中信息知, ① 煅烧石灰石的化学方程式为CaCO3 CaO+CO2↑。
② 利用滤液A或滤渣B设计方案证明石灰石分解情况。
实验操作 判断依据 结论
取滤液A少量于试管中,滴加酚酞(或通入二氧化碳) 变红(变浑浊),氧化钙与水反应生成氢氧化钙,具有碱性,可使酚酞变红 ﹙氢氧化钙与二氧化碳反应生成碳酸钙沉淀,可使石灰水变浑浊﹚ 石灰石已分解
取滤渣B少量于试管中,滴加足量盐酸 无气泡 石灰石完全分解
点睛∶氧化钙与水反应生成氢氧化钙,具有碱性,可使酚酞变红。
21.(1)8.7
(2)解:设氯化镁的质量为x,生成的氯化钠的质量为y,则有
溶液中氯化钠质量为38.0g-19.0g+23.4g=42.4g,溶液质量为38.0g+105.6g+80.0g-11.6g=212g,
恰好完全反应时,所得不饱和溶液中溶质的质量分数为×100%=20.0%;
答:恰好完全反应时,所得不饱和溶液中溶质的质量分数为20.0%。
【详解】(1)由图中信息可知,20g氢氧化钠溶液完全反应生成2.9g沉淀,加入氢氧化钠溶液60g以后仍然产生沉淀,说明加入60g氢氧化钠溶液时,氢氧化钠完全反应,生成氢氧化镁质量是2.9g ×=8.7g,故填:8.7;
(2)见答案。
答案第1页,共2页
答案第1页,共2页
