安徽省宿州市2023-2024学年高一上学期11月期中联考化学试题(含答案)
文档属性
| 名称 | 安徽省宿州市2023-2024学年高一上学期11月期中联考化学试题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 189.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 00:00:00 | ||
图片预览


文档简介
宿州市2023-2024学年高一上学期11月期中联考
化学试题
可能用到的相对原子质量:
H 1 C 12 N 14 O 16 S 32 Na 23 Mg 24 Cl 35.5 Ca 40 Fe 56
一、选择题:(本题共16小题,共48分。在每小题给出的四个选项中,只有一项是符合题目要求)
1.生活处处皆化学,它已渗透到社会生活各方面.下列叙述不合理的是( )
A.实验室中若金属钠失火,一定不能采用泡沫灭火器灭火
B.血液透析净化尿毒症患者的血液,利用了胶体的性质
C.牙膏中的摩擦剂(如SiO2等)一般都易溶于水
D.家庭中84消毒液杀菌、消毒过生中发生了氧化还原反应
2. 下列金属在氧气中燃烧的产物属于碱性氧化物的是( )
A .Na B. Al C. Fe D. Mg
3.古老而神奇的蓝色染料普鲁士蓝的一种合成方法如下:
下列表达正确的是( )
A.牛血浆属于胶体,有丁达尔效应
B.FeCl3溶液中可能大量存在K+、CN-、Fe2+、SO42-离子
C.铁与盐酸或氯气都生成FeCl3
D.FeCl3能导电,所以FeCl3溶液属于电解质
4.航天探测发现:金星是一个被浓密大气层包围的固体球,大气层的成分之一是三氧化二碳(C2O3),实验证明它的化学性质与一氧化碳相似。下列关于三氧化二碳(C2O3)的说法中不正确的是( )
A. 属于氧化物 B.阻燃性 C.有氧化性 D.有还原性
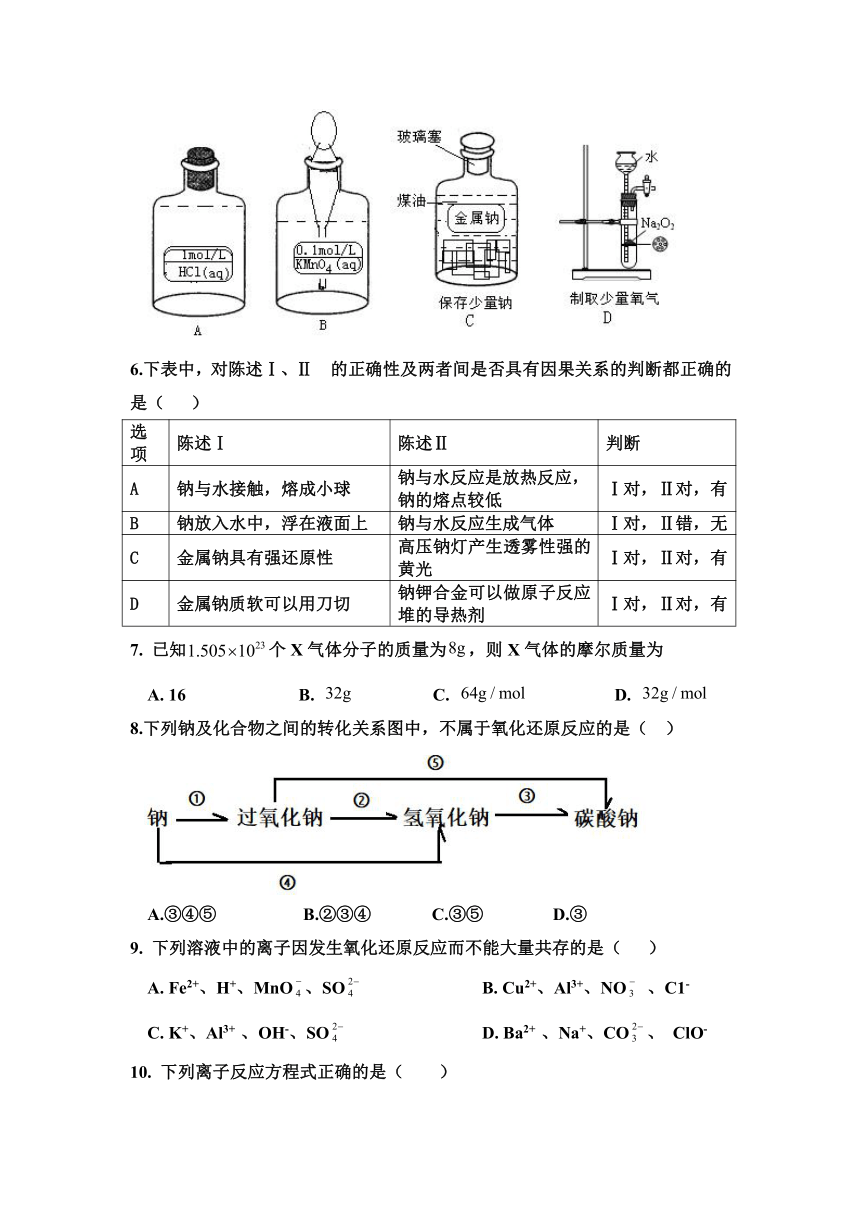
5. 下列装置和操作没有错误,且能达到实验目的是( )
6.下表中,对陈述Ⅰ、Ⅱ 的正确性及两者间是否具有因果关系的判断都正确的是( )
选项 陈述Ⅰ 陈述Ⅱ 判断
A 钠与水接触,熔成小球 钠与水反应是放热反应, 钠的熔点较低 Ⅰ对,Ⅱ对,有
B 钠放入水中,浮在液面上 钠与水反应生成气体 Ⅰ对,Ⅱ错,无
C 金属钠具有强还原性 高压钠灯产生透雾性强的黄光 Ⅰ对,Ⅱ对,有
D 金属钠质软可以用刀切 钠钾合金可以做原子反应堆的导热剂 Ⅰ对,Ⅱ对,有
7. 已知个X气体分子的质量为,则X气体的摩尔质量为
A. 16 B. C. D.
8.下列钠及化合物之间的转化关系图中,不属于氧化还原反应的是( )
A.③④⑤ B.②③④ C.③⑤ D.③
9. 下列溶液中的离子因发生氧化还原反应而不能大量共存的是( )
A. Fe2+、H+、MnO、SO B. Cu2+、Al3+、NO 、C1-
C. K+、Al3+ 、OH-、SO D. Ba2+ 、Na+、CO、 ClO-
10. 下列离子反应方程式正确的是( )
A. 向溶液中通入:
B. 将硫酸溶液与氢氧化钡溶液混合:
C. 碳酸氢钠与氢氧化钠溶液反应:
D. 用氢氧化钠溶液吸收氯气:
11.科学家开发出一种低成本光伏材料----蜂窝状石墨烯。生产原理是: Na2O +2CONa2CO3+C(石墨烯),然后用酸除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是( )
A.上述生产石墨烯的反应属于氧化还原反应
B.石墨烯与金刚石互为同素异形体
C. CO属于酸性氧化物,Na2O属于碱性氧化物,Na2CO3属于盐
D.自然界中碳元素有游离态和化合态两种存在形式
12 若NA表示阿佛加德罗常数的值,下列说法正确的是 ( )
A. 5.6g铁在2.24L氯气中燃烧,转移电子数0.3NA
B.过氧化钠与足量的水反应生成2.24LO2(标况下)转移电子数0.4NA
C. 6.9g钠与足量的O2反应,无论是否加热转移电子数都为0.3NA
D. 16.8g铁在足量氧气中完全燃烧,失去电子数为0.9NA
13.如图一密闭容器被无摩擦、可滑动的两隔板a、b分成甲、乙两室;在乙室中充入0.4molNH3,甲室中充入N2,静止时隔板位置如图所示位置。
下列说法正确的是( )
A. 甲室气体质量为22.4g B. 乙室气体体积8.96L
C. 原子数之比,甲:乙=2:1 D. 甲室气体密度为1.25g·L-1
14..若50g密度为 ρg/cm3的硝酸铁溶液里含2.8g 铁离子,则该溶液中硝酸根离子的物质的量浓度是( )
A.ρ/3 mol/L B.15/ρ mol/L C.3ρ mol/L D.1.5ρ mol/L
非选择题
15.科学家在研究化学物质常对其进行分类,以便对同类物质的性质进行深入研究,物质分类及转化思想贯穿整个化学学科学习的始终。
下列物质:①硫酸;②硝酸钾溶液;③铜;④Na2O固体;⑤Ba(OH)2固体;⑥K2CO3固体;⑦二氧化碳;⑧熔融KHSO4;⑨AgCl固体;⑩氨气;
(1)能导电的是_______(填序号,下同),属于电解质的是_______,属于非电解质的是_______ 。
(2)写出⑤、⑥在水溶液中的电离方程式:
⑤_____ __,⑥___ ____。
从物质的组成看KNO3、K2CO3、KHSO4都属于钾盐,其分类标准是:______;
检验②中金属阳离子的实验方法是_______(填实验操作的名称),确定该离子存在的现象是_______。
16. FeCl3和CuCl2都是重要的化工原料。工业上常采用将Cu与含少量FeCl3的稀盐酸中持续通入空气的条件下反应制备CuCl2,在该反应中FeCl3起催化作用。其反应原理如下图所示,请完成下列问题:
(1). 写出用饱和FeCl3溶液制取Fe(OH)3胶体的离子方程式 ;检验所得分散系是胶体的实验方法为 。
(2).0.2 L0.5 mol/LFeCl3溶液中的Cl-的物质的量浓度为___ __。
(3)图示制备CuCl2分为两步完成,写出反应Ⅰ的离子方程式 ;
反应Ⅱ属于氧化还原反应,其中氧化剂是 ,氧化产物为 ;
(4).写出总反应的化学方程式,并在方程式中表示出电子转移的方向与数目。
17.廉价的“84消毒液”能有效杀灭病毒。有效氯含量是衡量含氯消毒液的消毒能力的物理量,有效氯含量指一定量消毒剂的氧化能力相当于多少Cl2氧化能力。
(1).某同学欲用NaClO固体配制有效氯含量为35.5g·L-184消毒液960mL,用托盘天平称量NaClO的质量为 。
(2).配制该消毒液的几个关键操作步骤中有错误的操作是
(3)若定容操作时仰视观察,配制溶液的浓度将 (填“偏大”“偏小”“无影响”);若有误差将如何处理完成实验? 。
(4).①在适当的条件下NaClO溶液可以除去生活污水中的氨氮(以NH3计算)生成无污染性气体,该反应的离子方程式为_______________________________。
②实验发现废水中的氨氮去除率与溶液pH、温度及次氯酸钠投入量等因素有关。
其他条件一定时,氨氮去除率与温度的关系如下图所示(已知NaClO+H2ONaOH+HClO)。
实验现象可知用NaClO消除生活污水中的氨氮选择的合适温度为 ;
当温度高于30℃时,温度越高,氨氮去除率减小的原因可能是____________________。
18.过氧化钠保存不当容易变质生成Na2CO3
(1)关于碳酸钠的分类正确的是
A. 氧化物 B. 碱 C. 盐 D. 电解质
(2)某过氧化钠样品已经部分变质,用一种溶液,证明过氧化钠已经变质,这种试剂可以选用:
A. BaCl2溶液 B. 稀盐酸 C. 石蕊溶液 D. AgNO3溶液
(3)检验样品中还有过氧化钠的方法是取适量样品放入试管中,再加入适量的水,将气体通过盛有 的洗气瓶收集气体能使带火星的木条复燃,证明样品中仍有Na2O2。
(4)某课外活动小组为了测定过氧化钠的质量分数,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。
(A) (B) (C) (D) (E) (F)
写出仪器或装置的名称,图A中盛放盐酸的仪器 ;
装置B的名称 ;
②.上图中的E和F构成量气装置,用来测定O2的体积。他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为 ;若去掉(D)装置,测量数值偏 (填“高、低或无影响”)。
宿州市2023-2024学年高一上学期11月期中联考
参 考 答 案
选择题(14x3=42分)
题号 1 2 3 4 5 6 7
答案 C D A B B A D
题号 8 9 10 11 12 13 14
答案 D A D C C A C
二 非选择题(共58分)
15【答案】(15分)(1) ②③⑧ ①④⑤⑥⑧⑨ ⑦⑩ (2+2+2=6)
(2) (2+2=4)
(3) 阳离子都是钾离子 (2)
(4). 焰色试验 . 透过蓝色钴玻璃观察到火焰呈紫色(1+2=3)
16答案(14分)(1)Fe3++3H2OFe(OH)3(胶体)+3H+ ,
用光线照射该分散系有丁达尔效应(或丁达尔现象)(2+2=4分)
(2)1.5mol/L(2分)
(3)4Fe2++O2+4H+=4Fe3++2H2O; FeCl3、CuCl2(2+2+2=6分)
(4)(2分)
17【答案】(15分)(1) 37.3g (2分) (2)ACD (2分)
(3)偏小 ;倒掉溶液,洗净容量瓶后重新配制(2+2+2=6分)
(4)①2NH3+3ClO- =3Cl-+N2↑+3H2O ;(2分)
②15℃左右;温度高于30℃时,HClO(或NaClO)易分解,温度越高分解速率越快,去除率越低。(1+2分)
18答案(14分)
CD (2分) (2)A (2分) (3)NaOH溶液(合理即可)(2分)
(4)①分液漏斗、洗气瓶;(2+2=4分) ② (2分) ;高(2分)
化学试题
可能用到的相对原子质量:
H 1 C 12 N 14 O 16 S 32 Na 23 Mg 24 Cl 35.5 Ca 40 Fe 56
一、选择题:(本题共16小题,共48分。在每小题给出的四个选项中,只有一项是符合题目要求)
1.生活处处皆化学,它已渗透到社会生活各方面.下列叙述不合理的是( )
A.实验室中若金属钠失火,一定不能采用泡沫灭火器灭火
B.血液透析净化尿毒症患者的血液,利用了胶体的性质
C.牙膏中的摩擦剂(如SiO2等)一般都易溶于水
D.家庭中84消毒液杀菌、消毒过生中发生了氧化还原反应
2. 下列金属在氧气中燃烧的产物属于碱性氧化物的是( )
A .Na B. Al C. Fe D. Mg
3.古老而神奇的蓝色染料普鲁士蓝的一种合成方法如下:
下列表达正确的是( )
A.牛血浆属于胶体,有丁达尔效应
B.FeCl3溶液中可能大量存在K+、CN-、Fe2+、SO42-离子
C.铁与盐酸或氯气都生成FeCl3
D.FeCl3能导电,所以FeCl3溶液属于电解质
4.航天探测发现:金星是一个被浓密大气层包围的固体球,大气层的成分之一是三氧化二碳(C2O3),实验证明它的化学性质与一氧化碳相似。下列关于三氧化二碳(C2O3)的说法中不正确的是( )
A. 属于氧化物 B.阻燃性 C.有氧化性 D.有还原性
5. 下列装置和操作没有错误,且能达到实验目的是( )
6.下表中,对陈述Ⅰ、Ⅱ 的正确性及两者间是否具有因果关系的判断都正确的是( )
选项 陈述Ⅰ 陈述Ⅱ 判断
A 钠与水接触,熔成小球 钠与水反应是放热反应, 钠的熔点较低 Ⅰ对,Ⅱ对,有
B 钠放入水中,浮在液面上 钠与水反应生成气体 Ⅰ对,Ⅱ错,无
C 金属钠具有强还原性 高压钠灯产生透雾性强的黄光 Ⅰ对,Ⅱ对,有
D 金属钠质软可以用刀切 钠钾合金可以做原子反应堆的导热剂 Ⅰ对,Ⅱ对,有
7. 已知个X气体分子的质量为,则X气体的摩尔质量为
A. 16 B. C. D.
8.下列钠及化合物之间的转化关系图中,不属于氧化还原反应的是( )
A.③④⑤ B.②③④ C.③⑤ D.③
9. 下列溶液中的离子因发生氧化还原反应而不能大量共存的是( )
A. Fe2+、H+、MnO、SO B. Cu2+、Al3+、NO 、C1-
C. K+、Al3+ 、OH-、SO D. Ba2+ 、Na+、CO、 ClO-
10. 下列离子反应方程式正确的是( )
A. 向溶液中通入:
B. 将硫酸溶液与氢氧化钡溶液混合:
C. 碳酸氢钠与氢氧化钠溶液反应:
D. 用氢氧化钠溶液吸收氯气:
11.科学家开发出一种低成本光伏材料----蜂窝状石墨烯。生产原理是: Na2O +2CONa2CO3+C(石墨烯),然后用酸除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是( )
A.上述生产石墨烯的反应属于氧化还原反应
B.石墨烯与金刚石互为同素异形体
C. CO属于酸性氧化物,Na2O属于碱性氧化物,Na2CO3属于盐
D.自然界中碳元素有游离态和化合态两种存在形式
12 若NA表示阿佛加德罗常数的值,下列说法正确的是 ( )
A. 5.6g铁在2.24L氯气中燃烧,转移电子数0.3NA
B.过氧化钠与足量的水反应生成2.24LO2(标况下)转移电子数0.4NA
C. 6.9g钠与足量的O2反应,无论是否加热转移电子数都为0.3NA
D. 16.8g铁在足量氧气中完全燃烧,失去电子数为0.9NA
13.如图一密闭容器被无摩擦、可滑动的两隔板a、b分成甲、乙两室;在乙室中充入0.4molNH3,甲室中充入N2,静止时隔板位置如图所示位置。
下列说法正确的是( )
A. 甲室气体质量为22.4g B. 乙室气体体积8.96L
C. 原子数之比,甲:乙=2:1 D. 甲室气体密度为1.25g·L-1
14..若50g密度为 ρg/cm3的硝酸铁溶液里含2.8g 铁离子,则该溶液中硝酸根离子的物质的量浓度是( )
A.ρ/3 mol/L B.15/ρ mol/L C.3ρ mol/L D.1.5ρ mol/L
非选择题
15.科学家在研究化学物质常对其进行分类,以便对同类物质的性质进行深入研究,物质分类及转化思想贯穿整个化学学科学习的始终。
下列物质:①硫酸;②硝酸钾溶液;③铜;④Na2O固体;⑤Ba(OH)2固体;⑥K2CO3固体;⑦二氧化碳;⑧熔融KHSO4;⑨AgCl固体;⑩氨气;
(1)能导电的是_______(填序号,下同),属于电解质的是_______,属于非电解质的是_______ 。
(2)写出⑤、⑥在水溶液中的电离方程式:
⑤_____ __,⑥___ ____。
从物质的组成看KNO3、K2CO3、KHSO4都属于钾盐,其分类标准是:______;
检验②中金属阳离子的实验方法是_______(填实验操作的名称),确定该离子存在的现象是_______。
16. FeCl3和CuCl2都是重要的化工原料。工业上常采用将Cu与含少量FeCl3的稀盐酸中持续通入空气的条件下反应制备CuCl2,在该反应中FeCl3起催化作用。其反应原理如下图所示,请完成下列问题:
(1). 写出用饱和FeCl3溶液制取Fe(OH)3胶体的离子方程式 ;检验所得分散系是胶体的实验方法为 。
(2).0.2 L0.5 mol/LFeCl3溶液中的Cl-的物质的量浓度为___ __。
(3)图示制备CuCl2分为两步完成,写出反应Ⅰ的离子方程式 ;
反应Ⅱ属于氧化还原反应,其中氧化剂是 ,氧化产物为 ;
(4).写出总反应的化学方程式,并在方程式中表示出电子转移的方向与数目。
17.廉价的“84消毒液”能有效杀灭病毒。有效氯含量是衡量含氯消毒液的消毒能力的物理量,有效氯含量指一定量消毒剂的氧化能力相当于多少Cl2氧化能力。
(1).某同学欲用NaClO固体配制有效氯含量为35.5g·L-184消毒液960mL,用托盘天平称量NaClO的质量为 。
(2).配制该消毒液的几个关键操作步骤中有错误的操作是
(3)若定容操作时仰视观察,配制溶液的浓度将 (填“偏大”“偏小”“无影响”);若有误差将如何处理完成实验? 。
(4).①在适当的条件下NaClO溶液可以除去生活污水中的氨氮(以NH3计算)生成无污染性气体,该反应的离子方程式为_______________________________。
②实验发现废水中的氨氮去除率与溶液pH、温度及次氯酸钠投入量等因素有关。
其他条件一定时,氨氮去除率与温度的关系如下图所示(已知NaClO+H2ONaOH+HClO)。
实验现象可知用NaClO消除生活污水中的氨氮选择的合适温度为 ;
当温度高于30℃时,温度越高,氨氮去除率减小的原因可能是____________________。
18.过氧化钠保存不当容易变质生成Na2CO3
(1)关于碳酸钠的分类正确的是
A. 氧化物 B. 碱 C. 盐 D. 电解质
(2)某过氧化钠样品已经部分变质,用一种溶液,证明过氧化钠已经变质,这种试剂可以选用:
A. BaCl2溶液 B. 稀盐酸 C. 石蕊溶液 D. AgNO3溶液
(3)检验样品中还有过氧化钠的方法是取适量样品放入试管中,再加入适量的水,将气体通过盛有 的洗气瓶收集气体能使带火星的木条复燃,证明样品中仍有Na2O2。
(4)某课外活动小组为了测定过氧化钠的质量分数,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。
(A) (B) (C) (D) (E) (F)
写出仪器或装置的名称,图A中盛放盐酸的仪器 ;
装置B的名称 ;
②.上图中的E和F构成量气装置,用来测定O2的体积。他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为 ;若去掉(D)装置,测量数值偏 (填“高、低或无影响”)。
宿州市2023-2024学年高一上学期11月期中联考
参 考 答 案
选择题(14x3=42分)
题号 1 2 3 4 5 6 7
答案 C D A B B A D
题号 8 9 10 11 12 13 14
答案 D A D C C A C
二 非选择题(共58分)
15【答案】(15分)(1) ②③⑧ ①④⑤⑥⑧⑨ ⑦⑩ (2+2+2=6)
(2) (2+2=4)
(3) 阳离子都是钾离子 (2)
(4). 焰色试验 . 透过蓝色钴玻璃观察到火焰呈紫色(1+2=3)
16答案(14分)(1)Fe3++3H2OFe(OH)3(胶体)+3H+ ,
用光线照射该分散系有丁达尔效应(或丁达尔现象)(2+2=4分)
(2)1.5mol/L(2分)
(3)4Fe2++O2+4H+=4Fe3++2H2O; FeCl3、CuCl2(2+2+2=6分)
(4)(2分)
17【答案】(15分)(1) 37.3g (2分) (2)ACD (2分)
(3)偏小 ;倒掉溶液,洗净容量瓶后重新配制(2+2+2=6分)
(4)①2NH3+3ClO- =3Cl-+N2↑+3H2O ;(2分)
②15℃左右;温度高于30℃时,HClO(或NaClO)易分解,温度越高分解速率越快,去除率越低。(1+2分)
18答案(14分)
CD (2分) (2)A (2分) (3)NaOH溶液(合理即可)(2分)
(4)①分液漏斗、洗气瓶;(2+2=4分) ② (2分) ;高(2分)
同课章节目录
