化学人教版(2019)选择性必修2 1.2.2元素周期律 课件(共35张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 1.2.2元素周期律 课件(共35张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 10.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 00:00:00 | ||
图片预览









文档简介
(共35张PPT)
第二节 原 子 结 构与元素的性质
1.2.2 元素周期律
人教版高中化学选必二
新课导入
元素周期律:元素的性质随着原子序数的递增而呈周期性的变化
目录
电负性
03
04
原子半径
01
电离能
02
PART 01
·原子半径·
SAFE USE EDUCATION
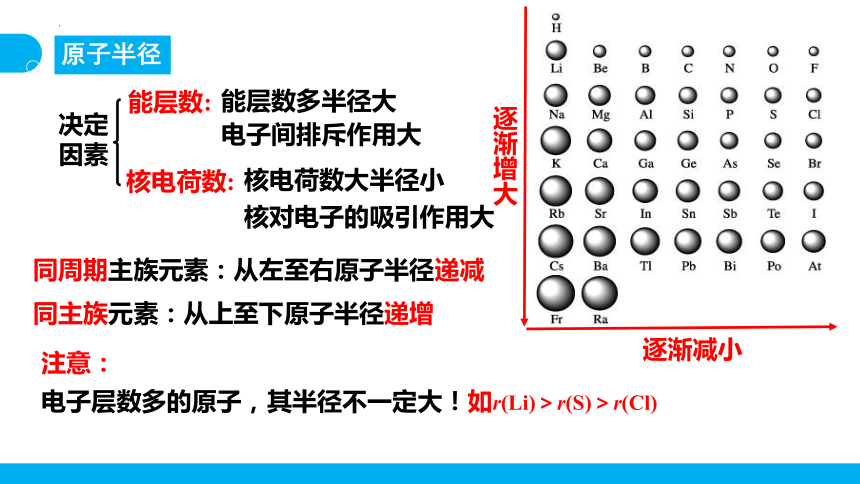
原子半径
决定因素
能层数:
能层数多半径大
电子间排斥作用大
核电荷数:
核电荷数大半径小
核对电子的吸引作用大
逐渐减小
逐渐增大
同周期主族元素:从左至右原子半径递减
同主族元素:从上至下原子半径递增
电子层数多的原子,其半径不一定大!如r(Li)>r(S)>r(Cl)
注意:
原子半径
微粒(原子或离子)半径比较的方法和一般规律:
一看电子层数
二看核电荷数
三看电子数
(1)电子层数不同时,电子层数越多,原子半径越大。
H Li Na K Rb Cs
<
<
<
<
<
<
<
<
Li Be B C N O F
>
>
>
>
>
>
(2)电子层数相同时,核电荷数越大,原子半径越小。(0族元素除外)
H->Li+ 、N3->O2->F->Na+>Mg2+>Al3+ 、P3->S2->Cl->K+>Ca2+
(3)电子层数、核电荷数都相同时,电子数越多,原子半径越大。
(序小径大)
“ 三看”:
F- Cl- Br- I-
原子半径
微粒(原子或离子)半径比较的方法和一般规律:
一看电子层数
二看核电荷数
三看电子数
“ 三看”:
(4)同种元素的离子半径:阴离子大于原子,原子大于阳离子,低价阳离子大于高价阳离子。Cl- Cl,Fe Fe2+ Fe3+
(5)核电荷数、能层数均不同的离子:可选一种离子参照比较。例如:比较r(K+)与r(Mg2+),可选r(Na+)为参照,r(K+) r(Na+) r(Mg2+)
>
>
>
>
>
原子半径——正误判断
(1)r(N3-)>r(O2-)>r(F-)>r(Na+)>r(Mg2+)。( )
(2)r(Si)>r(B)>r(C)。( )
(4)r(Fe3+)>r(Fe2+)>r(Fe)。( )
(3)r(F-)×
√
√
√
PART 02
·电离能·
SAFE USE EDUCATION
电离能
1.元素第一电离能的概念与意义
(1)概念
原子失去一个电子转化为 正离子所需要的_________
叫做第一电离能,符号:I1。
(2)意义:可以衡量元素的原子失去一个电子的 。第一电离能数值越小,原子越 失去一个电子;第一电离能数值越大,原子越
失去一个电子。
气态基态
气态基态
最低能量
难易程度
容易
难
电离能
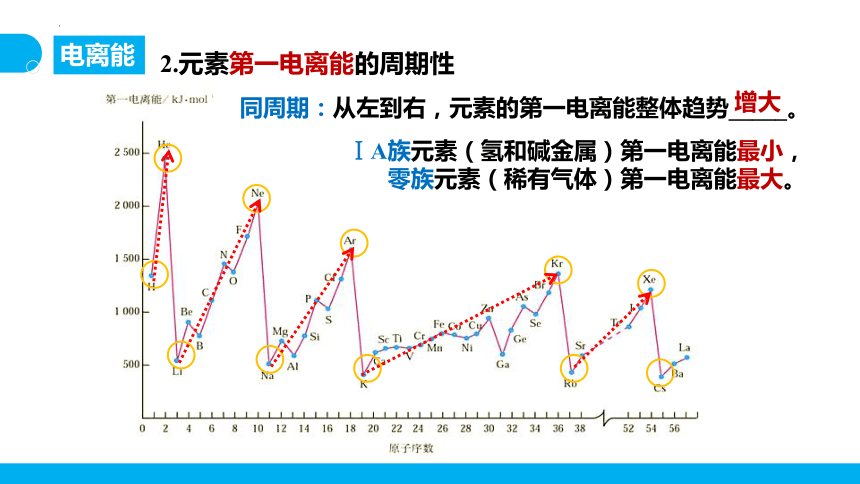
2.元素第一电离能的周期性
同周期:从左到右,元素的第一电离能整体趋势_____。
增大
ⅠA族元素(氢和碱金属)第一电离能最小,
零族元素(稀有气体)第一电离能最大。
电离能
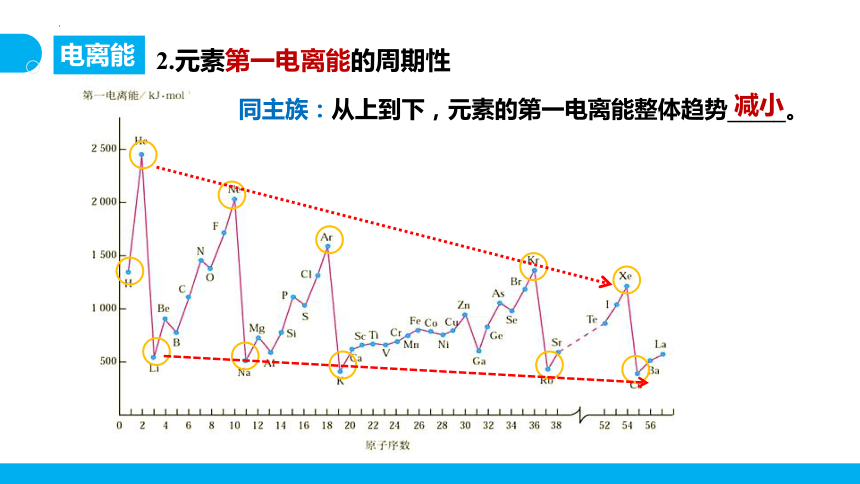
2.元素第一电离能的周期性
同主族:从上到下,元素的第一电离能整体趋势_____。
减小
电离能
2.元素第一电离能的周期性
为什么B、Al、O、S等元素的电离能比它们左边的元素的电离能要低,而使Li~Ne和Na~Ar的电离能曲线呈现锯齿状变化?
Be:1s22s2
B:1s22s22p1
Mg:1s22s22p63s2
Al:1s22s22p63s23p1
失去的电子是np能级的,该能级的能量比左边的ns能级的能量高,则不稳定,容易失去电子,第一电离能较低。
B和Al第一电离能:
电离能
2.元素第一电离能的周期性
N:1s22s22p3
O:1s22s22p4
P:1s22s22p63s23p3
S:1s22s22p63s23p4
N和P的电子排布:
半充满状态,比较稳定,难失去电子,第一电离能较高。
电离能
3.元素电离能的应用
(1)判断元素的金属性、非金属性强弱:I1越大,元素的 性越强;I1越小,元素的 性越强。
非金属
金属
(2)逐级电离能的应用
①逐级电离能
含义:原子的+1价气态基态离子再失去1个电子所需要的最低能量叫做第二电离能,依次类推。
可以表示为
M(g)===M+(g)+e- I1(第一电离能)
M+(g)===M2+(g)+e- I2(第二电离能)
M2+(g)===M2+(g)+e- I3(第三电离能)
电离能
3.元素电离能的应用
逐级电离能的变化规律
a.同一元素的电离能按I1、I2、I3……顺序逐级增大。
b.当相邻逐级电离能发生突变时,说明失去的电子所在的能层发生了变化。
(2)逐级电离能的应用
②应用
根据电离能数据确定元素原子核外电子的排布及元素的化合价,如Li:I1 I2<I3,表明Li原子核外的三个电子排布在两个能层上(K、L能层),且最外层上只有一个电子,易失去 形成 阳离子。
一个电子
+1价
电离能——思考与讨论
1.碱金属的电离能与碱金属的活泼性存在什么联系?
碱金属第一电离能越小,越容易失去电子,碱金属越活泼。
电离能——思考与讨论
2.下表的数据从上到下是钠、镁、铝逐级失去电子的电离能。
元素 Na Mg Al
496 738 578
4 562 1 451 1 817
6 912 7 733 2 745
9 543 10 540 11 575
13 353 13 630 14 830
16 610 17 995 18 376
20 114 21 703 23 293
为什么原子的逐级电离能越来越大?这些数据跟钠、镁、铝的化合价有什么联系?
电离能——思考与讨论
为什么原子的逐级电离能越来越大?
同一元素的逐级电离能是逐渐增大的,即I1I1,同理I3>I2。
电离能——思考与讨论
这些数据跟钠、镁、铝的化合价有什么联系?
元素 Na Mg Al
496 738 578
4 562 1 451 1 817
6 912 7 733 2 745
9 543 10 540 11 575
13 353 13 630 14 830
16 610 17 995 18 376
20 114 21 703 23 293
钠的I1比I2小很多,电离能差值很大,说明失去第一个电子比失去第二个电子容易得多,所以Na容易失去一个电子变成+1价离子;
Mg的I1和I2相差不多,而I3比I2大很多,说明Mg容易失去2个电子形成+2价离子;
Al的I1、I2、I3相差不多,而I4比I3大很多,所以Al容易失去3个电子形成+3价离子。
PART 03
·电负性·
SAFE USE EDUCATION
电负性
键合电子:元素相互化合时,原子中用于形成 的电子。
电负性:用来描述不同元素的原子对键合电子 的大小。电负性越大的原子,对键合电子的吸引力 。
电负性大小的标准:以氟的电负性为 和锂的电负性为 作为相对标准。
吸引力
化学键
越大
4.0
1.0
递变规律
(1)同周期元素从左到右,元素的电负性逐渐 ,元素的非金属性逐渐
、金属性逐渐 。
(2)同族元素从上到下,元素的电负性逐渐 ,元素的金属性逐渐 、非金属性逐渐 。
变大
增强
减弱
变小
增强
减弱
电负性
电负性
应用
(1)判断元素的金属性和非金属性强弱
①金属元素的电负性一般 1.8,非金属元素的电负性一般 1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在 ,它们既有金属性,又有非金属性。
②金属元素的电负性 ,金属元素越活泼;非金属元素的电负性 ,非金属元素越活泼。
小于
大于
1.8左右
越小
越大
电负性
(2)判断元素的化合价
①电负性数值小的元素在化合物中吸引电子的能力 ,元素的化合价为正值。
②电负性数值大的元素在化合物中吸引电子的能力 ,元素的化合价为负值。
弱
强
电负性
(3)判断化合物的类型
如H的电负性为2.1,Cl的电负性为3.0,Cl的电负性与H的电负性之差为3.0-2.1=0.9<1.7,故HCl为共价化合物;如Al的电负性为1.5,Cl的电负性与Al的电负性之差为3.0-1.5=1.5<1.7,因此AlCl3为共价化合物;同理,BeCl2也是共价化合物。
电负性
(3)判断化合物的类型
注意:
①电负性之差大于1.7的元素不一定都形成离子化合物,如F的电负性与H的电负性之差为1.9,但HF为共价化合物。
②电负性之差小于1.7的元素不一定形成共价化合物,Na的电负性为0.9,与H的电负性之差为1.2,但NaH中的化学键是离子键。
电负性——思考与讨论
第一电离能的变化趋势与电负性的变化趋势有什么不同?
元素的电负性越大,但第一电离能不一定越大,例如电负性:N<O,而第一电离能:N>O。
课堂小结
原子半径
同周期:从左→右,原子半径逐渐 。
同主族:从上→下,原子半径逐渐 。
影响因素
电子的能层数
核电荷数
增大
减小
电离能
同周期:从左到右,元素的第一电离能整体趋势_____。
增大
ⅡA>ⅢA ;ⅤA>ⅥA
同主族:从上到下,元素的第一电离能整体趋势_____。
减小
元素的逐级电离能越来越大
电负性
同周期:从左→右,电负性逐渐 。
同主族:从上→下,电负性逐渐 。
增大
减小
判断元素的金属性与非金属性的强弱
判断化学键的类型
判断共价化合物中元素的化合价的正负
应用
课堂练习
√
1.下列关于粒子半径的说法中正确的是
A.电子层数少的元素,其原子半径一定小于电子层数多的元素的原子半径
B.核外电子层结构相同的单核粒子的半径相同
C.质子数相同的不同单核粒子,电子数越多半径越大
D.原子序数越大,原子半径越大
课堂练习
√
2.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,下列叙述中正确的是
A.原子半径:A>B>D>C
B.原子序数:d>c>b>a
C.离子半径:C3->D->B+>A2+
D.单质的还原性:A>B>D>C
课堂练习
√
3.在下面的电子结构中,第一电离能最小的原子可能是
A.3s23p3 B.3s23p5 C.3s23p4 D.3s23p6
课堂练习
√
4.下列说法不正确的是
A.第ⅠA族元素的电负性从上到下逐渐减小,而第ⅦA族元素的电负性从上到下逐渐增大
B.电负性的大小可以作为衡量元素的金属性和非金属性强弱的尺度
C.元素的电负性越大,表示其原子在化合物中吸引电子的能力越强
D.NaH的存在能支持可将氢元素放在第ⅦA族的观点
课堂练习
3.一般认为,如果两个成键元素的电负性差值大于1.7,它们通常形成离子键;如果两个成键元素的电负性差值小于1.7,它们通常形成共价键。查阅下列元素的电负性数值,判断下列化合物:
①NaF ②AlCl3 ③NO ④MgO ⑤BeCl2 ⑥CO2
(1)属于共价化合物的是_________(填序号,下同)。
(2)属于离子化合物的是_____。
元素 Al B Be C Cl F Li Mg N Na O P S Si
电负性 1.5 2.0 1.5 2.5 3.0 4.0 1.0 1.2 3.0 0.9 3.5 2.1 2.5 1.8
②③⑤⑥
①④
课 程 结 束
人教版高中化学选必二
第二节 原 子 结 构与元素的性质
1.2.2 元素周期律
人教版高中化学选必二
新课导入
元素周期律:元素的性质随着原子序数的递增而呈周期性的变化
目录
电负性
03
04
原子半径
01
电离能
02
PART 01
·原子半径·
SAFE USE EDUCATION
原子半径
决定因素
能层数:
能层数多半径大
电子间排斥作用大
核电荷数:
核电荷数大半径小
核对电子的吸引作用大
逐渐减小
逐渐增大
同周期主族元素:从左至右原子半径递减
同主族元素:从上至下原子半径递增
电子层数多的原子,其半径不一定大!如r(Li)>r(S)>r(Cl)
注意:
原子半径
微粒(原子或离子)半径比较的方法和一般规律:
一看电子层数
二看核电荷数
三看电子数
(1)电子层数不同时,电子层数越多,原子半径越大。
H Li Na K Rb Cs
<
<
<
<
<
<
<
<
Li Be B C N O F
>
>
>
>
>
>
(2)电子层数相同时,核电荷数越大,原子半径越小。(0族元素除外)
H->Li+ 、N3->O2->F->Na+>Mg2+>Al3+ 、P3->S2->Cl->K+>Ca2+
(3)电子层数、核电荷数都相同时,电子数越多,原子半径越大。
(序小径大)
“ 三看”:
F- Cl- Br- I-
原子半径
微粒(原子或离子)半径比较的方法和一般规律:
一看电子层数
二看核电荷数
三看电子数
“ 三看”:
(4)同种元素的离子半径:阴离子大于原子,原子大于阳离子,低价阳离子大于高价阳离子。Cl- Cl,Fe Fe2+ Fe3+
(5)核电荷数、能层数均不同的离子:可选一种离子参照比较。例如:比较r(K+)与r(Mg2+),可选r(Na+)为参照,r(K+) r(Na+) r(Mg2+)
>
>
>
>
>
原子半径——正误判断
(1)r(N3-)>r(O2-)>r(F-)>r(Na+)>r(Mg2+)。( )
(2)r(Si)>r(B)>r(C)。( )
(4)r(Fe3+)>r(Fe2+)>r(Fe)。( )
(3)r(F-)
√
√
√
PART 02
·电离能·
SAFE USE EDUCATION
电离能
1.元素第一电离能的概念与意义
(1)概念
原子失去一个电子转化为 正离子所需要的_________
叫做第一电离能,符号:I1。
(2)意义:可以衡量元素的原子失去一个电子的 。第一电离能数值越小,原子越 失去一个电子;第一电离能数值越大,原子越
失去一个电子。
气态基态
气态基态
最低能量
难易程度
容易
难
电离能
2.元素第一电离能的周期性
同周期:从左到右,元素的第一电离能整体趋势_____。
增大
ⅠA族元素(氢和碱金属)第一电离能最小,
零族元素(稀有气体)第一电离能最大。
电离能
2.元素第一电离能的周期性
同主族:从上到下,元素的第一电离能整体趋势_____。
减小
电离能
2.元素第一电离能的周期性
为什么B、Al、O、S等元素的电离能比它们左边的元素的电离能要低,而使Li~Ne和Na~Ar的电离能曲线呈现锯齿状变化?
Be:1s22s2
B:1s22s22p1
Mg:1s22s22p63s2
Al:1s22s22p63s23p1
失去的电子是np能级的,该能级的能量比左边的ns能级的能量高,则不稳定,容易失去电子,第一电离能较低。
B和Al第一电离能:
电离能
2.元素第一电离能的周期性
N:1s22s22p3
O:1s22s22p4
P:1s22s22p63s23p3
S:1s22s22p63s23p4
N和P的电子排布:
半充满状态,比较稳定,难失去电子,第一电离能较高。
电离能
3.元素电离能的应用
(1)判断元素的金属性、非金属性强弱:I1越大,元素的 性越强;I1越小,元素的 性越强。
非金属
金属
(2)逐级电离能的应用
①逐级电离能
含义:原子的+1价气态基态离子再失去1个电子所需要的最低能量叫做第二电离能,依次类推。
可以表示为
M(g)===M+(g)+e- I1(第一电离能)
M+(g)===M2+(g)+e- I2(第二电离能)
M2+(g)===M2+(g)+e- I3(第三电离能)
电离能
3.元素电离能的应用
逐级电离能的变化规律
a.同一元素的电离能按I1、I2、I3……顺序逐级增大。
b.当相邻逐级电离能发生突变时,说明失去的电子所在的能层发生了变化。
(2)逐级电离能的应用
②应用
根据电离能数据确定元素原子核外电子的排布及元素的化合价,如Li:I1 I2<I3,表明Li原子核外的三个电子排布在两个能层上(K、L能层),且最外层上只有一个电子,易失去 形成 阳离子。
一个电子
+1价
电离能——思考与讨论
1.碱金属的电离能与碱金属的活泼性存在什么联系?
碱金属第一电离能越小,越容易失去电子,碱金属越活泼。
电离能——思考与讨论
2.下表的数据从上到下是钠、镁、铝逐级失去电子的电离能。
元素 Na Mg Al
496 738 578
4 562 1 451 1 817
6 912 7 733 2 745
9 543 10 540 11 575
13 353 13 630 14 830
16 610 17 995 18 376
20 114 21 703 23 293
为什么原子的逐级电离能越来越大?这些数据跟钠、镁、铝的化合价有什么联系?
电离能——思考与讨论
为什么原子的逐级电离能越来越大?
同一元素的逐级电离能是逐渐增大的,即I1
电离能——思考与讨论
这些数据跟钠、镁、铝的化合价有什么联系?
元素 Na Mg Al
496 738 578
4 562 1 451 1 817
6 912 7 733 2 745
9 543 10 540 11 575
13 353 13 630 14 830
16 610 17 995 18 376
20 114 21 703 23 293
钠的I1比I2小很多,电离能差值很大,说明失去第一个电子比失去第二个电子容易得多,所以Na容易失去一个电子变成+1价离子;
Mg的I1和I2相差不多,而I3比I2大很多,说明Mg容易失去2个电子形成+2价离子;
Al的I1、I2、I3相差不多,而I4比I3大很多,所以Al容易失去3个电子形成+3价离子。
PART 03
·电负性·
SAFE USE EDUCATION
电负性
键合电子:元素相互化合时,原子中用于形成 的电子。
电负性:用来描述不同元素的原子对键合电子 的大小。电负性越大的原子,对键合电子的吸引力 。
电负性大小的标准:以氟的电负性为 和锂的电负性为 作为相对标准。
吸引力
化学键
越大
4.0
1.0
递变规律
(1)同周期元素从左到右,元素的电负性逐渐 ,元素的非金属性逐渐
、金属性逐渐 。
(2)同族元素从上到下,元素的电负性逐渐 ,元素的金属性逐渐 、非金属性逐渐 。
变大
增强
减弱
变小
增强
减弱
电负性
电负性
应用
(1)判断元素的金属性和非金属性强弱
①金属元素的电负性一般 1.8,非金属元素的电负性一般 1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在 ,它们既有金属性,又有非金属性。
②金属元素的电负性 ,金属元素越活泼;非金属元素的电负性 ,非金属元素越活泼。
小于
大于
1.8左右
越小
越大
电负性
(2)判断元素的化合价
①电负性数值小的元素在化合物中吸引电子的能力 ,元素的化合价为正值。
②电负性数值大的元素在化合物中吸引电子的能力 ,元素的化合价为负值。
弱
强
电负性
(3)判断化合物的类型
如H的电负性为2.1,Cl的电负性为3.0,Cl的电负性与H的电负性之差为3.0-2.1=0.9<1.7,故HCl为共价化合物;如Al的电负性为1.5,Cl的电负性与Al的电负性之差为3.0-1.5=1.5<1.7,因此AlCl3为共价化合物;同理,BeCl2也是共价化合物。
电负性
(3)判断化合物的类型
注意:
①电负性之差大于1.7的元素不一定都形成离子化合物,如F的电负性与H的电负性之差为1.9,但HF为共价化合物。
②电负性之差小于1.7的元素不一定形成共价化合物,Na的电负性为0.9,与H的电负性之差为1.2,但NaH中的化学键是离子键。
电负性——思考与讨论
第一电离能的变化趋势与电负性的变化趋势有什么不同?
元素的电负性越大,但第一电离能不一定越大,例如电负性:N<O,而第一电离能:N>O。
课堂小结
原子半径
同周期:从左→右,原子半径逐渐 。
同主族:从上→下,原子半径逐渐 。
影响因素
电子的能层数
核电荷数
增大
减小
电离能
同周期:从左到右,元素的第一电离能整体趋势_____。
增大
ⅡA>ⅢA ;ⅤA>ⅥA
同主族:从上到下,元素的第一电离能整体趋势_____。
减小
元素的逐级电离能越来越大
电负性
同周期:从左→右,电负性逐渐 。
同主族:从上→下,电负性逐渐 。
增大
减小
判断元素的金属性与非金属性的强弱
判断化学键的类型
判断共价化合物中元素的化合价的正负
应用
课堂练习
√
1.下列关于粒子半径的说法中正确的是
A.电子层数少的元素,其原子半径一定小于电子层数多的元素的原子半径
B.核外电子层结构相同的单核粒子的半径相同
C.质子数相同的不同单核粒子,电子数越多半径越大
D.原子序数越大,原子半径越大
课堂练习
√
2.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,下列叙述中正确的是
A.原子半径:A>B>D>C
B.原子序数:d>c>b>a
C.离子半径:C3->D->B+>A2+
D.单质的还原性:A>B>D>C
课堂练习
√
3.在下面的电子结构中,第一电离能最小的原子可能是
A.3s23p3 B.3s23p5 C.3s23p4 D.3s23p6
课堂练习
√
4.下列说法不正确的是
A.第ⅠA族元素的电负性从上到下逐渐减小,而第ⅦA族元素的电负性从上到下逐渐增大
B.电负性的大小可以作为衡量元素的金属性和非金属性强弱的尺度
C.元素的电负性越大,表示其原子在化合物中吸引电子的能力越强
D.NaH的存在能支持可将氢元素放在第ⅦA族的观点
课堂练习
3.一般认为,如果两个成键元素的电负性差值大于1.7,它们通常形成离子键;如果两个成键元素的电负性差值小于1.7,它们通常形成共价键。查阅下列元素的电负性数值,判断下列化合物:
①NaF ②AlCl3 ③NO ④MgO ⑤BeCl2 ⑥CO2
(1)属于共价化合物的是_________(填序号,下同)。
(2)属于离子化合物的是_____。
元素 Al B Be C Cl F Li Mg N Na O P S Si
电负性 1.5 2.0 1.5 2.5 3.0 4.0 1.0 1.2 3.0 0.9 3.5 2.1 2.5 1.8
②③⑤⑥
①④
课 程 结 束
人教版高中化学选必二
