化学人教版(2019)选择性必修2 1.2.1原子结构与元素周期表 课件(共39张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 1.2.1原子结构与元素周期表 课件(共39张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 35.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 00:00:00 | ||
图片预览







文档简介
(共39张PPT)
第一节 原 子 结 构与元素的性质
1.2.1 原子结构与元素周期表
人教版高中化学选必二
课程导入-元素周期表
让我们结合原子结构再次认识元素周期表。
目录
03
元素周期系
01
元素周期表的分区
02
对角线规则
03
PART 01
·元素周期系·
SAFE USE EDUCATION
元素周期律
元素周期系
1.含义:
元素按其原子核电荷数递增排列的序列。
2.元素周期系的形成
元素周期系
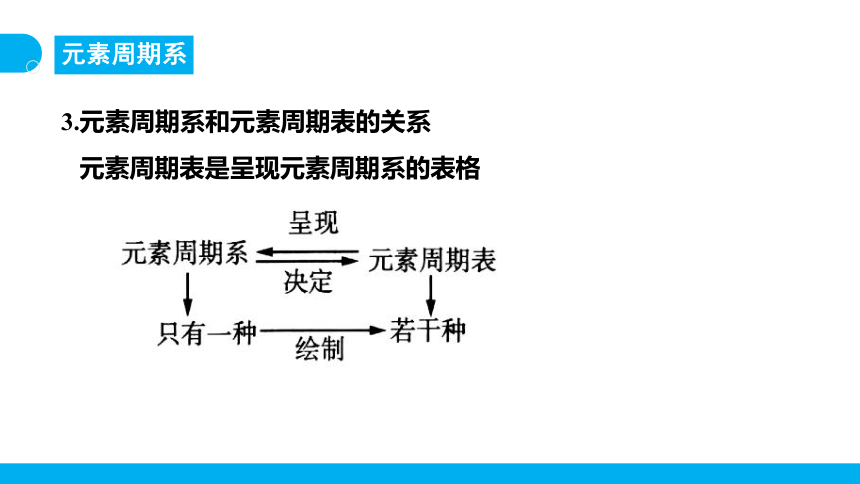
3.元素周期系和元素周期表的关系
元素周期表是呈现元素周期系的表格
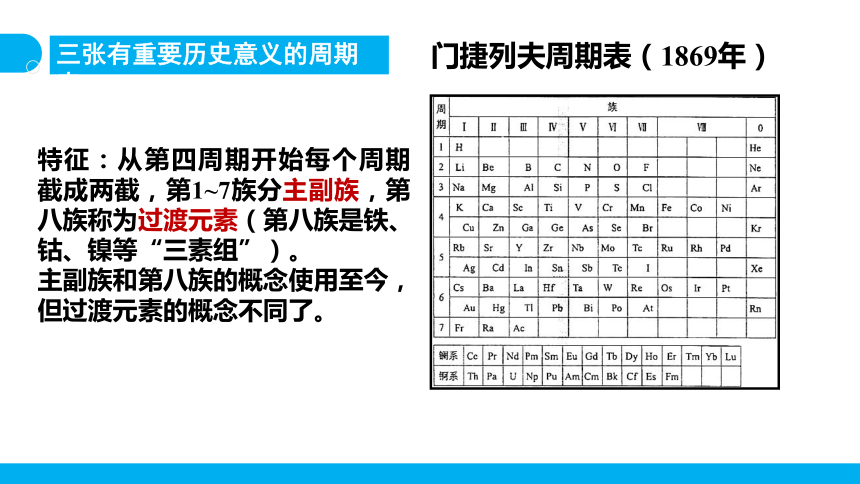
三张有重要历史意义的周期表
特征:从第四周期开始每个周期截成两截,第1~7族分主副族,第八族称为过渡元素(第八族是铁、钴、镍等“三素组”)。
主副族和第八族的概念使用至今,但过渡元素的概念不同了。
门捷列夫周期表(1869年)
维尔纳的特长式周期表(1905年)
每个周期一行,各族元素、过渡金属、稀有气体、镧系和锕系,各有各的位置,同族元素上下对齐。
三张有重要历史意义的周期表
维尔纳周期表前五个周期的元素种类被完全确定——2、8、8、18、18,但第六、七周期因镧系和锕系元素种类未知而未定。
现今的元素周期表与维尔纳周期表相似,但也有差异,如Be、Mg的位置不同。
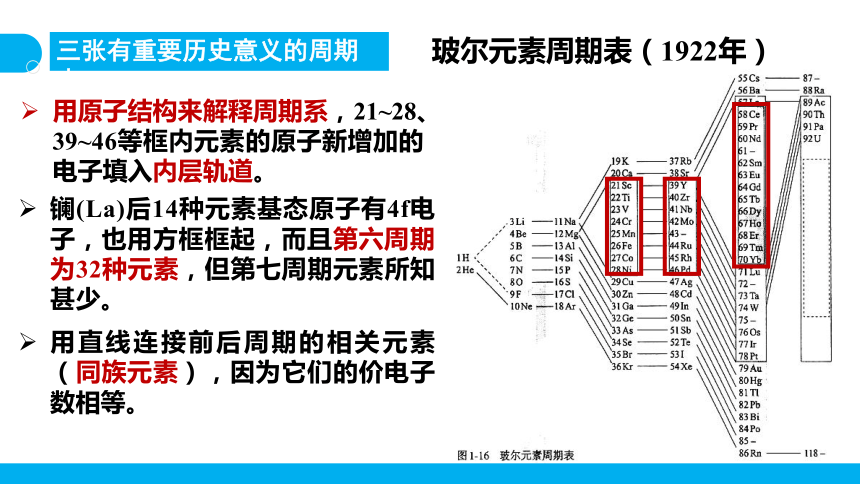
玻尔元素周期表(1922年)
用原子结构来解释周期系,21~28、39~46等框内元素的原子新增加的电子填入内层轨道。
三张有重要历史意义的周期表
镧(La)后14种元素基态原子有4f电子,也用方框框起,而且第六周期为32种元素,但第七周期元素所知甚少。
用直线连接前后周期的相关元素(同族元素),因为它们的价电子数相等。
构造原理与元素周期表
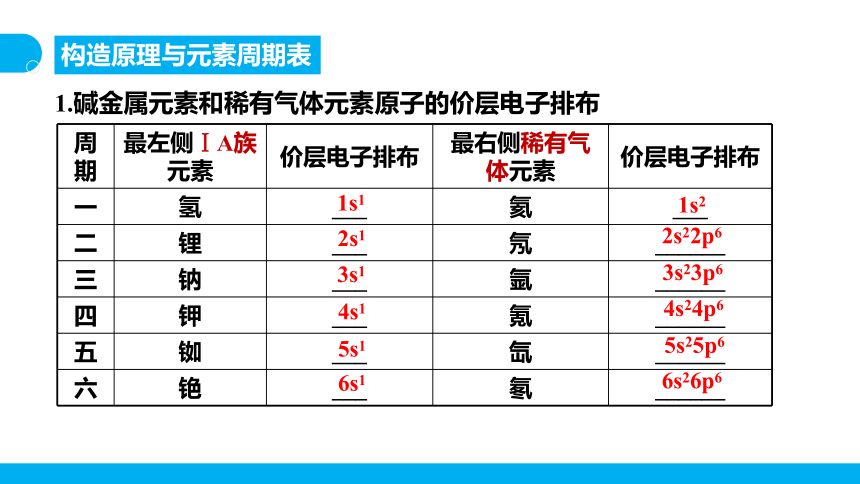
周期 最左侧ⅠA族元素 价层电子排布 最右侧稀有气体元素 价层电子排布
一 氢 ___ 氦 ___
二 锂 ___ 氖 ______
三 钠 ___ 氩 ______
四 钾 ___ 氪 ______
五 铷 ___ 氙 ______
六 铯 ___ 氡 ______
1s1
1s2
2s1
2s22p6
3s1
3s23p6
4s1
4s24p6
5s1
5s25p6
6s1
6s26p6
1.碱金属元素和稀有气体元素原子的价层电子排布
构造原理与元素周期表
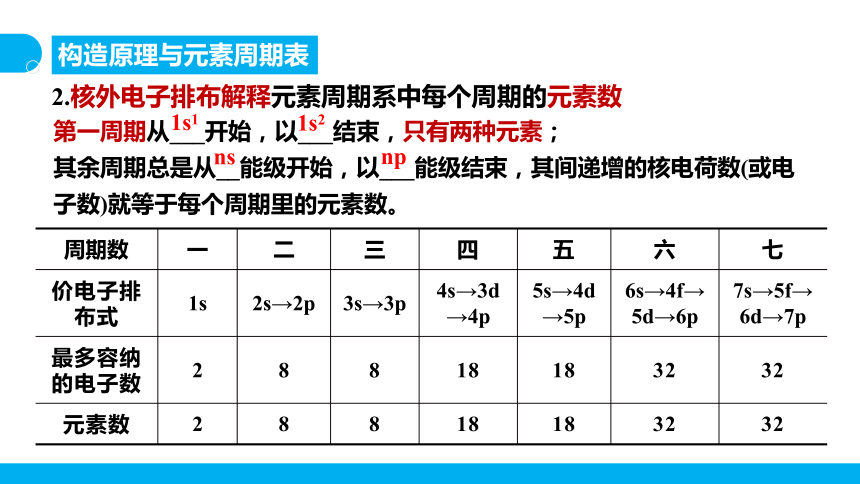
2.核外电子排布解释元素周期系中每个周期的元素数
第一周期从___开始,以___结束,只有两种元素;
其余周期总是从__能级开始,以___能级结束,其间递增的核电荷数(或电子数)就等于每个周期里的元素数。
1s1
1s2
ns
np
周期数 一 二 三 四 五 六 七
价电子排布式 1s 2s→2p 3s→3p 4s→3d→4p 5s→4d→5p 6s→4f→5d→6p 7s→5f→6d→7p
最多容纳的电子数 2 8 8 18 18 32 32
元素数 2 8 8 18 18 32 32
以一个方格代表一种元素,每个周期排一个横行,并按s、p、d、f分段,左侧对齐。
构造原理与元素周期表
构造原理与元素周期表
如何将下图变成书末的元素周期表?
p
f
d
s
s
p
s
d
p
f
s
d
p
d
s
p
p
s
s
【思考与讨论】
元素周期表
原因:它们的最外层电子数始终不超过2,即为ns1~2( Pd除外)。
1.同族元素价层电子数相等,是同族元素性质相似的结构基础。
最左侧第ⅠA族的基态原子最外层只有一个电子,即ns1;
最右侧稀有气体元素的基态原子除氦( 1s2)最外层均为8个电子,即ns2np6;
2.从第四周期开始的长周期,比短周期多出的元素均是金属元素。
第六、七周期比第四、五周期多出的14中元素的基态原子最外层也只有2个s电子,所以也是金属元素。
再探元素周期表——问题
1.元素周期表共有几个周期?每个周期有多少种元素?
为什么第一周期结尾元素的电子排布跟同族的其他周期元素的不同?
2.元素周期表共有多少列?各列的价层电子数各为多少?同列元素价层电子数是否相等 元素周期表可分为哪些族?族序有什么规律?
7 个
2,8,8,18,18,32,32
只有一个电子层,能级只有1s能级
18列
1 2 3(除镧系、 锕系外) 4 5 6 7 8 9 10
族序数 价层电子 排布通式 价层电子数 1 2 3 4 5 6 7 8 9 10
11 12 13 14 15 16 17 18
族序数 0(除氦外)
价层电子 排布通式
价层电子数 11 12 3 4 5 6 7 -
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
ns1
ns2
ns2np1
ns2np2
ns2np3
ns2np4
ns2np5
Ⅰ B
Ⅱ B
Ⅲ B
Ⅳ B
Ⅴ B
Ⅵ B
Ⅶ B
Ⅷ
(n-1)d1ns2
(n-1)d2ns2
(n-1)d3ns2
(n-1)d5ns1
(n-1)d5ns2
(n-1)d6~8ns2
(n-1)d10ns1
(n-1)d10ns2
ns2np6
主族序数=价层电子数
ⅢB-ⅦB:族序数 = 价层电子数
ⅠB-ⅡB:族序数 = 最外层电子数
再探元素周期表——问题
2. 同列元素价层电子数是否相等 元素周期表可分为哪些族?
相等(除0族中的He)
Ⅰ~ⅦA族、Ⅰ~ⅦB 和Ⅷ、0族
再探元素周期表——问题
1.为什么副族元素又称为过渡元素?
从金属元素过渡到非金属元素的中间元素
过渡元素价层电子数跟它们的族序数有什么关系?
ⅢB-ⅦB:族序数 = 价层电子数
ⅠB-ⅡB:族序数 = 最外层电子数
写出它们的价层电子排布通式。
(n-1)d1~10ns1~2
再探元素周期表——讨论
PART 02
·元素周期表的分区·
SAFE USE EDUCATION
元素周期表的分区
按电子排布,可把周期表里的元素划分成5个区。
除ds区(第ⅠB、第ⅡB族这2个纵列的元素的核外电子因先填满了 能级而后再填充 能级而得名ds区)外,各区( s区、d区、ds区、 p区)的名称来自按构造原理_____________的能级符号。
最后填入电子
讨论:(2)s区、d区、ds区、 p区分别有几个列?
s区有2列,d区有8列,ds区有2列、 p区有6列。
为什么s区(H除外)、d区、ds区的元素都是金属元素?
最外层电子数为1~2个( 始终不超过2 ),即为ns1-2(Pd例外),容易失去电子(H除外)
(n-1)d
ns
元素周期表的分区
包括元素 价电子排布 元素分类
s区 ⅠA、ⅡA族 ns1、ns2 活泼金属
p区 ⅢA~0族 ns2np1~6 大多为非金属
d区 ⅢB~Ⅷ族 (n-1)d1~9ns1~2 过渡元素
ds区 ⅠB、ⅡB族 (n-1)d10ns1~2 过渡元素
f区 镧系和锕系 (n-2)f0~14(n-1)d0~2ns2 过渡元素
(3)处于非金属与金属分界线上的元素常被称为半金属或类金属,为什么?
处于非金属与金属分界线上的元素:既能表现出一定的非金属性,又能表现出一定的金属性
再探元素周期表——讨论
(4)在周期表里找出Cr和Cu的价层电子。它们的价层电子排布符合构造原理吗?此外还有哪些元素的基态原子电子排布不符合构造原理?
Nb、Mo、Ru、Pd、Ag、Pt、Au等
(5)预言119号元素基态原子最外层电子排布,并预测第八周期有多少种元素。
8s1
50 种
价层电子填入的能级顺序:
8s → 5g → 6f → 7d → 8p
元素个数为:
2 + 18 + 14 + 10 + 6 = 50 种
再探元素周期表——讨论
由元素的价电子排布判断其在周期表中的位置的规律:
元素周期表的分区——练习
价电子排布 x或y的取值 周期表中位置
nsx x=1,2 第n周期xA族(说明:书写时,x、y应换成相应的罗马字母表示,下同)
ns2npx x=1,2,3,4,5 第n周期(2+x)A族
x=6 第n周期0族
(n-1)dxnsy x+y≤7 第n周期(x+y)B族
7(n-1)d10nsx x=1,2 第n周期xB族
元素周期表的分区——练习
下列各元素是主族元素还是副族元素?位于周期表的第几周期和哪个族?属于哪个区?
(1)1s22s22p63s23p5
(2)[Kr]4d105s25p2
(3)[Ar]3d34s2
(4)[Ar]3d104s1
(5)[Ar]4s1
主族
主族
副族
主族
副族
第三周期第ⅦA族
p区
第五周期第ⅣA族
p区
第四周期第ⅤB族
d区
第四周期第ⅠB族
ds区
第四周期第ⅠA族
s区
PART 03
·对角线规则·
SAFE USE EDUCATION
对角线规则
在元素周期表中,某些主族元素与其右下方的主族元素(如图)的有些性质是相似的(如锂和镁在过量的氧气中燃烧均生成正常氧化物,而不是过氧化物)。
b.在过量的氧气中燃烧均生成正常氧化物,而不是过氧化物,并且Li2O和MgO与水反应都十分缓慢。
元素 Li Na Be Mg
沸点/℃ 1 341 881.4 2 467 1 100
1.锂和镁的相似性
a.锂与镁的沸点较为接近:
对角线规则
1.锂和镁的相似性
c. 能直接与氮气反应:
d. 锂和镁的氢氧化物加热分解:
生成相应的氮化物Li3N和Mg3N2。
Li2O、H2O和MgO、H2O。
e. 在碱金属的氟化物、碳酸盐和磷酸盐中:
只有锂盐是难溶于水的,
相应的镁盐也难溶于水。
对角线规则
2.铍和铝的相似性
(2)都可与酸、碱反应放出氢气
(3)铍在浓硝酸中也发生钝化
(1)二者的氧化物Al2O3和BeO的熔点和硬度都很高
对角线规则
3.硼和硅的相似性
1. 自然界中B与Si均以化合物的形式存在。
2. B与Si的单质都易与强碱反应,且不与稀酸反应:
2B+2KOH+2H2O = 2KBO2+3H2↑
Si+2KOH+H2O= K2SiO3+2H2↑
课堂小结
元素周期表、元素周期系、元素周期律
元素性质随着________递增发生周期性的重复
元素按原子__________递增排列的序列
核电荷数
呈现元素周期系的表格
元素周期系只有一个,
元素周期表多种多样。
构造原理与元素周期表
对角线规则
原子序数
周期序数=基态原子的能层数
某些主族元素与其右下方的主族元素
有些性质是相似的。
ⅢB-ⅦB:族序数 = 价层电子数
ⅠB-ⅡB:族序数 = 最外层电子数
Ⅰ A-ⅦA:族序数 = 价层电子数
族序数
课堂练习
1.正误判断
(1)价层电子一定是最外层电子( )
(2)元素的价层电子数一定等于其所在族的族序数( )
(3)同一族元素的价层电子数一定相同( )
(4)基态原子的N层上只有一个电子的元素,一定是第ⅠA族元素( )
(5)基态原子的价层电子排布为(n-1)d6~8ns2的元素一定是过渡元素( )
×
×
×
×
√
课堂练习
√
2.若某原子的价层电子排布式为4d15s2,则下列说法正确的是
A.该元素位于元素周期表中第五周期第ⅢB族
B.该元素原子价层电子数为2
C.该元素为非金属元素
D.该元素原子N能层共有8个电子
课堂练习
√
3.下列关于元素在元素周期表中的位置以及元素原子的价层电子排布特点的有关叙述正确的是
A.Cu位于元素周期表中第四周期第ⅠB族,属于ds区元素
B.O的基态原子中,2p能级为半充满,属于p区元素
C.最外层电子排布式为4s1,一定属于第ⅠA族
D.最外层电子排布式为ns2np1,该元素可能是
第ⅢA族或第ⅢB族
课堂练习
√
4.下列叙述正确的是
A.除0族元素外,短周期元素的最高化合价在数值上都等于该元素所属
的族序数
B.除短周期外,其他周期均有18种元素
C.副族元素中没有非金属元素
D.碱金属元素是指第ⅠA族的所有元素
课堂练习
5.在研究原子核外电子排布与元素周期表的关系时,人们发现价层电子排布相似的元素集中在一起。据此,人们将元素
周期表分为5个区,如图所示。请回答下列问题:
(1)在s区中,族序数最大、原子序数最小的元素,其原子的价层电子的电子云轮廓图为________。
球形
(2)在d区中,族序数最大、原子序数最小的元素,其常见离子的电子排布式为______________________________________________,其中较稳定的是_____。
Fe2+:1s22s22p63s23p63d6、Fe3+:1s22s22p63s23p63d5
Fe3+
课堂练习
(3)在ds区中,族序数最大、原子序数最小的元素,其原子的价层电子排布式为________。
3d104s2
(4)在p区中,第二周期第ⅤA族元素原子的价层
电子的轨道表示式为____________________。
(5)当今常用于核能开发的元素是铀和钚,它们在___区中。
f
课 程 结 束
人教版高中化学选必二
第一节 原 子 结 构与元素的性质
1.2.1 原子结构与元素周期表
人教版高中化学选必二
课程导入-元素周期表
让我们结合原子结构再次认识元素周期表。
目录
03
元素周期系
01
元素周期表的分区
02
对角线规则
03
PART 01
·元素周期系·
SAFE USE EDUCATION
元素周期律
元素周期系
1.含义:
元素按其原子核电荷数递增排列的序列。
2.元素周期系的形成
元素周期系
3.元素周期系和元素周期表的关系
元素周期表是呈现元素周期系的表格
三张有重要历史意义的周期表
特征:从第四周期开始每个周期截成两截,第1~7族分主副族,第八族称为过渡元素(第八族是铁、钴、镍等“三素组”)。
主副族和第八族的概念使用至今,但过渡元素的概念不同了。
门捷列夫周期表(1869年)
维尔纳的特长式周期表(1905年)
每个周期一行,各族元素、过渡金属、稀有气体、镧系和锕系,各有各的位置,同族元素上下对齐。
三张有重要历史意义的周期表
维尔纳周期表前五个周期的元素种类被完全确定——2、8、8、18、18,但第六、七周期因镧系和锕系元素种类未知而未定。
现今的元素周期表与维尔纳周期表相似,但也有差异,如Be、Mg的位置不同。
玻尔元素周期表(1922年)
用原子结构来解释周期系,21~28、39~46等框内元素的原子新增加的电子填入内层轨道。
三张有重要历史意义的周期表
镧(La)后14种元素基态原子有4f电子,也用方框框起,而且第六周期为32种元素,但第七周期元素所知甚少。
用直线连接前后周期的相关元素(同族元素),因为它们的价电子数相等。
构造原理与元素周期表
周期 最左侧ⅠA族元素 价层电子排布 最右侧稀有气体元素 价层电子排布
一 氢 ___ 氦 ___
二 锂 ___ 氖 ______
三 钠 ___ 氩 ______
四 钾 ___ 氪 ______
五 铷 ___ 氙 ______
六 铯 ___ 氡 ______
1s1
1s2
2s1
2s22p6
3s1
3s23p6
4s1
4s24p6
5s1
5s25p6
6s1
6s26p6
1.碱金属元素和稀有气体元素原子的价层电子排布
构造原理与元素周期表
2.核外电子排布解释元素周期系中每个周期的元素数
第一周期从___开始,以___结束,只有两种元素;
其余周期总是从__能级开始,以___能级结束,其间递增的核电荷数(或电子数)就等于每个周期里的元素数。
1s1
1s2
ns
np
周期数 一 二 三 四 五 六 七
价电子排布式 1s 2s→2p 3s→3p 4s→3d→4p 5s→4d→5p 6s→4f→5d→6p 7s→5f→6d→7p
最多容纳的电子数 2 8 8 18 18 32 32
元素数 2 8 8 18 18 32 32
以一个方格代表一种元素,每个周期排一个横行,并按s、p、d、f分段,左侧对齐。
构造原理与元素周期表
构造原理与元素周期表
如何将下图变成书末的元素周期表?
p
f
d
s
s
p
s
d
p
f
s
d
p
d
s
p
p
s
s
【思考与讨论】
元素周期表
原因:它们的最外层电子数始终不超过2,即为ns1~2( Pd除外)。
1.同族元素价层电子数相等,是同族元素性质相似的结构基础。
最左侧第ⅠA族的基态原子最外层只有一个电子,即ns1;
最右侧稀有气体元素的基态原子除氦( 1s2)最外层均为8个电子,即ns2np6;
2.从第四周期开始的长周期,比短周期多出的元素均是金属元素。
第六、七周期比第四、五周期多出的14中元素的基态原子最外层也只有2个s电子,所以也是金属元素。
再探元素周期表——问题
1.元素周期表共有几个周期?每个周期有多少种元素?
为什么第一周期结尾元素的电子排布跟同族的其他周期元素的不同?
2.元素周期表共有多少列?各列的价层电子数各为多少?同列元素价层电子数是否相等 元素周期表可分为哪些族?族序有什么规律?
7 个
2,8,8,18,18,32,32
只有一个电子层,能级只有1s能级
18列
1 2 3(除镧系、 锕系外) 4 5 6 7 8 9 10
族序数 价层电子 排布通式 价层电子数 1 2 3 4 5 6 7 8 9 10
11 12 13 14 15 16 17 18
族序数 0(除氦外)
价层电子 排布通式
价层电子数 11 12 3 4 5 6 7 -
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
ns1
ns2
ns2np1
ns2np2
ns2np3
ns2np4
ns2np5
Ⅰ B
Ⅱ B
Ⅲ B
Ⅳ B
Ⅴ B
Ⅵ B
Ⅶ B
Ⅷ
(n-1)d1ns2
(n-1)d2ns2
(n-1)d3ns2
(n-1)d5ns1
(n-1)d5ns2
(n-1)d6~8ns2
(n-1)d10ns1
(n-1)d10ns2
ns2np6
主族序数=价层电子数
ⅢB-ⅦB:族序数 = 价层电子数
ⅠB-ⅡB:族序数 = 最外层电子数
再探元素周期表——问题
2. 同列元素价层电子数是否相等 元素周期表可分为哪些族?
相等(除0族中的He)
Ⅰ~ⅦA族、Ⅰ~ⅦB 和Ⅷ、0族
再探元素周期表——问题
1.为什么副族元素又称为过渡元素?
从金属元素过渡到非金属元素的中间元素
过渡元素价层电子数跟它们的族序数有什么关系?
ⅢB-ⅦB:族序数 = 价层电子数
ⅠB-ⅡB:族序数 = 最外层电子数
写出它们的价层电子排布通式。
(n-1)d1~10ns1~2
再探元素周期表——讨论
PART 02
·元素周期表的分区·
SAFE USE EDUCATION
元素周期表的分区
按电子排布,可把周期表里的元素划分成5个区。
除ds区(第ⅠB、第ⅡB族这2个纵列的元素的核外电子因先填满了 能级而后再填充 能级而得名ds区)外,各区( s区、d区、ds区、 p区)的名称来自按构造原理_____________的能级符号。
最后填入电子
讨论:(2)s区、d区、ds区、 p区分别有几个列?
s区有2列,d区有8列,ds区有2列、 p区有6列。
为什么s区(H除外)、d区、ds区的元素都是金属元素?
最外层电子数为1~2个( 始终不超过2 ),即为ns1-2(Pd例外),容易失去电子(H除外)
(n-1)d
ns
元素周期表的分区
包括元素 价电子排布 元素分类
s区 ⅠA、ⅡA族 ns1、ns2 活泼金属
p区 ⅢA~0族 ns2np1~6 大多为非金属
d区 ⅢB~Ⅷ族 (n-1)d1~9ns1~2 过渡元素
ds区 ⅠB、ⅡB族 (n-1)d10ns1~2 过渡元素
f区 镧系和锕系 (n-2)f0~14(n-1)d0~2ns2 过渡元素
(3)处于非金属与金属分界线上的元素常被称为半金属或类金属,为什么?
处于非金属与金属分界线上的元素:既能表现出一定的非金属性,又能表现出一定的金属性
再探元素周期表——讨论
(4)在周期表里找出Cr和Cu的价层电子。它们的价层电子排布符合构造原理吗?此外还有哪些元素的基态原子电子排布不符合构造原理?
Nb、Mo、Ru、Pd、Ag、Pt、Au等
(5)预言119号元素基态原子最外层电子排布,并预测第八周期有多少种元素。
8s1
50 种
价层电子填入的能级顺序:
8s → 5g → 6f → 7d → 8p
元素个数为:
2 + 18 + 14 + 10 + 6 = 50 种
再探元素周期表——讨论
由元素的价电子排布判断其在周期表中的位置的规律:
元素周期表的分区——练习
价电子排布 x或y的取值 周期表中位置
nsx x=1,2 第n周期xA族(说明:书写时,x、y应换成相应的罗马字母表示,下同)
ns2npx x=1,2,3,4,5 第n周期(2+x)A族
x=6 第n周期0族
(n-1)dxnsy x+y≤7 第n周期(x+y)B族
7
元素周期表的分区——练习
下列各元素是主族元素还是副族元素?位于周期表的第几周期和哪个族?属于哪个区?
(1)1s22s22p63s23p5
(2)[Kr]4d105s25p2
(3)[Ar]3d34s2
(4)[Ar]3d104s1
(5)[Ar]4s1
主族
主族
副族
主族
副族
第三周期第ⅦA族
p区
第五周期第ⅣA族
p区
第四周期第ⅤB族
d区
第四周期第ⅠB族
ds区
第四周期第ⅠA族
s区
PART 03
·对角线规则·
SAFE USE EDUCATION
对角线规则
在元素周期表中,某些主族元素与其右下方的主族元素(如图)的有些性质是相似的(如锂和镁在过量的氧气中燃烧均生成正常氧化物,而不是过氧化物)。
b.在过量的氧气中燃烧均生成正常氧化物,而不是过氧化物,并且Li2O和MgO与水反应都十分缓慢。
元素 Li Na Be Mg
沸点/℃ 1 341 881.4 2 467 1 100
1.锂和镁的相似性
a.锂与镁的沸点较为接近:
对角线规则
1.锂和镁的相似性
c. 能直接与氮气反应:
d. 锂和镁的氢氧化物加热分解:
生成相应的氮化物Li3N和Mg3N2。
Li2O、H2O和MgO、H2O。
e. 在碱金属的氟化物、碳酸盐和磷酸盐中:
只有锂盐是难溶于水的,
相应的镁盐也难溶于水。
对角线规则
2.铍和铝的相似性
(2)都可与酸、碱反应放出氢气
(3)铍在浓硝酸中也发生钝化
(1)二者的氧化物Al2O3和BeO的熔点和硬度都很高
对角线规则
3.硼和硅的相似性
1. 自然界中B与Si均以化合物的形式存在。
2. B与Si的单质都易与强碱反应,且不与稀酸反应:
2B+2KOH+2H2O = 2KBO2+3H2↑
Si+2KOH+H2O= K2SiO3+2H2↑
课堂小结
元素周期表、元素周期系、元素周期律
元素性质随着________递增发生周期性的重复
元素按原子__________递增排列的序列
核电荷数
呈现元素周期系的表格
元素周期系只有一个,
元素周期表多种多样。
构造原理与元素周期表
对角线规则
原子序数
周期序数=基态原子的能层数
某些主族元素与其右下方的主族元素
有些性质是相似的。
ⅢB-ⅦB:族序数 = 价层电子数
ⅠB-ⅡB:族序数 = 最外层电子数
Ⅰ A-ⅦA:族序数 = 价层电子数
族序数
课堂练习
1.正误判断
(1)价层电子一定是最外层电子( )
(2)元素的价层电子数一定等于其所在族的族序数( )
(3)同一族元素的价层电子数一定相同( )
(4)基态原子的N层上只有一个电子的元素,一定是第ⅠA族元素( )
(5)基态原子的价层电子排布为(n-1)d6~8ns2的元素一定是过渡元素( )
×
×
×
×
√
课堂练习
√
2.若某原子的价层电子排布式为4d15s2,则下列说法正确的是
A.该元素位于元素周期表中第五周期第ⅢB族
B.该元素原子价层电子数为2
C.该元素为非金属元素
D.该元素原子N能层共有8个电子
课堂练习
√
3.下列关于元素在元素周期表中的位置以及元素原子的价层电子排布特点的有关叙述正确的是
A.Cu位于元素周期表中第四周期第ⅠB族,属于ds区元素
B.O的基态原子中,2p能级为半充满,属于p区元素
C.最外层电子排布式为4s1,一定属于第ⅠA族
D.最外层电子排布式为ns2np1,该元素可能是
第ⅢA族或第ⅢB族
课堂练习
√
4.下列叙述正确的是
A.除0族元素外,短周期元素的最高化合价在数值上都等于该元素所属
的族序数
B.除短周期外,其他周期均有18种元素
C.副族元素中没有非金属元素
D.碱金属元素是指第ⅠA族的所有元素
课堂练习
5.在研究原子核外电子排布与元素周期表的关系时,人们发现价层电子排布相似的元素集中在一起。据此,人们将元素
周期表分为5个区,如图所示。请回答下列问题:
(1)在s区中,族序数最大、原子序数最小的元素,其原子的价层电子的电子云轮廓图为________。
球形
(2)在d区中,族序数最大、原子序数最小的元素,其常见离子的电子排布式为______________________________________________,其中较稳定的是_____。
Fe2+:1s22s22p63s23p63d6、Fe3+:1s22s22p63s23p63d5
Fe3+
课堂练习
(3)在ds区中,族序数最大、原子序数最小的元素,其原子的价层电子排布式为________。
3d104s2
(4)在p区中,第二周期第ⅤA族元素原子的价层
电子的轨道表示式为____________________。
(5)当今常用于核能开发的元素是铀和钚,它们在___区中。
f
课 程 结 束
人教版高中化学选必二
