化学人教版(2019)必修第一册2.3.1物质的量(共30张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.3.1物质的量(共30张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 38.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 21:43:51 | ||
图片预览









文档简介
(共30张PPT)
第二章 第三节 物质的量
第一课时
思考与讨论
如何称量一粒米的质量?
聚少成多
把微小物质聚集成“一堆”,便于计数或称量
如何测得一个水分子的质量呢?
类比
迁移
一个水分子太小而难以称量,可以将很多个水分子聚集成“一堆”
宏观物质
(可见、可称量等)
微观粒子
(难见、难称量)
物质的量
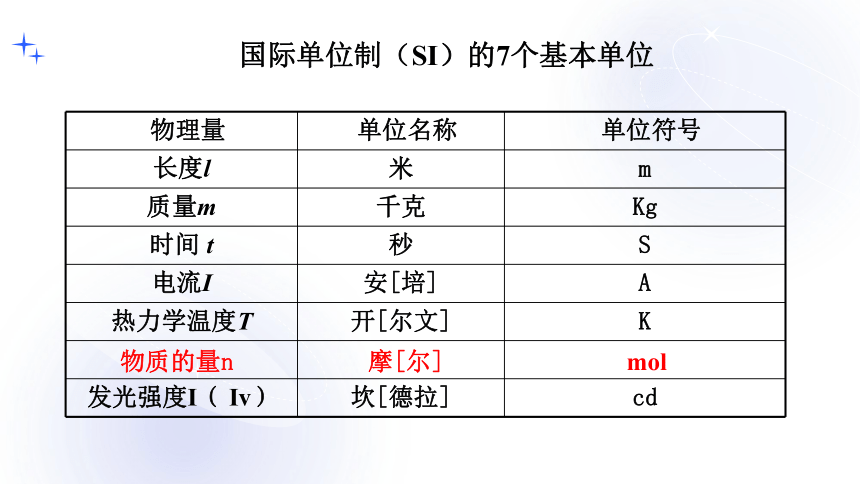
国际单位制(SI)的7个基本单位
物理量 单位名称 单位符号
长度l 米 m
质量m 千克 Kg
时间 t 秒 S
电流I 安[培] A
热力学温度T 开[尔文] K
发光强度I( Iv) 坎[德拉] cd
物质的量n
摩[尔]
mol
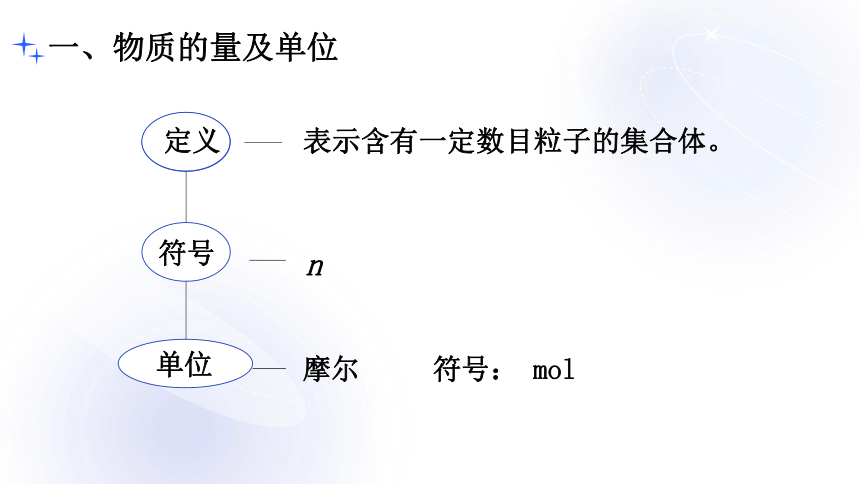
一、物质的量及单位
表示含有一定数目粒子的集合体。
符号
单位
摩尔 符号: mol
n
定义
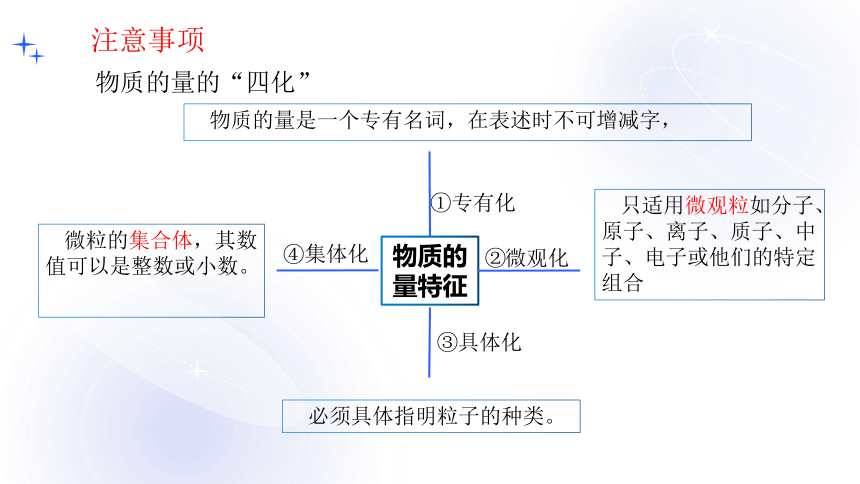
物质的量特征
①专有化
微观化
②
具体化
③
集体化
④
只适用微观粒如分子、原子、离子、质子、中子、电子或他们的特定组合
必须具体指明粒子的种类。
微粒的集合体,其数值可以是整数或小数。
注意事项
物质的量的“四化”
物质的量是一个专有名词,在表述时不可增减字,
练习1.判断下列说法是否正确:
(1)物质的量就是物质的质量( )
(2)摩尔是7个基本物理量之一( )
(3)1mol沙子( ) (4)1mol钠元素( )
(5)1mol氢( ) (6)0.5molH( )
×
×
×
√
×
表达式(数字+单位+微粒名称)
5 molH 2 molH2O 0.2 molOH-
×
铅笔12支
一打手套
一打啤酒
一打笔记本
一打铅笔
一打鸡蛋
那么,1 mol微观粒子是多少个呢?
国际上规定:1mol 粒子集合体所含粒子数约为6.02×1023
1 摩尔的标准:1971年,第14届国际计量大会上,规定0.012 kg12C中所含的碳原子数作为1mol的标准。
1 mol粒子集体所含的粒子数
= 0.012 kg12C中所含的碳原子数
2018年11月16日 ,第26届国际计量大会决定不再以任何物质为标准,而是以常数的方式定义“物质的量”:规定包含6.02214076×10 (约为6.02×10 )个微粒的集合体为1mol的标准。
1mol 粒子集合体所含粒子数约为6.02×1023
二、阿伏加德罗常数
1mol 任何粒子的粒子数
符号
定义
NA
约为6.02×1023 (近似值)
国际上规定:
单位
数值
mol-1
②假如现有 6.02×1023 块钱,分给全国14亿人花,每人每天花一百万, 可以花118万年!
①如果有 6.02×1023 粒米让全球60亿人吃,每人每天吃10斤,可吃1万4千年!
探究交流
粒子(H2O)(个) 物质的量(mol)
1 mol 水分子
2 mol 水分子
3 mol 水分子
2 X 6.02×1023
3 X 6.02×1023
1 X 6.02×1023
物质的量(n)、粒子数(N)与阿伏加德罗常数(NA)的关系
三、
n =
N
NA
NA=
N
n
N =n·NA
H2O -------- 2H -------- O
1×6.02×1023 2×6.02×1023 1×6.02×1023
1mol 2mol 1mol
1个 2个 1个
粒子数之比等于物质的量之比
n1
n2
=
N1
N2
例1:1 mol H2 含约 个氢分子, 个氢原子, mol 氢原子。
0.5 mol H2SO4 中含 mol 氢原子, mol 硫原子,约
个 氧原子。
6.02 x 1023
1.204 x 1024
2
1
0.5
1.204 x 1024
下图为课本第55页 图2-21 1mol几种物质的质量,你发现了1mol不同物质的质量有什么规律?
结论:1mol 任何粒子或物质的质量以克为单位时,在数值都与该粒子的相对原子质量或相对分子质量相等。
1mol物质的质量到底有多大?
作为相对原子质量标准的碳12,当碳原子的质量为12 g时,则碳原子约为6.02×1023 。
1 mol C 的质量为12 g
1 mol C其质量为12 g
C的相对原子质量为12
以克为单位,两者在数值上相等
三、摩尔质量
1.定义:
4.数值:
2.符号:
3.常用单位:
单位物质的量的物质所具有的质量叫做摩尔质量。
g/mol(或 g·mol-1 )
M
摩尔质量以g·mol-1为单位时,数值等于其相对原子质量或相对分子质量。
相对分子(原子)质量
Na
CO2
H2O
NaCl
CO32-
SO42-
摩尔质量
23
23 g·mol-1
44
44 g·mol-1
18
18 g·mol-1
58.5
58.5g·mol-1
60
60 g·mol-1
96
96 g·mol-1
探究交流
粒子(C)质量/g 物质的量(mol)
1 mol C
2 mol C
3 mol C
2 X 12
3 X 12
12
物质的量(n)、物质的质量(m)与摩尔质量(M)的关系
三、
n =
m
M
M=
m
n
m =n·M
练习
(1) 3mol H2的质量是___________
(2) 2.5mol O2的质量是___________
(3) 60g NaOH的物质的量是___________
(4) 49g H2SO4的物质的量是___________
80 g
6 g
1.5mol
0.5mol
(5)下列叙述正确的是( )
A.物质的摩尔质量等于其相对分子(原子)质量
B.1 mol CO2的质量为44 g·mol-1
C.SO42-的摩尔质量为96 g·mol-1
D.2 mol H2O的摩尔质量是1 mol H2O的摩尔质量的2倍
C
18克水中含有多少个水分子?
质量(m)
粒子个数(N)
物质的量(n)
物质的量
宏观物质
微观粒子
质量(m)
÷ NA
×NA
×M
÷ M
粒子数(N)
(1)3.6gH2O的物质的量是 ,含有约
个水分子。
(2)3.01×1023个OH-的物质的量为 ,
质量为 ,
0.2 mol
1. 204×1023
0.5 mol
8.5g
课堂小结
微观粒子数(N)
宏观物质质量(m)
物质的量
桥梁
n
m
N
M
NA
NA
M
某原子的摩尔质量是M g·mol-1,则一个该原子的真实质量约为 ( )
A.M g
C
练习巩固
THANK YOU
第二章 第三节 物质的量
第一课时
思考与讨论
如何称量一粒米的质量?
聚少成多
把微小物质聚集成“一堆”,便于计数或称量
如何测得一个水分子的质量呢?
类比
迁移
一个水分子太小而难以称量,可以将很多个水分子聚集成“一堆”
宏观物质
(可见、可称量等)
微观粒子
(难见、难称量)
物质的量
国际单位制(SI)的7个基本单位
物理量 单位名称 单位符号
长度l 米 m
质量m 千克 Kg
时间 t 秒 S
电流I 安[培] A
热力学温度T 开[尔文] K
发光强度I( Iv) 坎[德拉] cd
物质的量n
摩[尔]
mol
一、物质的量及单位
表示含有一定数目粒子的集合体。
符号
单位
摩尔 符号: mol
n
定义
物质的量特征
①专有化
微观化
②
具体化
③
集体化
④
只适用微观粒如分子、原子、离子、质子、中子、电子或他们的特定组合
必须具体指明粒子的种类。
微粒的集合体,其数值可以是整数或小数。
注意事项
物质的量的“四化”
物质的量是一个专有名词,在表述时不可增减字,
练习1.判断下列说法是否正确:
(1)物质的量就是物质的质量( )
(2)摩尔是7个基本物理量之一( )
(3)1mol沙子( ) (4)1mol钠元素( )
(5)1mol氢( ) (6)0.5molH( )
×
×
×
√
×
表达式(数字+单位+微粒名称)
5 molH 2 molH2O 0.2 molOH-
×
铅笔12支
一打手套
一打啤酒
一打笔记本
一打铅笔
一打鸡蛋
那么,1 mol微观粒子是多少个呢?
国际上规定:1mol 粒子集合体所含粒子数约为6.02×1023
1 摩尔的标准:1971年,第14届国际计量大会上,规定0.012 kg12C中所含的碳原子数作为1mol的标准。
1 mol粒子集体所含的粒子数
= 0.012 kg12C中所含的碳原子数
2018年11月16日 ,第26届国际计量大会决定不再以任何物质为标准,而是以常数的方式定义“物质的量”:规定包含6.02214076×10 (约为6.02×10 )个微粒的集合体为1mol的标准。
1mol 粒子集合体所含粒子数约为6.02×1023
二、阿伏加德罗常数
1mol 任何粒子的粒子数
符号
定义
NA
约为6.02×1023 (近似值)
国际上规定:
单位
数值
mol-1
②假如现有 6.02×1023 块钱,分给全国14亿人花,每人每天花一百万, 可以花118万年!
①如果有 6.02×1023 粒米让全球60亿人吃,每人每天吃10斤,可吃1万4千年!
探究交流
粒子(H2O)(个) 物质的量(mol)
1 mol 水分子
2 mol 水分子
3 mol 水分子
2 X 6.02×1023
3 X 6.02×1023
1 X 6.02×1023
物质的量(n)、粒子数(N)与阿伏加德罗常数(NA)的关系
三、
n =
N
NA
NA=
N
n
N =n·NA
H2O -------- 2H -------- O
1×6.02×1023 2×6.02×1023 1×6.02×1023
1mol 2mol 1mol
1个 2个 1个
粒子数之比等于物质的量之比
n1
n2
=
N1
N2
例1:1 mol H2 含约 个氢分子, 个氢原子, mol 氢原子。
0.5 mol H2SO4 中含 mol 氢原子, mol 硫原子,约
个 氧原子。
6.02 x 1023
1.204 x 1024
2
1
0.5
1.204 x 1024
下图为课本第55页 图2-21 1mol几种物质的质量,你发现了1mol不同物质的质量有什么规律?
结论:1mol 任何粒子或物质的质量以克为单位时,在数值都与该粒子的相对原子质量或相对分子质量相等。
1mol物质的质量到底有多大?
作为相对原子质量标准的碳12,当碳原子的质量为12 g时,则碳原子约为6.02×1023 。
1 mol C 的质量为12 g
1 mol C其质量为12 g
C的相对原子质量为12
以克为单位,两者在数值上相等
三、摩尔质量
1.定义:
4.数值:
2.符号:
3.常用单位:
单位物质的量的物质所具有的质量叫做摩尔质量。
g/mol(或 g·mol-1 )
M
摩尔质量以g·mol-1为单位时,数值等于其相对原子质量或相对分子质量。
相对分子(原子)质量
Na
CO2
H2O
NaCl
CO32-
SO42-
摩尔质量
23
23 g·mol-1
44
44 g·mol-1
18
18 g·mol-1
58.5
58.5g·mol-1
60
60 g·mol-1
96
96 g·mol-1
探究交流
粒子(C)质量/g 物质的量(mol)
1 mol C
2 mol C
3 mol C
2 X 12
3 X 12
12
物质的量(n)、物质的质量(m)与摩尔质量(M)的关系
三、
n =
m
M
M=
m
n
m =n·M
练习
(1) 3mol H2的质量是___________
(2) 2.5mol O2的质量是___________
(3) 60g NaOH的物质的量是___________
(4) 49g H2SO4的物质的量是___________
80 g
6 g
1.5mol
0.5mol
(5)下列叙述正确的是( )
A.物质的摩尔质量等于其相对分子(原子)质量
B.1 mol CO2的质量为44 g·mol-1
C.SO42-的摩尔质量为96 g·mol-1
D.2 mol H2O的摩尔质量是1 mol H2O的摩尔质量的2倍
C
18克水中含有多少个水分子?
质量(m)
粒子个数(N)
物质的量(n)
物质的量
宏观物质
微观粒子
质量(m)
÷ NA
×NA
×M
÷ M
粒子数(N)
(1)3.6gH2O的物质的量是 ,含有约
个水分子。
(2)3.01×1023个OH-的物质的量为 ,
质量为 ,
0.2 mol
1. 204×1023
0.5 mol
8.5g
课堂小结
微观粒子数(N)
宏观物质质量(m)
物质的量
桥梁
n
m
N
M
NA
NA
M
某原子的摩尔质量是M g·mol-1,则一个该原子的真实质量约为 ( )
A.M g
C
练习巩固
THANK YOU
