3.1氯气及氯的化合物 同步练习(含答案) 2023-2024学年高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 3.1氯气及氯的化合物 同步练习(含答案) 2023-2024学年高一上学期化学苏教版(2019)必修第一册 |
|
|
| 格式 | docx | ||
| 文件大小 | 353.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 00:00:00 | ||
图片预览


文档简介
3.1氯气及氯的化合物
1.Cl2是常见的氧化剂,可氧化Fe2+、Br-、I-等离子,且已知还原性顺序是:I->Fe2+>Br->Cl-。在FeI2和FeBr2混合溶液中,通入一定量Cl2,溶液中存在的离子组不合理的是( )
A.Fe3+、Br-、Cl- B.Fe2+、Cl-、I-
C.Fe2+、Br-、Cl- D.Fe2+、Br-、Cl-、I-
2.下列反应中,既属于氧化还原反应同时又是吸热反应的是( )
A.灼热的炭与CO2反应 B.铝与盐酸的反应
C.Ba(OH)2 8H2O与NH4Cl反应 D.酸碱中和反应
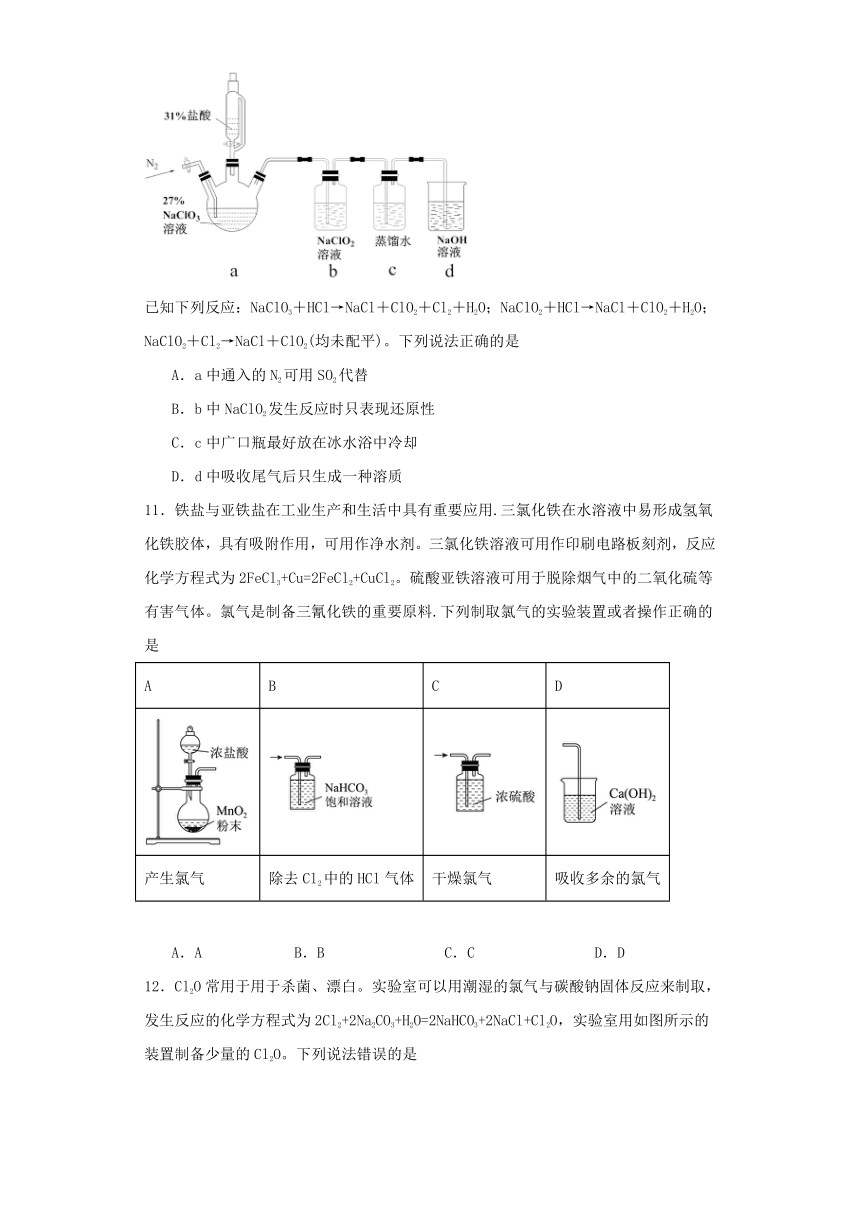
3.用如图装置进行实验,将A中浓盐酸逐滴加入到固体B(KMnO4)中,下列叙述正确的是
A.装置D可起到防倒吸作用
B.若C中盛紫色石蕊溶液,溶液变红
C.若C中盛饱和NaCl溶液,无明显现象
D.若C中盛少量淀粉碘化钾溶液,溶液一定变蓝
4.下列关于氯及其化合物的说法中正确的是
A.Cl2的氧化性很强,铁丝在氯气中燃烧产生大量白烟,产物为FeCl3
B.H2在Cl2中燃烧,火焰呈苍白色,工业上利用该反应原理生产盐酸
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有HClO
D.将氯水滴在pH试纸上一定显红色,因为氯水中含有HCl
5.将氯气持续通入紫色石蕊试液中,颜色变化为:紫色浅红色无色黄绿色,导致变色的微粒I、II、III依次为
A.HCl、HClO、Cl2 B.H+、ClO-、Cl-
C.HCl、ClO-、Cl- D.H+、HClO、Cl2
6.制备单质硅时,主要化学反应如下:
①SiO2+2CSi+2CO↑
②Si+2Cl2SiCl4
③SiCl4+2H2Si+4HCl
下列对上述三个反应的叙述中,不正确的是
A.①③为置换反应
B.①②③均为氧化还原反应
C.②为化合反应
D.三个反应的反应物中硅元素化合价均升高
7.下列物质既能由金属和盐酸反应获得,也能通过金属和氯气反应获得的是
A.CuCl2 B.FeCl2 C.FeCl3 D.MgCl2
8.用自来水养金鱼时,通常先将自来水经日晒一段时间后,再注入鱼缸,其目的是( )
A.利用紫外线杀死水中的细菌 B.提高水温,有利于金鱼生长
C.增加水中氧气的含量 D.促使水中的次氯酸分解
9.2023年3月,“三星堆”遗址考古又发掘出大量青铜器。火法炼铜主要发生的反应为 ,下列说法不正确的是
A.中铜的化合价为+1 B.该反应为置换反应
C.中的铜元素被还原 D.反应中的氧化剂仅为
10.ClO2是一种极易溶于水且几乎不与冷水反应的黄绿色气体(沸点11℃),实验室制备纯净ClO2溶液的装置如图所示:
已知下列反应:NaClO3+HCl→NaCl+ClO2+Cl2+H2O;NaClO2+HCl→NaCl+ClO2+H2O;NaClO2+Cl2→NaCl+ClO2(均未配平)。下列说法正确的是
A.a中通入的N2可用SO2代替
B.b中NaClO2发生反应时只表现还原性
C.c中广口瓶最好放在冰水浴中冷却
D.d中吸收尾气后只生成一种溶质
11.铁盐与亚铁盐在工业生产和生活中具有重要应用.三氯化铁在水溶液中易形成氢氧化铁胶体,具有吸附作用,可用作净水剂。三氯化铁溶液可用作印刷电路板刻剂,反应化学方程式为2FeCl3+Cu=2FeCl2+CuCl2。硫酸亚铁溶液可用于脱除烟气中的二氧化硫等有害气体。氯气是制备三氰化铁的重要原料.下列制取氯气的实验装置或者操作正确的是
A B C D
产生氯气 除去Cl2中的HCl气体 干燥氯气 吸收多余的氯气
A.A B.B C.C D.D
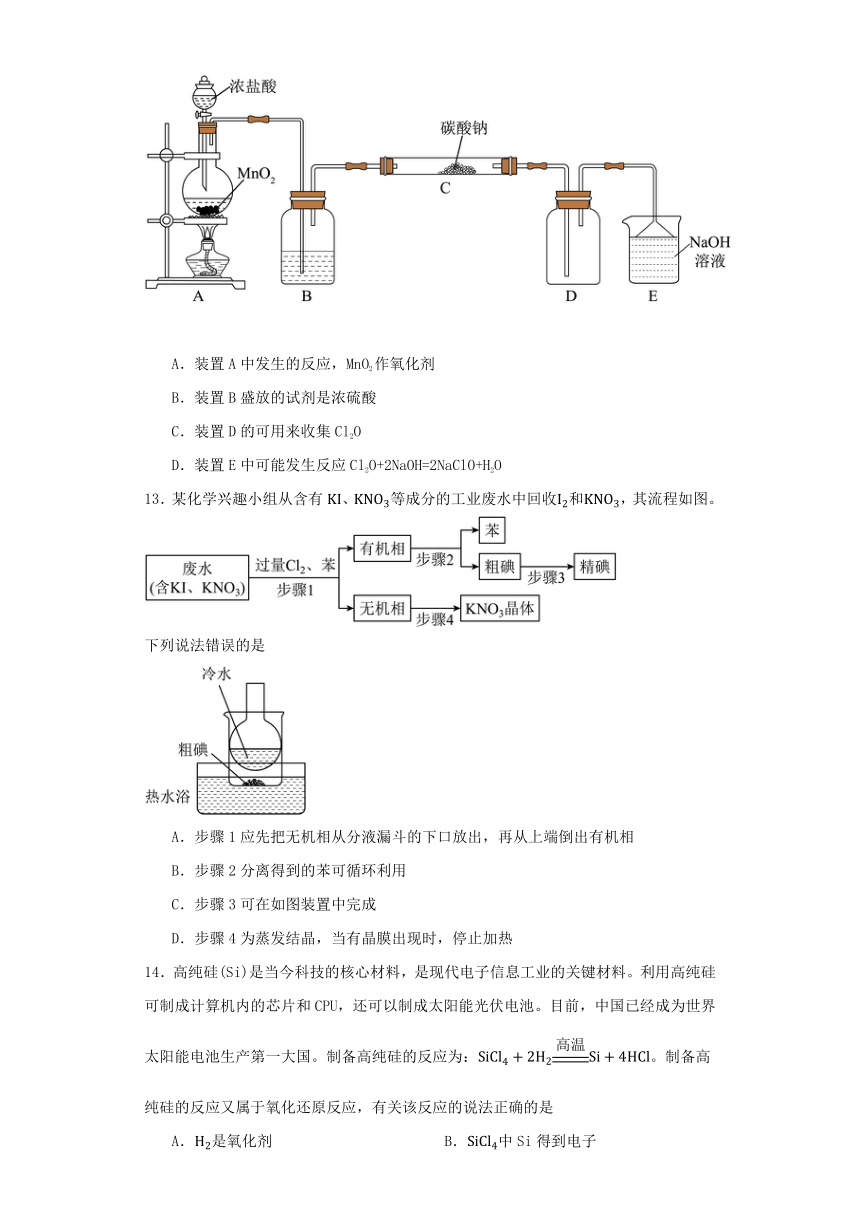
12.Cl2O常用于用于杀菌、漂白。实验室可以用潮湿的氯气与碳酸钠固体反应来制取,发生反应的化学方程式为2Cl2+2Na2CO3+H2O=2NaHCO3+2NaCl+Cl2O,实验室用如图所示的装置制备少量的Cl2O。下列说法错误的是
A.装置A中发生的反应,MnO2作氧化剂
B.装置B盛放的试剂是浓硫酸
C.装置D的可用来收集Cl2O
D.装置E中可能发生反应Cl2O+2NaOH=2NaClO+H2O
13.某化学兴趣小组从含有、等成分的工业废水中回收和,其流程如图。
下列说法错误的是
A.步骤1应先把无机相从分液漏斗的下口放出,再从上端倒出有机相
B.步骤2分离得到的苯可循环利用
C.步骤3可在如图装置中完成
D.步骤4为蒸发结晶,当有晶膜出现时,停止加热
14.高纯硅(Si)是当今科技的核心材料,是现代电子信息工业的关键材料。利用高纯硅可制成计算机内的芯片和CPU,还可以制成太阳能光伏电池。目前,中国已经成为世界太阳能电池生产第一大国。制备高纯硅的反应为:。制备高纯硅的反应又属于氧化还原反应,有关该反应的说法正确的是
A.是氧化剂 B.中Si得到电子
C.发生还原反应 D.是还原剂
15.下列叙述中错误的是
A.液氯是纯净物,氯水是混合物
B.氯气在氢气中燃烧是工业制盐酸的方法
C.Ca(ClO)2比HClO稳定
D.漂白粉的有效成分是Ca(ClO)2
16.请分析下列氧化还原反应,该反应为实验室用MnO2和浓盐酸(注意不是稀盐酸)反应制备Cl2:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
①用单线桥法表示出电子转移方向和数量
②该反应的氧化剂是 。
③HCl在该反应中体现的化学性质有 、 。
17.某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是 。
(2)已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为 。
(3)根据上述反应可推知 。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的计量数填入下列方框中,并标出电子转移的方向和数目。
18.分类是研究物质组成及其变化的一种常用的科学方法。
I.下列物质是实验室常见的药品:NaOH溶液、K2CO3溶液、H2SO4溶液、SO2、Zn、CaO固体、K2SO4固体,按要求回答问题:
(1)以上物质中,既属于盐又属于电解质的是 。写出其电离方程式: 。
(2)写出上述物质间可以发生氧化还原反应的化学方程式: 。
(3)二氧化硫是一种有毒气体,可以用过量NaOH溶液吸收,请写出对应的化学方程式 。
(4)NaOH溶液和Al(OH)3胶体外观相似,区别它们的实验方法是 。
Ⅱ.四种基本反应类型与氧化还原反应的关系如下图所示,其中甲、乙、丙、丁分别表示一种基本反应类型。
(5)下列反应中,与图中丙所表示反应类型一致的是___________。
A.
B.
C.
D.
(6)宋代《千里江山图》描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿色来自孔雀石颜料(主要成分为),青色来自蓝铜矿颜料(主要成分为)。其中属于 (填“纯净物”或“混合物”),请写出与盐酸反应的化学方程式 。
19.回答下列问题:
(1)铁钉在氯气中被锈蚀为棕黄色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液。则在Cl2、Cl-、H+中,具有氧化性的是
(2)盐酸在不同的反应中。可以分别表现出酸性、氧化性和还原性。请写出盐酸在该个反应中,表现什么性质:KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O
(3)用双线桥法表示反应4NH3+5O2=4NO+6H2O的电子转移方向和数目:
(4)配平以下反应: 、
________Cu+_______HNO3 (稀)=______Cu(NO3)2 +_________NO↑+________H2O
________KI+_______KIO3+________H2SO4=________K2SO4+________I2+________H2O
20.对于众多化学物质和化学反应,分类法的作用几乎是无可代替的。
I.现有以下物质:
①熔融氯化钠②③Cu④酒精⑤胶体⑥⑦稀硫酸⑧液氯⑨溶液
(1)以上物质在题给条件下能导电的是 (填序号,下同),属于非电解质的是 ,属于强电解质的是 。
(2)利用 可以快速区分⑤和⑨。
II.虽然分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系。
(3)下图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是 (填字母)。
(4)写出在熔融状态下的电离方程式 。
参考答案:
1.B2.A3.A4.B5.D6.D7.D8.D9.D10.C11.C12.B13.D14.B15.B
16. MnO2 酸性 还原性
17. AsH3 Br2 ac
18.(1) K2SO4固体 K2SO4═2K++
(2)Zn+H2SO4═ZnSO4+H2↑
(3)SO2+2NaOH=Na2SO3+H2O
(4)一束光线透过分散系,从侧面能观察到光亮通路的为Al(OH)3胶体,无此现象的为NaOH溶液
(5)BC
(6) 纯净物 Cu(OH)2·2CuCO3+6HCl=3CuCl2+4H2O+2CO2↑
19.(1)Cl2、H+
(2)酸性、还原性
(3)
(4) 3Cu+8HNO3 (稀)=3Cu(NO3)2 +2NO↑+4H2O 5KI+1KIO3+3H2SO4=3K2SO4+3I2+3H2O
20.(1) ①③⑤⑦⑨ ④⑥ ①②
(2)丁达尔效应
(3)C
(4)
1.Cl2是常见的氧化剂,可氧化Fe2+、Br-、I-等离子,且已知还原性顺序是:I->Fe2+>Br->Cl-。在FeI2和FeBr2混合溶液中,通入一定量Cl2,溶液中存在的离子组不合理的是( )
A.Fe3+、Br-、Cl- B.Fe2+、Cl-、I-
C.Fe2+、Br-、Cl- D.Fe2+、Br-、Cl-、I-
2.下列反应中,既属于氧化还原反应同时又是吸热反应的是( )
A.灼热的炭与CO2反应 B.铝与盐酸的反应
C.Ba(OH)2 8H2O与NH4Cl反应 D.酸碱中和反应
3.用如图装置进行实验,将A中浓盐酸逐滴加入到固体B(KMnO4)中,下列叙述正确的是
A.装置D可起到防倒吸作用
B.若C中盛紫色石蕊溶液,溶液变红
C.若C中盛饱和NaCl溶液,无明显现象
D.若C中盛少量淀粉碘化钾溶液,溶液一定变蓝
4.下列关于氯及其化合物的说法中正确的是
A.Cl2的氧化性很强,铁丝在氯气中燃烧产生大量白烟,产物为FeCl3
B.H2在Cl2中燃烧,火焰呈苍白色,工业上利用该反应原理生产盐酸
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有HClO
D.将氯水滴在pH试纸上一定显红色,因为氯水中含有HCl
5.将氯气持续通入紫色石蕊试液中,颜色变化为:紫色浅红色无色黄绿色,导致变色的微粒I、II、III依次为
A.HCl、HClO、Cl2 B.H+、ClO-、Cl-
C.HCl、ClO-、Cl- D.H+、HClO、Cl2
6.制备单质硅时,主要化学反应如下:
①SiO2+2CSi+2CO↑
②Si+2Cl2SiCl4
③SiCl4+2H2Si+4HCl
下列对上述三个反应的叙述中,不正确的是
A.①③为置换反应
B.①②③均为氧化还原反应
C.②为化合反应
D.三个反应的反应物中硅元素化合价均升高
7.下列物质既能由金属和盐酸反应获得,也能通过金属和氯气反应获得的是
A.CuCl2 B.FeCl2 C.FeCl3 D.MgCl2
8.用自来水养金鱼时,通常先将自来水经日晒一段时间后,再注入鱼缸,其目的是( )
A.利用紫外线杀死水中的细菌 B.提高水温,有利于金鱼生长
C.增加水中氧气的含量 D.促使水中的次氯酸分解
9.2023年3月,“三星堆”遗址考古又发掘出大量青铜器。火法炼铜主要发生的反应为 ,下列说法不正确的是
A.中铜的化合价为+1 B.该反应为置换反应
C.中的铜元素被还原 D.反应中的氧化剂仅为
10.ClO2是一种极易溶于水且几乎不与冷水反应的黄绿色气体(沸点11℃),实验室制备纯净ClO2溶液的装置如图所示:
已知下列反应:NaClO3+HCl→NaCl+ClO2+Cl2+H2O;NaClO2+HCl→NaCl+ClO2+H2O;NaClO2+Cl2→NaCl+ClO2(均未配平)。下列说法正确的是
A.a中通入的N2可用SO2代替
B.b中NaClO2发生反应时只表现还原性
C.c中广口瓶最好放在冰水浴中冷却
D.d中吸收尾气后只生成一种溶质
11.铁盐与亚铁盐在工业生产和生活中具有重要应用.三氯化铁在水溶液中易形成氢氧化铁胶体,具有吸附作用,可用作净水剂。三氯化铁溶液可用作印刷电路板刻剂,反应化学方程式为2FeCl3+Cu=2FeCl2+CuCl2。硫酸亚铁溶液可用于脱除烟气中的二氧化硫等有害气体。氯气是制备三氰化铁的重要原料.下列制取氯气的实验装置或者操作正确的是
A B C D
产生氯气 除去Cl2中的HCl气体 干燥氯气 吸收多余的氯气
A.A B.B C.C D.D
12.Cl2O常用于用于杀菌、漂白。实验室可以用潮湿的氯气与碳酸钠固体反应来制取,发生反应的化学方程式为2Cl2+2Na2CO3+H2O=2NaHCO3+2NaCl+Cl2O,实验室用如图所示的装置制备少量的Cl2O。下列说法错误的是
A.装置A中发生的反应,MnO2作氧化剂
B.装置B盛放的试剂是浓硫酸
C.装置D的可用来收集Cl2O
D.装置E中可能发生反应Cl2O+2NaOH=2NaClO+H2O
13.某化学兴趣小组从含有、等成分的工业废水中回收和,其流程如图。
下列说法错误的是
A.步骤1应先把无机相从分液漏斗的下口放出,再从上端倒出有机相
B.步骤2分离得到的苯可循环利用
C.步骤3可在如图装置中完成
D.步骤4为蒸发结晶,当有晶膜出现时,停止加热
14.高纯硅(Si)是当今科技的核心材料,是现代电子信息工业的关键材料。利用高纯硅可制成计算机内的芯片和CPU,还可以制成太阳能光伏电池。目前,中国已经成为世界太阳能电池生产第一大国。制备高纯硅的反应为:。制备高纯硅的反应又属于氧化还原反应,有关该反应的说法正确的是
A.是氧化剂 B.中Si得到电子
C.发生还原反应 D.是还原剂
15.下列叙述中错误的是
A.液氯是纯净物,氯水是混合物
B.氯气在氢气中燃烧是工业制盐酸的方法
C.Ca(ClO)2比HClO稳定
D.漂白粉的有效成分是Ca(ClO)2
16.请分析下列氧化还原反应,该反应为实验室用MnO2和浓盐酸(注意不是稀盐酸)反应制备Cl2:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
①用单线桥法表示出电子转移方向和数量
②该反应的氧化剂是 。
③HCl在该反应中体现的化学性质有 、 。
17.某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是 。
(2)已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为 。
(3)根据上述反应可推知 。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的计量数填入下列方框中,并标出电子转移的方向和数目。
18.分类是研究物质组成及其变化的一种常用的科学方法。
I.下列物质是实验室常见的药品:NaOH溶液、K2CO3溶液、H2SO4溶液、SO2、Zn、CaO固体、K2SO4固体,按要求回答问题:
(1)以上物质中,既属于盐又属于电解质的是 。写出其电离方程式: 。
(2)写出上述物质间可以发生氧化还原反应的化学方程式: 。
(3)二氧化硫是一种有毒气体,可以用过量NaOH溶液吸收,请写出对应的化学方程式 。
(4)NaOH溶液和Al(OH)3胶体外观相似,区别它们的实验方法是 。
Ⅱ.四种基本反应类型与氧化还原反应的关系如下图所示,其中甲、乙、丙、丁分别表示一种基本反应类型。
(5)下列反应中,与图中丙所表示反应类型一致的是___________。
A.
B.
C.
D.
(6)宋代《千里江山图》描绘了山清水秀的美丽景色,历经千年色彩依然,其中绿色来自孔雀石颜料(主要成分为),青色来自蓝铜矿颜料(主要成分为)。其中属于 (填“纯净物”或“混合物”),请写出与盐酸反应的化学方程式 。
19.回答下列问题:
(1)铁钉在氯气中被锈蚀为棕黄色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液。则在Cl2、Cl-、H+中,具有氧化性的是
(2)盐酸在不同的反应中。可以分别表现出酸性、氧化性和还原性。请写出盐酸在该个反应中,表现什么性质:KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O
(3)用双线桥法表示反应4NH3+5O2=4NO+6H2O的电子转移方向和数目:
(4)配平以下反应: 、
________Cu+_______HNO3 (稀)=______Cu(NO3)2 +_________NO↑+________H2O
________KI+_______KIO3+________H2SO4=________K2SO4+________I2+________H2O
20.对于众多化学物质和化学反应,分类法的作用几乎是无可代替的。
I.现有以下物质:
①熔融氯化钠②③Cu④酒精⑤胶体⑥⑦稀硫酸⑧液氯⑨溶液
(1)以上物质在题给条件下能导电的是 (填序号,下同),属于非电解质的是 ,属于强电解质的是 。
(2)利用 可以快速区分⑤和⑨。
II.虽然分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系。
(3)下图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是 (填字母)。
(4)写出在熔融状态下的电离方程式 。
参考答案:
1.B2.A3.A4.B5.D6.D7.D8.D9.D10.C11.C12.B13.D14.B15.B
16. MnO2 酸性 还原性
17. AsH3 Br2 ac
18.(1) K2SO4固体 K2SO4═2K++
(2)Zn+H2SO4═ZnSO4+H2↑
(3)SO2+2NaOH=Na2SO3+H2O
(4)一束光线透过分散系,从侧面能观察到光亮通路的为Al(OH)3胶体,无此现象的为NaOH溶液
(5)BC
(6) 纯净物 Cu(OH)2·2CuCO3+6HCl=3CuCl2+4H2O+2CO2↑
19.(1)Cl2、H+
(2)酸性、还原性
(3)
(4) 3Cu+8HNO3 (稀)=3Cu(NO3)2 +2NO↑+4H2O 5KI+1KIO3+3H2SO4=3K2SO4+3I2+3H2O
20.(1) ①③⑤⑦⑨ ④⑥ ①②
(2)丁达尔效应
(3)C
(4)
