4.1原电池 同步练习题(含解析) 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.1原电池 同步练习题(含解析) 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 331.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 22:07:01 | ||
图片预览


文档简介
4.1原电池同步练习题
一、选择题
1.下列对如图所示装置实验现象的描述正确的是
a电极 b电极 X溶液 实验现象
A 石墨 石墨 a极质量增加,b极放出无色气体
B 石墨 Fe a极质量增加,b极放出无色气体
C Cu Fe a极质量增加,b极质量减少
D 石墨 石墨 HCl a、b极都放出无色气体
A.A B.B C.C D.D
2.科学家近年发明了一种新型水介质电池,该电池可将转化为HCOOH。下列说法正确的是
A.Zn为正极 B.发生还原反应
C.电子由正极流向负极 D.电能转化为化学能
3.下列关于仪器名称或使用的说法错误的是
A.甲仪器有“0”刻度,使用前需要先检漏、洗涤和润洗
B.乙仪器可用于加热硫酸铜溶液得到硫酸铜晶体
C.用丙仪器(不限数量)、电极材料、导线及必要试剂可设计一个产生电流的装置
D.丁仪器的名称为坩埚,需垫石棉网进行固体加热
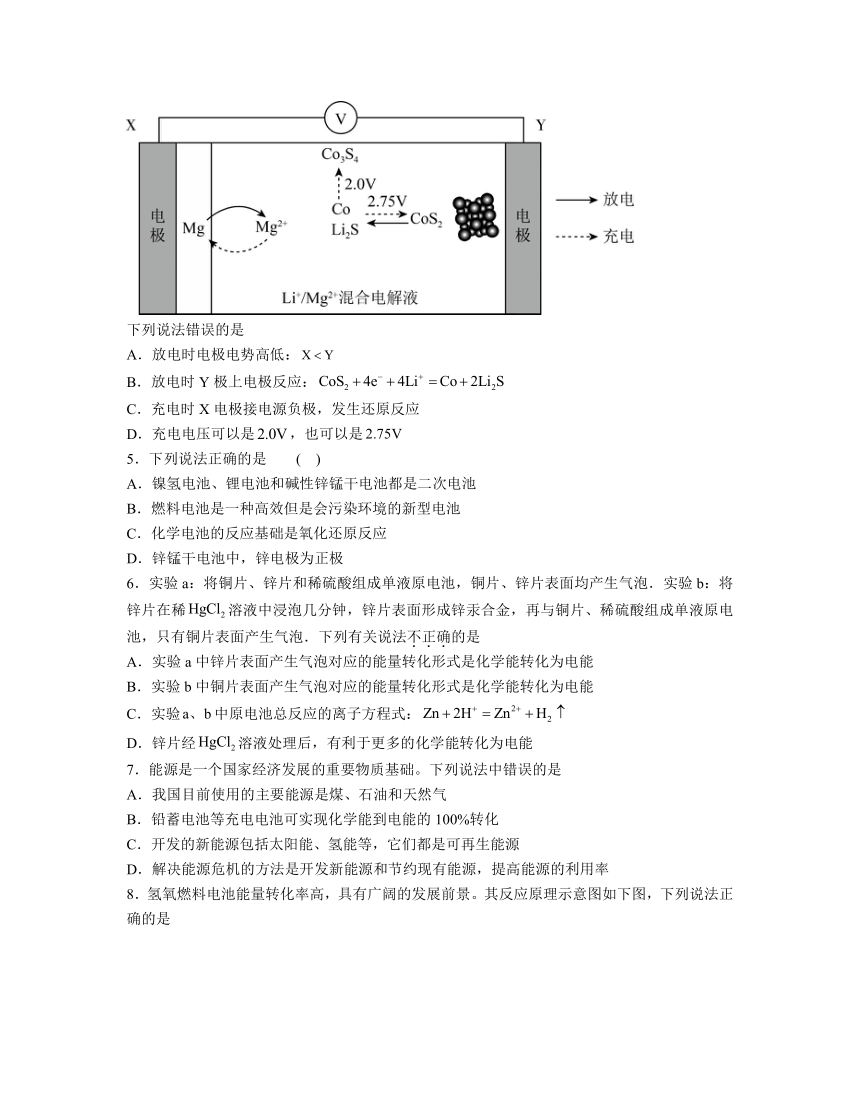
4.双盐电池因具有高比容量与高安全性而日益受到关注,其充放电过程如图所示:
下列说法错误的是
A.放电时电极电势高低:
B.放电时Y极上电极反应:
C.充电时X电极接电源负极,发生还原反应
D.充电电压可以是,也可以是
5.下列说法正确的是 ( )
A.镍氢电池、锂电池和碱性锌锰干电池都是二次电池
B.燃料电池是一种高效但是会污染环境的新型电池
C.化学电池的反应基础是氧化还原反应
D.锌锰干电池中,锌电极为正极
6.实验a:将铜片、锌片和稀硫酸组成单液原电池,铜片、锌片表面均产生气泡.实验b:将锌片在稀溶液中浸泡几分钟,锌片表面形成锌汞合金,再与铜片、稀硫酸组成单液原电池,只有铜片表面产生气泡.下列有关说法不正确的是
A.实验a中锌片表面产生气泡对应的能量转化形式是化学能转化为电能
B.实验b中铜片表面产生气泡对应的能量转化形式是化学能转化为电能
C.实验中原电池总反应的离子方程式:
D.锌片经溶液处理后,有利于更多的化学能转化为电能
7.能源是一个国家经济发展的重要物质基础。下列说法中错误的是
A.我国目前使用的主要能源是煤、石油和天然气
B.铅蓄电池等充电电池可实现化学能到电能的100%转化
C.开发的新能源包括太阳能、氢能等,它们都是可再生能源
D.解决能源危机的方法是开发新能源和节约现有能源,提高能源的利用率
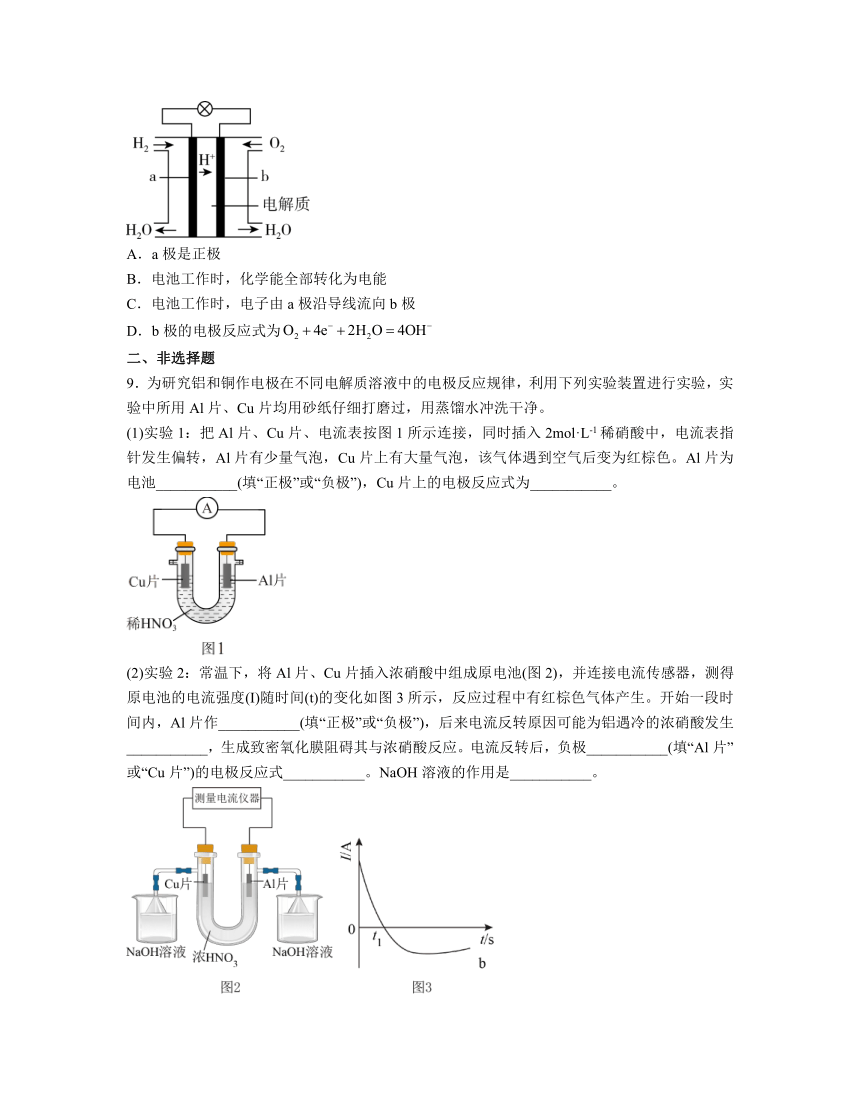
8.氢氧燃料电池能量转化率高,具有广阔的发展前景。其反应原理示意图如下图,下列说法正确的是
A.a极是正极
B.电池工作时,化学能全部转化为电能
C.电池工作时,电子由a极沿导线流向b极
D.b极的电极反应式为
二、非选择题
9.为研究铝和铜作电极在不同电解质溶液中的电极反应规律,利用下列实验装置进行实验,实验中所用Al片、Cu片均用砂纸仔细打磨过,用蒸馏水冲洗干净。
(1)实验1:把Al片、Cu片、电流表按图1所示连接,同时插入2mol·L-1稀硝酸中,电流表指针发生偏转,Al片有少量气泡,Cu片上有大量气泡,该气体遇到空气后变为红棕色。Al片为电池___________(填“正极”或“负极”),Cu片上的电极反应式为___________。
(2)实验2:常温下,将Al片、Cu片插入浓硝酸中组成原电池(图2),并连接电流传感器,测得原电池的电流强度(I)随时间(t)的变化如图3所示,反应过程中有红棕色气体产生。开始一段时间内,Al片作___________(填“正极”或“负极”),后来电流反转原因可能为铝遇冷的浓硝酸发生___________,生成致密氧化膜阻碍其与浓硝酸反应。电流反转后,负极___________(填“Al片”或“Cu片”)的电极反应式___________。NaOH溶液的作用是___________。
10.(1)物质的量浓度相同的 ① 氨水 ② 氯化铵 ③硫酸氢铵 ④硫酸铵四种溶液中c(NH)大小的顺序是_______。(用序号回答)
(2)常温下,pH=13的Ba(OH)2溶液a L与pH=3的H2SO4溶液b L混合(混合后溶液体积变化忽略不计)。若所得混合溶液呈中性,则a∶b=_______。
(3)常温下,测得CH3COONH4溶液的pH=7,此溶液中水的电离程度 _______该温度下纯水的电离程度(填“>”、“<”或“=”)
(4)常温下,将0.1 mol·L-1 NH3·H2O与a mol/L盐酸等体积混合(不考虑溶液体积的变化),反应后溶液恰好呈中性,用含a的代数式表示NH3·H2O的电离平衡常数为_______。
(5)甲醇(CH3OH)可以用作燃料电池,该电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。负极发生的电极反应式是_______。
【参考答案】
一、选择题
1.C
解析:A.没有自发的氧化还原反应,不能构成原电池,A错误;
B.符合原电池构成条件,且Fe(b)为负极,发生反应:Fe-2e-=Fe2+,电极质量减小,无气体放出,石墨(a)为正极,发生反应:O2+4e-+2H2O=4OH-,无质量增加,B错误;
C.符合原电池构成条件,且Fe(b)为负极,发生反应:Fe-2e-=Fe2+,电极质量减小,Cu(a)为正极,发生反应:Cu2++2e-=Cu,电极质量增加,C正确;
D.没有自发的氧化还原反应,不能构成原电池,没有反应发生,D错误;
故选C。
2.B
【分析】新型水介质电池,该电池可将转化为HCOOH,二氧化碳发生还原反应,为正极,则锌为负极;
解析:A.由分析可知,锌为负极,A错误;
B.发生还原反应为原电池的正极,B正确;
C.原电池中电子由负极流向正极,C错误;
D.原电池是化学能转化为电能的装置,D错误;
故选B。
3.D
解析:A.甲为酸、碱式滴定管,“0”刻度在上部,使用前需要先检漏、洗涤和润洗,A正确;
B.乙为蒸发皿,可用于蒸发结晶,B正确;
C.丙为烧杯和U形管,取两烧杯装电解质溶液,U形管作盐桥,金属活动性不同的两金属条作电极材料,分别插在两烧杯中,用导线连接两电极材料,就构成了原电池,C正确;
D.丁为坩埚,可直接加热,不需要垫石棉网,D错误;
故选D。
4.D
【分析】由图可知,放电时镁失去电子发生氧化反应生成镁离子,X为负极,则Y极为正极;
解析:A.放电时X为负极,Y极为正极,电极电势高低:,A正确;
B.放电时Y极上发生还原反应,CoS2生成Co和Li2S,电极反应:,B正确;
C.充电时X电极接电源负极,为阴极发生还原反应,C正确;
D.由图可知,充电时电压为,才会发生氧化反应生成,D错误;
故选D。
5.C
解析:A.镍氢电池、锂电池都是二次电池,碱性锌锰干电池为一次电池,故A错误;
B.燃料电池有氢氧燃料电池、甲烷燃料电池、乙醇燃料电池等,产物多为CO2、H2O等,不污染环境,故B错误;
C.化学电池是将化学能转变为电能的装置,有电子的转移,实质为氧化还原反应,选项C正确;
D.锌锰干电池中,活泼电极作负极,锌电极为负极,故D错误;
答案选C。
6.A
解析:A.实验a中产生气泡是因为锌片和稀硫酸发生氧化还原反应生成氢气,对应的能量转换形式是化学能转化为热能,故A错误;
B.实验b中铜片表面产生气泡是因为形成原电池,对应的能量转化形式是化学能转化为电能,故B正确;
C.实验a中锌片和稀硫酸发生反应,实验b中形成原电池,锌片作负极,电极反应为,铜片作正极,电极反应为,总反应为,故C正确;
D. 将锌片在稀溶液中浸泡几分钟,锌片表面形成锌汞合金,阻止锌与稀硫酸反应,从而有利于更多的化学能转化为电能,故D正确;
答案选A。
7.B
解析:A.化石燃料包括煤、石油、天然气,我国目前使用的主要能源是煤、石油和天然气,故A正确;
B.铅蓄电池等充电电池可实现化学能到电能的转化,但这种不是100%的,故B错误;
C.开发的新能源包括太阳能、氢能等,它们都是可再生能源,故C正确;
D.解决能源问题的根本出路就是:节约能源,提高现有能源利用率,积极寻找和开发新能源,故D正确;
故选B。
8.C
【分析】已知燃料电池中通入燃料H2的一极为负极,发生氧化反应,电极反应为:H2-2e-=2H+,通O2的一极为正极,发生还原反应,电极反应为:4H++O2+4e-=2H2O,据此分析解题。
解析:A.由分析可知,a极是负极,A错误;
B.电池工作时,化学能不可能全部转化为电能,还将转化为热能等其他形式的能量,B错误;
C.由分析可知,电池工作时,电子由负极即a极沿导线流向正极即b极,C正确;
D.由分析可知,b极的电极反应式为4H++O2+4e-=2H2O,D错误;
故答案为:C。
二、非选择题
9.(1) 负极 NO +4H++3e-=NO↑+2H2O
(2) 负极 钝化 Cu Cu-2e-=Cu2+ 吸收产生的NO2气体,防止污染空气
解析:(1)电解质溶液是稀硝酸,Al片、Cu片常温下都与稀硝酸反应,更活泼的金属环做负极,故Al片为电池负极;Cu片是正极,电极反应式为NO +4H++3e-=NO +2H2O;
(2)Al片、Cu片插入浓硝酸中组成原电池,开始时候Al做负极,变成三氧化二铝;后来电流反转原因可能为铝遇冷的浓硝酸发生钝化;电流反转后,负极是Cu,电极反应式Cu-2e-=Cu2+;NaOH溶液的作用是吸收产生的NO2气体,防止污染空气。
10. ④ >③ >② > ① 1:100 > CH3OH -6e-+H2O=CO2↑+6H+
解析:(1)可分3种情况讨论:(1)氨水电离产生NH、OH ;(2)NH水解产生H+及剩余NH;(3)NH水解受到影响,促进或抑制;在分析时要注意两点:氨水电离程度较小,NH水解程度也较小;另外,NH4HSO4溶液中,H+抑制NH水解,(NH4)2SO4中含有2个铵根离子,所以(NH4)2SO4中NH的浓度最大;所以,NH的浓度由大到小顺序为(NH4)2SO4、NH4HSO4、NH4Cl、NH3 H2O,故答案为:④>③>②>①;
(2)常温下,pH=13的Ba(OH)2溶液aL与pH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计),若所得混合溶液呈中性,说明酸中n(H+)等于碱中n(OH ),则存在0.1mol/L×aL=0.001mol/L×bL,则a:b=1:100,故答案为:1:100;
(3)0.1mol L 1CH3COONH4溶液中醋酸根离子和铵根离子水解相互促进,常温下,测得溶液的pH=7,促进了水的电离程度相同,溶液显中性,此溶液中水的电离程度>该温度下纯水的电离程度,故答案为:>;
(4)溶液显中性,所以c(H+)=c(OH ),溶液的电荷守恒可得:c(H+)+c(NH)=c(Cl )+c(OH ),故c(NH)=c(Cl ),氯化铵是强酸弱碱盐其水溶液呈酸性,要使氯化铵溶液呈中性,则氨水应稍微过量,因为盐酸和氨水的体积相等,则氨水的物质的量浓度大于盐酸,
溶液中c(H+)=c(OH )=10 7mol/L,c(NH)=c(Cl )=mol/L,c(NH3·H2O)=()mol/L,电离常数只与温度有关,则此时NH3·H2O的电离常数Kb===,故答案为:;
(5)甲醇燃料电池工作时,原电池中负极上燃料甲醇失电子发生氧化反应:CH3OH -6e-+H2O=CO2↑+6H+,故答案为:CH3OH -6e-+H2O=CO2↑+6H+
一、选择题
1.下列对如图所示装置实验现象的描述正确的是
a电极 b电极 X溶液 实验现象
A 石墨 石墨 a极质量增加,b极放出无色气体
B 石墨 Fe a极质量增加,b极放出无色气体
C Cu Fe a极质量增加,b极质量减少
D 石墨 石墨 HCl a、b极都放出无色气体
A.A B.B C.C D.D
2.科学家近年发明了一种新型水介质电池,该电池可将转化为HCOOH。下列说法正确的是
A.Zn为正极 B.发生还原反应
C.电子由正极流向负极 D.电能转化为化学能
3.下列关于仪器名称或使用的说法错误的是
A.甲仪器有“0”刻度,使用前需要先检漏、洗涤和润洗
B.乙仪器可用于加热硫酸铜溶液得到硫酸铜晶体
C.用丙仪器(不限数量)、电极材料、导线及必要试剂可设计一个产生电流的装置
D.丁仪器的名称为坩埚,需垫石棉网进行固体加热
4.双盐电池因具有高比容量与高安全性而日益受到关注,其充放电过程如图所示:
下列说法错误的是
A.放电时电极电势高低:
B.放电时Y极上电极反应:
C.充电时X电极接电源负极,发生还原反应
D.充电电压可以是,也可以是
5.下列说法正确的是 ( )
A.镍氢电池、锂电池和碱性锌锰干电池都是二次电池
B.燃料电池是一种高效但是会污染环境的新型电池
C.化学电池的反应基础是氧化还原反应
D.锌锰干电池中,锌电极为正极
6.实验a:将铜片、锌片和稀硫酸组成单液原电池,铜片、锌片表面均产生气泡.实验b:将锌片在稀溶液中浸泡几分钟,锌片表面形成锌汞合金,再与铜片、稀硫酸组成单液原电池,只有铜片表面产生气泡.下列有关说法不正确的是
A.实验a中锌片表面产生气泡对应的能量转化形式是化学能转化为电能
B.实验b中铜片表面产生气泡对应的能量转化形式是化学能转化为电能
C.实验中原电池总反应的离子方程式:
D.锌片经溶液处理后,有利于更多的化学能转化为电能
7.能源是一个国家经济发展的重要物质基础。下列说法中错误的是
A.我国目前使用的主要能源是煤、石油和天然气
B.铅蓄电池等充电电池可实现化学能到电能的100%转化
C.开发的新能源包括太阳能、氢能等,它们都是可再生能源
D.解决能源危机的方法是开发新能源和节约现有能源,提高能源的利用率
8.氢氧燃料电池能量转化率高,具有广阔的发展前景。其反应原理示意图如下图,下列说法正确的是
A.a极是正极
B.电池工作时,化学能全部转化为电能
C.电池工作时,电子由a极沿导线流向b极
D.b极的电极反应式为
二、非选择题
9.为研究铝和铜作电极在不同电解质溶液中的电极反应规律,利用下列实验装置进行实验,实验中所用Al片、Cu片均用砂纸仔细打磨过,用蒸馏水冲洗干净。
(1)实验1:把Al片、Cu片、电流表按图1所示连接,同时插入2mol·L-1稀硝酸中,电流表指针发生偏转,Al片有少量气泡,Cu片上有大量气泡,该气体遇到空气后变为红棕色。Al片为电池___________(填“正极”或“负极”),Cu片上的电极反应式为___________。
(2)实验2:常温下,将Al片、Cu片插入浓硝酸中组成原电池(图2),并连接电流传感器,测得原电池的电流强度(I)随时间(t)的变化如图3所示,反应过程中有红棕色气体产生。开始一段时间内,Al片作___________(填“正极”或“负极”),后来电流反转原因可能为铝遇冷的浓硝酸发生___________,生成致密氧化膜阻碍其与浓硝酸反应。电流反转后,负极___________(填“Al片”或“Cu片”)的电极反应式___________。NaOH溶液的作用是___________。
10.(1)物质的量浓度相同的 ① 氨水 ② 氯化铵 ③硫酸氢铵 ④硫酸铵四种溶液中c(NH)大小的顺序是_______。(用序号回答)
(2)常温下,pH=13的Ba(OH)2溶液a L与pH=3的H2SO4溶液b L混合(混合后溶液体积变化忽略不计)。若所得混合溶液呈中性,则a∶b=_______。
(3)常温下,测得CH3COONH4溶液的pH=7,此溶液中水的电离程度 _______该温度下纯水的电离程度(填“>”、“<”或“=”)
(4)常温下,将0.1 mol·L-1 NH3·H2O与a mol/L盐酸等体积混合(不考虑溶液体积的变化),反应后溶液恰好呈中性,用含a的代数式表示NH3·H2O的电离平衡常数为_______。
(5)甲醇(CH3OH)可以用作燃料电池,该电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。负极发生的电极反应式是_______。
【参考答案】
一、选择题
1.C
解析:A.没有自发的氧化还原反应,不能构成原电池,A错误;
B.符合原电池构成条件,且Fe(b)为负极,发生反应:Fe-2e-=Fe2+,电极质量减小,无气体放出,石墨(a)为正极,发生反应:O2+4e-+2H2O=4OH-,无质量增加,B错误;
C.符合原电池构成条件,且Fe(b)为负极,发生反应:Fe-2e-=Fe2+,电极质量减小,Cu(a)为正极,发生反应:Cu2++2e-=Cu,电极质量增加,C正确;
D.没有自发的氧化还原反应,不能构成原电池,没有反应发生,D错误;
故选C。
2.B
【分析】新型水介质电池,该电池可将转化为HCOOH,二氧化碳发生还原反应,为正极,则锌为负极;
解析:A.由分析可知,锌为负极,A错误;
B.发生还原反应为原电池的正极,B正确;
C.原电池中电子由负极流向正极,C错误;
D.原电池是化学能转化为电能的装置,D错误;
故选B。
3.D
解析:A.甲为酸、碱式滴定管,“0”刻度在上部,使用前需要先检漏、洗涤和润洗,A正确;
B.乙为蒸发皿,可用于蒸发结晶,B正确;
C.丙为烧杯和U形管,取两烧杯装电解质溶液,U形管作盐桥,金属活动性不同的两金属条作电极材料,分别插在两烧杯中,用导线连接两电极材料,就构成了原电池,C正确;
D.丁为坩埚,可直接加热,不需要垫石棉网,D错误;
故选D。
4.D
【分析】由图可知,放电时镁失去电子发生氧化反应生成镁离子,X为负极,则Y极为正极;
解析:A.放电时X为负极,Y极为正极,电极电势高低:,A正确;
B.放电时Y极上发生还原反应,CoS2生成Co和Li2S,电极反应:,B正确;
C.充电时X电极接电源负极,为阴极发生还原反应,C正确;
D.由图可知,充电时电压为,才会发生氧化反应生成,D错误;
故选D。
5.C
解析:A.镍氢电池、锂电池都是二次电池,碱性锌锰干电池为一次电池,故A错误;
B.燃料电池有氢氧燃料电池、甲烷燃料电池、乙醇燃料电池等,产物多为CO2、H2O等,不污染环境,故B错误;
C.化学电池是将化学能转变为电能的装置,有电子的转移,实质为氧化还原反应,选项C正确;
D.锌锰干电池中,活泼电极作负极,锌电极为负极,故D错误;
答案选C。
6.A
解析:A.实验a中产生气泡是因为锌片和稀硫酸发生氧化还原反应生成氢气,对应的能量转换形式是化学能转化为热能,故A错误;
B.实验b中铜片表面产生气泡是因为形成原电池,对应的能量转化形式是化学能转化为电能,故B正确;
C.实验a中锌片和稀硫酸发生反应,实验b中形成原电池,锌片作负极,电极反应为,铜片作正极,电极反应为,总反应为,故C正确;
D. 将锌片在稀溶液中浸泡几分钟,锌片表面形成锌汞合金,阻止锌与稀硫酸反应,从而有利于更多的化学能转化为电能,故D正确;
答案选A。
7.B
解析:A.化石燃料包括煤、石油、天然气,我国目前使用的主要能源是煤、石油和天然气,故A正确;
B.铅蓄电池等充电电池可实现化学能到电能的转化,但这种不是100%的,故B错误;
C.开发的新能源包括太阳能、氢能等,它们都是可再生能源,故C正确;
D.解决能源问题的根本出路就是:节约能源,提高现有能源利用率,积极寻找和开发新能源,故D正确;
故选B。
8.C
【分析】已知燃料电池中通入燃料H2的一极为负极,发生氧化反应,电极反应为:H2-2e-=2H+,通O2的一极为正极,发生还原反应,电极反应为:4H++O2+4e-=2H2O,据此分析解题。
解析:A.由分析可知,a极是负极,A错误;
B.电池工作时,化学能不可能全部转化为电能,还将转化为热能等其他形式的能量,B错误;
C.由分析可知,电池工作时,电子由负极即a极沿导线流向正极即b极,C正确;
D.由分析可知,b极的电极反应式为4H++O2+4e-=2H2O,D错误;
故答案为:C。
二、非选择题
9.(1) 负极 NO +4H++3e-=NO↑+2H2O
(2) 负极 钝化 Cu Cu-2e-=Cu2+ 吸收产生的NO2气体,防止污染空气
解析:(1)电解质溶液是稀硝酸,Al片、Cu片常温下都与稀硝酸反应,更活泼的金属环做负极,故Al片为电池负极;Cu片是正极,电极反应式为NO +4H++3e-=NO +2H2O;
(2)Al片、Cu片插入浓硝酸中组成原电池,开始时候Al做负极,变成三氧化二铝;后来电流反转原因可能为铝遇冷的浓硝酸发生钝化;电流反转后,负极是Cu,电极反应式Cu-2e-=Cu2+;NaOH溶液的作用是吸收产生的NO2气体,防止污染空气。
10. ④ >③ >② > ① 1:100 > CH3OH -6e-+H2O=CO2↑+6H+
解析:(1)可分3种情况讨论:(1)氨水电离产生NH、OH ;(2)NH水解产生H+及剩余NH;(3)NH水解受到影响,促进或抑制;在分析时要注意两点:氨水电离程度较小,NH水解程度也较小;另外,NH4HSO4溶液中,H+抑制NH水解,(NH4)2SO4中含有2个铵根离子,所以(NH4)2SO4中NH的浓度最大;所以,NH的浓度由大到小顺序为(NH4)2SO4、NH4HSO4、NH4Cl、NH3 H2O,故答案为:④>③>②>①;
(2)常温下,pH=13的Ba(OH)2溶液aL与pH=3的H2SO4溶液bL混合(混合后溶液体积变化忽略不计),若所得混合溶液呈中性,说明酸中n(H+)等于碱中n(OH ),则存在0.1mol/L×aL=0.001mol/L×bL,则a:b=1:100,故答案为:1:100;
(3)0.1mol L 1CH3COONH4溶液中醋酸根离子和铵根离子水解相互促进,常温下,测得溶液的pH=7,促进了水的电离程度相同,溶液显中性,此溶液中水的电离程度>该温度下纯水的电离程度,故答案为:>;
(4)溶液显中性,所以c(H+)=c(OH ),溶液的电荷守恒可得:c(H+)+c(NH)=c(Cl )+c(OH ),故c(NH)=c(Cl ),氯化铵是强酸弱碱盐其水溶液呈酸性,要使氯化铵溶液呈中性,则氨水应稍微过量,因为盐酸和氨水的体积相等,则氨水的物质的量浓度大于盐酸,
溶液中c(H+)=c(OH )=10 7mol/L,c(NH)=c(Cl )=mol/L,c(NH3·H2O)=()mol/L,电离常数只与温度有关,则此时NH3·H2O的电离常数Kb===,故答案为:;
(5)甲醇燃料电池工作时,原电池中负极上燃料甲醇失电子发生氧化反应:CH3OH -6e-+H2O=CO2↑+6H+,故答案为:CH3OH -6e-+H2O=CO2↑+6H+
