4.3 化学键 同步练习题 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.3 化学键 同步练习题 2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 224.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 22:03:52 | ||
图片预览



文档简介
4.3 化学键 同步练习题
一、选择题
1.X、Y、Z、R、W是五种短周期元素,原子序数依次增大,其中X是形成化合物最多的元素,Y、R同主族,X、Y、Z、W四种元素能形成化合物Z2Y和XW4。下列说法正确的是
A.简单离子半径的大小顺序:R>Z>Y
B.气态氢化物的稳定性:HmW<HnR
C.化合物Z2R2Y3水溶液与W的氢化物反应能够生成沉淀
D.R2W2 和Z2Y2具有相同的化学键类型
2.北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质在熔融状态下能导电,具有良好的超导性。下列有关分析不正确的是
A.K3C60中含有离子键 B.K3C60中含有非极性共价键
C.该晶体融化过程中破坏了离子键 D.C60与12C互为同位素
3.下列化学用语表达正确的是
A.分子中含有非极性键 B.的电子式:
C.硫化氢 D.(肼)的结构式:
4.下列表示或说法正确的是
A.硫原子结构示意图: B.CS2的球棍模型:
C.甲酸甲酯的最简式:CH2O D.氯化钙的分子式:CaCl2
5.下列物质中,既含有离子键又含有共价键的是
A.Na2O B.CO2 C.MgCl2 D.NaOH
6.下列化学用语表述正确的是
A.二氧化碳分子的结构式: O-C-O B.乙烯的结构简式:CH2CH2
C.水分子的分子结构模型: D.氯原子的结构示意图:
7.下列有关化学用语中,正确的是
A.氯化钠的电子式: B.的结构示意图:
C.分子的结构式:O—C—O D.中子数为10的氧的核素:
8.物质结构决定性质,下列叙述正确的是
A.离子化合物熔沸点较高、共价化合物熔沸点较低
B.非金属原子间不可能形成离子化合物
C.确定某化合物为离子化合物,可以用熔融时能否导电来判断
D.共价化合物中可能有离子键
二、非选择题
9.“遂古之初,谁传道之?上下未形,何由考之?”屈原的《天问》中华民族对真理追求的坚韧与执着。
(1)在2021年5月15日,“天问一号”探测器成功实现环绕器和着陆巡视器的“两器分离”并成功着陆。“天问一号”采用了我国自主研制的高性能碳化硅增强铝基复合材料。工业上制取碳化硅的化学反应方程式为:SiO2+3CSiC+2X↑。
回答下列问题:
请写出X的化学式 。
(2)上述材料所涉及元素中,某元素原子核外的M层上有3个电子数,则其离子结构示意图为 ;某元素的最外层电子数是其核外电子层数3倍,则其简单离子的电子式为 ,请写出与它具有相电子数的三核微粒的化学式 。
(3)硅元素存在多种同位素。已知三种天然稳定同位素的数据如下:
硅的同位素 同位素的相对原子质量 自然界中各同位素原子的丰度
27.977 92.23%
28.976 4.67%
29.974 3.10%
请列出硅元素的相对原子质量为的计算式 。
(4)下列有关的说法正确的是
A.由变为的变化是化学变化
B.的近似相对原子质量为28
C.比原子核外多两个电子
D.硅元素的两种单质无定形硅和晶体硅互为同素异形体
(5)若生成4g碳化硅,则其中含有 个碳原子;生成4g碳化硅的同时,生成X气体的体积在标准状况下为 L。
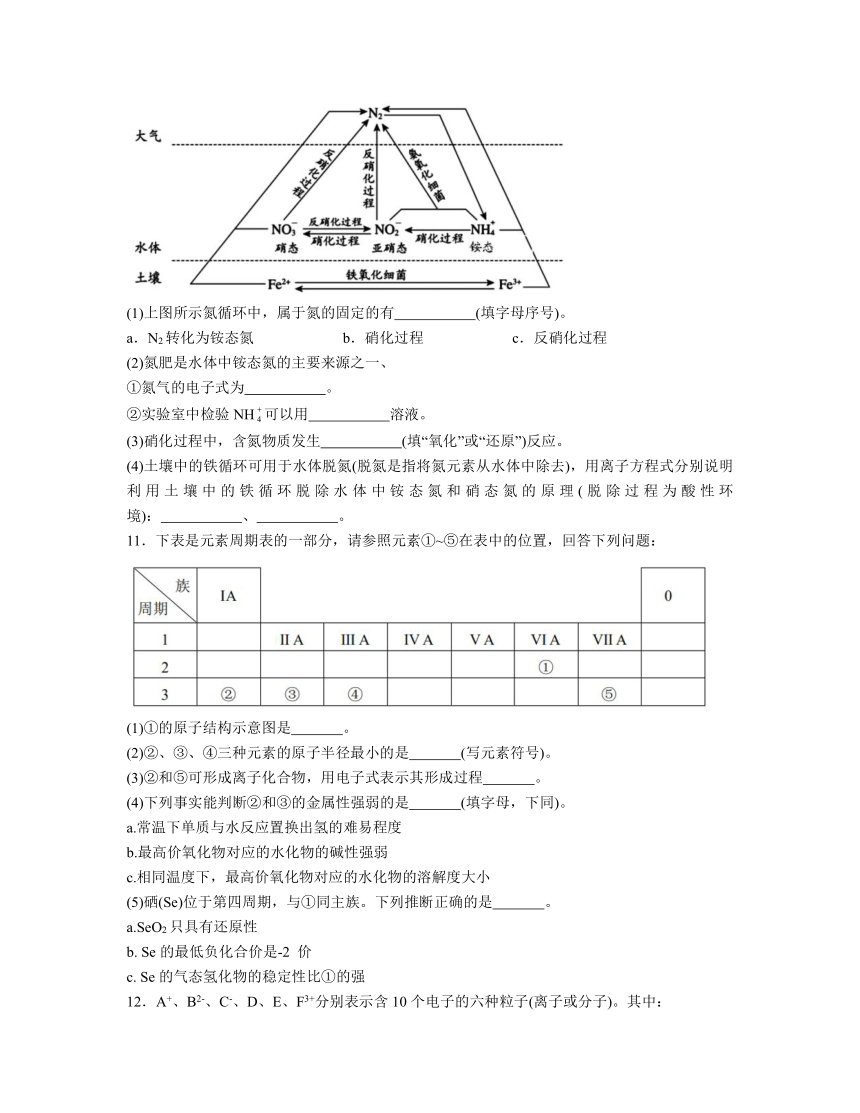
10.细菌可以促使铁、氮两种元素进行氧化还原反应,并耦合两种元素的循环。耦合循环中的部分转化如下图所示。
(1)上图所示氮循环中,属于氮的固定的有 (填字母序号)。
a.N2转化为铵态氮 b.硝化过程 c.反硝化过程
(2)氮肥是水体中铵态氮的主要来源之一、
①氮气的电子式为 。
②实验室中检验NH可以用 溶液。
(3)硝化过程中,含氮物质发生 (填“氧化”或“还原”)反应。
(4)土壤中的铁循环可用于水体脱氮(脱氮是指将氮元素从水体中除去),用离子方程式分别说明利用土壤中的铁循环脱除水体中铵态氮和硝态氮的原理(脱除过程为酸性环境): 、 。
11.下表是元素周期表的一部分,请参照元素①~⑤在表中的位置,回答下列问题:
(1)①的原子结构示意图是 。
(2)②、③、④三种元素的原子半径最小的是 (写元素符号)。
(3)②和⑤可形成离子化合物,用电子式表示其形成过程 。
(4)下列事实能判断②和③的金属性强弱的是 (填字母,下同)。
a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
(5)硒(Se)位于第四周期,与①同主族。下列推断正确的是 。
a.SeO2只具有还原性
b. Se的最低负化合价是-2 价
c. Se的气态氢化物的稳定性比①的强
12.A+、B2-、C-、D、E、F3+分别表示含10个电子的六种粒子(离子或分子)。其中:
a.A+、B2-、F3+核外电子层结构相同
b.C-是由两种元素组成的
c.D是两种元素组成的四原子分子
d.E在常温下是无色液体
e.往含F3+的溶液中滴加含C-的溶液至过量,先有白色沉淀生成,后白色沉淀消失
(1)C-的电子式 。
(2)A+、B2-、F3+离子半径由大到小的顺序为 (用离子符号表示)。
(3)含F3+的溶液中通入过量D,反应的离子方程式是 。
(4)A单质与E反应的离子方程式为 ,生成的化合物中化学键的类型是 。
【参考答案】
一、选择题
1.C
【分析】X、Y、Z、R、W是五种短周期元素,原子序数依次增大,其中X是形成化合物最多的元素,则X为C,Y、R同主族,X、Y、Z、W四种元素能形成化合物Z2Y和XW4,则Y为O,Z为Na,R为S,W为Cl。
解析:A.根据层多径大,同电子层结构核多径小,则简单离子半径的大小顺序:R>Y>Z,故A错误;
B.根据同周期从左到右非金属性逐渐增强,其气态氢化物稳定在增强,则气态氢化物的稳定性:HmW>HnR,故B错误;
C.化合物Z2R2Y3(Na2S2O3)水溶液与W的氢化物(HCl)反应生成二氧化硫、硫单质和氯化钠,反应能够生成沉淀,故C正确;
D.R2W2(S2Cl2)含有极性键和非极性键,Z2Y2(Na2O2)含有离子键和非极性键,两者具有的化学键类型不全相同,故D错误。
综上所述,答案为C。
2.D
解析:A.K3C60为离子化合物,含有离子键,C、C之间为非极性共价键,故A正确;
B.C、C之间为非极性共价键,故B正确;
C.K3C60晶体在熔融状态下破坏了离子键,有自由移动的离子,能导电,故C正确;
D.C60为单质,12C为原子,不互为同素异形体,故D错误;
故选D。
3.D
解析:A.分子中含有碳氧极性键,没有非极性键,故A错误;
B.是离子化合物,其电子式:,故B错误;
C.硫化氢是共价化合物,其电子式为,故C错误;
D.(肼)中含有氮氮单键和氮氢单键,其结构式: ,故D正确。
综上所述,答案为D。
4.C
【分析】原子结构示意图判断,核内数字表示质子数,也是原子序数,核外数字表示各层电子数,根据电子排布原则进行判断;球棍模型根据分子的结构判断,而结构通过杂化类型判断;最简式是化学式中各原子的最简比;物质的分子式表示根据物质的组成进行判断。
解析:A.根据硫原子的原子序数是16判断,核内质子数是16,核外电子数也是16,故A不正确;
B.根据杂化类型判断,二硫化碳中碳采用sp杂化,空间构型是直线型,故B不正确;
C.根据甲酸甲酯的结构简式为HCOOCH3,最简式为CH2O,故C正确;
D.氯化钙是离子化合物,不是由分子构成,故D不正确;
故选答案D。
【点睛】此题考查化学用语,根据基本概念进行判断,注意物质的化学式不一定是分子式,需要根据物质的组成进行判断。
5.D
解析:A.氧化钠中只含有离子键,A不符合题意;
B.二氧化碳中只含有共价键,B不符合题意;
C.氯化镁中只含有离子键,C不符合题意;
D.氢氧化钠中,氢氧根与钠离子之间形成离子键,氢氧根中含有共价键,D符合题意;
故答案选D。
6.C
解析:A.二氧化碳的结构式为O=C=O,A选项错误;
B.乙烯的结构简式为CH2=CH2,B选项错误;
C .水分子的分子结构空间构型为折线型,C选项正确;
D.氯原子结构示意图中最外层电子数为7,D选项错误;
答案选C。
7.A
解析:A.氯化钠是离子化合物,其电子式为,A正确;
B.S2-是硫原子得到2个电子形成的离子,结构示意图应为,B错误;
C.CO2分子的结构式应为,C错误;
D.核素的表示方法为:元素符号左下角为质子数,左上角为质量数;中子数为10的氧的核素应为,D错误;
故选A。
8.C
解析:A.共价化合物包括分子晶体和共价晶体,而离子化合物的熔点有可能比共价晶体的熔点低,A错误;
B.铵盐如NH4Cl就是非金属原子构成的离子化合物,B错误;
C.离子化合物熔融时电离可以导电,共价化合物熔融时不电离不导电,故可以用熔融时能否导电来判断,C正确;
D.共价化合物中只有共价键,没有离子键,D错误;
故选C。
二、非选择题
9.(1)CO
(2) H2O
(3)27.977×92.23%+28.976×4.67%+29.974×3.10%
(4)D
(5) 0.1NA 4.48L
解析:(1)由质量守恒定律可知:反应前后,原子种类、数目均不变,由反应的化学方程式SiO2+3CSiC+2X↑可知,反应前硅、氧、碳原子个数分别为1、2、2,反应后的生成物中硅、氧、碳原子个数分别为1、0、0,根据反应前后原子种类、数目不变,2X分子中含有2个碳原子和2个氧原子,每个X分子由1个碳原子和1个氧原子构成,物质X的化学式为CO;
(2)某元素原子核外的M层上有3个电子,则该元素为Al,Al3+核外有10个电子,结构示意图为;某元素的最外层电子数是其核外电子层数3倍,该元素为O,O2-的电子式为;O2-有10个电子,10电子的三核微粒为H2O;
(3)一种元素的相对原子质量实际上是按其各种同位素原子所占百分含量计算而得的平均值,因此硅元素的相对原子质量为的计算式为27.977×92.23%+28.976×4.67%+29.974×3.10%;
(4)A.28Si转化为29Si只有中子的变化,化学变化研究的最小粒子是原子,因此原子核内的变化不属于化学变化,A错误;
B.29Si的近似相对原子质量为29,B错误;
C.28Si与30Si核外电子数均为14,C错误;
D.无定形硅和晶体硅是同种元素组成的不同单质,属于同素异形体,D正确;
故选D。
(5)4gSiC的物质的量为=0.1mol,含有C原子数目为0.1NA;由方程式可知,n(CO)=2n(SiC)=0.2mol,标况下的体积为0.2mol×22.4L/mol=4.48L。
10.(1)a
(2) NaOH
(3)氧化
(4)
解析:(1)氮的固定是指将氮元素从游离态转化为化合态,所以选a。
(2)①氮气是共价分子,分子内氮原子之间共用三对电子对,氮气的电子式为。
②在含有铵根离子溶液中加入氢氧化钠溶液,微热后会有氨气逸出,可以使红色石蕊试纸变蓝,则实验室中检验NH可以用NaOH溶液。
(3)由图知,硝化过程中氮元素化合价升高的,则硝化过程中,含氮物质发生氧化反应。
(4)由图知,铁离子和铵离子反应可以使水体脱氮,该反应中氮元素从-3价升高到0价、铁元素从+3价降低到+2价,则按得失电子数守恒、元素质量守恒得:、亚铁离子和硝酸根离子反应可以使水体脱氮,该反应中铁元素从+2价升高到+3价、氮元素从+5价降低到0价,则按得失电子数守恒、元素质量守恒得:,则土壤中的铁循环可用于水体脱氮的离子方程式分别为:和。
11. Al ab b
【分析】根据元素所在的位置关系可知,①为O元素,②为Na元素,③为Mg元素,④为Al元素,⑤为Cl元素,据此结合元素周期律及元素化合物的结构与性质分析解答。
解析:(1)①为O元素,原子序数为8,核外电子数为8,其原子结构示意图是;
(2)同周期元素从左到右原子半径依次减弱,所以②、③、④三种元素的原子半径最小的是Al;
(3)②为Na元素,⑤为Cl元素,两者通过离子键可形成离子化合物,用电子式表示其形成过程为:;
(4)a.常温下单质与水反应置换出氢气越容易,其金属性越强,a符合题意;
b.最高价氧化物对应的水化物的碱性越强,其金属性越强,b符合题意;
c.相同温度下,最高价氧化物对应的水化物的溶解度大小与物理性质有关,与其金属性无关,c错误;
故答案为:ab;
(5)硒(Se)位于第四周期,与①同主族,属于VIA族,同族元素的性质具有相似性与递变性,则
a.因为SeO2中Se的化合价为+4价,不是最高价,也不是最低价,处于中间价态的元素即具有还原性,也具有氧化性,故a错误;
b.Se位于VIA族,其最低负化合价的绝对值与最外层电子数之和为8,所以其最低负化合价是-2价,故b正确;
c.同族元素非金属性从上到下依次减弱,其气态氢化物的稳定性依次减弱,所以Se的气态氢化物的稳定性比①的弱,故c错误;
故答案为:b。
12. O2->Na+>Al3+ Al3++3NH3 H2O=Al(OH)3↓+3NH 2Na+2H2O=2Na++2OH-+H2↑ 离子键和极性键
【分析】A+、B2-、C-、D、E、F3+分别表示含10个电子的六种粒子(离子或分子),其中a.A+、B2-、F3+核外电子层结构相同,可知A为Na、B为O、F为Al;b.C-是由两种元素组成的,C-为OH-;c.D是两种元素组成的四原子分子,D为NH3;d.E在常温下是无色液体,E为H2O;往含F3+的溶液中滴加含C-的溶液至过量,先有白色沉淀生成,后白色沉淀消失,白色沉淀为氢氧化铝,综合分析可知:A为Na、B为O、C-为OH-、D为NH3、E为H2O 、F为Al,据此分析。
解析:(1)C-是氢氧根离子,氧原子最外层满足8电子结构,它的电子式为;
(2)A+、B2-、F3+分别为Na+、O2-、Al3+,核外电子排布相同的离子,核电荷数越大,原子核对核外电子的吸引能力越强,半径越小,半径由大到小的顺序为O2->Na+>Al3+;
(3)含F3+的溶液中通入过量D,发生的反应是铝离子和氨水的反应,反应的离子方程式是Al3++3NH3 H2O=Al(OH)3↓+3NH;
(4)钠单质与水反应生成氢氧化钠和氢气,离子方程式为2Na+2H2O=2Na++2OH-+H2↑,生成的化合物是氢氧化钠,化学键的类型是离子键和共价键
一、选择题
1.X、Y、Z、R、W是五种短周期元素,原子序数依次增大,其中X是形成化合物最多的元素,Y、R同主族,X、Y、Z、W四种元素能形成化合物Z2Y和XW4。下列说法正确的是
A.简单离子半径的大小顺序:R>Z>Y
B.气态氢化物的稳定性:HmW<HnR
C.化合物Z2R2Y3水溶液与W的氢化物反应能够生成沉淀
D.R2W2 和Z2Y2具有相同的化学键类型
2.北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质在熔融状态下能导电,具有良好的超导性。下列有关分析不正确的是
A.K3C60中含有离子键 B.K3C60中含有非极性共价键
C.该晶体融化过程中破坏了离子键 D.C60与12C互为同位素
3.下列化学用语表达正确的是
A.分子中含有非极性键 B.的电子式:
C.硫化氢 D.(肼)的结构式:
4.下列表示或说法正确的是
A.硫原子结构示意图: B.CS2的球棍模型:
C.甲酸甲酯的最简式:CH2O D.氯化钙的分子式:CaCl2
5.下列物质中,既含有离子键又含有共价键的是
A.Na2O B.CO2 C.MgCl2 D.NaOH
6.下列化学用语表述正确的是
A.二氧化碳分子的结构式: O-C-O B.乙烯的结构简式:CH2CH2
C.水分子的分子结构模型: D.氯原子的结构示意图:
7.下列有关化学用语中,正确的是
A.氯化钠的电子式: B.的结构示意图:
C.分子的结构式:O—C—O D.中子数为10的氧的核素:
8.物质结构决定性质,下列叙述正确的是
A.离子化合物熔沸点较高、共价化合物熔沸点较低
B.非金属原子间不可能形成离子化合物
C.确定某化合物为离子化合物,可以用熔融时能否导电来判断
D.共价化合物中可能有离子键
二、非选择题
9.“遂古之初,谁传道之?上下未形,何由考之?”屈原的《天问》中华民族对真理追求的坚韧与执着。
(1)在2021年5月15日,“天问一号”探测器成功实现环绕器和着陆巡视器的“两器分离”并成功着陆。“天问一号”采用了我国自主研制的高性能碳化硅增强铝基复合材料。工业上制取碳化硅的化学反应方程式为:SiO2+3CSiC+2X↑。
回答下列问题:
请写出X的化学式 。
(2)上述材料所涉及元素中,某元素原子核外的M层上有3个电子数,则其离子结构示意图为 ;某元素的最外层电子数是其核外电子层数3倍,则其简单离子的电子式为 ,请写出与它具有相电子数的三核微粒的化学式 。
(3)硅元素存在多种同位素。已知三种天然稳定同位素的数据如下:
硅的同位素 同位素的相对原子质量 自然界中各同位素原子的丰度
27.977 92.23%
28.976 4.67%
29.974 3.10%
请列出硅元素的相对原子质量为的计算式 。
(4)下列有关的说法正确的是
A.由变为的变化是化学变化
B.的近似相对原子质量为28
C.比原子核外多两个电子
D.硅元素的两种单质无定形硅和晶体硅互为同素异形体
(5)若生成4g碳化硅,则其中含有 个碳原子;生成4g碳化硅的同时,生成X气体的体积在标准状况下为 L。
10.细菌可以促使铁、氮两种元素进行氧化还原反应,并耦合两种元素的循环。耦合循环中的部分转化如下图所示。
(1)上图所示氮循环中,属于氮的固定的有 (填字母序号)。
a.N2转化为铵态氮 b.硝化过程 c.反硝化过程
(2)氮肥是水体中铵态氮的主要来源之一、
①氮气的电子式为 。
②实验室中检验NH可以用 溶液。
(3)硝化过程中,含氮物质发生 (填“氧化”或“还原”)反应。
(4)土壤中的铁循环可用于水体脱氮(脱氮是指将氮元素从水体中除去),用离子方程式分别说明利用土壤中的铁循环脱除水体中铵态氮和硝态氮的原理(脱除过程为酸性环境): 、 。
11.下表是元素周期表的一部分,请参照元素①~⑤在表中的位置,回答下列问题:
(1)①的原子结构示意图是 。
(2)②、③、④三种元素的原子半径最小的是 (写元素符号)。
(3)②和⑤可形成离子化合物,用电子式表示其形成过程 。
(4)下列事实能判断②和③的金属性强弱的是 (填字母,下同)。
a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
(5)硒(Se)位于第四周期,与①同主族。下列推断正确的是 。
a.SeO2只具有还原性
b. Se的最低负化合价是-2 价
c. Se的气态氢化物的稳定性比①的强
12.A+、B2-、C-、D、E、F3+分别表示含10个电子的六种粒子(离子或分子)。其中:
a.A+、B2-、F3+核外电子层结构相同
b.C-是由两种元素组成的
c.D是两种元素组成的四原子分子
d.E在常温下是无色液体
e.往含F3+的溶液中滴加含C-的溶液至过量,先有白色沉淀生成,后白色沉淀消失
(1)C-的电子式 。
(2)A+、B2-、F3+离子半径由大到小的顺序为 (用离子符号表示)。
(3)含F3+的溶液中通入过量D,反应的离子方程式是 。
(4)A单质与E反应的离子方程式为 ,生成的化合物中化学键的类型是 。
【参考答案】
一、选择题
1.C
【分析】X、Y、Z、R、W是五种短周期元素,原子序数依次增大,其中X是形成化合物最多的元素,则X为C,Y、R同主族,X、Y、Z、W四种元素能形成化合物Z2Y和XW4,则Y为O,Z为Na,R为S,W为Cl。
解析:A.根据层多径大,同电子层结构核多径小,则简单离子半径的大小顺序:R>Y>Z,故A错误;
B.根据同周期从左到右非金属性逐渐增强,其气态氢化物稳定在增强,则气态氢化物的稳定性:HmW>HnR,故B错误;
C.化合物Z2R2Y3(Na2S2O3)水溶液与W的氢化物(HCl)反应生成二氧化硫、硫单质和氯化钠,反应能够生成沉淀,故C正确;
D.R2W2(S2Cl2)含有极性键和非极性键,Z2Y2(Na2O2)含有离子键和非极性键,两者具有的化学键类型不全相同,故D错误。
综上所述,答案为C。
2.D
解析:A.K3C60为离子化合物,含有离子键,C、C之间为非极性共价键,故A正确;
B.C、C之间为非极性共价键,故B正确;
C.K3C60晶体在熔融状态下破坏了离子键,有自由移动的离子,能导电,故C正确;
D.C60为单质,12C为原子,不互为同素异形体,故D错误;
故选D。
3.D
解析:A.分子中含有碳氧极性键,没有非极性键,故A错误;
B.是离子化合物,其电子式:,故B错误;
C.硫化氢是共价化合物,其电子式为,故C错误;
D.(肼)中含有氮氮单键和氮氢单键,其结构式: ,故D正确。
综上所述,答案为D。
4.C
【分析】原子结构示意图判断,核内数字表示质子数,也是原子序数,核外数字表示各层电子数,根据电子排布原则进行判断;球棍模型根据分子的结构判断,而结构通过杂化类型判断;最简式是化学式中各原子的最简比;物质的分子式表示根据物质的组成进行判断。
解析:A.根据硫原子的原子序数是16判断,核内质子数是16,核外电子数也是16,故A不正确;
B.根据杂化类型判断,二硫化碳中碳采用sp杂化,空间构型是直线型,故B不正确;
C.根据甲酸甲酯的结构简式为HCOOCH3,最简式为CH2O,故C正确;
D.氯化钙是离子化合物,不是由分子构成,故D不正确;
故选答案D。
【点睛】此题考查化学用语,根据基本概念进行判断,注意物质的化学式不一定是分子式,需要根据物质的组成进行判断。
5.D
解析:A.氧化钠中只含有离子键,A不符合题意;
B.二氧化碳中只含有共价键,B不符合题意;
C.氯化镁中只含有离子键,C不符合题意;
D.氢氧化钠中,氢氧根与钠离子之间形成离子键,氢氧根中含有共价键,D符合题意;
故答案选D。
6.C
解析:A.二氧化碳的结构式为O=C=O,A选项错误;
B.乙烯的结构简式为CH2=CH2,B选项错误;
C .水分子的分子结构空间构型为折线型,C选项正确;
D.氯原子结构示意图中最外层电子数为7,D选项错误;
答案选C。
7.A
解析:A.氯化钠是离子化合物,其电子式为,A正确;
B.S2-是硫原子得到2个电子形成的离子,结构示意图应为,B错误;
C.CO2分子的结构式应为,C错误;
D.核素的表示方法为:元素符号左下角为质子数,左上角为质量数;中子数为10的氧的核素应为,D错误;
故选A。
8.C
解析:A.共价化合物包括分子晶体和共价晶体,而离子化合物的熔点有可能比共价晶体的熔点低,A错误;
B.铵盐如NH4Cl就是非金属原子构成的离子化合物,B错误;
C.离子化合物熔融时电离可以导电,共价化合物熔融时不电离不导电,故可以用熔融时能否导电来判断,C正确;
D.共价化合物中只有共价键,没有离子键,D错误;
故选C。
二、非选择题
9.(1)CO
(2) H2O
(3)27.977×92.23%+28.976×4.67%+29.974×3.10%
(4)D
(5) 0.1NA 4.48L
解析:(1)由质量守恒定律可知:反应前后,原子种类、数目均不变,由反应的化学方程式SiO2+3CSiC+2X↑可知,反应前硅、氧、碳原子个数分别为1、2、2,反应后的生成物中硅、氧、碳原子个数分别为1、0、0,根据反应前后原子种类、数目不变,2X分子中含有2个碳原子和2个氧原子,每个X分子由1个碳原子和1个氧原子构成,物质X的化学式为CO;
(2)某元素原子核外的M层上有3个电子,则该元素为Al,Al3+核外有10个电子,结构示意图为;某元素的最外层电子数是其核外电子层数3倍,该元素为O,O2-的电子式为;O2-有10个电子,10电子的三核微粒为H2O;
(3)一种元素的相对原子质量实际上是按其各种同位素原子所占百分含量计算而得的平均值,因此硅元素的相对原子质量为的计算式为27.977×92.23%+28.976×4.67%+29.974×3.10%;
(4)A.28Si转化为29Si只有中子的变化,化学变化研究的最小粒子是原子,因此原子核内的变化不属于化学变化,A错误;
B.29Si的近似相对原子质量为29,B错误;
C.28Si与30Si核外电子数均为14,C错误;
D.无定形硅和晶体硅是同种元素组成的不同单质,属于同素异形体,D正确;
故选D。
(5)4gSiC的物质的量为=0.1mol,含有C原子数目为0.1NA;由方程式可知,n(CO)=2n(SiC)=0.2mol,标况下的体积为0.2mol×22.4L/mol=4.48L。
10.(1)a
(2) NaOH
(3)氧化
(4)
解析:(1)氮的固定是指将氮元素从游离态转化为化合态,所以选a。
(2)①氮气是共价分子,分子内氮原子之间共用三对电子对,氮气的电子式为。
②在含有铵根离子溶液中加入氢氧化钠溶液,微热后会有氨气逸出,可以使红色石蕊试纸变蓝,则实验室中检验NH可以用NaOH溶液。
(3)由图知,硝化过程中氮元素化合价升高的,则硝化过程中,含氮物质发生氧化反应。
(4)由图知,铁离子和铵离子反应可以使水体脱氮,该反应中氮元素从-3价升高到0价、铁元素从+3价降低到+2价,则按得失电子数守恒、元素质量守恒得:、亚铁离子和硝酸根离子反应可以使水体脱氮,该反应中铁元素从+2价升高到+3价、氮元素从+5价降低到0价,则按得失电子数守恒、元素质量守恒得:,则土壤中的铁循环可用于水体脱氮的离子方程式分别为:和。
11. Al ab b
【分析】根据元素所在的位置关系可知,①为O元素,②为Na元素,③为Mg元素,④为Al元素,⑤为Cl元素,据此结合元素周期律及元素化合物的结构与性质分析解答。
解析:(1)①为O元素,原子序数为8,核外电子数为8,其原子结构示意图是;
(2)同周期元素从左到右原子半径依次减弱,所以②、③、④三种元素的原子半径最小的是Al;
(3)②为Na元素,⑤为Cl元素,两者通过离子键可形成离子化合物,用电子式表示其形成过程为:;
(4)a.常温下单质与水反应置换出氢气越容易,其金属性越强,a符合题意;
b.最高价氧化物对应的水化物的碱性越强,其金属性越强,b符合题意;
c.相同温度下,最高价氧化物对应的水化物的溶解度大小与物理性质有关,与其金属性无关,c错误;
故答案为:ab;
(5)硒(Se)位于第四周期,与①同主族,属于VIA族,同族元素的性质具有相似性与递变性,则
a.因为SeO2中Se的化合价为+4价,不是最高价,也不是最低价,处于中间价态的元素即具有还原性,也具有氧化性,故a错误;
b.Se位于VIA族,其最低负化合价的绝对值与最外层电子数之和为8,所以其最低负化合价是-2价,故b正确;
c.同族元素非金属性从上到下依次减弱,其气态氢化物的稳定性依次减弱,所以Se的气态氢化物的稳定性比①的弱,故c错误;
故答案为:b。
12. O2->Na+>Al3+ Al3++3NH3 H2O=Al(OH)3↓+3NH 2Na+2H2O=2Na++2OH-+H2↑ 离子键和极性键
【分析】A+、B2-、C-、D、E、F3+分别表示含10个电子的六种粒子(离子或分子),其中a.A+、B2-、F3+核外电子层结构相同,可知A为Na、B为O、F为Al;b.C-是由两种元素组成的,C-为OH-;c.D是两种元素组成的四原子分子,D为NH3;d.E在常温下是无色液体,E为H2O;往含F3+的溶液中滴加含C-的溶液至过量,先有白色沉淀生成,后白色沉淀消失,白色沉淀为氢氧化铝,综合分析可知:A为Na、B为O、C-为OH-、D为NH3、E为H2O 、F为Al,据此分析。
解析:(1)C-是氢氧根离子,氧原子最外层满足8电子结构,它的电子式为;
(2)A+、B2-、F3+分别为Na+、O2-、Al3+,核外电子排布相同的离子,核电荷数越大,原子核对核外电子的吸引能力越强,半径越小,半径由大到小的顺序为O2->Na+>Al3+;
(3)含F3+的溶液中通入过量D,发生的反应是铝离子和氨水的反应,反应的离子方程式是Al3++3NH3 H2O=Al(OH)3↓+3NH;
(4)钠单质与水反应生成氢氧化钠和氢气,离子方程式为2Na+2H2O=2Na++2OH-+H2↑,生成的化合物是氢氧化钠,化学键的类型是离子键和共价键
