第三章 铁 金属材料 测试题(含解析) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 第三章 铁 金属材料 测试题(含解析) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 277.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 22:04:51 | ||
图片预览



文档简介
第三章 铁金属材料 测试题
一、选择题
1.下列离子方程式书写正确的是
A.盐酸中滴入碳酸钠溶液:CO+ 2H+ =H2O + CO2↑
B.铁粉与稀硫酸反应:2Fe + 6H+ = 2Fe3+ + 3H2↑
C.盐酸中滴入氢氧化钠溶液:HCl + OH-=H2O + C1-
D.稀硫酸滴入氢氧化钡溶液:SO+ H+ + Ba2+ + OH-=BaSO4↓+ H2O
2.将23.0gNa溶于一定量水中,反应后溶液的体积为1.00L,设NA为阿伏加德罗常数的值,下列叙述错误的是
A.反应后溶液中c(OH-)为1.00mol/L B.反应后溶液中Na+数目为NA
C.反应生成标准状况下气体22.4L D.反应转移的电子数为NA
3.纳米氧化铝(Al2O3)可用于制作精美的陶瓷,氧化铝中铝元素的化合价为
A.+3 B.+2 C.-3 D.-2
4.由Na2O和Na2O2组成的混合物质量为35.8g,此混合物中氧元素的质量为12.8g。Na2O与Na2O2物质的量之比为
A.5:4 B.4:3 C.2:3 D.无法确定
5.下列氧化物中,前者为黑色,后者为白色的是
A.Fe3O4、Na2O2 B.FeO、Na2O
C.Fe2O3、NaHCO3 D.Al2O3、CuO
6.常温下,下列溶液可以用铝槽车装运的是
A.氢氧化钠溶液 B.浓盐酸 C.浓硫酸 D.稀硫酸
7.设NA为阿伏加德罗常数的值。下列说法错误的是
A.室温下,0.2mol·L-1的Na2SO4 溶液中含Na+ 数目为0.4NA
B.高温下,0.3mol Fe与足量水蒸气反应,生成的H2 分子数目为0.4NA
C.标准状况下, NA个HI 分子所占的体积约为22.4L
D.2.3g的金属钠与足量的O2 反应,转移的电子数目为0.1 NA
8.下列说法正确的是
A.用托盘天平称量时,将NaOH固体放在右盘内的滤纸上,读数为10.3g
B.用量筒准确量取16.25mL2.50mol/L的碳酸钠溶液
C.用同一针筒先后抽取80mL氯气、20mL水,振荡,气体完全溶解,溶液变为黄绿色
D.在试管中制备时,将吸有NaOH溶液的滴管插入溶液的底部
9.下列各物质对应的保存方法正确的是(盛装容器均为玻璃试剂瓶)
A.NaOH溶液 磨口玻璃塞 B.AgNO3溶液 棕色瓶
C.FeCl3溶液 加铁粉 D.Na 冷水中
10.下列过程对应的离子反应方程式书写正确的是
A.溶液与过量澄清石灰水混合:
B.通入冷的溶液:
C.向明矾溶液中通入过量氨气:
D.溶液中加入产生沉淀:
11.春秋初年,我国已掌握了冶铁技术。下列有关铁的化学反应的叙述正确的是
A.室温下,过量Fe与浓硝酸反应生成Fe(NO3)2
B.加热时,过量Fe与氯气反应生成FeCl2
C.高温下,铁与水蒸气反应有Fe3O4生成
D.高温下,铁粉与氧化铝粉末反应生成单质铝
12.室温下,下列各组离子在指定溶液中一定能大量共存的是
A.饱和氯水中: K+、Ca2+、NO、Ag+
B.0.1mol/LFe2(SO4)3的溶液中:I-、NH、Mg2+、NO
C.使酚酞溶液变红的溶液中:Ba2+、K+、HCO、NO
D.某澄清透明溶液中:K+、MnO、H+、SO
二、非选择题
13.化学式 Fe(OH)2 Fe(OH)3
颜色状态 白色固体 红褐色固体
与盐酸反应 Fe(OH)2+2H+=Fe2++2H2O Fe(OH)3+3H+=Fe3++3H2O
受热分解 -
制备 可溶性亚铁盐与碱溶液反应: 可溶性铁盐与碱溶液反应:
二者的关系 在空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色絮状沉淀迅速变成 色,最后变成 色,反应的化学方程式为
14.北宋张潜在其《浸铜要略序》一书中对铜的冶炼有如下记载:“山麓有胆泉,土人汲以浸铁,数日辄类朽木,刮取其屑,锻炼成铜”。
(1)书中提及的“胆泉”为硫酸铜溶液,“浸铁”即将铁放入其中,写出此冶炼铜方法中生成铜的化学方程式 。
(2)若“浸铁”前后溶液中存在的离子种类如图所示,其中“ ”、“”、“”表示不同种类的离子,则“”表示 (填写离子符号)。
15.铁的氧化物的组成与性质差异明显,在化工生产等领域有着广泛的应用。补全下列表格。
化学式
颜色
铁元素的化合价
与稀硫酸反应的离子方程式
16.2020 年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性。其中含氯消毒剂在生产生活中有着广泛的用途。
(1)①写出实验室中制取氯气的离子方程式 ;
②已知KMnO4与浓盐酸反应的化学方程式如下,该反应也可以用来制取氯气:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O 15.8 g KMnO4能和 mol HCl发生上述反应、产生的Cl2在标准状况下的体积为 L;
③实验室还可以利用如下反应制取氯气:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。若制取标准状况下6.72 L氯气,反应过程中转移电子的物质的量为 mol;
(2)常温下,氯气与烧碱溶液反应得“84”消毒液,NaClO 是“84”消毒液的有效成分,在此次抗击新冠病毒中发挥了重要作用 ,浸泡衣物时加入“84”消毒液在空气中放置一段时间漂白效果更好,原因用化学方程式表示为: ;
17.铜、铁、锌等质量合成的合金W g,加入FeCl3和盐酸的混合液中,充分反应后:
(1)若无固体剩余,则溶液中的阳离子一定有 ,还可能有 。
(2)若剩余固体为g,则溶液中的阳离子一定有 ,可能还有 。一定没有 。
(3)若剩余固体为g,则溶液中的阳离子一定有 ,一定没有 。
18.已知 2FeCl3+Fe=3FeCl2。在 FeCl3 溶液中加入一定量的 Fe,当反应进行到氯化铁和氯化亚铁的质量分数相等时,求此刻已参加反应的氯化铁和剩余的氯化铁的质量比 。(相对分子质量 FeCl3:162.5 FeCl2:127 )
19.(1)碱洗铝材除其表面的氧化膜,碱洗时常有气泡冒出,原因是 (用离子方程式表示)。为将碱洗后溶液中的铝以沉淀形式回收,最好应加入下列试剂中的 (填字母)。
a.稀H2SO4 b.盐酸 c.CO2 d.氨水 e.NaOH
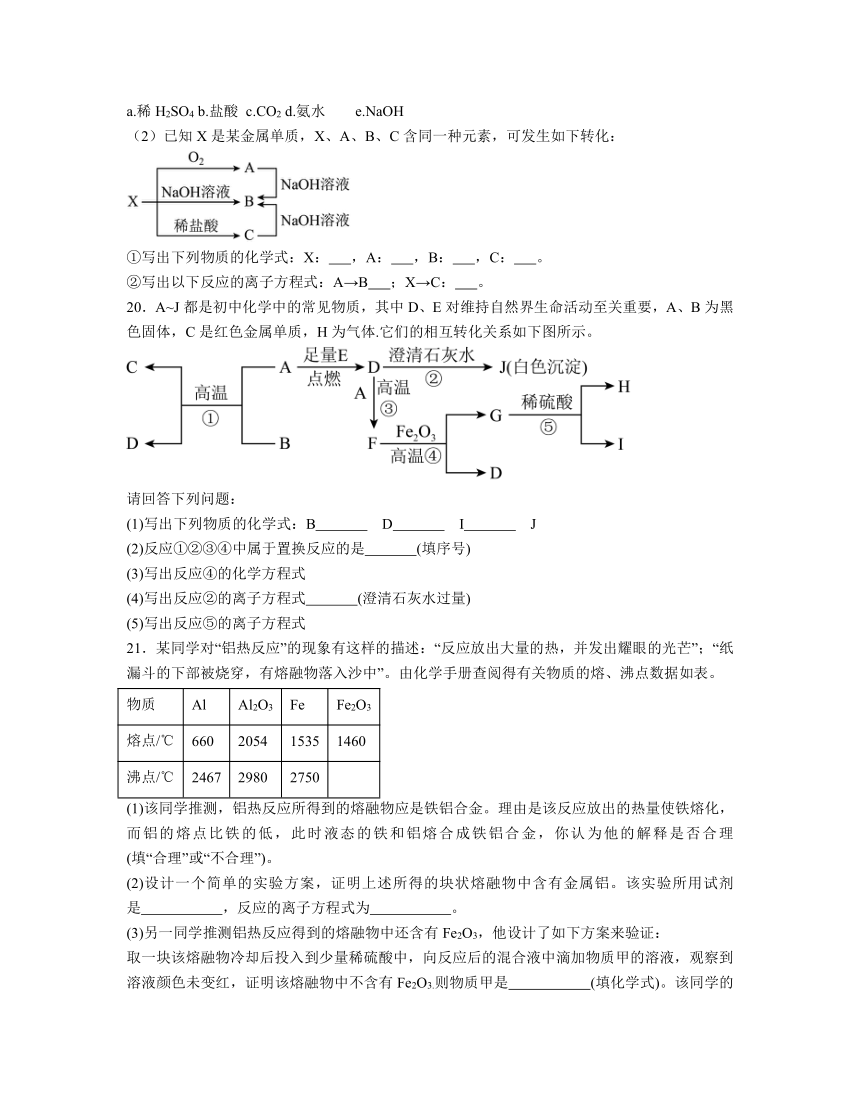
(2)已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:
①写出下列物质的化学式:X: ,A: ,B: ,C: 。
②写出以下反应的离子方程式:A→B ;X→C: 。
20.A~J都是初中化学中的常见物质,其中D、E对维持自然界生命活动至关重要,A、B为黑色固体,C是红色金属单质,H为气体.它们的相互转化关系如下图所示。
请回答下列问题:
(1)写出下列物质的化学式:B D I J
(2)反应①②③④中属于置换反应的是 (填序号)
(3)写出反应④的化学方程式
(4)写出反应②的离子方程式 (澄清石灰水过量)
(5)写出反应⑤的离子方程式
21.某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔、沸点数据如表。
物质 Al Al2O3 Fe Fe2O3
熔点/℃ 660 2054 1535 1460
沸点/℃ 2467 2980 2750
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,你认为他的解释是否合理 (填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是 ,反应的离子方程式为 。
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物冷却后投入到少量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有Fe2O3.则物质甲是 (填化学式)。该同学的实验方案是否合理? (填“合理”或“不合理”)。理由: 。
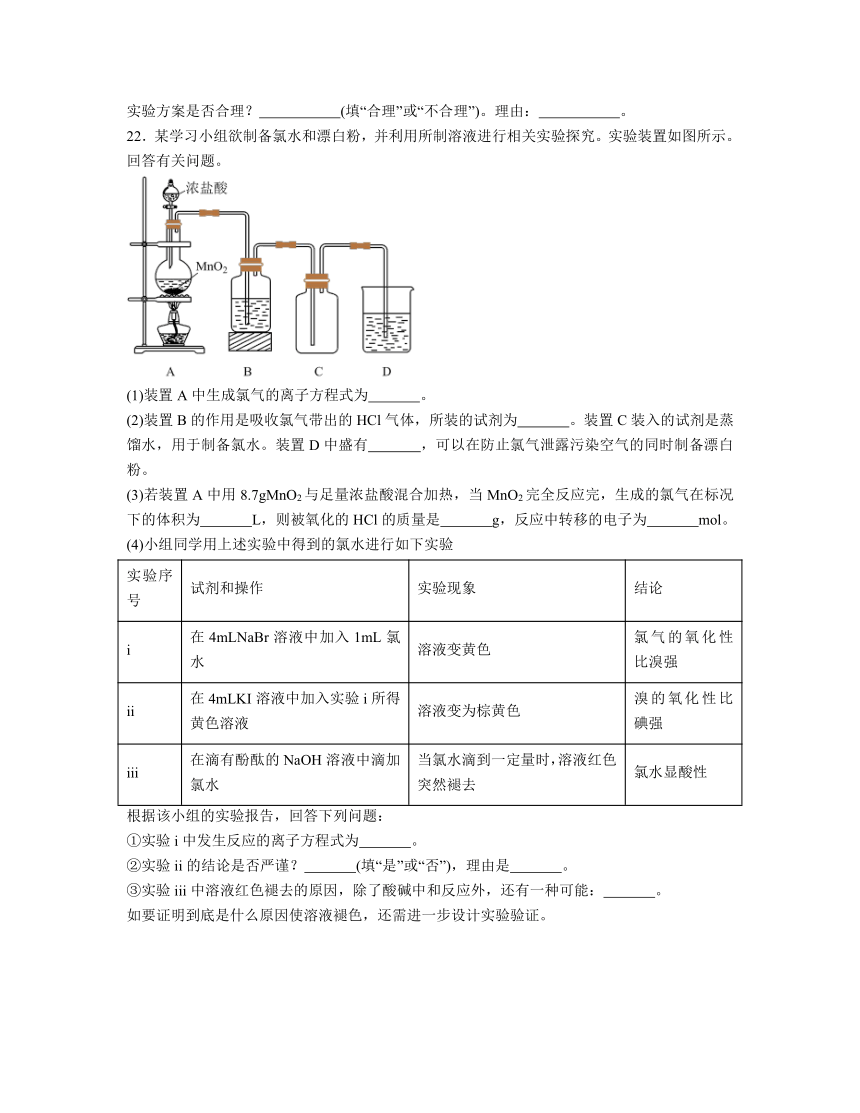
22.某学习小组欲制备氯水和漂白粉,并利用所制溶液进行相关实验探究。实验装置如图所示。回答有关问题。
(1)装置A中生成氯气的离子方程式为 。
(2)装置B的作用是吸收氯气带出的HCl气体,所装的试剂为 。装置C装入的试剂是蒸馏水,用于制备氯水。装置D中盛有 ,可以在防止氯气泄露污染空气的同时制备漂白粉。
(3)若装置A中用8.7gMnO2与足量浓盐酸混合加热,当MnO2完全反应完,生成的氯气在标况下的体积为 L,则被氧化的HCl的质量是 g,反应中转移的电子为 mol。
(4)小组同学用上述实验中得到的氯水进行如下实验
实验序号 试剂和操作 实验现象 结论
i 在4mLNaBr溶液中加入1mL氯水 溶液变黄色 氯气的氧化性比溴强
ii 在4mLKI溶液中加入实验i所得黄色溶液 溶液变为棕黄色 溴的氧化性比碘强
iii 在滴有酚酞的NaOH溶液中滴加氯水 当氯水滴到一定量时,溶液红色突然褪去 氯水显酸性
根据该小组的实验报告,回答下列问题:
①实验i中发生反应的离子方程式为 。
②实验ii的结论是否严谨? (填“是”或“否”),理由是 。
③实验iii中溶液红色褪去的原因,除了酸碱中和反应外,还有一种可能: 。
如要证明到底是什么原因使溶液褪色,还需进一步设计实验验证。
【参考答案】
一、选择题
1.A
解析:A.HCl与Na2CO3反应,实质是H+与反应,对应离子方程式为:2H++=CO2↑+H2O,A正确;
B.Fe与稀硫酸反应生成Fe2+,对应离子方程式为:Fe+2H+=Fe2++H2↑,B错误;
C.HCl属于强酸,书写离子方程式时应拆写为离子形式,正确离子方程式为:H++OH-=H2O,C错误;
D.Ba(OH)2与H2SO4反应时,Ba2+、、BaSO4系数为1,对应H+、OH-、H2O系数应为2,正确离子方程式为:2H++2OH-+Ba2++=BaSO4↓+2H2O,D错误;
故答案选A。
2.C
【分析】23.0gNa的物质的量为1mol,将23.0gNa溶于一定量水中,发生反应2Na+2H2O=2NaOH+H2↑。
解析:A.1molNa和水反应生成1mol氢氧化钠,反应后溶液中c(OH-)为1mol÷1L=1.00mol/L,故A正确;
B.23.0gNa的物质的量为1mol,所以反应后溶液中Na+数目为NA,故B正确;
C.根据2Na+2H2O=2NaOH+H2↑,1molNa生成0.5mol氢气,反应生成标准状况下气体11.2L,故C错误;
D.2Na+2H2O=2NaOH+H2↑反应,钠元素化合价由0升高为+1,1mol钠反应转移的电子数为NA,故D正确;
选C。
3.A
解析:纳米氧化铝(Al2O3)可用于制作精美的陶瓷,氧化铝中氧元素的化合价为-2价,Al元素的化合价为x,设根据化合物的正负化合价代数和为零可得,则2x+3(-2)=0,解得:x=+3,故氧化铝(Al2O3)中Al元素的化合价为+3价,答案选A。
4.C
解析:混合物中钠元素的质量为35.8g-12.8g=23g,混合物中钠原子的物质的量为=1mol,混合物中氧原子的物质的量为=0.8mol;
令Na2O与Na2O2物质的量分别为x、y,则:
解得:x=0.2mol,y=0.3mol
故Na2O与Na2O2物质的量之比为0.2mol:0.3mol=2:3,
故选C。
5.B
解析:A.Fe3O4为黑色,Na2O2为淡黄色,A错误;
B.FeO为黑色,Na2O为白色,B正确;
C.Fe2O3为红棕色,NaHCO3为白色,C错误;
D.Al2O3为白色,CuO为黑色,D错误;
答案选B。
6.C
解析:A.铝能与氢氧化钠反应生成偏铝酸钠和氢气,则不能用铝槽车装运氢氧化钠溶液,A与题意不符;
B.铝能与浓盐酸反应生成氯化铝和氢气,则不能用铝槽车装运浓盐酸,B与题意不符;
C.铝能与浓硫酸发生钝化,生成的致密氧化薄膜阻止铝与浓硫酸接触,能用铝槽车装运浓硫酸,C符合题意;
D.铝能与稀硫酸反应生成硫酸铝和氢气,则不能用铝槽车装运浓盐酸,D与题意不符;
答案为C。
7.A
解析:A.只有溶液浓度缺少溶液体积,不能计算微粒数目,A错误;
B.高温下Fe与水蒸气发生反应:3Fe+4H2O(g)Fe3O4+4H2,每3 mol Fe反应产生4 mol H2,则0.3 mol Fe反应产生H2的物质的量为0.4mol,故反应产生H2的数目是0.4NA,B正确;
C.标准状况下 NA个HI 分子为1mol,所占的体积约为22.4L,C正确;
D.2.3 gNa的物质的量是0.1 mol,由于Na是+1价金属,所以0.1 mol Na与足量的O2反应,转移电子的物质的量是0.1 mol,则转移的电子数目为0.1NA,D正确;
故选A。
8.D
解析:A.氢氧化钠固体会吸收空气中的二氧化碳和水蒸气,所以用托盘天平称量氢氧化钠固体时,应将氢氧化钠放在玻璃器皿中称量,故A错误;
B.量筒是粗量器,不可能准确量取16.25mL2.50mol/L的碳酸钠溶液,故B错误;
C.常温常压下,1体积水只能溶解2体积氯气,所以80mL氯气不能完全溶于20mL水中,故C错误;
D.在试管中制备氢氧化亚铁时,将吸有氢氧化钠溶液的滴管插入硫酸亚铁溶液的底部可以减少空气中的氧气进入,防止氢氧化亚铁被氧化,故D正确;
故选D。
9.B
解析:A.NaOH能与玻璃中的SiO2反应生成Na2SiO3具有黏性,因此装NaOH溶液的容器不能用磨口玻璃塞,A错误;
B.AgNO3见光易分解,因此使用棕色瓶盛装,B正确;
C.FeCl3能与Fe反应生成FeCl2,因此保存FeCl3时不能加铁粉,C错误;
D.Na能与冷水反应,生成氢氧化钠和氢气,Na通常保存在煤油中,D错误;
故答案选B。
10.B
解析:A.小苏打溶液与过量澄清石灰水混合,离子方程式为:Ca2++OH-+═CaCO3↓+H2O,故A错误;
B.将Cl2通入冷的NaOH溶液生成NaCl和NaClO,离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故B正确;
C.氨水是弱碱溶液,因此能与明矾溶液中的Al3+结合生成Al(OH)3沉淀,但不能将其转化为,故C错误;
D.FeSO4溶液中加入H2O2产生氢氧化铁沉淀和硫酸,其反应的离子方程式为:2Fe2++H2O2+4H2O═2Fe(OH)3↓+4H+,故D错误;
故选:B。
11.C
解析:A.室温下,Fe在浓硝酸中钝化,无法持续反应,A错误;
B.氯气氧化性较强,无论Fe是否过量,与氯气加热反应都只生成FeCl3,B错误;
C.高温条件下,Fe与水蒸气反应得到Fe3O4和H2,C正确;
D.Fe的活动性不如Al,不能从氧化铝中置换出Al单质,D错误;
故选:C。
12.D
解析:A.饱和氯水存在Cl-,Cl-和Ag+会反应生成AgCl沉淀,不能大量共存,故A不选;
B.0.1mol/LFe2(SO4)3的溶液中,I-会和Fe3+发生氧化还原反应,不能大量共存,故B不选;
C.使酚酞溶液变红的溶液中存在大量OH-,OH-会和HCO、Ba2+发生反应,不能大量共存,故C不选;
D.某澄清透明溶液中,K+、MnO、H+、SO之间不发生反应,可以大量共存,故D选;
答案为D。
二、非选择题
13. 2Fe(OH)3Fe2O3+3H2O Fe2++2OH-=Fe(OH)2↓ Fe3++3OH-=Fe(OH)3↓ 灰绿 红褐 4Fe(OH)2+O2+2H2O=4Fe(OH)3
解析:氢氧化铁受热分解生成氧化铁和水,2Fe(OH)3Fe2O3+3H2O;
可溶性亚铁盐与碱溶液中氢氧根离子生成氢氧化亚铁沉淀,Fe2++2OH-=Fe(OH)2↓;
可溶性铁盐与碱溶液中氢氧根离子生成氢氧化铁沉淀,Fe3++3OH-=Fe(OH)3↓;
在空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色絮状沉淀迅速变成灰绿色,最后变成红褐色,反应为氢氧化亚铁和氧气生成氢氧化铜,化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
14. Fe + CuSO4 === FeSO4 + Cu Fe2+
解析:(1)铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Fe + CuSO4 ===FeSO4 + Cu;
(2)铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为:Fe + CuSO4 ===FeSO4 + Cu,在反应前的溶液中含有硫酸根离子和铜离子,反应一段时间后,溶液中含有离子是亚铁离子、铜离子和硫酸根离子,由离子的变化可知,表示铜离子,表示亚铁离子, 表示硫酸根离子。
15. 黑色 红棕色 黑色 +2 +3 +2、+3 FeO+2H+=Fe2++H2O Fe2O3+6H+=2Fe3++3H2O Fe3O4+8H+=Fe2++2Fe3++4H2O
解析:、、分别为黑色、红棕色、黑色;、、中铁元素价态分别为:+2,+3,+2、+3;、、分别与稀硫酸反应的离子方程式为:FeO+2H+=Fe2++H2O、Fe2O3+6H+=2Fe3++3H2O、Fe3O4+8H+=Fe2++2Fe3++4H2O。
16.(1) MnO2+4H++2Cl-Mn2++Cl2↑+2H2O 0.8 5.6 0.5
(2)NaClO+H2O+CO2═HClO+NaHCO3
解析:(1)①在实验室中一般是用MnO2与浓盐酸混合加热,发生氧化还原反应产生MnCl2、Cl2、H2O,反应的离子方程式为:MnO2+4H++2Cl-Mn2++Cl2↑+2H2O;
②在反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中,每有2 mol KMnO4发生反应,反应消耗16 mol HCl,反应过程中转移10 mol电子,反应产生5 mol Cl2。15.8 g KMnO4的物质的量是0.1 mol,其完全反应消耗HCl的物质的量n(HCl)=;反应产生Cl2的物质的量n(Cl2)=,反应产生Cl2在标准状况下的体积V(HCl)=0.25 mol×22.4 L/mol=5.6 L;
③实验室还可以利用如下反应制取氯气:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。若制取标准状况下6.72 L氯气,(Cl2)=,根据反应方程式可知:每反应产生3 mol Cl2,反应过程中会转移5 mol电子,则反应产生了0.3 mol Cl2,反应过程中转移电子的物质的量为0.5 mol;
(2)浸泡衣物时加入“84”消毒液在空气中放置一段时间,NaClO、CO2、H2O会发生反应产生HClO、NaHCO3,溶液中HClO的浓度增大,因而漂白效果更好,原因用化学方程式表示为:NaClO+H2O+CO2═HClO+NaHCO3。
17.(1) Zn2+、Fe2+、Cu2+ H+、Fe3+
(2) Zn2+、Fe2+ H+ Fe3+、Cu2+
(3) Zn2+、Fe2+ Fe3+、Cu2+、H+
解析:(1)氯化铁能溶解铜、锌、铁,而盐酸只能溶解锌、铁,又因为三种金属性强弱顺序是Zn>Fe>Cu,所以若无固体剩余,则溶液中的阳离子一定有Zn2+、Fe2+、Cu2+,可能还含有Fe3+、H+;因此,本题正确答案是:Zn2+、Fe2+、Cu2+;H+、Fe3+;
(2)若剩余固体为 g,因为金属还原性:Zn>Fe>Cu,则剩余的固体一定是铜,则溶液中的阳离子一定有Zn2+、Fe2+,而一定没有铁离子和铜离子,氢离子可能含有,也可能没有;因此,本题正确答案是:Zn2+、Fe2+;H+;Fe3+、Cu2+;
(3)若剩余固体为g,因为金属还原性:Zn>Fe>Cu,则剩余的固体中一定含有铜、铁,所以溶液中的阳离子一定有Zn2+、Fe2+,而一定不会含有Fe3+、Cu2+、H+;因此,本题正确答案是:Zn2+、Fe2+;Fe3+、Cu2+、H+。
18.325:381
解析:当反应进行到氯化铁和氯化亚铁的质量分数相同时,设氯化铁的质量为m,那么氯化亚铁的质量也为m,参加反应的氯化铁质量为m1。
所以已参加反应的氯化铁和剩余的氯化铁的质量比是325m/381:m=325:381。
19.2Al+2OH-+2H2O=2AlO2-+3H2↑ c Al Al2O3 NaAlO2 AlCl3 Al2O3+2OH-=2AlO2-+H2O 2Al+6H+=2Al3++3H2↑
【分析】X即可以和碱反应,又可以和酸反应,故X是铝(Al),A是氧化铝(Al2O3),B是偏铝酸钠(NaAlO2),C是氯化铝(AlCl3),据此作答。
解析:(1)铝单质可以和碱反应生成氢气:2Al+2OH-+2H2O=2AlO2-+3H2↑,碱洗后,铝元素主要以偏绿酸根的形式存在,在加入盐酸和硫酸等强酸时会先生成沉淀,当酸过量,沉淀会溶解,碱不和偏铝酸盐反应,故选用二氧化碳;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;c;
(2)①根据推断可知:X是铝(Al),A是氧化铝(Al2O3),B是偏铝酸钠(NaAlO2),C是氯化铝(AlCl3);
②A→B的离子方程式为:Al2O3+2OH-=2AlO2-+H2O;X→C的离子方程式为:2Al+6H+=2Al3++3H2↑。
【点睛】即可以和碱反应,又可以和酸反应的金属单质是金属铝,注意铝三角的互相转换。
20.(1) CuO CO2 FeSO4 CaCO3
(2)①
(3)3CO+Fe2O32Fe+3CO2
(4)CO2+Ca2++2OH-=CaCO3↓+H2O
(5)Fe+2H+=Fe2++H2↑
解析:根据A-J都是初中化学中的常见物质,D、E对维持自然界生命活动至关重要,所以D、E可能是水、氧气或二氧化碳中的一种,C是红色的金属单质,所以C是铜,A、B为黑色固体,高温会生成铜和D,A在足量的E中可以燃烧,所以A是木炭,B就是氧化铜,D就是二氧化碳,木炭和氧气反应会生成二氧化碳,所以E是氧气,二氧化碳和木炭会生成一氧化碳,所以F是一氧化碳,二氧化碳和氢氧化钙反应会生成碳酸钙沉淀,所以J是碳酸钙,一氧化碳和氧化铁会生成铁和二氧化碳,G是铁,铁和稀硫酸反应会生成硫酸亚铁和氢气,H是一种气体,所以H是氢气,I是硫酸亚铁;据此解答。
(1)由上述分析可知,B是氧化铜(CuO),D是二氧化碳(CO2),I是硫酸亚铁(FeSO4),J是碳酸钙(CaCO3);答案为CuO;CO2;FeSO4;CaCO3。
(2)反应①为C+2CuO2Cu+CO2,反应②为CO2+Ca(OH)2=CaCO3↓+H2O,反应③为CO2+C2CO,反应④为3CO+Fe2O32Fe+3CO2,则反应①②③④中属于置换反应的是①;答案为①。
(3)反应④是一氧化碳和氧化铁在高温条件下发生反应生成铁和二氧化碳,其化学方程式为3CO+Fe2O32Fe+3CO2;答案为3CO+Fe2O32Fe+3CO2。
(4)反应②是二氧化碳和澄清石灰水(过量)发生反应生成碳酸钙沉淀和水,其离子方程式为CO2+Ca2++2OH-=CaCO3↓+H2O;答案为CO2+Ca2++2OH-=CaCO3↓+H2O。
(5)反应⑤是铁与稀硫酸发生反应生成硫酸亚铁和氢气,其离子方程式为Fe+2H+=Fe2++H2↑;答案为Fe+2H+=Fe2++H2↑。
21.(1)合理
(2) NaOH溶液 2Al+2OH-+2H2O=2+3H2↑
(3) KSCN 不合理 Fe3+可能被Fe全部还原为Fe2+而不能使KSCN溶液变红
解析:(1)铝的熔点比铁低,生成铁和液态铝一起滴落至盛有沙子的容器中形成合金,故铝热反应所得到的熔融物应是铁铝合金,故此处填:合理;
(2)铝与NaOH溶液反应生成气体,反应的离子方程式为2Al+2OH-+2H2O=2+3H2↑,所以可用NaOH溶液检验所得的块状熔融物中含有金属铝;
(3)氧化铁和稀硫酸反应生成硫酸铁,铁离子用硫氰化钾溶液检验,故答案为:KSCN;取一块该熔融物投入到少量稀硫酸中,向反应后的混合液中滴加物质硫氰化钾的溶液,Fe3+可能被Fe全部还原为Fe2+而不能使KSCN溶液变红,所以无法证明熔融物中不含有Fe2O3,所以该同学的实验方案不合理,故答案为:不合理、Fe3+可能被Fe全部还原为Fe2+而不能使KSCN溶液变红。
22.(1)
(2)饱和食盐水 石灰乳
(3) 2.24 7.3 0.2
(4) 否 实验i溶液中可能还有未反应完全的Cl2 强氧化性的HClO与酚酞发生反应
【分析】装置A为二氧化锰和浓盐酸反应生成氯化锰和氯气,反应的离子方程式为:,由于浓盐酸会挥发,制取氯气中含有杂质气体HCl,用装置B中饱和食盐水吸收HCl,氯气密度比空气大,用装置C的向上排空气法收集氯气,最后用装置D中Ca(OH)2溶液吸收氯气并制取漂白粉。
解析:(1)装置A为二氧化锰和浓盐酸反应生成氯化锰和氯气,反应的离子方程式为:。
(2)装置B的作用是吸收氯气带出的HCl气体,所装的试剂为饱和食盐水;装置C用于制备氯水,应装入的试剂是蒸馏水,装置D中盛有石灰乳,含有溶质质量更大,氯气和Ca(OH)2反应生成Ca(ClO)2制取漂白粉,由于氯气有毒,可防止氯气泄露污染空气。
(3)若装置A中用8.7gMnO2与足量浓盐酸混合加热,MnO2的物质的量为=0.1mol,由方程式可知生成的氯气物质的量为0.1mol,在标况下的体积为2.24L,被氧化的HCl的质量是0.2mol,质量为0.2mol×36.5g/mol=7.3g,Cl元素化合价由-1价上升到0价,生成0.1molCl2,转移0.2mol电子。
(4)①由氧化性:Cl2>Br2,实验i中发生反应的离子方程式为;
②由于实验i溶液中可能还有未反应完全的Cl2,也可以氧化KI,则实验ii的结论不严谨;
③实验iii中溶液红色褪去的原因,有可能是:强氧化性的HClO与酚酞发生反应
一、选择题
1.下列离子方程式书写正确的是
A.盐酸中滴入碳酸钠溶液:CO+ 2H+ =H2O + CO2↑
B.铁粉与稀硫酸反应:2Fe + 6H+ = 2Fe3+ + 3H2↑
C.盐酸中滴入氢氧化钠溶液:HCl + OH-=H2O + C1-
D.稀硫酸滴入氢氧化钡溶液:SO+ H+ + Ba2+ + OH-=BaSO4↓+ H2O
2.将23.0gNa溶于一定量水中,反应后溶液的体积为1.00L,设NA为阿伏加德罗常数的值,下列叙述错误的是
A.反应后溶液中c(OH-)为1.00mol/L B.反应后溶液中Na+数目为NA
C.反应生成标准状况下气体22.4L D.反应转移的电子数为NA
3.纳米氧化铝(Al2O3)可用于制作精美的陶瓷,氧化铝中铝元素的化合价为
A.+3 B.+2 C.-3 D.-2
4.由Na2O和Na2O2组成的混合物质量为35.8g,此混合物中氧元素的质量为12.8g。Na2O与Na2O2物质的量之比为
A.5:4 B.4:3 C.2:3 D.无法确定
5.下列氧化物中,前者为黑色,后者为白色的是
A.Fe3O4、Na2O2 B.FeO、Na2O
C.Fe2O3、NaHCO3 D.Al2O3、CuO
6.常温下,下列溶液可以用铝槽车装运的是
A.氢氧化钠溶液 B.浓盐酸 C.浓硫酸 D.稀硫酸
7.设NA为阿伏加德罗常数的值。下列说法错误的是
A.室温下,0.2mol·L-1的Na2SO4 溶液中含Na+ 数目为0.4NA
B.高温下,0.3mol Fe与足量水蒸气反应,生成的H2 分子数目为0.4NA
C.标准状况下, NA个HI 分子所占的体积约为22.4L
D.2.3g的金属钠与足量的O2 反应,转移的电子数目为0.1 NA
8.下列说法正确的是
A.用托盘天平称量时,将NaOH固体放在右盘内的滤纸上,读数为10.3g
B.用量筒准确量取16.25mL2.50mol/L的碳酸钠溶液
C.用同一针筒先后抽取80mL氯气、20mL水,振荡,气体完全溶解,溶液变为黄绿色
D.在试管中制备时,将吸有NaOH溶液的滴管插入溶液的底部
9.下列各物质对应的保存方法正确的是(盛装容器均为玻璃试剂瓶)
A.NaOH溶液 磨口玻璃塞 B.AgNO3溶液 棕色瓶
C.FeCl3溶液 加铁粉 D.Na 冷水中
10.下列过程对应的离子反应方程式书写正确的是
A.溶液与过量澄清石灰水混合:
B.通入冷的溶液:
C.向明矾溶液中通入过量氨气:
D.溶液中加入产生沉淀:
11.春秋初年,我国已掌握了冶铁技术。下列有关铁的化学反应的叙述正确的是
A.室温下,过量Fe与浓硝酸反应生成Fe(NO3)2
B.加热时,过量Fe与氯气反应生成FeCl2
C.高温下,铁与水蒸气反应有Fe3O4生成
D.高温下,铁粉与氧化铝粉末反应生成单质铝
12.室温下,下列各组离子在指定溶液中一定能大量共存的是
A.饱和氯水中: K+、Ca2+、NO、Ag+
B.0.1mol/LFe2(SO4)3的溶液中:I-、NH、Mg2+、NO
C.使酚酞溶液变红的溶液中:Ba2+、K+、HCO、NO
D.某澄清透明溶液中:K+、MnO、H+、SO
二、非选择题
13.化学式 Fe(OH)2 Fe(OH)3
颜色状态 白色固体 红褐色固体
与盐酸反应 Fe(OH)2+2H+=Fe2++2H2O Fe(OH)3+3H+=Fe3++3H2O
受热分解 -
制备 可溶性亚铁盐与碱溶液反应: 可溶性铁盐与碱溶液反应:
二者的关系 在空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色絮状沉淀迅速变成 色,最后变成 色,反应的化学方程式为
14.北宋张潜在其《浸铜要略序》一书中对铜的冶炼有如下记载:“山麓有胆泉,土人汲以浸铁,数日辄类朽木,刮取其屑,锻炼成铜”。
(1)书中提及的“胆泉”为硫酸铜溶液,“浸铁”即将铁放入其中,写出此冶炼铜方法中生成铜的化学方程式 。
(2)若“浸铁”前后溶液中存在的离子种类如图所示,其中“ ”、“”、“”表示不同种类的离子,则“”表示 (填写离子符号)。
15.铁的氧化物的组成与性质差异明显,在化工生产等领域有着广泛的应用。补全下列表格。
化学式
颜色
铁元素的化合价
与稀硫酸反应的离子方程式
16.2020 年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性。其中含氯消毒剂在生产生活中有着广泛的用途。
(1)①写出实验室中制取氯气的离子方程式 ;
②已知KMnO4与浓盐酸反应的化学方程式如下,该反应也可以用来制取氯气:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O 15.8 g KMnO4能和 mol HCl发生上述反应、产生的Cl2在标准状况下的体积为 L;
③实验室还可以利用如下反应制取氯气:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。若制取标准状况下6.72 L氯气,反应过程中转移电子的物质的量为 mol;
(2)常温下,氯气与烧碱溶液反应得“84”消毒液,NaClO 是“84”消毒液的有效成分,在此次抗击新冠病毒中发挥了重要作用 ,浸泡衣物时加入“84”消毒液在空气中放置一段时间漂白效果更好,原因用化学方程式表示为: ;
17.铜、铁、锌等质量合成的合金W g,加入FeCl3和盐酸的混合液中,充分反应后:
(1)若无固体剩余,则溶液中的阳离子一定有 ,还可能有 。
(2)若剩余固体为g,则溶液中的阳离子一定有 ,可能还有 。一定没有 。
(3)若剩余固体为g,则溶液中的阳离子一定有 ,一定没有 。
18.已知 2FeCl3+Fe=3FeCl2。在 FeCl3 溶液中加入一定量的 Fe,当反应进行到氯化铁和氯化亚铁的质量分数相等时,求此刻已参加反应的氯化铁和剩余的氯化铁的质量比 。(相对分子质量 FeCl3:162.5 FeCl2:127 )
19.(1)碱洗铝材除其表面的氧化膜,碱洗时常有气泡冒出,原因是 (用离子方程式表示)。为将碱洗后溶液中的铝以沉淀形式回收,最好应加入下列试剂中的 (填字母)。
a.稀H2SO4 b.盐酸 c.CO2 d.氨水 e.NaOH
(2)已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:
①写出下列物质的化学式:X: ,A: ,B: ,C: 。
②写出以下反应的离子方程式:A→B ;X→C: 。
20.A~J都是初中化学中的常见物质,其中D、E对维持自然界生命活动至关重要,A、B为黑色固体,C是红色金属单质,H为气体.它们的相互转化关系如下图所示。
请回答下列问题:
(1)写出下列物质的化学式:B D I J
(2)反应①②③④中属于置换反应的是 (填序号)
(3)写出反应④的化学方程式
(4)写出反应②的离子方程式 (澄清石灰水过量)
(5)写出反应⑤的离子方程式
21.某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔、沸点数据如表。
物质 Al Al2O3 Fe Fe2O3
熔点/℃ 660 2054 1535 1460
沸点/℃ 2467 2980 2750
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,你认为他的解释是否合理 (填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是 ,反应的离子方程式为 。
(3)另一同学推测铝热反应得到的熔融物中还含有Fe2O3,他设计了如下方案来验证:
取一块该熔融物冷却后投入到少量稀硫酸中,向反应后的混合液中滴加物质甲的溶液,观察到溶液颜色未变红,证明该熔融物中不含有Fe2O3.则物质甲是 (填化学式)。该同学的实验方案是否合理? (填“合理”或“不合理”)。理由: 。
22.某学习小组欲制备氯水和漂白粉,并利用所制溶液进行相关实验探究。实验装置如图所示。回答有关问题。
(1)装置A中生成氯气的离子方程式为 。
(2)装置B的作用是吸收氯气带出的HCl气体,所装的试剂为 。装置C装入的试剂是蒸馏水,用于制备氯水。装置D中盛有 ,可以在防止氯气泄露污染空气的同时制备漂白粉。
(3)若装置A中用8.7gMnO2与足量浓盐酸混合加热,当MnO2完全反应完,生成的氯气在标况下的体积为 L,则被氧化的HCl的质量是 g,反应中转移的电子为 mol。
(4)小组同学用上述实验中得到的氯水进行如下实验
实验序号 试剂和操作 实验现象 结论
i 在4mLNaBr溶液中加入1mL氯水 溶液变黄色 氯气的氧化性比溴强
ii 在4mLKI溶液中加入实验i所得黄色溶液 溶液变为棕黄色 溴的氧化性比碘强
iii 在滴有酚酞的NaOH溶液中滴加氯水 当氯水滴到一定量时,溶液红色突然褪去 氯水显酸性
根据该小组的实验报告,回答下列问题:
①实验i中发生反应的离子方程式为 。
②实验ii的结论是否严谨? (填“是”或“否”),理由是 。
③实验iii中溶液红色褪去的原因,除了酸碱中和反应外,还有一种可能: 。
如要证明到底是什么原因使溶液褪色,还需进一步设计实验验证。
【参考答案】
一、选择题
1.A
解析:A.HCl与Na2CO3反应,实质是H+与反应,对应离子方程式为:2H++=CO2↑+H2O,A正确;
B.Fe与稀硫酸反应生成Fe2+,对应离子方程式为:Fe+2H+=Fe2++H2↑,B错误;
C.HCl属于强酸,书写离子方程式时应拆写为离子形式,正确离子方程式为:H++OH-=H2O,C错误;
D.Ba(OH)2与H2SO4反应时,Ba2+、、BaSO4系数为1,对应H+、OH-、H2O系数应为2,正确离子方程式为:2H++2OH-+Ba2++=BaSO4↓+2H2O,D错误;
故答案选A。
2.C
【分析】23.0gNa的物质的量为1mol,将23.0gNa溶于一定量水中,发生反应2Na+2H2O=2NaOH+H2↑。
解析:A.1molNa和水反应生成1mol氢氧化钠,反应后溶液中c(OH-)为1mol÷1L=1.00mol/L,故A正确;
B.23.0gNa的物质的量为1mol,所以反应后溶液中Na+数目为NA,故B正确;
C.根据2Na+2H2O=2NaOH+H2↑,1molNa生成0.5mol氢气,反应生成标准状况下气体11.2L,故C错误;
D.2Na+2H2O=2NaOH+H2↑反应,钠元素化合价由0升高为+1,1mol钠反应转移的电子数为NA,故D正确;
选C。
3.A
解析:纳米氧化铝(Al2O3)可用于制作精美的陶瓷,氧化铝中氧元素的化合价为-2价,Al元素的化合价为x,设根据化合物的正负化合价代数和为零可得,则2x+3(-2)=0,解得:x=+3,故氧化铝(Al2O3)中Al元素的化合价为+3价,答案选A。
4.C
解析:混合物中钠元素的质量为35.8g-12.8g=23g,混合物中钠原子的物质的量为=1mol,混合物中氧原子的物质的量为=0.8mol;
令Na2O与Na2O2物质的量分别为x、y,则:
解得:x=0.2mol,y=0.3mol
故Na2O与Na2O2物质的量之比为0.2mol:0.3mol=2:3,
故选C。
5.B
解析:A.Fe3O4为黑色,Na2O2为淡黄色,A错误;
B.FeO为黑色,Na2O为白色,B正确;
C.Fe2O3为红棕色,NaHCO3为白色,C错误;
D.Al2O3为白色,CuO为黑色,D错误;
答案选B。
6.C
解析:A.铝能与氢氧化钠反应生成偏铝酸钠和氢气,则不能用铝槽车装运氢氧化钠溶液,A与题意不符;
B.铝能与浓盐酸反应生成氯化铝和氢气,则不能用铝槽车装运浓盐酸,B与题意不符;
C.铝能与浓硫酸发生钝化,生成的致密氧化薄膜阻止铝与浓硫酸接触,能用铝槽车装运浓硫酸,C符合题意;
D.铝能与稀硫酸反应生成硫酸铝和氢气,则不能用铝槽车装运浓盐酸,D与题意不符;
答案为C。
7.A
解析:A.只有溶液浓度缺少溶液体积,不能计算微粒数目,A错误;
B.高温下Fe与水蒸气发生反应:3Fe+4H2O(g)Fe3O4+4H2,每3 mol Fe反应产生4 mol H2,则0.3 mol Fe反应产生H2的物质的量为0.4mol,故反应产生H2的数目是0.4NA,B正确;
C.标准状况下 NA个HI 分子为1mol,所占的体积约为22.4L,C正确;
D.2.3 gNa的物质的量是0.1 mol,由于Na是+1价金属,所以0.1 mol Na与足量的O2反应,转移电子的物质的量是0.1 mol,则转移的电子数目为0.1NA,D正确;
故选A。
8.D
解析:A.氢氧化钠固体会吸收空气中的二氧化碳和水蒸气,所以用托盘天平称量氢氧化钠固体时,应将氢氧化钠放在玻璃器皿中称量,故A错误;
B.量筒是粗量器,不可能准确量取16.25mL2.50mol/L的碳酸钠溶液,故B错误;
C.常温常压下,1体积水只能溶解2体积氯气,所以80mL氯气不能完全溶于20mL水中,故C错误;
D.在试管中制备氢氧化亚铁时,将吸有氢氧化钠溶液的滴管插入硫酸亚铁溶液的底部可以减少空气中的氧气进入,防止氢氧化亚铁被氧化,故D正确;
故选D。
9.B
解析:A.NaOH能与玻璃中的SiO2反应生成Na2SiO3具有黏性,因此装NaOH溶液的容器不能用磨口玻璃塞,A错误;
B.AgNO3见光易分解,因此使用棕色瓶盛装,B正确;
C.FeCl3能与Fe反应生成FeCl2,因此保存FeCl3时不能加铁粉,C错误;
D.Na能与冷水反应,生成氢氧化钠和氢气,Na通常保存在煤油中,D错误;
故答案选B。
10.B
解析:A.小苏打溶液与过量澄清石灰水混合,离子方程式为:Ca2++OH-+═CaCO3↓+H2O,故A错误;
B.将Cl2通入冷的NaOH溶液生成NaCl和NaClO,离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故B正确;
C.氨水是弱碱溶液,因此能与明矾溶液中的Al3+结合生成Al(OH)3沉淀,但不能将其转化为,故C错误;
D.FeSO4溶液中加入H2O2产生氢氧化铁沉淀和硫酸,其反应的离子方程式为:2Fe2++H2O2+4H2O═2Fe(OH)3↓+4H+,故D错误;
故选:B。
11.C
解析:A.室温下,Fe在浓硝酸中钝化,无法持续反应,A错误;
B.氯气氧化性较强,无论Fe是否过量,与氯气加热反应都只生成FeCl3,B错误;
C.高温条件下,Fe与水蒸气反应得到Fe3O4和H2,C正确;
D.Fe的活动性不如Al,不能从氧化铝中置换出Al单质,D错误;
故选:C。
12.D
解析:A.饱和氯水存在Cl-,Cl-和Ag+会反应生成AgCl沉淀,不能大量共存,故A不选;
B.0.1mol/LFe2(SO4)3的溶液中,I-会和Fe3+发生氧化还原反应,不能大量共存,故B不选;
C.使酚酞溶液变红的溶液中存在大量OH-,OH-会和HCO、Ba2+发生反应,不能大量共存,故C不选;
D.某澄清透明溶液中,K+、MnO、H+、SO之间不发生反应,可以大量共存,故D选;
答案为D。
二、非选择题
13. 2Fe(OH)3Fe2O3+3H2O Fe2++2OH-=Fe(OH)2↓ Fe3++3OH-=Fe(OH)3↓ 灰绿 红褐 4Fe(OH)2+O2+2H2O=4Fe(OH)3
解析:氢氧化铁受热分解生成氧化铁和水,2Fe(OH)3Fe2O3+3H2O;
可溶性亚铁盐与碱溶液中氢氧根离子生成氢氧化亚铁沉淀,Fe2++2OH-=Fe(OH)2↓;
可溶性铁盐与碱溶液中氢氧根离子生成氢氧化铁沉淀,Fe3++3OH-=Fe(OH)3↓;
在空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色絮状沉淀迅速变成灰绿色,最后变成红褐色,反应为氢氧化亚铁和氧气生成氢氧化铜,化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
14. Fe + CuSO4 === FeSO4 + Cu Fe2+
解析:(1)铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Fe + CuSO4 ===FeSO4 + Cu;
(2)铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为:Fe + CuSO4 ===FeSO4 + Cu,在反应前的溶液中含有硫酸根离子和铜离子,反应一段时间后,溶液中含有离子是亚铁离子、铜离子和硫酸根离子,由离子的变化可知,表示铜离子,表示亚铁离子, 表示硫酸根离子。
15. 黑色 红棕色 黑色 +2 +3 +2、+3 FeO+2H+=Fe2++H2O Fe2O3+6H+=2Fe3++3H2O Fe3O4+8H+=Fe2++2Fe3++4H2O
解析:、、分别为黑色、红棕色、黑色;、、中铁元素价态分别为:+2,+3,+2、+3;、、分别与稀硫酸反应的离子方程式为:FeO+2H+=Fe2++H2O、Fe2O3+6H+=2Fe3++3H2O、Fe3O4+8H+=Fe2++2Fe3++4H2O。
16.(1) MnO2+4H++2Cl-Mn2++Cl2↑+2H2O 0.8 5.6 0.5
(2)NaClO+H2O+CO2═HClO+NaHCO3
解析:(1)①在实验室中一般是用MnO2与浓盐酸混合加热,发生氧化还原反应产生MnCl2、Cl2、H2O,反应的离子方程式为:MnO2+4H++2Cl-Mn2++Cl2↑+2H2O;
②在反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中,每有2 mol KMnO4发生反应,反应消耗16 mol HCl,反应过程中转移10 mol电子,反应产生5 mol Cl2。15.8 g KMnO4的物质的量是0.1 mol,其完全反应消耗HCl的物质的量n(HCl)=;反应产生Cl2的物质的量n(Cl2)=,反应产生Cl2在标准状况下的体积V(HCl)=0.25 mol×22.4 L/mol=5.6 L;
③实验室还可以利用如下反应制取氯气:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。若制取标准状况下6.72 L氯气,(Cl2)=,根据反应方程式可知:每反应产生3 mol Cl2,反应过程中会转移5 mol电子,则反应产生了0.3 mol Cl2,反应过程中转移电子的物质的量为0.5 mol;
(2)浸泡衣物时加入“84”消毒液在空气中放置一段时间,NaClO、CO2、H2O会发生反应产生HClO、NaHCO3,溶液中HClO的浓度增大,因而漂白效果更好,原因用化学方程式表示为:NaClO+H2O+CO2═HClO+NaHCO3。
17.(1) Zn2+、Fe2+、Cu2+ H+、Fe3+
(2) Zn2+、Fe2+ H+ Fe3+、Cu2+
(3) Zn2+、Fe2+ Fe3+、Cu2+、H+
解析:(1)氯化铁能溶解铜、锌、铁,而盐酸只能溶解锌、铁,又因为三种金属性强弱顺序是Zn>Fe>Cu,所以若无固体剩余,则溶液中的阳离子一定有Zn2+、Fe2+、Cu2+,可能还含有Fe3+、H+;因此,本题正确答案是:Zn2+、Fe2+、Cu2+;H+、Fe3+;
(2)若剩余固体为 g,因为金属还原性:Zn>Fe>Cu,则剩余的固体一定是铜,则溶液中的阳离子一定有Zn2+、Fe2+,而一定没有铁离子和铜离子,氢离子可能含有,也可能没有;因此,本题正确答案是:Zn2+、Fe2+;H+;Fe3+、Cu2+;
(3)若剩余固体为g,因为金属还原性:Zn>Fe>Cu,则剩余的固体中一定含有铜、铁,所以溶液中的阳离子一定有Zn2+、Fe2+,而一定不会含有Fe3+、Cu2+、H+;因此,本题正确答案是:Zn2+、Fe2+;Fe3+、Cu2+、H+。
18.325:381
解析:当反应进行到氯化铁和氯化亚铁的质量分数相同时,设氯化铁的质量为m,那么氯化亚铁的质量也为m,参加反应的氯化铁质量为m1。
所以已参加反应的氯化铁和剩余的氯化铁的质量比是325m/381:m=325:381。
19.2Al+2OH-+2H2O=2AlO2-+3H2↑ c Al Al2O3 NaAlO2 AlCl3 Al2O3+2OH-=2AlO2-+H2O 2Al+6H+=2Al3++3H2↑
【分析】X即可以和碱反应,又可以和酸反应,故X是铝(Al),A是氧化铝(Al2O3),B是偏铝酸钠(NaAlO2),C是氯化铝(AlCl3),据此作答。
解析:(1)铝单质可以和碱反应生成氢气:2Al+2OH-+2H2O=2AlO2-+3H2↑,碱洗后,铝元素主要以偏绿酸根的形式存在,在加入盐酸和硫酸等强酸时会先生成沉淀,当酸过量,沉淀会溶解,碱不和偏铝酸盐反应,故选用二氧化碳;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;c;
(2)①根据推断可知:X是铝(Al),A是氧化铝(Al2O3),B是偏铝酸钠(NaAlO2),C是氯化铝(AlCl3);
②A→B的离子方程式为:Al2O3+2OH-=2AlO2-+H2O;X→C的离子方程式为:2Al+6H+=2Al3++3H2↑。
【点睛】即可以和碱反应,又可以和酸反应的金属单质是金属铝,注意铝三角的互相转换。
20.(1) CuO CO2 FeSO4 CaCO3
(2)①
(3)3CO+Fe2O32Fe+3CO2
(4)CO2+Ca2++2OH-=CaCO3↓+H2O
(5)Fe+2H+=Fe2++H2↑
解析:根据A-J都是初中化学中的常见物质,D、E对维持自然界生命活动至关重要,所以D、E可能是水、氧气或二氧化碳中的一种,C是红色的金属单质,所以C是铜,A、B为黑色固体,高温会生成铜和D,A在足量的E中可以燃烧,所以A是木炭,B就是氧化铜,D就是二氧化碳,木炭和氧气反应会生成二氧化碳,所以E是氧气,二氧化碳和木炭会生成一氧化碳,所以F是一氧化碳,二氧化碳和氢氧化钙反应会生成碳酸钙沉淀,所以J是碳酸钙,一氧化碳和氧化铁会生成铁和二氧化碳,G是铁,铁和稀硫酸反应会生成硫酸亚铁和氢气,H是一种气体,所以H是氢气,I是硫酸亚铁;据此解答。
(1)由上述分析可知,B是氧化铜(CuO),D是二氧化碳(CO2),I是硫酸亚铁(FeSO4),J是碳酸钙(CaCO3);答案为CuO;CO2;FeSO4;CaCO3。
(2)反应①为C+2CuO2Cu+CO2,反应②为CO2+Ca(OH)2=CaCO3↓+H2O,反应③为CO2+C2CO,反应④为3CO+Fe2O32Fe+3CO2,则反应①②③④中属于置换反应的是①;答案为①。
(3)反应④是一氧化碳和氧化铁在高温条件下发生反应生成铁和二氧化碳,其化学方程式为3CO+Fe2O32Fe+3CO2;答案为3CO+Fe2O32Fe+3CO2。
(4)反应②是二氧化碳和澄清石灰水(过量)发生反应生成碳酸钙沉淀和水,其离子方程式为CO2+Ca2++2OH-=CaCO3↓+H2O;答案为CO2+Ca2++2OH-=CaCO3↓+H2O。
(5)反应⑤是铁与稀硫酸发生反应生成硫酸亚铁和氢气,其离子方程式为Fe+2H+=Fe2++H2↑;答案为Fe+2H+=Fe2++H2↑。
21.(1)合理
(2) NaOH溶液 2Al+2OH-+2H2O=2+3H2↑
(3) KSCN 不合理 Fe3+可能被Fe全部还原为Fe2+而不能使KSCN溶液变红
解析:(1)铝的熔点比铁低,生成铁和液态铝一起滴落至盛有沙子的容器中形成合金,故铝热反应所得到的熔融物应是铁铝合金,故此处填:合理;
(2)铝与NaOH溶液反应生成气体,反应的离子方程式为2Al+2OH-+2H2O=2+3H2↑,所以可用NaOH溶液检验所得的块状熔融物中含有金属铝;
(3)氧化铁和稀硫酸反应生成硫酸铁,铁离子用硫氰化钾溶液检验,故答案为:KSCN;取一块该熔融物投入到少量稀硫酸中,向反应后的混合液中滴加物质硫氰化钾的溶液,Fe3+可能被Fe全部还原为Fe2+而不能使KSCN溶液变红,所以无法证明熔融物中不含有Fe2O3,所以该同学的实验方案不合理,故答案为:不合理、Fe3+可能被Fe全部还原为Fe2+而不能使KSCN溶液变红。
22.(1)
(2)饱和食盐水 石灰乳
(3) 2.24 7.3 0.2
(4) 否 实验i溶液中可能还有未反应完全的Cl2 强氧化性的HClO与酚酞发生反应
【分析】装置A为二氧化锰和浓盐酸反应生成氯化锰和氯气,反应的离子方程式为:,由于浓盐酸会挥发,制取氯气中含有杂质气体HCl,用装置B中饱和食盐水吸收HCl,氯气密度比空气大,用装置C的向上排空气法收集氯气,最后用装置D中Ca(OH)2溶液吸收氯气并制取漂白粉。
解析:(1)装置A为二氧化锰和浓盐酸反应生成氯化锰和氯气,反应的离子方程式为:。
(2)装置B的作用是吸收氯气带出的HCl气体,所装的试剂为饱和食盐水;装置C用于制备氯水,应装入的试剂是蒸馏水,装置D中盛有石灰乳,含有溶质质量更大,氯气和Ca(OH)2反应生成Ca(ClO)2制取漂白粉,由于氯气有毒,可防止氯气泄露污染空气。
(3)若装置A中用8.7gMnO2与足量浓盐酸混合加热,MnO2的物质的量为=0.1mol,由方程式可知生成的氯气物质的量为0.1mol,在标况下的体积为2.24L,被氧化的HCl的质量是0.2mol,质量为0.2mol×36.5g/mol=7.3g,Cl元素化合价由-1价上升到0价,生成0.1molCl2,转移0.2mol电子。
(4)①由氧化性:Cl2>Br2,实验i中发生反应的离子方程式为;
②由于实验i溶液中可能还有未反应完全的Cl2,也可以氧化KI,则实验ii的结论不严谨;
③实验iii中溶液红色褪去的原因,有可能是:强氧化性的HClO与酚酞发生反应
