专题 化学能与热能(共50张PPT)
文档属性
| 名称 | 专题 化学能与热能(共50张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 23:08:29 | ||
图片预览









文档简介
(共50张PPT)
专题 化学能与热能
考情分析
高考命题分析
命 题 情 境 (1)日常生活情境:从新型化学电源(锂离子电池、钠离子电池、液流电池、燃料电池等)等情境选材,要求考生利用基本概念和原理解释化学中的现象。
(2)生产环保情境:从化工生产(如合成氨、电化学合成)等情境选材,理解反应原理,解决化工生产实际问题。
(3)学术探索情境:从最新与化学有关的学术研究成果选材,开拓学生的学科视野,提高学生的创新思维能力。
素 养 能 力 (1)理解与辨析能力:理解盖斯定律、原电池和电解池的工作原理,并能迁移应用于新型电池等,理解“两池”在生产、生活中的应用。
(2)分析与推测能力:基于质量守恒和能量守恒等规律,分析化学电源、反应机理等,分析物质的结构与变化、推测反应原理及结果。
(3)实践探索:依据原电池或电解池原理,结合实验探究目的(如物质的氧化性等)、图表信息等,设计实验方案,运用相关原理,描述实验现象并分析实验数据等,提升化学实验技能。
考题统计
化学能与热能:
广东卷(2023),山东卷(2023、2022、2021、2020),湖南卷(2023、2022、2021),重庆卷(2022),湖北卷(2023、2022、2021),海南卷(2022、2021),河北卷(2022、2021),辽宁卷(2021),浙江卷(2023、2022、2021、2020),江苏卷(2022、2021),全国新课标卷(2023)
聚焦核心要点
要点1反应中能量变化与热化学方程式
课标指引:1.知道内能是体系内物质的各种能量的总和,受温度、压强、物质的聚集状态的影响。 2.能用热化学方程式表示反应中的能量变化,能运用反应焓变合理选择和利用化学反应。
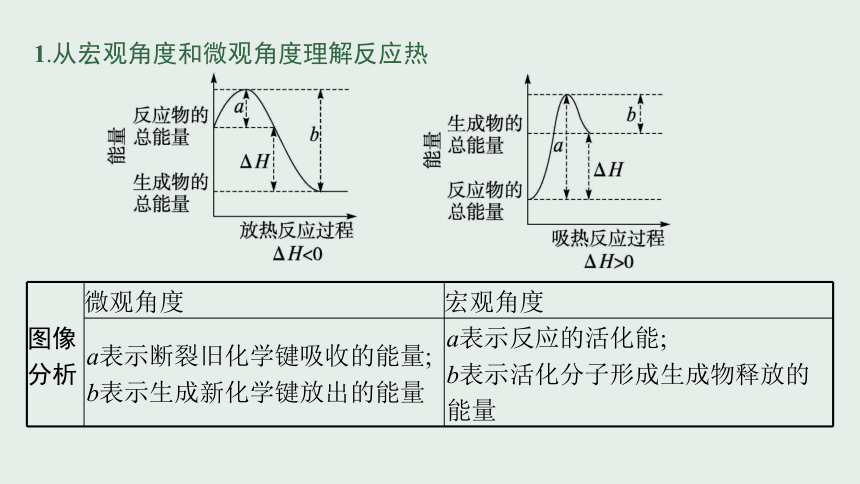
1.从宏观角度和微观角度理解反应热
图像 分析 微观角度 宏观角度
a表示断裂旧化学键吸收的能量; b表示生成新化学键放出的能量 a表示反应的活化能;
b表示活化分子形成生成物释放的能量
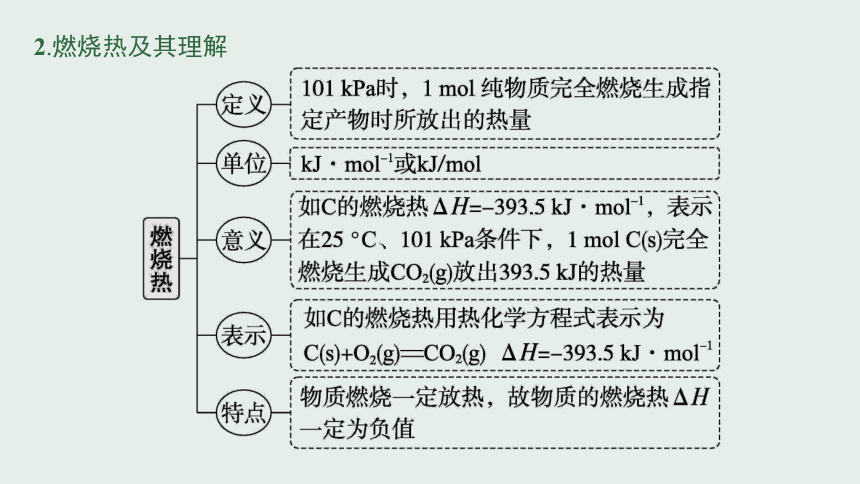
2.燃烧热及其理解
3.书写热化学方程式的“五步骤”
要点2ΔH的计算和盖斯定律
课标指引:1.认识化学能与热能的相互转化,恒温恒压条件下化学反应的反应热可以用焓变表示,能进行反应焓变的简单计算。 2.了解盖斯定律及其简单应用。
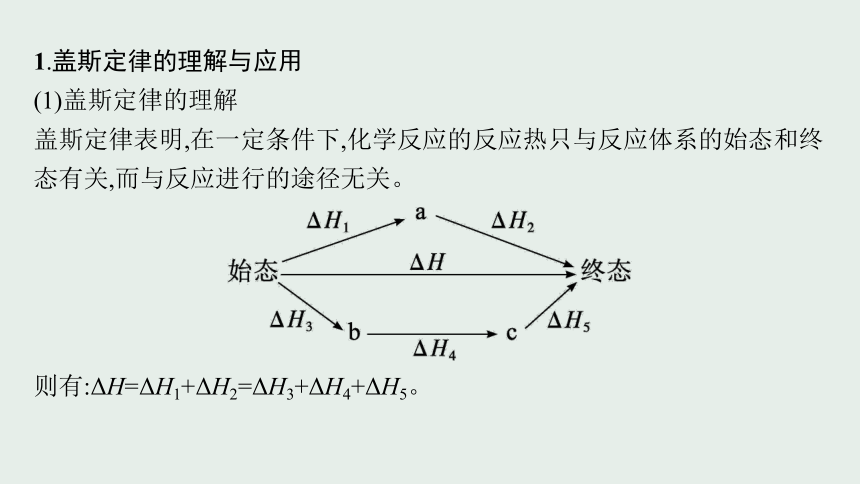
1.盖斯定律的理解与应用
(1)盖斯定律的理解
盖斯定律表明,在一定条件下,化学反应的反应热只与反应体系的始态和终态有关,而与反应进行的途径无关。
则有:ΔH=ΔH1+ΔH2=ΔH3+ΔH4+ΔH5。
(2)盖斯定律的应用
根据盖斯定律,可以利用已知反应的反应热来计算未知反应的反应热。
2.计算反应热(ΔH)的四种常用方法
(1)根据物质的能量(焓值)计算反应热:ΔH=生成物总能量-反应物总能量。
(2)根据键能计算反应热:ΔH=反应物的总键能-生成物的总键能。
(3)根据活化能计算反应热:ΔH=Ea(正反应)-Ea(逆反应)。
(4)根据盖斯定律计算反应热:将热化学方程式进行叠加,符合质量守恒和能量守恒规律。
易错辨析
用CH4催化还原NOx,可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g) ══ 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g) ══ 2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
试判断下列说法的正误。
1.若用0.1 mol CH4还原NO2生成N2和水蒸气,放出的热量为173.4 kJ。( )
×
①CH4(g)+4NO2(g) ══ 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g) ══ 2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
根据盖斯定律,①+②可得
2CH4(g)+4NO2(g) ══ 2N2(g)+2CO2(g)+4H2O(g) ΔH=-1 734 kJ·mol-1,则用0.1 mol CH4还原NO2生成N2和水蒸气时,放出的热量为86.7 kJ。
2.由反应①可推知:CH4(g)+4NO2(g) ══ 4NO(g)+CO2(g)+2H2O(l)
ΔH>-574 kJ·mol-1。( )
3.等量甲烷参与反应时,①②转移的电子数相同。( )
4.若反应②放出116 kJ热量,则转移电子的物质的量为1.6 mol。( )
×
气态水变成液态水时放热,所以ΔH<-574 kJ·mol-1。
√
反应①和反应②中,CH4都变成了CO2,所以等物质的量的甲烷分别参加反应①、②,反应转移的电子数相同。
×
若反应②放出116 kJ热量,则有0.4 mol NO参加反应,转移电子的物质的量为0.8 mol。
精研核心命题
命题点1反应中能量变化和热化学方程式
典例1 (2023·浙江1月选考卷)标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下[已知O2(g)和Cl2(g)的相对能量为0],下列说法不正确的是( )
A.E6-E3=E5-E2
B.可计算Cl—Cl键能为2(E2-E3) kJ·mol-1
C.相同条件下,O3的平衡转化率:历程Ⅱ>历程Ⅰ
D.历程Ⅰ、历程Ⅱ中速率最快的一步反应的热化学方程式为ClO(g)+O(g) ══ O2(g)+Cl(g) ΔH=(E5-E4) kJ·mol-1
答案 C
解析 由图可知,反应O3(g)+O(g) ══ 2O2(g)的ΔH=(E6-E3) kJ·mol-1,反应O3(g)+O(g)+Cl(g) ══ 2O2(g)+Cl(g)[即O3(g)+O(g) ══ 2O2(g)]的ΔH=(E5-E2) kJ·mol-1,从而可得:E6-E3=E5-E2,A正确。由于Cl2(g)的相对能量为0,[O3(g)+O(g)]的相对能量为E3 kJ·mol-1,[O3(g)+O(g)+Cl(g)]的相对能量为E2 kJ·mol-1,则Cl(g)的相对能量为(E2-E3) kJ·mol-1,故Cl—Cl的键能为2(E2-E3) kJ·mol-1,B正确。由图可知,历程Ⅱ使用了催化剂,但催化剂不能使平衡发生移动,则平衡转化率不同,故O3的平衡转化率:历程Ⅰ=历程Ⅱ,C错误。一般来说,活化能越低,反应速率越快,由图可知,历程Ⅱ中第二步反应的活化能最低,该步反应速率最快,结合图中物质的相对能量,可得热化学方程式为ClO(g)+O(g) ══ O2(g)+Cl(g) ΔH=(E5-E4) kJ·mol-1,D正确。
思路分析 解答本题的思路如下:
(1)分析历程Ⅰ、Ⅱ中物质变化及能量变化,确定两个过程中能量变化的
关系。
(2)结合Cl2(g)的相对能量、图中物质变化与相对能量,推测Cl(g)的相对能量及Cl—Cl的键能。
(3)根据反应速率与活化能的关系,确定图中速率最快的步骤及能量变化,写出热化学方程式。
变式演练(2021·全国甲卷,28节选)二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。二氧化碳加氢制甲醇的总反应可表示为CO2(g)+3H2(g) ══ CH3OH(g)+H2O(g),该反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g) ══ CO(g)+H2O(g) ΔH1=+41 kJ·mol-1
②CO(g)+2H2(g) ══ CH3OH(g) ΔH2=-90 kJ·mol-1
总反应的ΔH= kJ·mol-1;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是 (填字母),判断的理由是______________________________
。
-49
A
ΔH1为正值,ΔH2和ΔH为负值,
反应①的活化能大于反应②的
解析 二氧化碳加氢制甲醇的总反应可表示为CO2(g)+3H2(g) ══ CH3OH(g)+H2O(g),该反应一般认为通过如下步骤来实现:①CO2(g)+H2(g) ══ CO(g)+H2O(g) ΔH1=+41 kJ·mol-1,②CO(g)+2H2(g) ══ CH3OH(g) ΔH2=-90 kJ·mol-1,根据盖斯定律可知,由①+②可得CO2(g)+3H2(g) ══ CH3OH(g)+H2O(g) ΔH=(+41 kJ·mol-1)+(-90 kJ·mol-1)=-49 kJ·mol-1;总反应为放热反应,因此生成物总能量低于反应物总能量,反应①为慢反应,因此反应①的活化能大于反应②,同时反应①的反应物总能量低于生成物总能量,反应②的反应物总能量高于生成物总能量,因此示意图中能体现反应能量变化的是A项。
命题点2反应热的计算与盖斯定律的应用
典例2 (2022·浙江6月选考卷)标准状态下,下列物质气态时的相对能量如下表:
物质(g)28 O H HO HOO H2 O2 H2O2 H2O
249 218 39 10 0 0 -136 -242
可根据HO(g)+HO(g) ══ H2O2(g)计算出H2O2中氧氧单键的键能为
214 kJ·mol-1。下列说法不正确的是( )
A.H2的键能为436 kJ·mol-1
B.O2的键能大于H2O2中氧氧单键的键能的两倍
C.解离氧氧单键所需能量:HOOD.H2O(g)+O(g) ══ H2O2(g) ΔH=-143 kJ·mol-1
C
解析 根据表格中的数据可知,H2的键能为218 kJ·mol-1×2=436 kJ·mol-1,A正确;O2的键能为249 kJ·mol-1×2=498 kJ·mol-1,H2O2中氧氧单键的键能为214 kJ·mol-1,则O2的键能大于H2O2中氧氧单键的键能的两倍,B正确;HOO ══ HO+O,解离其中氧氧单键需要的能量为249 kJ·mol-1+39 kJ·mol-1-10 kJ·mol-1=278 kJ·mol-1,H2O2中氧氧单键的键能为214 kJ·mol-1,C错误;由表中的数据可知H2O(g)+O(g) ══ H2O2(g)的ΔH=-136 kJ·mol-1-249 kJ·mol-1 -(-242 kJ·mol-1)=-143 kJ·mol-1,D正确。
典例3 (2023·湖北卷,19节选)纳米碗C40H10是一种奇特的碗状共轭体系。高温条件下,C40H10可以由C40H20分子经过连续5步氢抽提和闭环脱氢反应生成。C40H20(g) C40H18(g)+H2(g)的反应机理和能量变化如下:
(1)已知C40Hx中的碳氢键和碳碳键的键能分别为431.0 kJ·mol-1和298.0 kJ·mol-1,H—H键能为436.0 kJ·mol-1。估算C40H20(g) C40H18(g)+H2(g)的ΔH= kJ·mol-1。
(2)图示历程包含 个基元反应,其中速率最慢的是第 个。
+128
3
3
解析 (1)从结构分析,反应中断裂两条碳氢键,形成一条碳碳键和H—H。ΔH=431.0 kJ·mol-1×2-298.0 kJ·mol-1-436.0 kJ·mol-1=+128 kJ·mol-1。
(2)基元反应是指在反应中一步直接转化为产物的反应,从图中历程看包含3个基元反应,其中第3步活化能最大,故该步反应速率最慢。
变式演练(1)(2023·湖南卷,16节选)已知下列反应的热化学方程式:
+118
(2)(2022·全国乙卷,28节选)已知下列反应的热化学方程式:
+170
解析 (1)根据盖斯定律,反应④可由①-②-③得到,故ΔH4=ΔH1-ΔH2-ΔH3
=(-4 386.9+4 263.1+241.8) kJ·mol-1=+118 kJ·mol-1。
【思维建模】
解答有关盖斯定律及应用类题目的思维模型
训练分层落实
练真题·明考向
1.(2022·浙江1月选考卷)相关有机物分别与氢气发生加成反应生成1 mol环己烷( )的能量变化如图所示:
下列推理不正确的是( )
A.2ΔH1≈ΔH2,说明碳碳双键加氢放出的热量与分子内碳碳双键数目成正比
B.ΔH2<ΔH3,说明单双键交替的两个碳碳双键间存在相互作用,有利于物质稳定
C.3ΔH1<ΔH4,说明苯分子中不存在三个完全独立的碳碳双键
D.ΔH3-ΔH1<0,ΔH4-ΔH3>0,说明苯分子具有特殊稳定性
A
解析 虽然2ΔH1≈ΔH2,但是2ΔH1≠ΔH3,说明碳碳双键加氢放出的热量与分子内碳碳双键数目并不一定成正比,A错误;ΔH2<ΔH3,即单双键交替的物质能量低,更稳定,说明单双键交替的两个碳碳双键间存在相互作用,有利于物质稳定,B正确;3ΔH1<ΔH4,说明苯分子中不存在三个完全独立的碳碳双键,C正确;ΔH3-ΔH1<0,ΔH4-ΔH3>0,说明苯分子具有特殊稳定性,D正确。
2.(1)(2023·全国甲卷,28节选)已知下列反应的热化学方程式:
①3O2(g) ══ 2O3(g) K1 ΔH1=+285 kJ·mol-1
②2CH4(g)+O2(g) ══ 2CH3OH(l) K2 ΔH2=-329 kJ·mol-1
反应③CH4(g)+O3(g) ══ CH3OH(l)+O2(g)的ΔH3= kJ·mol-1。
(2)(2023·全国乙卷,28节选)已知下列热化学方程式:
FeSO4·7H2O(s) ══ FeSO4(s)+7H2O(g) ΔH1=a kJ·mol-1
FeSO4·xH2O(s) ══ FeSO4(s)+xH2O(g) ΔH2=b kJ·mol-1
FeSO4·yH2O(s) ══ FeSO4(s)+yH2O(g) ΔH3=c kJ·mol-1
则FeSO4·7H2O(s)+FeSO4·yH2O(s) ══ 2(FeSO4·xH2O)(s)的
ΔH= kJ·mol-1。
-307
a+c-2b
(3)(2023·山东卷,20节选)一定条件下,水气变换反应CO+H2O CO2+H2的中间产物是HCOOH。为探究该反应过程,研究HCOOH水溶液在密封石英管中的分解反应。
Ⅰ.HCOOH CO+H2O(快)
Ⅱ.HCOOH CO2+H2(慢)
一定条件下,反应Ⅰ、Ⅱ的焓变分别为ΔH1、ΔH2,则该条件下水气变换反应的焓变ΔH= (用含ΔH1、ΔH2的代数式表示)。
ΔH2-ΔH1
(2)将题给热化学方程式依次编号为①②③,因为x=4、y=1,根据盖斯定律,由①+③-②×2可得目标反应,故该反应的焓变ΔH=(a+c-2b) kJ·mol-1。
(3)根据盖斯定律,将反应Ⅱ减去反应Ⅰ,可得水气变换反应:CO+H2O CO2+H2,故该反应的ΔH=ΔH2-ΔH1。
练易错·避陷阱
3.(2023·上海闵行区一模)由N2O和NO反应生成N2和NO2的能量变化如图所示。下列说法正确的是( )
A.反应消耗1 mol N2O吸热139 kJ
B.反应物的总键能小于生成物的总键能
C.加入催化剂可以减少反应热,加快反应速率
D.相同条件下,反应物、生成物和过渡态中的物质,过渡态中的物质最稳定
B
解析 该反应中,反应物总能量高于生成物总能量,为放热反应,则反应消耗1 mol N2O时放热139 kJ,A错误;该反应是放热反应,则反应物的总键能小于生成物的总键能,B正确;加入催化剂可以改变反应的活化能,加快反应速率,但是不能改变反应热,C错误;相同条件下,反应物、生成物和过渡态中的物质,过渡态的能量最高,过渡态最不稳定,D错误。
4.(2023·广东汕头一模)下图是用钌(Ru)基催化剂催化CO2(g)和H2(g)的反应示意图,当反应生成46 g液态HCOOH时放出31.2 kJ的热量。下列说法错误的是( )
A.反应历程中存在极性键、非极性键的断裂与形成
B.图示中物质Ⅰ为该反应的催化剂,物质Ⅱ、Ⅲ为中间产物
C.使用催化剂可以降低反应的活化能,但无法改变反应的焓变
D.由题意知:HCOOH(l) ══ CO2(g)+H2(g) ΔH=+31.2 kJ·mol-1
A
解析 由反应示意图可知,反应过程中不存在非极性键的形成,A错误;物质Ⅰ为反应起点存在的物质,最终又生成该物质,则物质Ⅰ为催化剂,物质Ⅱ、Ⅲ为中间过程出现的物质,则物质Ⅱ、Ⅲ为中间产物,B正确;催化剂通过降低反应的活化能来加快反应速率,但不能改变反应的焓变,C正确;生成46 g(即1 mol)液态HCOOH时放出31.2 kJ的热量,该反应的热化学方程式为CO2(g)+H2(g) ══ HCOOH(l) ΔH=-31.2 kJ·mol-1,其逆反应为HCOOH(l) ══ CO2(g)+H2(g) ΔH=+31.2 kJ·mol-1,D正确。
5.(2023·天津十二区重点校联考)金属Ni可活化C2H6放出CH4,其反应历程如图所示:
下列关于该活化历程的说法错误的是( )
A.中间体1→中间体2的过程是放热过程
B.加入催化剂可降低该反应的反应热,加快反应速率
C.Ni和C2H6的总键能小于NiCH2和CH4的总键能
D.中间体2→中间体3的过程是决定整个历程反应速率的关键步骤
B
解析 中间体1的相对能量为-56.21 kJ·mol-1,中间体2的相对能量为-154.82 kJ·mol-1,中间体1→中间体2的过程是放热过程,A正确;催化剂不能改变反应物和生成物的能量,加入催化剂,该反应的反应热不变,B错误;Ni(s)和C2H6(g)的相对总能量为0,NiCH2(s)和CH4(g)的相对总能量为-6.57 kJ·mol-1,该反应是放热反应,Ni(s)和C2H6(g)的总键能小于NiCH2(s)和CH4(g)的总键能,C正确;慢反应决定总反应的速率,中间体2→中间体3的过程反应的活化能最大,反应速率最慢,则中间体2→中间体3的过程是决定整个历程反应速率的关键步骤,D正确。
练预测·押考向
6.肼(N2H4)在不同条件下的分解产物不同,200 ℃时在Cu表面分解的机理如图1所示。已知200 ℃时:
反应Ⅰ:3N2H4(g) ══ N2(g)+4NH3(g) ΔH1=-a kJ·mol-1(a>0);
反应Ⅱ:N2H4(g)+H2(g) ══ 2NH3(g) ΔH2=b kJ·mol-1;
总反应为N2H4(g) ══ N2(g)+2H2(g) ΔH3。
下列说法不正确的是( )
A.图示反应①是放热反应
B.b<0
C.3 mol N2H4(g)的总能量高于1 mol N2(g)和4 mol NH3(g)的总能量
D.ΔH3=(a+2b) kJ·mol-1
D
解析 图示反应①N2H4(g)分解为N2(g)和NH3(g)的ΔH<0,则①是放热反应,A正确;由图2可知,1 mol N2H4(g)和1 mol H2(g)具有总能量高于2 mol NH3(g)具有总能量,该反应是放热反应,则b<0,B正确;反应Ⅰ是放热反应,则3 mol N2H4(g)具有的总能量高于1 mol N2(g)和4 mol NH3(g)具有的总能量,C正确;由Ⅰ-Ⅱ×2可得:N2H4(g) ══ N2(g)+2H2(g),根据盖斯定律,该反应的ΔH3=-(a+2b) kJ· mol-1,D错误。
7.乙烯在硫酸催化下水合生成乙醇的反应机理与能量的关系如下图所示。下列说法正确的是( )
A.由图像可知总反应为放热反应,一定不需加热就能自发进行
B.第①步反应中只有O—H发生断裂
C.总反应速率由第①步反应决定
D.1 mol 乙烯的能量高于1 mol 乙醇的能量
答案 C
解析 从图中可知,反应物的总能量高于生成物的总能量,则总反应为放热反应,但第①步反应为吸热反应,需要加热来提供能量,A错误;第①步反应断裂了碳碳双键中的一个键及碳氢键,B错误;反应历程中活化能越大,反应越慢,活化能最大的反应决定总反应速率,题给反应中第①步反应的活化能最大,决定总反应速率,C正确;根据总反应可知,因反应物和生成物均为两种,则无法比较1 mol C2H4和1 mol CH3CH2OH的能量高低,D错误。
8.碳及其化合物间的转化广泛存在于自然界及人类的生产和生活中。已知25 ℃、101 kPa时:
①1 mol葡萄糖[C6H12O6(s)]完全燃烧生成CO2(g)和H2O(l),放出2 804 kJ热量。
②CO(g)+ O2(g) ══ CO2(g) ΔH=-283 kJ·mol-1。
(1)25 ℃时,CO2(g)与H2O(l)经光合作用生成葡萄糖[C6H12O6(s)]和O2(g)的热化学方程式为 。
(2)25 ℃、101 kPa时,气态分子断开1 mol化学键的焓变称为键焓。已知O=O、C≡O的键焓分别为495 kJ·mol-1、799 kJ·mol-1,CO2(g)分子中碳氧键的键焓为 kJ·mol-1。
6CO2(g)+6H2O(l) === C6H12O6(s)+6O2(g) ΔH=+2 804 kJ·mol-1
664.75
(3)天然气的主要成分为CH4,一般还含有C2H6等烃类,是重要的燃料和化工原料。乙烷在一定条件可发生如下反应:C2H6(g) ══ C2H4(g)+H2(g) ΔH,相关物质的燃烧热数据如下表所示:
物质 C2H6(g) C2H4(g) H2(g)
燃烧热ΔH/(kJ·mol-1) -1 560 -1 411 -286
则ΔH= kJ·mol-1。
+137
解析 (1)由已知信息①可写出热化学方程式:C6H12O6(s)+6O2(g) ══ 6CO2(g)+6H2O(l) ΔH=-2 804 kJ·mol-1,CO2(g)与H2O(l)经光合作用生成葡萄糖[C6H12O6(s)]和O2(g)是葡萄糖燃烧反应的逆反应,生成1 mol葡萄糖会吸收2 804 kJ的热量,故反应的热化学方程式为6CO2(g)+6H2O(l) ══ C6H12O6(s)+6O2(g) ΔH=+2 804 kJ·mol-1。
专题 化学能与热能
考情分析
高考命题分析
命 题 情 境 (1)日常生活情境:从新型化学电源(锂离子电池、钠离子电池、液流电池、燃料电池等)等情境选材,要求考生利用基本概念和原理解释化学中的现象。
(2)生产环保情境:从化工生产(如合成氨、电化学合成)等情境选材,理解反应原理,解决化工生产实际问题。
(3)学术探索情境:从最新与化学有关的学术研究成果选材,开拓学生的学科视野,提高学生的创新思维能力。
素 养 能 力 (1)理解与辨析能力:理解盖斯定律、原电池和电解池的工作原理,并能迁移应用于新型电池等,理解“两池”在生产、生活中的应用。
(2)分析与推测能力:基于质量守恒和能量守恒等规律,分析化学电源、反应机理等,分析物质的结构与变化、推测反应原理及结果。
(3)实践探索:依据原电池或电解池原理,结合实验探究目的(如物质的氧化性等)、图表信息等,设计实验方案,运用相关原理,描述实验现象并分析实验数据等,提升化学实验技能。
考题统计
化学能与热能:
广东卷(2023),山东卷(2023、2022、2021、2020),湖南卷(2023、2022、2021),重庆卷(2022),湖北卷(2023、2022、2021),海南卷(2022、2021),河北卷(2022、2021),辽宁卷(2021),浙江卷(2023、2022、2021、2020),江苏卷(2022、2021),全国新课标卷(2023)
聚焦核心要点
要点1反应中能量变化与热化学方程式
课标指引:1.知道内能是体系内物质的各种能量的总和,受温度、压强、物质的聚集状态的影响。 2.能用热化学方程式表示反应中的能量变化,能运用反应焓变合理选择和利用化学反应。
1.从宏观角度和微观角度理解反应热
图像 分析 微观角度 宏观角度
a表示断裂旧化学键吸收的能量; b表示生成新化学键放出的能量 a表示反应的活化能;
b表示活化分子形成生成物释放的能量
2.燃烧热及其理解
3.书写热化学方程式的“五步骤”
要点2ΔH的计算和盖斯定律
课标指引:1.认识化学能与热能的相互转化,恒温恒压条件下化学反应的反应热可以用焓变表示,能进行反应焓变的简单计算。 2.了解盖斯定律及其简单应用。
1.盖斯定律的理解与应用
(1)盖斯定律的理解
盖斯定律表明,在一定条件下,化学反应的反应热只与反应体系的始态和终态有关,而与反应进行的途径无关。
则有:ΔH=ΔH1+ΔH2=ΔH3+ΔH4+ΔH5。
(2)盖斯定律的应用
根据盖斯定律,可以利用已知反应的反应热来计算未知反应的反应热。
2.计算反应热(ΔH)的四种常用方法
(1)根据物质的能量(焓值)计算反应热:ΔH=生成物总能量-反应物总能量。
(2)根据键能计算反应热:ΔH=反应物的总键能-生成物的总键能。
(3)根据活化能计算反应热:ΔH=Ea(正反应)-Ea(逆反应)。
(4)根据盖斯定律计算反应热:将热化学方程式进行叠加,符合质量守恒和能量守恒规律。
易错辨析
用CH4催化还原NOx,可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g) ══ 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g) ══ 2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
试判断下列说法的正误。
1.若用0.1 mol CH4还原NO2生成N2和水蒸气,放出的热量为173.4 kJ。( )
×
①CH4(g)+4NO2(g) ══ 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g) ══ 2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
根据盖斯定律,①+②可得
2CH4(g)+4NO2(g) ══ 2N2(g)+2CO2(g)+4H2O(g) ΔH=-1 734 kJ·mol-1,则用0.1 mol CH4还原NO2生成N2和水蒸气时,放出的热量为86.7 kJ。
2.由反应①可推知:CH4(g)+4NO2(g) ══ 4NO(g)+CO2(g)+2H2O(l)
ΔH>-574 kJ·mol-1。( )
3.等量甲烷参与反应时,①②转移的电子数相同。( )
4.若反应②放出116 kJ热量,则转移电子的物质的量为1.6 mol。( )
×
气态水变成液态水时放热,所以ΔH<-574 kJ·mol-1。
√
反应①和反应②中,CH4都变成了CO2,所以等物质的量的甲烷分别参加反应①、②,反应转移的电子数相同。
×
若反应②放出116 kJ热量,则有0.4 mol NO参加反应,转移电子的物质的量为0.8 mol。
精研核心命题
命题点1反应中能量变化和热化学方程式
典例1 (2023·浙江1月选考卷)标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下[已知O2(g)和Cl2(g)的相对能量为0],下列说法不正确的是( )
A.E6-E3=E5-E2
B.可计算Cl—Cl键能为2(E2-E3) kJ·mol-1
C.相同条件下,O3的平衡转化率:历程Ⅱ>历程Ⅰ
D.历程Ⅰ、历程Ⅱ中速率最快的一步反应的热化学方程式为ClO(g)+O(g) ══ O2(g)+Cl(g) ΔH=(E5-E4) kJ·mol-1
答案 C
解析 由图可知,反应O3(g)+O(g) ══ 2O2(g)的ΔH=(E6-E3) kJ·mol-1,反应O3(g)+O(g)+Cl(g) ══ 2O2(g)+Cl(g)[即O3(g)+O(g) ══ 2O2(g)]的ΔH=(E5-E2) kJ·mol-1,从而可得:E6-E3=E5-E2,A正确。由于Cl2(g)的相对能量为0,[O3(g)+O(g)]的相对能量为E3 kJ·mol-1,[O3(g)+O(g)+Cl(g)]的相对能量为E2 kJ·mol-1,则Cl(g)的相对能量为(E2-E3) kJ·mol-1,故Cl—Cl的键能为2(E2-E3) kJ·mol-1,B正确。由图可知,历程Ⅱ使用了催化剂,但催化剂不能使平衡发生移动,则平衡转化率不同,故O3的平衡转化率:历程Ⅰ=历程Ⅱ,C错误。一般来说,活化能越低,反应速率越快,由图可知,历程Ⅱ中第二步反应的活化能最低,该步反应速率最快,结合图中物质的相对能量,可得热化学方程式为ClO(g)+O(g) ══ O2(g)+Cl(g) ΔH=(E5-E4) kJ·mol-1,D正确。
思路分析 解答本题的思路如下:
(1)分析历程Ⅰ、Ⅱ中物质变化及能量变化,确定两个过程中能量变化的
关系。
(2)结合Cl2(g)的相对能量、图中物质变化与相对能量,推测Cl(g)的相对能量及Cl—Cl的键能。
(3)根据反应速率与活化能的关系,确定图中速率最快的步骤及能量变化,写出热化学方程式。
变式演练(2021·全国甲卷,28节选)二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。二氧化碳加氢制甲醇的总反应可表示为CO2(g)+3H2(g) ══ CH3OH(g)+H2O(g),该反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g) ══ CO(g)+H2O(g) ΔH1=+41 kJ·mol-1
②CO(g)+2H2(g) ══ CH3OH(g) ΔH2=-90 kJ·mol-1
总反应的ΔH= kJ·mol-1;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是 (填字母),判断的理由是______________________________
。
-49
A
ΔH1为正值,ΔH2和ΔH为负值,
反应①的活化能大于反应②的
解析 二氧化碳加氢制甲醇的总反应可表示为CO2(g)+3H2(g) ══ CH3OH(g)+H2O(g),该反应一般认为通过如下步骤来实现:①CO2(g)+H2(g) ══ CO(g)+H2O(g) ΔH1=+41 kJ·mol-1,②CO(g)+2H2(g) ══ CH3OH(g) ΔH2=-90 kJ·mol-1,根据盖斯定律可知,由①+②可得CO2(g)+3H2(g) ══ CH3OH(g)+H2O(g) ΔH=(+41 kJ·mol-1)+(-90 kJ·mol-1)=-49 kJ·mol-1;总反应为放热反应,因此生成物总能量低于反应物总能量,反应①为慢反应,因此反应①的活化能大于反应②,同时反应①的反应物总能量低于生成物总能量,反应②的反应物总能量高于生成物总能量,因此示意图中能体现反应能量变化的是A项。
命题点2反应热的计算与盖斯定律的应用
典例2 (2022·浙江6月选考卷)标准状态下,下列物质气态时的相对能量如下表:
物质(g)28 O H HO HOO H2 O2 H2O2 H2O
249 218 39 10 0 0 -136 -242
可根据HO(g)+HO(g) ══ H2O2(g)计算出H2O2中氧氧单键的键能为
214 kJ·mol-1。下列说法不正确的是( )
A.H2的键能为436 kJ·mol-1
B.O2的键能大于H2O2中氧氧单键的键能的两倍
C.解离氧氧单键所需能量:HOO
C
解析 根据表格中的数据可知,H2的键能为218 kJ·mol-1×2=436 kJ·mol-1,A正确;O2的键能为249 kJ·mol-1×2=498 kJ·mol-1,H2O2中氧氧单键的键能为214 kJ·mol-1,则O2的键能大于H2O2中氧氧单键的键能的两倍,B正确;HOO ══ HO+O,解离其中氧氧单键需要的能量为249 kJ·mol-1+39 kJ·mol-1-10 kJ·mol-1=278 kJ·mol-1,H2O2中氧氧单键的键能为214 kJ·mol-1,C错误;由表中的数据可知H2O(g)+O(g) ══ H2O2(g)的ΔH=-136 kJ·mol-1-249 kJ·mol-1 -(-242 kJ·mol-1)=-143 kJ·mol-1,D正确。
典例3 (2023·湖北卷,19节选)纳米碗C40H10是一种奇特的碗状共轭体系。高温条件下,C40H10可以由C40H20分子经过连续5步氢抽提和闭环脱氢反应生成。C40H20(g) C40H18(g)+H2(g)的反应机理和能量变化如下:
(1)已知C40Hx中的碳氢键和碳碳键的键能分别为431.0 kJ·mol-1和298.0 kJ·mol-1,H—H键能为436.0 kJ·mol-1。估算C40H20(g) C40H18(g)+H2(g)的ΔH= kJ·mol-1。
(2)图示历程包含 个基元反应,其中速率最慢的是第 个。
+128
3
3
解析 (1)从结构分析,反应中断裂两条碳氢键,形成一条碳碳键和H—H。ΔH=431.0 kJ·mol-1×2-298.0 kJ·mol-1-436.0 kJ·mol-1=+128 kJ·mol-1。
(2)基元反应是指在反应中一步直接转化为产物的反应,从图中历程看包含3个基元反应,其中第3步活化能最大,故该步反应速率最慢。
变式演练(1)(2023·湖南卷,16节选)已知下列反应的热化学方程式:
+118
(2)(2022·全国乙卷,28节选)已知下列反应的热化学方程式:
+170
解析 (1)根据盖斯定律,反应④可由①-②-③得到,故ΔH4=ΔH1-ΔH2-ΔH3
=(-4 386.9+4 263.1+241.8) kJ·mol-1=+118 kJ·mol-1。
【思维建模】
解答有关盖斯定律及应用类题目的思维模型
训练分层落实
练真题·明考向
1.(2022·浙江1月选考卷)相关有机物分别与氢气发生加成反应生成1 mol环己烷( )的能量变化如图所示:
下列推理不正确的是( )
A.2ΔH1≈ΔH2,说明碳碳双键加氢放出的热量与分子内碳碳双键数目成正比
B.ΔH2<ΔH3,说明单双键交替的两个碳碳双键间存在相互作用,有利于物质稳定
C.3ΔH1<ΔH4,说明苯分子中不存在三个完全独立的碳碳双键
D.ΔH3-ΔH1<0,ΔH4-ΔH3>0,说明苯分子具有特殊稳定性
A
解析 虽然2ΔH1≈ΔH2,但是2ΔH1≠ΔH3,说明碳碳双键加氢放出的热量与分子内碳碳双键数目并不一定成正比,A错误;ΔH2<ΔH3,即单双键交替的物质能量低,更稳定,说明单双键交替的两个碳碳双键间存在相互作用,有利于物质稳定,B正确;3ΔH1<ΔH4,说明苯分子中不存在三个完全独立的碳碳双键,C正确;ΔH3-ΔH1<0,ΔH4-ΔH3>0,说明苯分子具有特殊稳定性,D正确。
2.(1)(2023·全国甲卷,28节选)已知下列反应的热化学方程式:
①3O2(g) ══ 2O3(g) K1 ΔH1=+285 kJ·mol-1
②2CH4(g)+O2(g) ══ 2CH3OH(l) K2 ΔH2=-329 kJ·mol-1
反应③CH4(g)+O3(g) ══ CH3OH(l)+O2(g)的ΔH3= kJ·mol-1。
(2)(2023·全国乙卷,28节选)已知下列热化学方程式:
FeSO4·7H2O(s) ══ FeSO4(s)+7H2O(g) ΔH1=a kJ·mol-1
FeSO4·xH2O(s) ══ FeSO4(s)+xH2O(g) ΔH2=b kJ·mol-1
FeSO4·yH2O(s) ══ FeSO4(s)+yH2O(g) ΔH3=c kJ·mol-1
则FeSO4·7H2O(s)+FeSO4·yH2O(s) ══ 2(FeSO4·xH2O)(s)的
ΔH= kJ·mol-1。
-307
a+c-2b
(3)(2023·山东卷,20节选)一定条件下,水气变换反应CO+H2O CO2+H2的中间产物是HCOOH。为探究该反应过程,研究HCOOH水溶液在密封石英管中的分解反应。
Ⅰ.HCOOH CO+H2O(快)
Ⅱ.HCOOH CO2+H2(慢)
一定条件下,反应Ⅰ、Ⅱ的焓变分别为ΔH1、ΔH2,则该条件下水气变换反应的焓变ΔH= (用含ΔH1、ΔH2的代数式表示)。
ΔH2-ΔH1
(2)将题给热化学方程式依次编号为①②③,因为x=4、y=1,根据盖斯定律,由①+③-②×2可得目标反应,故该反应的焓变ΔH=(a+c-2b) kJ·mol-1。
(3)根据盖斯定律,将反应Ⅱ减去反应Ⅰ,可得水气变换反应:CO+H2O CO2+H2,故该反应的ΔH=ΔH2-ΔH1。
练易错·避陷阱
3.(2023·上海闵行区一模)由N2O和NO反应生成N2和NO2的能量变化如图所示。下列说法正确的是( )
A.反应消耗1 mol N2O吸热139 kJ
B.反应物的总键能小于生成物的总键能
C.加入催化剂可以减少反应热,加快反应速率
D.相同条件下,反应物、生成物和过渡态中的物质,过渡态中的物质最稳定
B
解析 该反应中,反应物总能量高于生成物总能量,为放热反应,则反应消耗1 mol N2O时放热139 kJ,A错误;该反应是放热反应,则反应物的总键能小于生成物的总键能,B正确;加入催化剂可以改变反应的活化能,加快反应速率,但是不能改变反应热,C错误;相同条件下,反应物、生成物和过渡态中的物质,过渡态的能量最高,过渡态最不稳定,D错误。
4.(2023·广东汕头一模)下图是用钌(Ru)基催化剂催化CO2(g)和H2(g)的反应示意图,当反应生成46 g液态HCOOH时放出31.2 kJ的热量。下列说法错误的是( )
A.反应历程中存在极性键、非极性键的断裂与形成
B.图示中物质Ⅰ为该反应的催化剂,物质Ⅱ、Ⅲ为中间产物
C.使用催化剂可以降低反应的活化能,但无法改变反应的焓变
D.由题意知:HCOOH(l) ══ CO2(g)+H2(g) ΔH=+31.2 kJ·mol-1
A
解析 由反应示意图可知,反应过程中不存在非极性键的形成,A错误;物质Ⅰ为反应起点存在的物质,最终又生成该物质,则物质Ⅰ为催化剂,物质Ⅱ、Ⅲ为中间过程出现的物质,则物质Ⅱ、Ⅲ为中间产物,B正确;催化剂通过降低反应的活化能来加快反应速率,但不能改变反应的焓变,C正确;生成46 g(即1 mol)液态HCOOH时放出31.2 kJ的热量,该反应的热化学方程式为CO2(g)+H2(g) ══ HCOOH(l) ΔH=-31.2 kJ·mol-1,其逆反应为HCOOH(l) ══ CO2(g)+H2(g) ΔH=+31.2 kJ·mol-1,D正确。
5.(2023·天津十二区重点校联考)金属Ni可活化C2H6放出CH4,其反应历程如图所示:
下列关于该活化历程的说法错误的是( )
A.中间体1→中间体2的过程是放热过程
B.加入催化剂可降低该反应的反应热,加快反应速率
C.Ni和C2H6的总键能小于NiCH2和CH4的总键能
D.中间体2→中间体3的过程是决定整个历程反应速率的关键步骤
B
解析 中间体1的相对能量为-56.21 kJ·mol-1,中间体2的相对能量为-154.82 kJ·mol-1,中间体1→中间体2的过程是放热过程,A正确;催化剂不能改变反应物和生成物的能量,加入催化剂,该反应的反应热不变,B错误;Ni(s)和C2H6(g)的相对总能量为0,NiCH2(s)和CH4(g)的相对总能量为-6.57 kJ·mol-1,该反应是放热反应,Ni(s)和C2H6(g)的总键能小于NiCH2(s)和CH4(g)的总键能,C正确;慢反应决定总反应的速率,中间体2→中间体3的过程反应的活化能最大,反应速率最慢,则中间体2→中间体3的过程是决定整个历程反应速率的关键步骤,D正确。
练预测·押考向
6.肼(N2H4)在不同条件下的分解产物不同,200 ℃时在Cu表面分解的机理如图1所示。已知200 ℃时:
反应Ⅰ:3N2H4(g) ══ N2(g)+4NH3(g) ΔH1=-a kJ·mol-1(a>0);
反应Ⅱ:N2H4(g)+H2(g) ══ 2NH3(g) ΔH2=b kJ·mol-1;
总反应为N2H4(g) ══ N2(g)+2H2(g) ΔH3。
下列说法不正确的是( )
A.图示反应①是放热反应
B.b<0
C.3 mol N2H4(g)的总能量高于1 mol N2(g)和4 mol NH3(g)的总能量
D.ΔH3=(a+2b) kJ·mol-1
D
解析 图示反应①N2H4(g)分解为N2(g)和NH3(g)的ΔH<0,则①是放热反应,A正确;由图2可知,1 mol N2H4(g)和1 mol H2(g)具有总能量高于2 mol NH3(g)具有总能量,该反应是放热反应,则b<0,B正确;反应Ⅰ是放热反应,则3 mol N2H4(g)具有的总能量高于1 mol N2(g)和4 mol NH3(g)具有的总能量,C正确;由Ⅰ-Ⅱ×2可得:N2H4(g) ══ N2(g)+2H2(g),根据盖斯定律,该反应的ΔH3=-(a+2b) kJ· mol-1,D错误。
7.乙烯在硫酸催化下水合生成乙醇的反应机理与能量的关系如下图所示。下列说法正确的是( )
A.由图像可知总反应为放热反应,一定不需加热就能自发进行
B.第①步反应中只有O—H发生断裂
C.总反应速率由第①步反应决定
D.1 mol 乙烯的能量高于1 mol 乙醇的能量
答案 C
解析 从图中可知,反应物的总能量高于生成物的总能量,则总反应为放热反应,但第①步反应为吸热反应,需要加热来提供能量,A错误;第①步反应断裂了碳碳双键中的一个键及碳氢键,B错误;反应历程中活化能越大,反应越慢,活化能最大的反应决定总反应速率,题给反应中第①步反应的活化能最大,决定总反应速率,C正确;根据总反应可知,因反应物和生成物均为两种,则无法比较1 mol C2H4和1 mol CH3CH2OH的能量高低,D错误。
8.碳及其化合物间的转化广泛存在于自然界及人类的生产和生活中。已知25 ℃、101 kPa时:
①1 mol葡萄糖[C6H12O6(s)]完全燃烧生成CO2(g)和H2O(l),放出2 804 kJ热量。
②CO(g)+ O2(g) ══ CO2(g) ΔH=-283 kJ·mol-1。
(1)25 ℃时,CO2(g)与H2O(l)经光合作用生成葡萄糖[C6H12O6(s)]和O2(g)的热化学方程式为 。
(2)25 ℃、101 kPa时,气态分子断开1 mol化学键的焓变称为键焓。已知O=O、C≡O的键焓分别为495 kJ·mol-1、799 kJ·mol-1,CO2(g)分子中碳氧键的键焓为 kJ·mol-1。
6CO2(g)+6H2O(l) === C6H12O6(s)+6O2(g) ΔH=+2 804 kJ·mol-1
664.75
(3)天然气的主要成分为CH4,一般还含有C2H6等烃类,是重要的燃料和化工原料。乙烷在一定条件可发生如下反应:C2H6(g) ══ C2H4(g)+H2(g) ΔH,相关物质的燃烧热数据如下表所示:
物质 C2H6(g) C2H4(g) H2(g)
燃烧热ΔH/(kJ·mol-1) -1 560 -1 411 -286
则ΔH= kJ·mol-1。
+137
解析 (1)由已知信息①可写出热化学方程式:C6H12O6(s)+6O2(g) ══ 6CO2(g)+6H2O(l) ΔH=-2 804 kJ·mol-1,CO2(g)与H2O(l)经光合作用生成葡萄糖[C6H12O6(s)]和O2(g)是葡萄糖燃烧反应的逆反应,生成1 mol葡萄糖会吸收2 804 kJ的热量,故反应的热化学方程式为6CO2(g)+6H2O(l) ══ C6H12O6(s)+6O2(g) ΔH=+2 804 kJ·mol-1。
同课章节目录
