专题 电解池原理及金属的腐蚀与防护(共43张PPT)
文档属性
| 名称 | 专题 电解池原理及金属的腐蚀与防护(共43张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 23:09:36 | ||
图片预览







文档简介
(共43张PPT)
专题 电解池原理及金属的腐蚀与防护
考题统计
电解池原理及金属的腐蚀与防护:
湖南卷(2023、2022、2021),湖北卷(2023、2022、2021),广东卷(2023、2022、2021),海南卷(2022、2021),江苏卷(2022、2021、2020),河北卷(2022),重庆卷(2022、2021),北京卷(2022、2020),山东卷(2023、2022、2020),浙江卷(2023、2022),辽宁卷(2023、2021),天津卷(2021)
聚焦核心要点
要点1电解池原理及应用
课标指引:1.了解电解池的工作原理,认识电解在实现物质转化和储存能量中的具体应用。 2.能分析、解释电解池的工作原理,能设计简单的电解池。
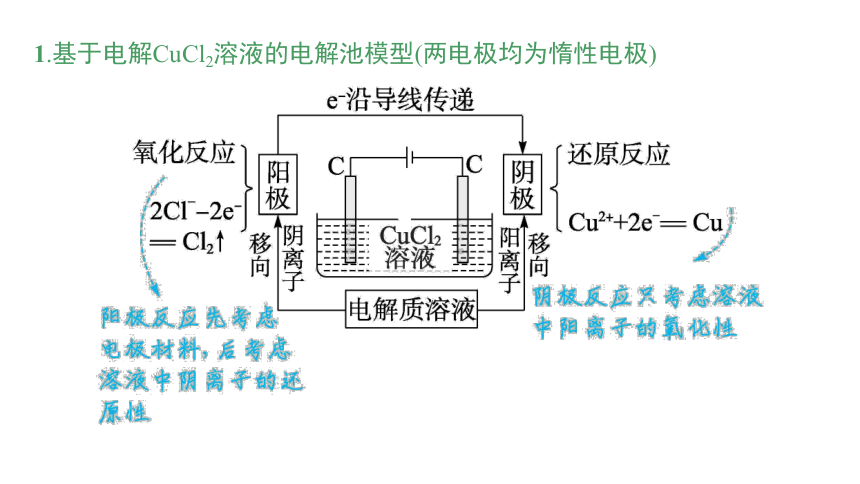
1.基于电解CuCl2溶液的电解池模型(两电极均为惰性电极)
2.判断电解池的电极产物的方法
(1)阳极产物的判断首先看电极,若为活性电极作阳极,则电极材料失电子,电极本身溶解;若为惰性电极作阳极,则需看溶液中阴离子的失电子能力,阴离子放电顺序为S2->I->Br->Cl->OH-(水)。
(2)阴极产物的判断直接根据阳离子的放电顺序进行判断:Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Fe2+>Zn2+>H+(水)。
微点拨
①铁作为阳极时,发生氧化反应生成Fe2+而溶解,不是生成Fe3+;②电解时,溶液中Fe3+发生还原反应,一般生成Fe2+。
易错辨析
1.在电解精炼粗铜的过程中,当阴极质量增重32 g时转移的电子数为NA(NA为阿伏加德罗常数的值)。( )
2.用铜作电极电解AgNO3溶液:4Ag++2H2O 4Ag+O2↑+4H+。( )
√
×
用铜作电极电解AgNO3溶液,阳极上Cu失电子转化为Cu2+,阴极上是Ag+得到电子转化为Ag,故该电解反应为Cu+2Ag+ 2Ag+Cu2+。
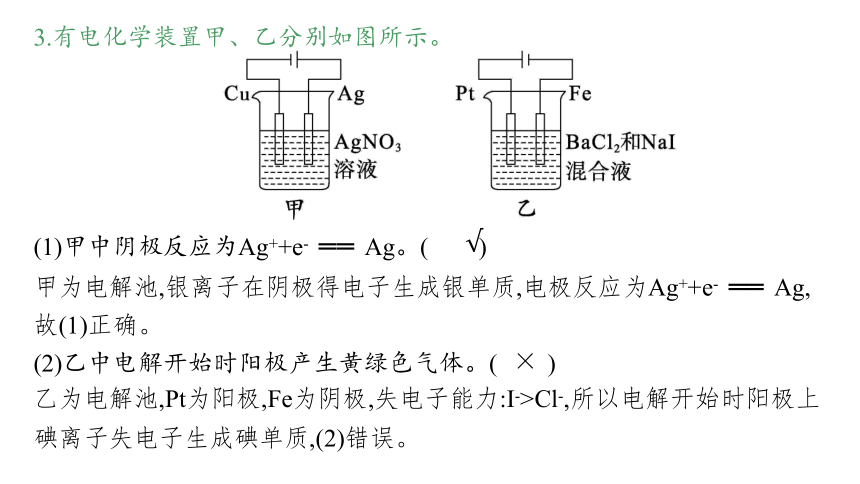
3.有电化学装置甲、乙分别如图所示。
(1)甲中阴极反应为Ag++e- ══ Ag。( )
(2)乙中电解开始时阳极产生黄绿色气体。( )
√
甲为电解池,银离子在阴极得电子生成银单质,电极反应为Ag++e- ══ Ag,故(1)正确。
×
乙为电解池,Pt为阳极,Fe为阴极,失电子能力:I->Cl-,所以电解开始时阳极上碘离子失电子生成碘单质,(2)错误。
要点2金属的腐蚀与防护
课标指引:1.了解金属发生电化学腐蚀的本质,知道金属腐蚀的危害,了解防止金属腐蚀的措施。 2.能利用电化学原理解释金属腐蚀的现象,选择并设计防腐措施。
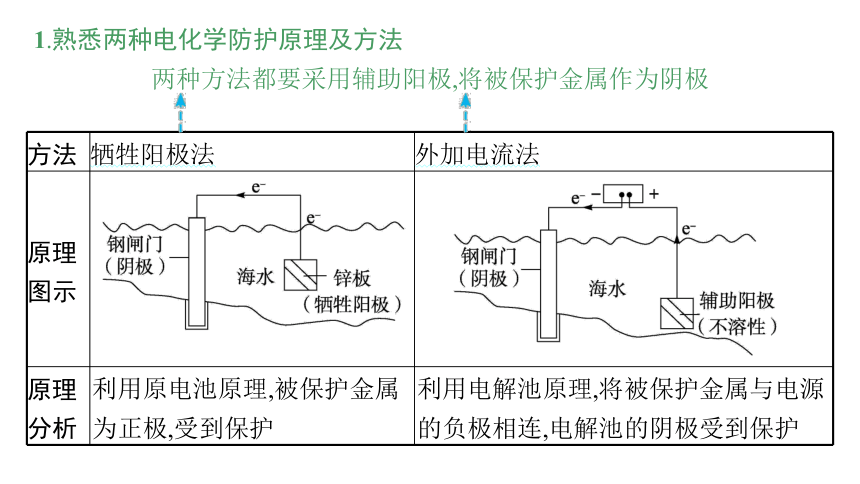
1.熟悉两种电化学防护原理及方法
两种方法都要采用辅助阳极,将被保护金属作为阴极
方法 牺牲阳极法 外加电流法
原理 图示
原理 分析 利用原电池原理,被保护金属为正极,受到保护 利用电解池原理,将被保护金属与电源的负极相连,电解池的阴极受到保护
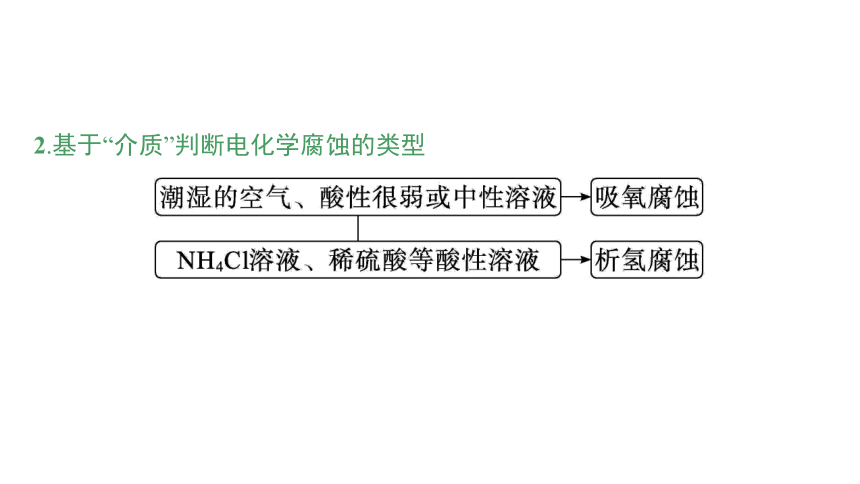
2.基于“介质”判断电化学腐蚀的类型
精研核心命题
命题点1电解池原理及其应用
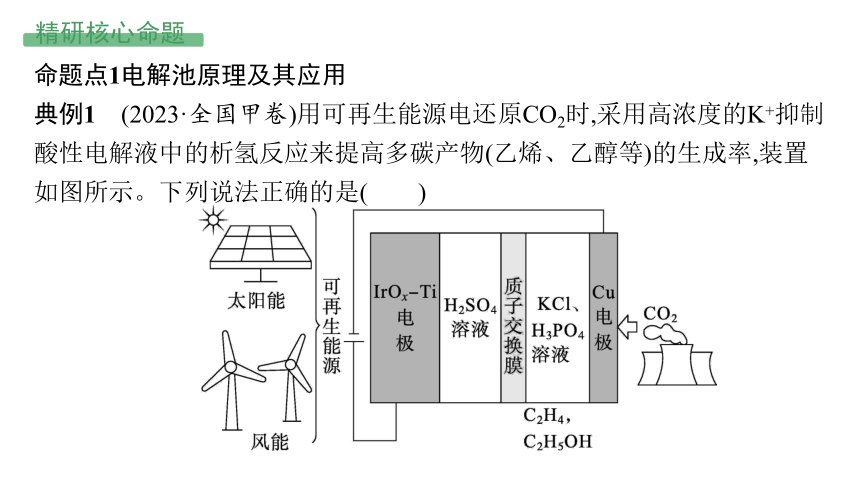
典例1 (2023·全国甲卷)用可再生能源电还原CO2时,采用高浓度的K+抑制酸性电解液中的析氢反应来提高多碳产物(乙烯、乙醇等)的生成率,装置如图所示。下列说法正确的是( )
A.析氢反应发生在IrOx-Ti电极上
B.Cl-从Cu电极迁移到IrOx-Ti电极
C.阴极发生的反应有:2CO2+12H++12e- ══ C2H4+4H2O
D.每转移1 mol电子,阳极生成11.2 L气体(标准状况)
答案 C
思路分析 电化学装置定位:电解池。本题中电极反应分析如下:
电极类型 物质变化及类型 电极反应
Cu电极(阴极) CO2→C2H4等,发生还原反应 2CO2+12H++12e-══C2H4+4H2O等
IrOx-Ti(阳极) H2O→O2,发生氧化反应 2H2O-4e-══O2↑+4H+
变式演练(2023·浙江6月选考)氯碱工业能耗大,通过如图改进的设计可大幅度降低能耗,下列说法不正确的是( )
A.电极A接电源正极,发生氧化反应
B.电极B的电极反应为2H2O+2e- ══ H2↑+2OH-
C.应选用阳离子交换膜,在右室获得浓度较高的NaOH溶液
D.改进设计中通过提高电极B上反应物的氧化性来降低电解电压,减少能耗
B
解析 电极A上氯离子变为氯气,化合价升高,失去电子,是电解池阳极,因此电极A接电源正极,发生氧化反应,A正确;电极B为阴极,通入氧气,氧气得到电子,其电极反应为2H2O+4e-+O2 ══ 4OH-,B错误;右室生成氢氧根,应选用阳离子交换膜,让左室的钠离子进入右室,在右室获得浓度较高的NaOH溶液,C正确;改进设计中增大了氧气的量,提高了电极B处的氧化性,通过反应物的氧化性来降低电解电压,减少能耗,D正确。
【思维建模】
解答电解原理及其应用类题目的思维模型
(1)判断电解池阴、阳极的方法
(2)判断电极产物和书写电极反应的方法
命题点2金属腐蚀的电化学防护
典例2 (2022·广东卷)为检验牺牲阳极的阴极保护法对钢铁防腐的效果,将镀层有破损的镀锌铁片放入酸化的3%NaCl溶液中。一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是( )
A.加入AgNO3溶液产生沉淀
B.加入淀粉碘化钾溶液无蓝色出现
C.加入KSCN溶液无红色出现
D.加入K3[Fe(CN)6]溶液无蓝色沉淀生成
D
解析 NaCl溶液中含有Cl-,加入AgNO3溶液后,不管铁片是否被腐蚀,均会出现白色沉淀,A错误;淀粉碘化钾溶液可检测氧化性物质,但不论铁片是否被腐蚀,均无氧化性物质生成,B错误;KSCN溶液可检测Fe3+是否存在,钢铁腐蚀生成Fe2+,无论铁片是否被腐蚀,加入KSCN溶液后,均无红色出现,C错误;K3[Fe(CN)6]是用于检测Fe2+的试剂,若铁片没有被腐蚀,溶液中不会生成Fe2+,则加入K3[Fe(CN)6]溶液就不会出现蓝色沉淀,D正确。
变式演练(2023·辽宁鞍山一模)点蚀又称为孔蚀,是一种集中于金属表面很小的范围并深入金属内部的腐蚀形态。某铁合金钝化膜破损后的孔蚀如图,下列说法错误的是( )
A.孔隙中有可能发生析氢腐蚀
B.孔蚀中Fe2+水解导致电解质溶液酸性增强
C.为防止孔蚀发生可以将外接电源负极与金属相连
D.孔蚀外每吸收2.24 L O2,可氧化0.2 mol Fe
D
解析 孔隙中电解质溶液呈酸性,可以发生析氢腐蚀,A正确;孔蚀中Fe2+发生水解反应:Fe2++2H2O Fe(OH)2+2H+,导致电解质溶液酸性增强,B正确;将外接电源的负极与金属相连,金属作电解池阴极,利用了外加电流法进行保护,可以防止孔蚀发生,C正确;题目未指明O2是否处于标准状况,不能计算O2的物质的量,D错误。
训练分层落实
练真题·明考向
1.(2023·浙江1月选考卷)在熔融盐体系中,通过电解TiO2和SiO2获得电池材料(TiSi),电解装置如图,下列说法正确的是( )
A.石墨电极为阴极,发生氧化反应
B.电极A的电极反应:
8H++TiO2+SiO2+8e- ══ TiSi+4H2O
C.该体系中,石墨优先于Cl-参与反应
D.电解时,阳离子向石墨电极移动
C
解析 由图可知,电极A上获得TiSi,则电极A是阴极,石墨电极是阳极,A错误。因为是熔融盐体系,不可能有H+存在,B错误。图中石墨电极上生成CO,未生成Cl2,说明石墨先于Cl-参与电极反应,C正确。电解池中,阳离子向阴极移动,电极A是阴极,则阳离子向电极A移动,D错误。
2.(2023·湖北卷)我国科学家设计如图所示的电解池,实现了海水直接制备氢气技术的绿色化。该装置工作时阳极无Cl2生成且KOH溶液的浓度不变,电解生成氢气的速率为x mol·h-1。下列说法错误的是( )
A.b电极反应为2H2O+2e- ══ H2↑+2OH-
B.离子交换膜为阴离子交换膜
C.电解时海水中动能高的水分子可穿过PTFE膜
D.海水为电解池补水的速率为2x mol·h-1
D
解析 该装置工作时,b电极连接电源负极为阴极,电极上放出H2:2H2O+2e- ══ H2↑+2OH-,A正确;阳极无Cl2生成且KOH溶液浓度不变,则本质上是电解水,阳极生成O2,两极之间转移OH-,离子交换膜为阴离子交换膜,B正确;电解的本质是电解水,而KOH浓度不变,PTFE膜不透液态水,则通过PTFE膜的水应为动能高的水分子(透汽),C正确;电解生成H2的速率为x mol·h-1,根据总反应可知,海水为电解池补水的速率为x mol·h-1,D错误。
3.(2023·辽宁卷)某无隔膜流动海水电解法制H2的装置如图所示,其中高选择性催化剂PRT可抑制O2产生。下列说法正确的是( )
A.b端电势高于a端电势
B.理论上转移2 mol e-生成4 g H2
C.电解后海水pH下降
D.阳极发生:Cl-+H2O-2e- ══ HClO+H+
D
解析 H2为还原产物,故钛箔为电解池的阴极,钛网电极为阳极。阳极连接电源正极,阴极连接电源负极,故a端电势高于b端电势,A错误;电解时,阳极反应为Cl-+H2O-2e- ══ HClO+H+,阴极反应为2H2O+2e- ══H2↑+2OH-,总反应方程式为Cl-+H2O ══ ClO-+H2↑,理论上转移2 mol e-生成2 g H2,B错误、D正确;流动海水电解后,海水中含有NaClO,其为强碱弱酸盐,pH不会下降,C错误。
练易错·避陷阱
4.(2023·北京东城区一模)用石墨作电极电解a浊液,记录如表。
实验装置 实验现象 Ⅰ.a为AgCl Ⅱ.a为AgI
两电极均产生气泡,有黑色固体在阴极附近生成,并沉降在烧杯底部,烧杯中的液体逐渐变澄清透明 两电极均产生气泡,阴极表面附着少量银白色固体,烧杯中的液体逐渐变为棕黄色
下列说法不正确的是( )
A.Ⅰ中阳极气体可能为Cl2和O2,Ⅱ中阳极气体为O2
B.Ⅰ和Ⅱ中阴极生成气体的电极反应均为2H2O+2e- ══ H2↑+2OH-
C.Ⅱ中液体变为棕黄色,说明阳极上发生了反应2AgI-2e- ══ I2+2Ag+
D.两实验阴极现象有差异的原因可能是Ⅱ中c(Ag+)比Ⅰ中的小
答案 C
解析 Ⅰ中Cl-和H2O均可能在阳极发生氧化反应,则Ⅰ中阳极气体可能为Cl2和O2,Ⅱ中阳极气体为氧气,A正确。Ⅰ和Ⅱ中阴极生成的气体都是H2,电极反应为2H2O+2e- ══ H2↑+2OH-,B正确。Ⅱ中H2O在阳极发生氧化反应生成氧气,电极反应为2H2O-4e- ══ O2↑+4H+,反应生成的氧气将I-氧化为I2,从而使Ⅱ中液体变为棕黄色,C错误。AgCl的溶解度大于AgI,AgCl悬浊液中c(Ag+)大于AgI悬浊液中c(Ag+),故两实验中阴极现象有差异的原因可能是Ⅱ中c(Ag+)比Ⅰ中的小,D正确。
5.(2023·四川成都一模)某种电催化法以CoP、Ni2P为催化电极合成腈类化合物(RCN)和偶氮化合物(R—N=N—R),装置示意图如图所示。下列说法错误的是( )
A.左侧电极的电势比右侧的高,且发生氧化反应
C.OH-从右侧经过阴离子交换膜向左侧移动
D.每当合成得到1 mol RCN时,同时合成1 mol R—N=N—R
D
解析 右侧电极上硝基苯发生还原反应,则右侧为阴极、左侧为阳极,故左侧电极的电势比右侧的高,且发生氧化反应,A正确;右侧电极反应为
电解质溶液中阴离子向阳极移动,则OH-从右侧经过阴离子交换膜向左侧移动,C正确;阳极反应为RCH2NH2+4OH--4e- ══ RCN+4H2O,根据得失电子守恒,当合成得到1 mol RCN时,同时合成0.5 mol R—N=N—R,D错误。
6.(2023·山西忻州一模)镍离子(Ni2+)和钴离子(Co2+)性质相似,工业上可通过电化学装置将废水中的Co2+和Ni2+分离,装置如图。已知Co2+和乙酰丙酮不反应,下列说法错误的是( )
A.膜a为阴离子交换膜,膜b为阳离子交换膜
B.通电过程中Ⅳ室内硫酸浓度逐渐增大
C.Ⅲ室中Ni2+参与的反应为Ni2++2CH3COCH2COCH3+2OH- ══ Ni(CH3COCHCOCH3)2+2H2O
D.通电过程中N极每产生11.2 L(标准状况下)气体,双极膜内减少18 g H2O
答案 B
解析 根据电解池中离子移动方向可知,左侧石墨M为阳极,右侧石墨N为阴极,Ⅱ室为原料室,膜b为阳离子交换膜,Co2+、Ni2+进入Ⅲ室,Co2+和乙酰丙酮不反应,Ni2+和乙酰丙酮反应。膜a为阴离子交换膜,膜b为阳离子交换膜,A正确;石墨N为阴极,电极反应为2H++2e- ══ H2↑,Ⅳ室内消耗的H+与转移来的H+相等,故硫酸浓度不变,B错误;由题中信息可知,Ⅲ室中Ni2+参与的反应为Ni2++2CH3COCH2COCH3+2OH- ══ Ni(CH3COCHCOCH3)2 +2H2O,C正确;通电过程中N极每产生11.2 L(标准状况下)气体,即0.5 mol H2,透过双极膜的H+为1 mol,则双极膜内减少18 g H2O,D正确。
练预测·押考向
下列说法不正确的是( )
A.在0~20 min时,a为电源的负极
答案 B
8.我国科技工作者设计了一种电解装置,能将甘油(C3H8O3)和二氧化碳转化为甘油醛(C3H6O3)和合成气(CO和H2),原理如图所示,下列说法错误的是( )
A.催化电极b与电源负极相连
B.电解时催化电极a附近的pH增大
C.电解时阴离子透过交换膜向催化电极a迁移
D.生成合成气时电极上发生还原反应
B
9.我国科学家设计了一种CO2捕获和利用一体化装置,利用含 的废水和CO2制备甲酸铵(HCOONH4),其反应过程示意图如下。有关说法错误的是( )
C.装置Ⅱ中OH-穿过阴离子交换膜由左向右迁移
D.空气的作用是将含NH3的气体吹出反应器
答案 B
专题 电解池原理及金属的腐蚀与防护
考题统计
电解池原理及金属的腐蚀与防护:
湖南卷(2023、2022、2021),湖北卷(2023、2022、2021),广东卷(2023、2022、2021),海南卷(2022、2021),江苏卷(2022、2021、2020),河北卷(2022),重庆卷(2022、2021),北京卷(2022、2020),山东卷(2023、2022、2020),浙江卷(2023、2022),辽宁卷(2023、2021),天津卷(2021)
聚焦核心要点
要点1电解池原理及应用
课标指引:1.了解电解池的工作原理,认识电解在实现物质转化和储存能量中的具体应用。 2.能分析、解释电解池的工作原理,能设计简单的电解池。
1.基于电解CuCl2溶液的电解池模型(两电极均为惰性电极)
2.判断电解池的电极产物的方法
(1)阳极产物的判断首先看电极,若为活性电极作阳极,则电极材料失电子,电极本身溶解;若为惰性电极作阳极,则需看溶液中阴离子的失电子能力,阴离子放电顺序为S2->I->Br->Cl->OH-(水)。
(2)阴极产物的判断直接根据阳离子的放电顺序进行判断:Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+>Fe2+>Zn2+>H+(水)。
微点拨
①铁作为阳极时,发生氧化反应生成Fe2+而溶解,不是生成Fe3+;②电解时,溶液中Fe3+发生还原反应,一般生成Fe2+。
易错辨析
1.在电解精炼粗铜的过程中,当阴极质量增重32 g时转移的电子数为NA(NA为阿伏加德罗常数的值)。( )
2.用铜作电极电解AgNO3溶液:4Ag++2H2O 4Ag+O2↑+4H+。( )
√
×
用铜作电极电解AgNO3溶液,阳极上Cu失电子转化为Cu2+,阴极上是Ag+得到电子转化为Ag,故该电解反应为Cu+2Ag+ 2Ag+Cu2+。
3.有电化学装置甲、乙分别如图所示。
(1)甲中阴极反应为Ag++e- ══ Ag。( )
(2)乙中电解开始时阳极产生黄绿色气体。( )
√
甲为电解池,银离子在阴极得电子生成银单质,电极反应为Ag++e- ══ Ag,故(1)正确。
×
乙为电解池,Pt为阳极,Fe为阴极,失电子能力:I->Cl-,所以电解开始时阳极上碘离子失电子生成碘单质,(2)错误。
要点2金属的腐蚀与防护
课标指引:1.了解金属发生电化学腐蚀的本质,知道金属腐蚀的危害,了解防止金属腐蚀的措施。 2.能利用电化学原理解释金属腐蚀的现象,选择并设计防腐措施。
1.熟悉两种电化学防护原理及方法
两种方法都要采用辅助阳极,将被保护金属作为阴极
方法 牺牲阳极法 外加电流法
原理 图示
原理 分析 利用原电池原理,被保护金属为正极,受到保护 利用电解池原理,将被保护金属与电源的负极相连,电解池的阴极受到保护
2.基于“介质”判断电化学腐蚀的类型
精研核心命题
命题点1电解池原理及其应用
典例1 (2023·全国甲卷)用可再生能源电还原CO2时,采用高浓度的K+抑制酸性电解液中的析氢反应来提高多碳产物(乙烯、乙醇等)的生成率,装置如图所示。下列说法正确的是( )
A.析氢反应发生在IrOx-Ti电极上
B.Cl-从Cu电极迁移到IrOx-Ti电极
C.阴极发生的反应有:2CO2+12H++12e- ══ C2H4+4H2O
D.每转移1 mol电子,阳极生成11.2 L气体(标准状况)
答案 C
思路分析 电化学装置定位:电解池。本题中电极反应分析如下:
电极类型 物质变化及类型 电极反应
Cu电极(阴极) CO2→C2H4等,发生还原反应 2CO2+12H++12e-══C2H4+4H2O等
IrOx-Ti(阳极) H2O→O2,发生氧化反应 2H2O-4e-══O2↑+4H+
变式演练(2023·浙江6月选考)氯碱工业能耗大,通过如图改进的设计可大幅度降低能耗,下列说法不正确的是( )
A.电极A接电源正极,发生氧化反应
B.电极B的电极反应为2H2O+2e- ══ H2↑+2OH-
C.应选用阳离子交换膜,在右室获得浓度较高的NaOH溶液
D.改进设计中通过提高电极B上反应物的氧化性来降低电解电压,减少能耗
B
解析 电极A上氯离子变为氯气,化合价升高,失去电子,是电解池阳极,因此电极A接电源正极,发生氧化反应,A正确;电极B为阴极,通入氧气,氧气得到电子,其电极反应为2H2O+4e-+O2 ══ 4OH-,B错误;右室生成氢氧根,应选用阳离子交换膜,让左室的钠离子进入右室,在右室获得浓度较高的NaOH溶液,C正确;改进设计中增大了氧气的量,提高了电极B处的氧化性,通过反应物的氧化性来降低电解电压,减少能耗,D正确。
【思维建模】
解答电解原理及其应用类题目的思维模型
(1)判断电解池阴、阳极的方法
(2)判断电极产物和书写电极反应的方法
命题点2金属腐蚀的电化学防护
典例2 (2022·广东卷)为检验牺牲阳极的阴极保护法对钢铁防腐的效果,将镀层有破损的镀锌铁片放入酸化的3%NaCl溶液中。一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是( )
A.加入AgNO3溶液产生沉淀
B.加入淀粉碘化钾溶液无蓝色出现
C.加入KSCN溶液无红色出现
D.加入K3[Fe(CN)6]溶液无蓝色沉淀生成
D
解析 NaCl溶液中含有Cl-,加入AgNO3溶液后,不管铁片是否被腐蚀,均会出现白色沉淀,A错误;淀粉碘化钾溶液可检测氧化性物质,但不论铁片是否被腐蚀,均无氧化性物质生成,B错误;KSCN溶液可检测Fe3+是否存在,钢铁腐蚀生成Fe2+,无论铁片是否被腐蚀,加入KSCN溶液后,均无红色出现,C错误;K3[Fe(CN)6]是用于检测Fe2+的试剂,若铁片没有被腐蚀,溶液中不会生成Fe2+,则加入K3[Fe(CN)6]溶液就不会出现蓝色沉淀,D正确。
变式演练(2023·辽宁鞍山一模)点蚀又称为孔蚀,是一种集中于金属表面很小的范围并深入金属内部的腐蚀形态。某铁合金钝化膜破损后的孔蚀如图,下列说法错误的是( )
A.孔隙中有可能发生析氢腐蚀
B.孔蚀中Fe2+水解导致电解质溶液酸性增强
C.为防止孔蚀发生可以将外接电源负极与金属相连
D.孔蚀外每吸收2.24 L O2,可氧化0.2 mol Fe
D
解析 孔隙中电解质溶液呈酸性,可以发生析氢腐蚀,A正确;孔蚀中Fe2+发生水解反应:Fe2++2H2O Fe(OH)2+2H+,导致电解质溶液酸性增强,B正确;将外接电源的负极与金属相连,金属作电解池阴极,利用了外加电流法进行保护,可以防止孔蚀发生,C正确;题目未指明O2是否处于标准状况,不能计算O2的物质的量,D错误。
训练分层落实
练真题·明考向
1.(2023·浙江1月选考卷)在熔融盐体系中,通过电解TiO2和SiO2获得电池材料(TiSi),电解装置如图,下列说法正确的是( )
A.石墨电极为阴极,发生氧化反应
B.电极A的电极反应:
8H++TiO2+SiO2+8e- ══ TiSi+4H2O
C.该体系中,石墨优先于Cl-参与反应
D.电解时,阳离子向石墨电极移动
C
解析 由图可知,电极A上获得TiSi,则电极A是阴极,石墨电极是阳极,A错误。因为是熔融盐体系,不可能有H+存在,B错误。图中石墨电极上生成CO,未生成Cl2,说明石墨先于Cl-参与电极反应,C正确。电解池中,阳离子向阴极移动,电极A是阴极,则阳离子向电极A移动,D错误。
2.(2023·湖北卷)我国科学家设计如图所示的电解池,实现了海水直接制备氢气技术的绿色化。该装置工作时阳极无Cl2生成且KOH溶液的浓度不变,电解生成氢气的速率为x mol·h-1。下列说法错误的是( )
A.b电极反应为2H2O+2e- ══ H2↑+2OH-
B.离子交换膜为阴离子交换膜
C.电解时海水中动能高的水分子可穿过PTFE膜
D.海水为电解池补水的速率为2x mol·h-1
D
解析 该装置工作时,b电极连接电源负极为阴极,电极上放出H2:2H2O+2e- ══ H2↑+2OH-,A正确;阳极无Cl2生成且KOH溶液浓度不变,则本质上是电解水,阳极生成O2,两极之间转移OH-,离子交换膜为阴离子交换膜,B正确;电解的本质是电解水,而KOH浓度不变,PTFE膜不透液态水,则通过PTFE膜的水应为动能高的水分子(透汽),C正确;电解生成H2的速率为x mol·h-1,根据总反应可知,海水为电解池补水的速率为x mol·h-1,D错误。
3.(2023·辽宁卷)某无隔膜流动海水电解法制H2的装置如图所示,其中高选择性催化剂PRT可抑制O2产生。下列说法正确的是( )
A.b端电势高于a端电势
B.理论上转移2 mol e-生成4 g H2
C.电解后海水pH下降
D.阳极发生:Cl-+H2O-2e- ══ HClO+H+
D
解析 H2为还原产物,故钛箔为电解池的阴极,钛网电极为阳极。阳极连接电源正极,阴极连接电源负极,故a端电势高于b端电势,A错误;电解时,阳极反应为Cl-+H2O-2e- ══ HClO+H+,阴极反应为2H2O+2e- ══H2↑+2OH-,总反应方程式为Cl-+H2O ══ ClO-+H2↑,理论上转移2 mol e-生成2 g H2,B错误、D正确;流动海水电解后,海水中含有NaClO,其为强碱弱酸盐,pH不会下降,C错误。
练易错·避陷阱
4.(2023·北京东城区一模)用石墨作电极电解a浊液,记录如表。
实验装置 实验现象 Ⅰ.a为AgCl Ⅱ.a为AgI
两电极均产生气泡,有黑色固体在阴极附近生成,并沉降在烧杯底部,烧杯中的液体逐渐变澄清透明 两电极均产生气泡,阴极表面附着少量银白色固体,烧杯中的液体逐渐变为棕黄色
下列说法不正确的是( )
A.Ⅰ中阳极气体可能为Cl2和O2,Ⅱ中阳极气体为O2
B.Ⅰ和Ⅱ中阴极生成气体的电极反应均为2H2O+2e- ══ H2↑+2OH-
C.Ⅱ中液体变为棕黄色,说明阳极上发生了反应2AgI-2e- ══ I2+2Ag+
D.两实验阴极现象有差异的原因可能是Ⅱ中c(Ag+)比Ⅰ中的小
答案 C
解析 Ⅰ中Cl-和H2O均可能在阳极发生氧化反应,则Ⅰ中阳极气体可能为Cl2和O2,Ⅱ中阳极气体为氧气,A正确。Ⅰ和Ⅱ中阴极生成的气体都是H2,电极反应为2H2O+2e- ══ H2↑+2OH-,B正确。Ⅱ中H2O在阳极发生氧化反应生成氧气,电极反应为2H2O-4e- ══ O2↑+4H+,反应生成的氧气将I-氧化为I2,从而使Ⅱ中液体变为棕黄色,C错误。AgCl的溶解度大于AgI,AgCl悬浊液中c(Ag+)大于AgI悬浊液中c(Ag+),故两实验中阴极现象有差异的原因可能是Ⅱ中c(Ag+)比Ⅰ中的小,D正确。
5.(2023·四川成都一模)某种电催化法以CoP、Ni2P为催化电极合成腈类化合物(RCN)和偶氮化合物(R—N=N—R),装置示意图如图所示。下列说法错误的是( )
A.左侧电极的电势比右侧的高,且发生氧化反应
C.OH-从右侧经过阴离子交换膜向左侧移动
D.每当合成得到1 mol RCN时,同时合成1 mol R—N=N—R
D
解析 右侧电极上硝基苯发生还原反应,则右侧为阴极、左侧为阳极,故左侧电极的电势比右侧的高,且发生氧化反应,A正确;右侧电极反应为
电解质溶液中阴离子向阳极移动,则OH-从右侧经过阴离子交换膜向左侧移动,C正确;阳极反应为RCH2NH2+4OH--4e- ══ RCN+4H2O,根据得失电子守恒,当合成得到1 mol RCN时,同时合成0.5 mol R—N=N—R,D错误。
6.(2023·山西忻州一模)镍离子(Ni2+)和钴离子(Co2+)性质相似,工业上可通过电化学装置将废水中的Co2+和Ni2+分离,装置如图。已知Co2+和乙酰丙酮不反应,下列说法错误的是( )
A.膜a为阴离子交换膜,膜b为阳离子交换膜
B.通电过程中Ⅳ室内硫酸浓度逐渐增大
C.Ⅲ室中Ni2+参与的反应为Ni2++2CH3COCH2COCH3+2OH- ══ Ni(CH3COCHCOCH3)2+2H2O
D.通电过程中N极每产生11.2 L(标准状况下)气体,双极膜内减少18 g H2O
答案 B
解析 根据电解池中离子移动方向可知,左侧石墨M为阳极,右侧石墨N为阴极,Ⅱ室为原料室,膜b为阳离子交换膜,Co2+、Ni2+进入Ⅲ室,Co2+和乙酰丙酮不反应,Ni2+和乙酰丙酮反应。膜a为阴离子交换膜,膜b为阳离子交换膜,A正确;石墨N为阴极,电极反应为2H++2e- ══ H2↑,Ⅳ室内消耗的H+与转移来的H+相等,故硫酸浓度不变,B错误;由题中信息可知,Ⅲ室中Ni2+参与的反应为Ni2++2CH3COCH2COCH3+2OH- ══ Ni(CH3COCHCOCH3)2 +2H2O,C正确;通电过程中N极每产生11.2 L(标准状况下)气体,即0.5 mol H2,透过双极膜的H+为1 mol,则双极膜内减少18 g H2O,D正确。
练预测·押考向
下列说法不正确的是( )
A.在0~20 min时,a为电源的负极
答案 B
8.我国科技工作者设计了一种电解装置,能将甘油(C3H8O3)和二氧化碳转化为甘油醛(C3H6O3)和合成气(CO和H2),原理如图所示,下列说法错误的是( )
A.催化电极b与电源负极相连
B.电解时催化电极a附近的pH增大
C.电解时阴离子透过交换膜向催化电极a迁移
D.生成合成气时电极上发生还原反应
B
9.我国科学家设计了一种CO2捕获和利用一体化装置,利用含 的废水和CO2制备甲酸铵(HCOONH4),其反应过程示意图如下。有关说法错误的是( )
C.装置Ⅱ中OH-穿过阴离子交换膜由左向右迁移
D.空气的作用是将含NH3的气体吹出反应器
答案 B
同课章节目录
