专题 反应机理与隔膜的应用(共27张PPT)
文档属性
| 名称 | 专题 反应机理与隔膜的应用(共27张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-22 23:13:08 | ||
图片预览






文档简介
(共27张PPT)
专题 反应机理与隔膜的应用
考题统计
电化学的综合应用:
山东卷(2022),湖南卷(2022),辽宁卷(2022),北京卷(2022、2021)
突破点1 反应机理的分析及应用
高考指引:近几年,化学反应机理的分析及应用是高考命题的热点之一,此类试题大多以“能量-历程转化”“物质转化循环”等为载体,考查吸热(或放热)反应、共价键及变化、活化能与反应速率等,侧重考查考生的“理解与辨析能力”“分析与推测能力”等关键能力。
核心归纳
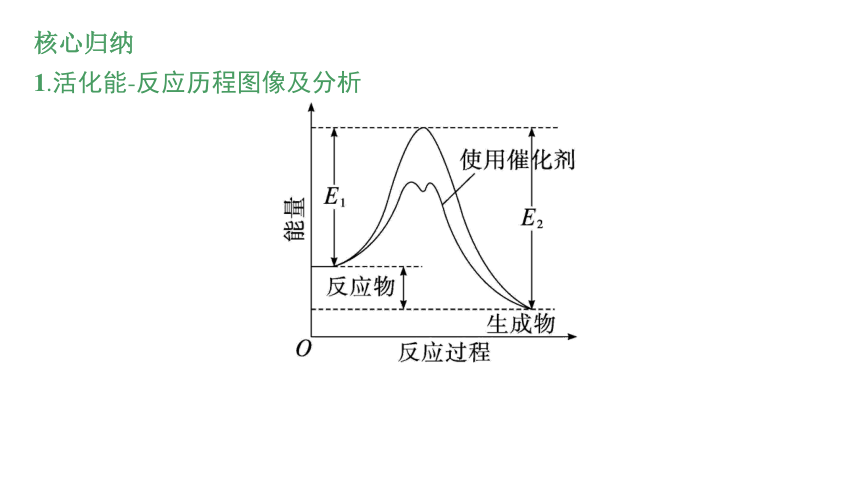
1.活化能-反应历程图像及分析
(1)反应热取决于反应物的总能量与生成物的总能量的相对大小,仅由部分反应物和部分生成物的总能量,不能判断反应是吸热反应还是放热反应。
(2)从反应物至最高点的能量数值代表正反应的活化能(E1),从最高点到生成物的能量数值代表逆反应的活化能(E2)。
(3)催化剂只能改变正、逆反应的活化能,从而改变反应速率,但不能改变反应的ΔH。
(4)涉及反应热的相关计算时,要特别注意图中反应物和生成物的物质的量。
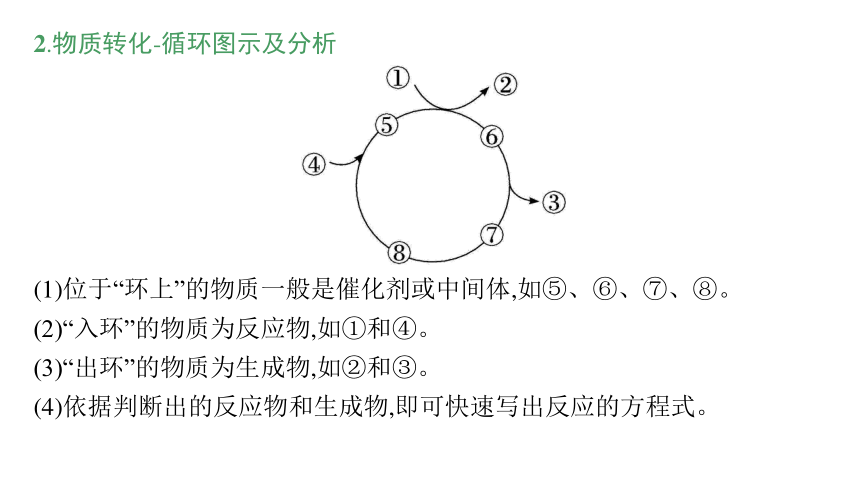
2.物质转化-循环图示及分析
(1)位于“环上”的物质一般是催化剂或中间体,如⑤、⑥、⑦、⑧。
(2)“入环”的物质为反应物,如①和④。
(3)“出环”的物质为生成物,如②和③。
(4)依据判断出的反应物和生成物,即可快速写出反应的方程式。
真题感悟
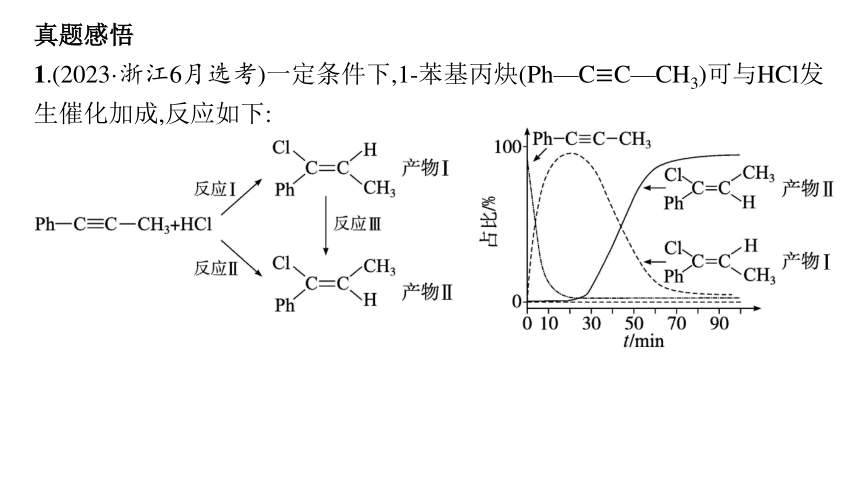
1.(2023·浙江6月选考)一定条件下,1-苯基丙炔(Ph—C≡C—CH3)可与HCl发生催化加成,反应如下:
反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应Ⅰ、Ⅲ为放热反应),下列说法不正确的是( )
A.反应焓变:反应Ⅰ>反应Ⅱ
B.反应活化能:反应Ⅰ<反应Ⅱ
C.增加HCl浓度可增加平衡时产物Ⅱ和产物Ⅰ的比例
D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ
C
解析 反应Ⅰ、Ⅲ为放热反应,相同物质的量的反应物,根据盖斯定律可知,反应Ⅰ放出的热量小于反应Ⅱ放出的热量,反应放出的热量越多,其焓变越小,因此反应焓变:反应Ⅰ>反应Ⅱ,A正确;开始一段时间里反应Ⅰ得到的产物比反应Ⅱ得到的产物多,说明反应Ⅰ的速率比反应Ⅱ的速率快,速率越快,其活化能越小,则反应活化能:反应Ⅰ<反应Ⅱ,B正确;增加HCl浓度,平衡正向移动,但平衡时产物Ⅱ和产物Ⅰ的比例可能降低,C错误;根据图中信息,选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ,D正确。
2.(2022·湖南卷改编)反应物(S)转化为产物(P或P·Z)的能量与反应历程的关系如下图所示:
下列有关四种不同反应历程的说法正确的是( )
A.历程Ⅰ是吸热反应 B.平衡时P的产率:Ⅱ>Ⅰ
C.生成P的速率:Ⅲ>Ⅱ D.历程Ⅳ中,Z没有催化作用
D
解析 历程Ⅰ中S的总能量高于产物P的总能量,则历程Ⅰ是放热反应,A错误;历程Ⅱ中使用了催化剂X,但是催化剂不能改变平衡产率,在两个历程中平衡时P的产率相同,B错误;历程Ⅲ中由S·Y转化为P·Y的活化能高于历程Ⅱ中由S·X转化为P·X的活化能,由于这两步反应分别是两个历程的决速步骤,则生成P的速率为Ⅲ<Ⅱ,C错误;历程Ⅳ中S吸附到Z表面生成S·Z,然后S·Z转化为产物P·Z,由于P·Z没有转化为P+Z,故Z没有表现出催化作用,D正确。
【思维建模】 解答物质转化历程-能量图像及分析类题目的方法
考向预测
1.(2023·山西临汾一模)不同含金化合物催化乙烯加氢的反应历程如图所示:
下列说法正确的是( )
A.从图中可得1 mol C2H4(g)具有的能量比1 mol C2H6(g)的能量高
B.过渡态1比过渡态2物质的稳定性弱
C.在催化剂 催化下,该反应的ΔH=-233.7 kJ· mol-1
D.相比催化剂 ,AuF催化乙烯加氢的效果更好
B
解析 根据图示可知,1 mol C2H4(g)和1 mol H2(g)具有的能量比1 mol C2H6(g)的能量高,A错误;过渡态1具有的能量比过渡态2高,则过渡态1比过渡态2物质的稳定性弱,B正确;该反应的ΔH=-129.6 kJ· mol-1,且焓变与催化剂无关,C错误;根据图示可知, 对应的活化能小,则催化效果好,D错误。
2.(2023·辽宁辽阳一模)某课题组对羧基化研究取得了很大的进展,历程如图所示。
已知:R—为烃基,Me—为甲基。下列叙述正确的是( )
A.NiCl2(PCy3)2能降低总反应的活化能
B.物质1和物质A反应时,只断裂了C—C
C.物质2中—R为
—CH(Me)Ar
D.C转化为D时,1个CO2分子断裂了2个π键
C
解析 NiCl2(PCy3)2是制备催化剂Ni0 L*的原料,不是催化剂,不能降低反应的活化能,A错误;物质1和物质A反应时,还断裂了C—N,B错误;由D到E的转化,根据D的结构简式可知,E中R应为—CH(Me)Ar,E到物质2的过程中R未改变,C正确;C→D过程中,1个CO2分子只断裂了1个π键,D错误。
突破点2 电化学装置中的隔膜及应用
高考指引:近几年,在高考试题的新型化学电源、电解池等电化学装置中重点考查了“隔膜”(阴、阳离子交换膜,双极膜等)的作用及分析,要求理解相关原理,并迁移应用于分析“双膜”电解槽、“多膜”电解槽等电化学装置,侧重考查考生的“理解与辨析能力”“分析与推测能力”等关键能力。
核心归纳
1.电渗析法的应用模型
将含AnBm的废水再生为HnB和A(OH)m的模型及原理如图,已知A为金属活动顺序中氢之前的金属,Bn-为含氧酸根离子。
2.“隔膜”(离子交换膜)的种类及作用
真题感悟
1.(2022·浙江6月选考卷)通过电解废旧锂电池中的LiMn2O4可获得难溶性的Li2CO3和MnO2,电解示意图如下(其中滤布的作用是阻挡固体颗粒,但离子可自由通过。电解过程中溶液的体积变化忽略不计)。下列说法不正确的是( )
A.电极A为阴极,发生还原反应
B.电极B的电极反应:2H2O+Mn2+-2e-
══ MnO2+4H+
C.电解一段时间后溶液中Mn2+浓度保持不变
D.电解结束,可通过调节pH除去Mn2+,再加入Na2CO3溶液以获得Li2CO3
C
解析 由电解示意图可知,电极B上Mn2+转化为MnO2,锰元素化合价升高,发生氧化反应,则电极B为阳极,电极A为阴极,电极A发生还原反应,A正确;电极B上Mn2+失电子转化为MnO2,电极反应为2H2O+Mn2+-2e- ══ MnO2+4H+,B正确;电极A为阴极,LiMn2O4得电子,电极反应为2LiMn2O4+16H++6e- ══ 2Li++4Mn2++8H2O,依据得失电子守恒,电解池总反应为2LiMn2O4+4H+ ══ 2Li++Mn2++3MnO2+2H2O,反应生成了Mn2+,Mn2+浓度增大,C错误;电解结束后,可通过调节溶液pH将锰离子转化为沉淀除去,然后加入碳酸钠溶液,从而获得碳酸锂,D正确。
2.(2022·全国甲卷)一种水性电解液Zn-MnO2离子选择双隔膜电池如图所示(KOH溶液中,Zn2+以[Zn(OH)4]2-存在)。电池放电时,下列叙述错误的是
( )
A.Ⅱ区的K+通过隔膜向Ⅲ区迁移
B.Ⅰ区的 通过隔膜向Ⅱ区迁移
C.MnO2电极反应:
MnO2+4H++2e- ══ Mn2++2H2O
D.电池总反应:Zn+4OH-+MnO2+4H+
══[Zn(OH)4]2-+Mn2++2H2O
A
解析 由图可知,Zn电极为负极,MnO2电极为正极,溶液中阳离子向正极迁移,故Ⅱ区的K+不能通过隔膜向Ⅲ区迁移,A错误;MnO2电极反应为MnO2+4H++2e- ══ Mn2++2H2O,反应消耗H+,则Ⅰ区的 通过隔膜向Ⅱ区迁移,以保持溶液呈电中性,B、C正确;放电时,负极反应为Zn+4OH--2e- ══[Zn(OH)4]2-,结合正极反应可得电池总反应为Zn+4OH-+MnO2+4H+ ══[Zn(OH)4]2-+Mn2++2H2O,D正确。
【思维建模】解答含“隔膜”电化学装置类题目的思维模板
考向预测
(2023·辽宁重点高中联合体联考)某团队开发出了用于制氢的膜基海水电解槽,其装置如图所示。已知隔水膜只允许水分子透过。下列说法正确的是( )
A.M极为阳极
B.理论上迁移1 mol OH-时,海水质量净减9 g
C.M极的电极反应为4H2O-4e- ══ 4OH-+O2↑
D.电路上每通过2 mol电子,理论上N极逸出22.4 L H2
B
解析 电解池中阴离子向阳极移动,OH-由M极移向N极,则M极为阴极,N极为阳极,A错误;M极电极反应为2H2O+2e- ══ 2OH-+H2↑,N极电极反应为2H2O-4e- ══ 4H++O2↑,理论上迁移1 mol OH-时,转移1 mol e-,则生成0.5 mol H2和0.25 mol O2,海水质量净减0.5 mol×2 g·mol-1+0.25 mol×
32 g·mol-1=9 g,B正确,C错误;题目未指明气体是否处于标准状况下,不能计算生成氢气的体积,D错误。
专题 反应机理与隔膜的应用
考题统计
电化学的综合应用:
山东卷(2022),湖南卷(2022),辽宁卷(2022),北京卷(2022、2021)
突破点1 反应机理的分析及应用
高考指引:近几年,化学反应机理的分析及应用是高考命题的热点之一,此类试题大多以“能量-历程转化”“物质转化循环”等为载体,考查吸热(或放热)反应、共价键及变化、活化能与反应速率等,侧重考查考生的“理解与辨析能力”“分析与推测能力”等关键能力。
核心归纳
1.活化能-反应历程图像及分析
(1)反应热取决于反应物的总能量与生成物的总能量的相对大小,仅由部分反应物和部分生成物的总能量,不能判断反应是吸热反应还是放热反应。
(2)从反应物至最高点的能量数值代表正反应的活化能(E1),从最高点到生成物的能量数值代表逆反应的活化能(E2)。
(3)催化剂只能改变正、逆反应的活化能,从而改变反应速率,但不能改变反应的ΔH。
(4)涉及反应热的相关计算时,要特别注意图中反应物和生成物的物质的量。
2.物质转化-循环图示及分析
(1)位于“环上”的物质一般是催化剂或中间体,如⑤、⑥、⑦、⑧。
(2)“入环”的物质为反应物,如①和④。
(3)“出环”的物质为生成物,如②和③。
(4)依据判断出的反应物和生成物,即可快速写出反应的方程式。
真题感悟
1.(2023·浙江6月选考)一定条件下,1-苯基丙炔(Ph—C≡C—CH3)可与HCl发生催化加成,反应如下:
反应过程中该炔烃及反应产物的占比随时间的变化如图(已知:反应Ⅰ、Ⅲ为放热反应),下列说法不正确的是( )
A.反应焓变:反应Ⅰ>反应Ⅱ
B.反应活化能:反应Ⅰ<反应Ⅱ
C.增加HCl浓度可增加平衡时产物Ⅱ和产物Ⅰ的比例
D.选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ
C
解析 反应Ⅰ、Ⅲ为放热反应,相同物质的量的反应物,根据盖斯定律可知,反应Ⅰ放出的热量小于反应Ⅱ放出的热量,反应放出的热量越多,其焓变越小,因此反应焓变:反应Ⅰ>反应Ⅱ,A正确;开始一段时间里反应Ⅰ得到的产物比反应Ⅱ得到的产物多,说明反应Ⅰ的速率比反应Ⅱ的速率快,速率越快,其活化能越小,则反应活化能:反应Ⅰ<反应Ⅱ,B正确;增加HCl浓度,平衡正向移动,但平衡时产物Ⅱ和产物Ⅰ的比例可能降低,C错误;根据图中信息,选择相对较短的反应时间,及时分离可获得高产率的产物Ⅰ,D正确。
2.(2022·湖南卷改编)反应物(S)转化为产物(P或P·Z)的能量与反应历程的关系如下图所示:
下列有关四种不同反应历程的说法正确的是( )
A.历程Ⅰ是吸热反应 B.平衡时P的产率:Ⅱ>Ⅰ
C.生成P的速率:Ⅲ>Ⅱ D.历程Ⅳ中,Z没有催化作用
D
解析 历程Ⅰ中S的总能量高于产物P的总能量,则历程Ⅰ是放热反应,A错误;历程Ⅱ中使用了催化剂X,但是催化剂不能改变平衡产率,在两个历程中平衡时P的产率相同,B错误;历程Ⅲ中由S·Y转化为P·Y的活化能高于历程Ⅱ中由S·X转化为P·X的活化能,由于这两步反应分别是两个历程的决速步骤,则生成P的速率为Ⅲ<Ⅱ,C错误;历程Ⅳ中S吸附到Z表面生成S·Z,然后S·Z转化为产物P·Z,由于P·Z没有转化为P+Z,故Z没有表现出催化作用,D正确。
【思维建模】 解答物质转化历程-能量图像及分析类题目的方法
考向预测
1.(2023·山西临汾一模)不同含金化合物催化乙烯加氢的反应历程如图所示:
下列说法正确的是( )
A.从图中可得1 mol C2H4(g)具有的能量比1 mol C2H6(g)的能量高
B.过渡态1比过渡态2物质的稳定性弱
C.在催化剂 催化下,该反应的ΔH=-233.7 kJ· mol-1
D.相比催化剂 ,AuF催化乙烯加氢的效果更好
B
解析 根据图示可知,1 mol C2H4(g)和1 mol H2(g)具有的能量比1 mol C2H6(g)的能量高,A错误;过渡态1具有的能量比过渡态2高,则过渡态1比过渡态2物质的稳定性弱,B正确;该反应的ΔH=-129.6 kJ· mol-1,且焓变与催化剂无关,C错误;根据图示可知, 对应的活化能小,则催化效果好,D错误。
2.(2023·辽宁辽阳一模)某课题组对羧基化研究取得了很大的进展,历程如图所示。
已知:R—为烃基,Me—为甲基。下列叙述正确的是( )
A.NiCl2(PCy3)2能降低总反应的活化能
B.物质1和物质A反应时,只断裂了C—C
C.物质2中—R为
—CH(Me)Ar
D.C转化为D时,1个CO2分子断裂了2个π键
C
解析 NiCl2(PCy3)2是制备催化剂Ni0 L*的原料,不是催化剂,不能降低反应的活化能,A错误;物质1和物质A反应时,还断裂了C—N,B错误;由D到E的转化,根据D的结构简式可知,E中R应为—CH(Me)Ar,E到物质2的过程中R未改变,C正确;C→D过程中,1个CO2分子只断裂了1个π键,D错误。
突破点2 电化学装置中的隔膜及应用
高考指引:近几年,在高考试题的新型化学电源、电解池等电化学装置中重点考查了“隔膜”(阴、阳离子交换膜,双极膜等)的作用及分析,要求理解相关原理,并迁移应用于分析“双膜”电解槽、“多膜”电解槽等电化学装置,侧重考查考生的“理解与辨析能力”“分析与推测能力”等关键能力。
核心归纳
1.电渗析法的应用模型
将含AnBm的废水再生为HnB和A(OH)m的模型及原理如图,已知A为金属活动顺序中氢之前的金属,Bn-为含氧酸根离子。
2.“隔膜”(离子交换膜)的种类及作用
真题感悟
1.(2022·浙江6月选考卷)通过电解废旧锂电池中的LiMn2O4可获得难溶性的Li2CO3和MnO2,电解示意图如下(其中滤布的作用是阻挡固体颗粒,但离子可自由通过。电解过程中溶液的体积变化忽略不计)。下列说法不正确的是( )
A.电极A为阴极,发生还原反应
B.电极B的电极反应:2H2O+Mn2+-2e-
══ MnO2+4H+
C.电解一段时间后溶液中Mn2+浓度保持不变
D.电解结束,可通过调节pH除去Mn2+,再加入Na2CO3溶液以获得Li2CO3
C
解析 由电解示意图可知,电极B上Mn2+转化为MnO2,锰元素化合价升高,发生氧化反应,则电极B为阳极,电极A为阴极,电极A发生还原反应,A正确;电极B上Mn2+失电子转化为MnO2,电极反应为2H2O+Mn2+-2e- ══ MnO2+4H+,B正确;电极A为阴极,LiMn2O4得电子,电极反应为2LiMn2O4+16H++6e- ══ 2Li++4Mn2++8H2O,依据得失电子守恒,电解池总反应为2LiMn2O4+4H+ ══ 2Li++Mn2++3MnO2+2H2O,反应生成了Mn2+,Mn2+浓度增大,C错误;电解结束后,可通过调节溶液pH将锰离子转化为沉淀除去,然后加入碳酸钠溶液,从而获得碳酸锂,D正确。
2.(2022·全国甲卷)一种水性电解液Zn-MnO2离子选择双隔膜电池如图所示(KOH溶液中,Zn2+以[Zn(OH)4]2-存在)。电池放电时,下列叙述错误的是
( )
A.Ⅱ区的K+通过隔膜向Ⅲ区迁移
B.Ⅰ区的 通过隔膜向Ⅱ区迁移
C.MnO2电极反应:
MnO2+4H++2e- ══ Mn2++2H2O
D.电池总反应:Zn+4OH-+MnO2+4H+
══[Zn(OH)4]2-+Mn2++2H2O
A
解析 由图可知,Zn电极为负极,MnO2电极为正极,溶液中阳离子向正极迁移,故Ⅱ区的K+不能通过隔膜向Ⅲ区迁移,A错误;MnO2电极反应为MnO2+4H++2e- ══ Mn2++2H2O,反应消耗H+,则Ⅰ区的 通过隔膜向Ⅱ区迁移,以保持溶液呈电中性,B、C正确;放电时,负极反应为Zn+4OH--2e- ══[Zn(OH)4]2-,结合正极反应可得电池总反应为Zn+4OH-+MnO2+4H+ ══[Zn(OH)4]2-+Mn2++2H2O,D正确。
【思维建模】解答含“隔膜”电化学装置类题目的思维模板
考向预测
(2023·辽宁重点高中联合体联考)某团队开发出了用于制氢的膜基海水电解槽,其装置如图所示。已知隔水膜只允许水分子透过。下列说法正确的是( )
A.M极为阳极
B.理论上迁移1 mol OH-时,海水质量净减9 g
C.M极的电极反应为4H2O-4e- ══ 4OH-+O2↑
D.电路上每通过2 mol电子,理论上N极逸出22.4 L H2
B
解析 电解池中阴离子向阳极移动,OH-由M极移向N极,则M极为阴极,N极为阳极,A错误;M极电极反应为2H2O+2e- ══ 2OH-+H2↑,N极电极反应为2H2O-4e- ══ 4H++O2↑,理论上迁移1 mol OH-时,转移1 mol e-,则生成0.5 mol H2和0.25 mol O2,海水质量净减0.5 mol×2 g·mol-1+0.25 mol×
32 g·mol-1=9 g,B正确,C错误;题目未指明气体是否处于标准状况下,不能计算生成氢气的体积,D错误。
同课章节目录
