2024苏教版高中化学必修第二册同步练习题--第2课时 化学电源(含解析)
文档属性
| 名称 | 2024苏教版高中化学必修第二册同步练习题--第2课时 化学电源(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-23 17:08:57 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2024苏教版高中化学必修第二册同步
第2课时 化学电源
基础过关练
题组一 化学电源的分类
1.(经典题)下列说法中正确的是 ( )
A.镍氢电池、锂离子电池和锌锰干电池都是二次电池
B.氢氧燃料电池是一种高效且不会污染环境的燃料电池
C.铅蓄电池放电的时候正极材料是铅,负极材料是二氧化铅
D.铅蓄电池充电时将化学能转化为电能
2.(经典题)下列说法中正确的是 ( )
①燃料电池的反应物必须储存在电池的内部
②锌锰干电池是一次电池,铅蓄电池是二次电池
③锂离子电池是新一代可充电电池
④燃料电池作为汽车驱动能源已研发成功
A.②③④ B.①②③④
C.①②③ D.①③④
题组二 化学电源
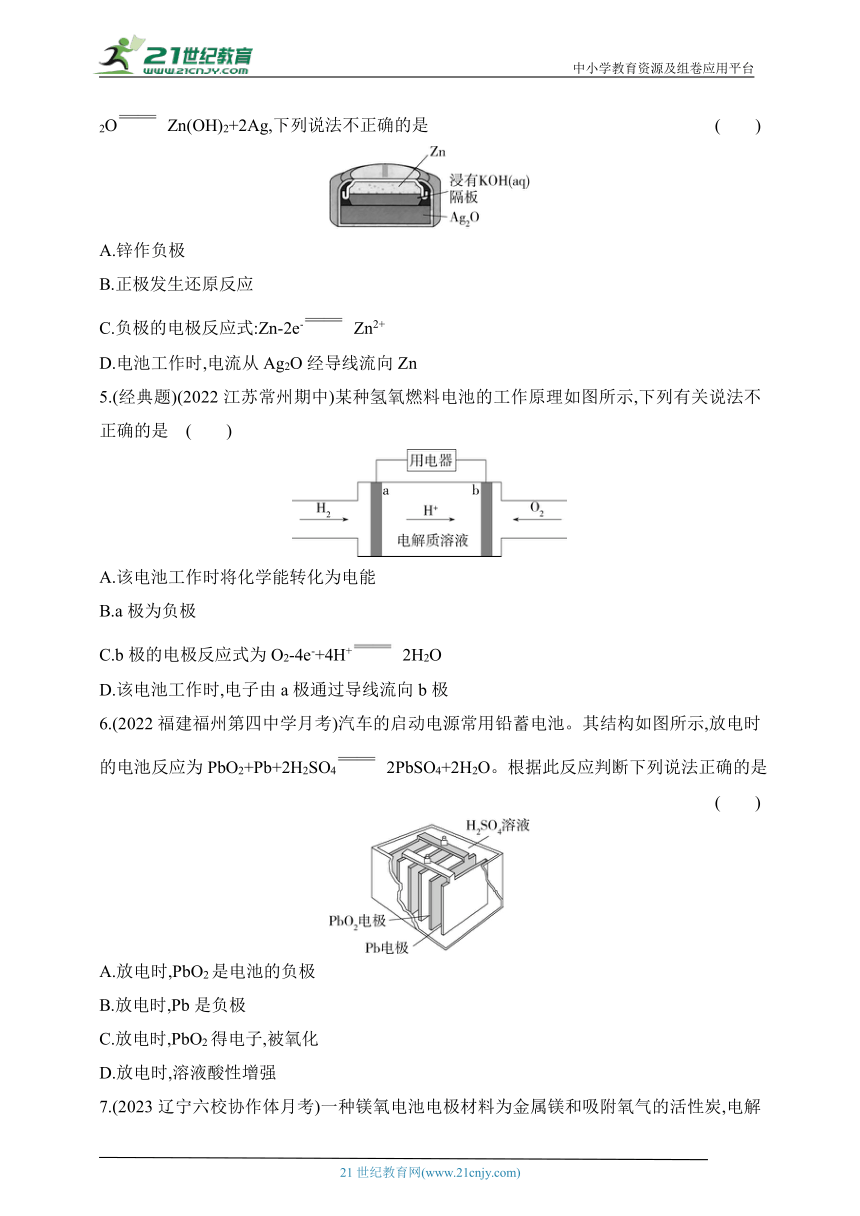
3.(2023辽宁沈阳郊校联考)下面是几种常见的化学电源示意图,有关说法不正确的是( )
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.铅蓄电池在工作中,负极每消耗1 mol铅,则硫酸溶液中就转移 2 mol电子
D.氢氧燃料电池的电解质溶液可以是稀硫酸或KOH溶液
4.(2023河北邯郸大名第一中学月考)如图为银锌纽扣电池,该电池的总反应为Zn+Ag2O+H2O Zn(OH)2+2Ag,下列说法不正确的是 ( )
A.锌作负极
B.正极发生还原反应
C.负极的电极反应式:Zn-2e- Zn2+
D.电池工作时,电流从Ag2O经导线流向Zn
5.(经典题)(2022江苏常州期中)某种氢氧燃料电池的工作原理如图所示,下列有关说法不正确的是 ( )
A.该电池工作时将化学能转化为电能
B.a极为负极
C.b极的电极反应式为O2-4e-+4H+ 2H2O
D.该电池工作时,电子由a极通过导线流向b极
6.(2022福建福州第四中学月考)汽车的启动电源常用铅蓄电池。其结构如图所示,放电时的电池反应为PbO2+Pb+2H2SO4 2PbSO4+2H2O。根据此反应判断下列说法正确的是 ( )
A.放电时,PbO2是电池的负极
B.放电时,Pb是负极
C.放电时,PbO2得电子,被氧化
D.放电时,溶液酸性增强
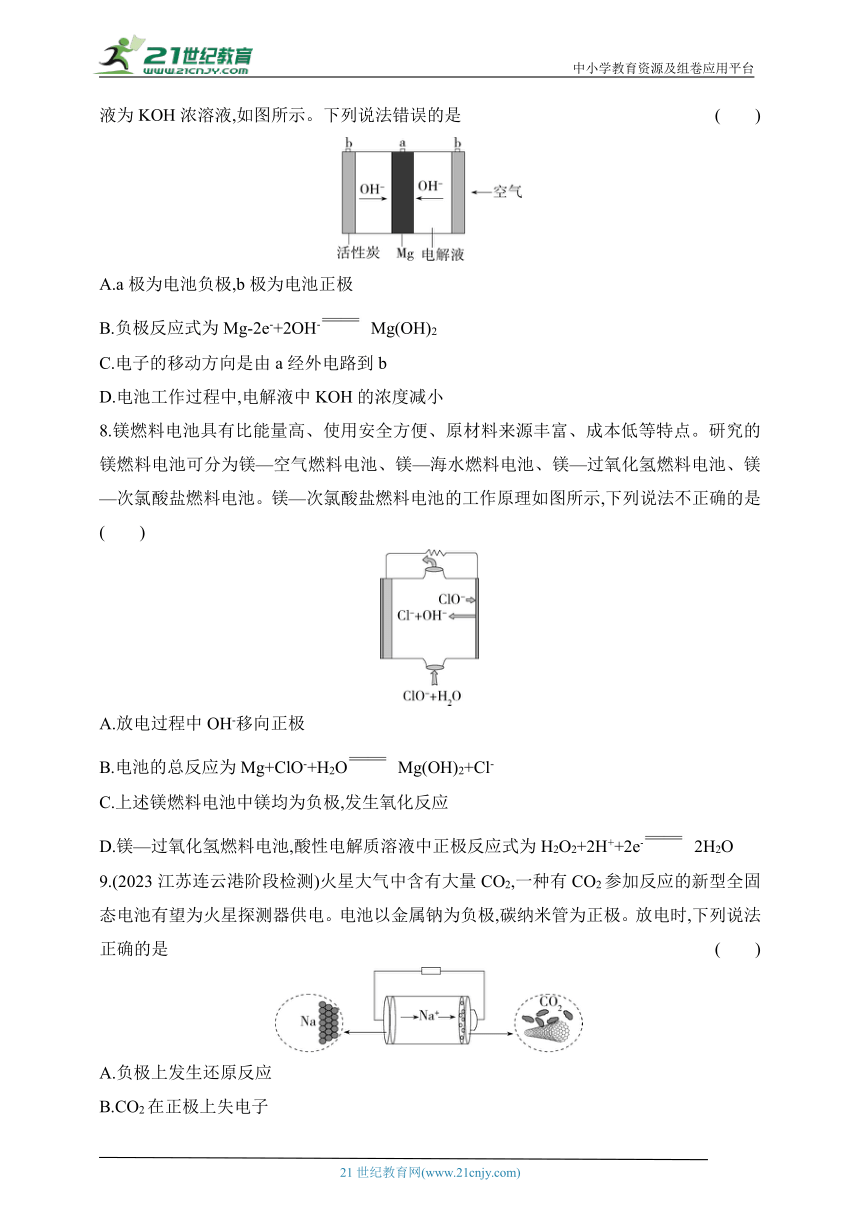
7.(2023辽宁六校协作体月考)一种镁氧电池电极材料为金属镁和吸附氧气的活性炭,电解液为KOH浓溶液,如图所示。下列说法错误的是 ( )
A.a极为电池负极,b极为电池正极
B.负极反应式为Mg-2e-+2OH- Mg(OH)2
C.电子的移动方向是由a经外电路到b
D.电池工作过程中,电解液中KOH的浓度减小
8.镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低等特点。研究的镁燃料电池可分为镁—空气燃料电池、镁—海水燃料电池、镁—过氧化氢燃料电池、镁—次氯酸盐燃料电池。镁—次氯酸盐燃料电池的工作原理如图所示,下列说法不正确的是( )
A.放电过程中OH-移向正极
B.电池的总反应为Mg+ClO-+H2O Mg(OH)2+Cl-
C.上述镁燃料电池中镁均为负极,发生氧化反应
D.镁—过氧化氢燃料电池,酸性电解质溶液中正极反应式为H2O2+2H++2e- 2H2O
9.(2023江苏连云港阶段检测)火星大气中含有大量CO2,一种有CO2参加反应的新型全固态电池有望为火星探测器供电。电池以金属钠为负极,碳纳米管为正极。放电时,下列说法正确的是 ( )
A.负极上发生还原反应
B.CO2在正极上失电子
C.工作时电子由碳纳米管经外电路流向金属钠
D.将化学能转化为电能
10.化学电池用途广泛,燃料电池具有能量转化率高、对环境友好等优点。燃料电池在工作时,从负极分别连续通入①H2、②CH4、 ③C2H5OH等,从正极连续通入④O2,在电池内部还有⑤KOH、 ⑥H2SO4等物质的溶液,反应生成⑦H2O、⑧CO2、⑨K2CO3等,同时产生电能。目前已研制成功铝—空气燃料电池,它可以代替汽油为汽车提供动力,也可用作照明电源。
(1)在上述短文标有序号的物质中,属于电解质的是 (填序号,下同);属于非电解质的是 ;和O3互为同素异形体的是 。
(2)写出上文有序号物质中盐的电离方程式: 。
(3)写出少量⑥的稀溶液滴加到⑨的溶液中的离子方程式: 。
写出向⑨的溶液中通入⑧的化学方程式: 。
(4)铝—空气燃料电池反应原理是金属Al在氯化钠溶液中与空气中的O2发生反应生成Al(OH)3,若负极有13.5 g Al参加反应,则正极消耗O2的质量为 g。
题组三 电解原理及其应用
11.(经典题)如图所示是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关判断正确的是( )
A.a为负极,b为正极
B.a为阳极,b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,溶液中氯离子浓度不变
12.通过电解法由CO2制备FeC2O4的原理如图所示,已知FeC2O4难溶于水,电解质不参与反应。下列说法正确的是 ( )
A.电极M所用材料为单质铁,b为负极,M电极发生氧化反应
B.若C2在电解液中的迁移速率大于Fe2+的迁移速率,则应选用阳离子交换膜
C.该装置工作过程的总反应为2CO2+FeFeC2O4
D.若电路中转移0.5 mol电子,则消耗CO2的体积为22.4 L(标准状况下)
13.电动汽车可以锂离子电池提供动力,锂离子电池技术已经成为汽车研究的前沿科技。某锂离子电池的总反应为xLi+Li3-xNiCoMnO6
Li3NiCoMnO6,下列说法正确的是 ( )
A.该电池的充、放电过程互为可逆反应
B.充电时主要为化学能转化为电能
C.放电过程中,Li+向电池的正极移动
D.充电时,电池上标有“-”的电极与外接电源正极相连
14.如下图所示,A、B两个装置的烧杯分别盛有足量的CuSO4溶液。
(1)A、B两个装置中属于原电池的是 (填字母,下同),属于电解池的是 。
(2)A中Zn是 极,发生 (填“氧化”或“还原”)反应,电极反应式为 ;Cu电极的电极反应式为 ;A中总反应的离子方程式为 。
(3)B中左边C是 极,发生 (填“氧化”或“还原”)反应,电极反应式为 ;B中总反应的化学方程式为 。
能力提升练
题组一 原电池正、负极的判断及电极反应式的书写
1.下列说法不正确的是 ( )
A.由Zn、Cu、稀H2SO4组成原电池,其负极反应式为Zn-2e- Zn2+
B.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为Fe-2e- Fe2+
C.由Mg、Al、NaOH溶液组成原电池,其负极反应式为Al-3e- Al3+
D.由Al、Cu、浓硝酸组成原电池,一般认为其负极反应式为Cu-2e- Cu2+
2.(2023江苏南京航空航天大学附属高级中学期中)“碳呼吸电池”是一种新型化学电源,其工作原理如图。
下列说法正确的是 ( )
A.该装置能将电能转变为化学能
B.正极的电极反应为C2+2e- 2CO2↑
C.每得到1 mol草酸铝,电路中转移3 mol电子
D.利用该技术可捕捉大气中的CO2
3.(2023江苏阜宁中学综合测试)利用反应6NO2+8NH3 7N2+ 12H2O设计的电池装置如图所示,该装置既能有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能。下列说法不正确的是 ( )
A.电极A上发生氧化反应,电极A为负极
B.电池工作时,OH-透过交换膜从右向左迁移
C.当有2.24 L NO2被处理时,溶液中通过电子0.4 mol
D.电极B的电极反应式为2NO2+8e-+4H2O N2+8OH-
4.(2022湖北新高考联考协作体期中)中国科学家发明了一种新型Zn-CO2电池,把CO2转化为HCOOH(甲酸)的同时还能对外提供电能,装置如下图所示(双极膜的阴、阳膜复合层间的H2O可解离成H+和 OH-,并可分别通过阳膜和阴膜)。下列说法错误的是( )
A.放电时,a极为负极,发生氧化反应
B.放电时,电流由b极经外电路流向a极
C.放电时,b极的电极反应式为CO2+2H+-2e- HCOOH
D.多孔钯纳米材料可增大CO2与电极的接触面积,加快反应速率
5.任何化学反应都伴随着能量的变化,通过化学反应,化学能可转化为热能、光能、电能等。
(1)用如图所示甲、乙装置进行实验:
甲 乙
甲装置中 (填“Zn”或“Cu”)棒上有氢气产生;乙装置中 (填“Zn”或“Cu”)棒上有氢气产生。若反应过程中有0.4 mol电子转移,生成的氢气在标准状况下的体积为 。
(2)用Mg、Al设计成如图所示原电池装置:
①若溶液为盐酸,Mg为 极。
②若溶液为氢氧化钠溶液,负极的电极反应式为 。
(3)已知2 mol氢气完全燃烧生成水蒸气时放出能量484 kJ,且氧气中1 mol OO键完全断裂时吸收能量496 kJ,水蒸气中1 mol H—O键形成时放出能量463 kJ,则氢气中1 mol H—H键断裂时吸收的能量为 kJ。
(4)氢氧燃料电池工作原理如图所示:
该电池工作时,外电路中电子的流向为
(填“a→b”或“b→a”),正极的电极反应式为 。
题组二 新型燃料电池
6.(2022河南创新发展联盟联考)科学家已开发出一种新型燃料电池——固体氧化物电池,工作原理如图所示。该电池用辛烷(C8H18)作燃料,电池中间部分的固体氧化物可传递O2-,下列说法正确的是 ( )
A.电池工作时,氧气发生氧化反应
B.正极的电极反应式为O2+2H2O+4e- 4OH-
C.电子由b电极经外电路流向a电极
D.电池的总反应为2C8H18+25O2 16CO2+18H2O
7.一种以联氨(N2H4)为燃料的环保电池工作原理如图所示,电解质溶液显酸性,电池工作时产生稳定无污染的物质。下列说法正确的是
( )
A.该燃料电池工作时,化学能只转化为电能
B.N极的电极反应式为O2+2H2O+4e- 4OH-
C.电池总反应式为N2H4+O2 N2+2H2O,电解质溶液中H+的浓度始终不变
D.在M极充入N2H4,每消耗1 mol N2H4,会有4 mol H+通过质子交换膜
8.(2023江苏扬州高邮阶段测试)热电厂尾气经处理得到较纯的SO2,可用于原电池法生产硫酸,其工作原理如图所示。电池工作时,下列说法不正确的是 ( )
A.电极b周围溶液pH变大
B.溶液中H+由a极区向b极区迁移
C.电极a的电极反应式为SO2-2e-+2H2O 4H++S
D.一段时间后,a极消耗的SO2与b极消耗的O2物质的量相等
答案与分层梯度式解析
第2课时 化学电源
基础过关练
1.B 2.A 3.C 4.C 5.C 6.B 7.D 8.A
9.D 11.C 12.C 13.C
1.B 镍氢电池、锂离子电池为可充电电池,为二次电池,锌锰干电池为一次电池,A错误;氢氧燃料电池的产物不污染环境,B正确;铅蓄电池放电时正极材料是PbO2,发生还原反应,负极材料是Pb,发生氧化反应,C错误;铅蓄电池充电时将电能转化为化学能,D错误。
2.A 燃料电池的反应物可不储存在电池的内部,①错误。
3.C 干电池属于一次电池,铅蓄电池属于二次电池,氢氧燃料电池属于燃料电池,A正确;在干电池中,Zn作负极,被氧化,因此长时间使用后,锌筒被破坏,B正确;铅蓄电池工作过程中,负极每消耗1 mol铅,外电路转移2 mol电子,硫酸溶液中不能转移电子,C错误;氢氧燃料电池的电解质溶液可以是酸性或者碱性溶液,故可以是稀硫酸或KOH溶液,D正确。
4.C 在反应中,Zn的化合价升高,发生氧化反应,故Zn作负极,A正确;正极为Ag2O得电子生成Ag,Ag元素化合价降低,发生还原反应,B正确;负极的电极反应式为Zn+2OH--2e- Zn(OH)2,C错误;电流由正极流向负极,Ag2O作正极,故电池工作时,电流从Ag2O经导线流向Zn,D正确。
5.C 该电池属于原电池,工作时将化学能转化成电能,A项正确;H+向b极移动,b极为电池的正极,a极为电池的负极,B项正确;b极为正极, b极的电极反应式为O2+4e-+4H+ 2H2O,C项错误;该电池工作时,电子由负极(a极)通过导线流向正极(b极),D项正确。
6.B 原电池中负极失去电子发生氧化反应,根据电池放电时的反应可知,Pb为负极,PbO2为正极,A错误,B正确;在放电过程中PbO2得到电子被还原,C错误;由于放电过程中消耗硫酸且生成水,电解质溶液中氢离子浓度逐渐减小,所以溶液酸性减弱,D错误。
7.D 该镁氧电池中,镁电极为负极,通入空气的一极为正极,电解液显碱性,所以负极反应式为Mg-2e-+2OH- Mg(OH)2,负极镁被氧化;正极反应式为O2+4e-+2H2O 4OH-,正极上O2被还原;电池总反应为2Mg+O2+2H2O 2Mg(OH)2。a极为电池负极,b极为电池正极,A正确;镁电极为负极,负极反应式为Mg-2e-+2OH- Mg(OH)2,B正确;电子的移动方向是沿外电路由负极到正极,即a到b,C正确;总反应中H2O被消耗,所以该电池在工作过程中,电解液中KOH的浓度增大,D错误。
8.A 题述镁燃料电池中镁均作负极,失去电子,产物由电解质溶液决定,若为酸性溶液生成Mg2+,若为碱性溶液生成Mg(OH)2;ClO-在正极反应,由题图可知有Cl-和OH-生成,OH-向负极移动。
9.D Na为负极,发生氧化反应,A项错误;碳纳米管为正极,CO2得电子发生还原反应,B项错误;电子由负极金属钠经外电路流向正极碳纳米管,C项错误;该电池为原电池,将化学能转化为电能,D项正确。
10.答案 (1)⑤⑥⑦⑨ ②③⑧ ④
(2)K2CO32K++C
(3)H++CHC K2CO3+CO2+H2O2KHCO3
(4)12
解析 (4)13.5 g Al的物质的量为=0.5 mol,则失去电子的物质的量为1.5 mol,根据得失电子守恒,正极上消耗氧气的物质的量为=0.375 mol,消耗O2的质量为0.375 mol×32 g/mol=12 g。
11.C 电流从直流电源的正极流出,因此a为电源正极,b为电源负极,c为阳极,d为阴极;电解CuCl2溶液,阳极(c电极)的电极反应式为2Cl--2e-Cl2↑,阴极(d电极)的电极反应式为Cu2++2e-Cu,故C项正确。
12.C CO2在Pt电极发生还原反应生成C2,则Pt电极为阴极,M电极为阳极,故M与电源的正极相连,M电极需产生Fe2+,所以M应该选用铁作电极,A错误;若C2在电解液中的迁移速率大于Fe2+的迁移速率,则应选用阴离子交换膜,B错误;阴极上CO2被还原生成C2,阳极上Fe被氧化生成Fe2+,故电池总反应为2CO2+FeFeC2O4,C正确;根据电池总反应可知,每转移2 mol电子消耗2 mol CO2,若转移电子的物质的量为0.5 mol,则消耗CO2的物质的量也为0.5 mol,标准状况下体积为11.2 L,D错误。
13.C 对电池充电是在外接电源的条件下,而放电是在没有外接电源的情况下自发进行的,充、放电也不是同时发生的,所以二者不互为可逆反应,A错误;充电时,电能转化为化学能,B错误;放电过程中,电池内部的阳离子向正极移动,阴离子向负极移动,所以Li+向电池的正极移动,C正确;充电时,电池上标有“-”的电极与外接电源负极相连,D错误。
14.答案 (1)A B
(2)负 氧化 Zn-2e-Zn2+ Cu2++2e-Cu Zn+Cu2+Zn2++Cu
(3)阴 还原 Cu2++2e-Cu 2CuSO4+2H2O2Cu+2H2SO4+O2↑
解析 (1)原电池和电解池的明显区别是电解池有外接直流电源,B属于电解池,A属于原电池。
(2)锌比铜活泼,Zn是负极,发生氧化反应,电极反应式为Zn-2e- Zn2+;Cu为正极,电极反应式为Cu2++2e-Cu;A中总反应的离子方程式为Zn+Cu2+Zn2++Cu。
(3)B是电解池,左边C和电源负极相连,是阴极,发生还原反应,电极反应式为Cu2++2e-Cu;B中总反应的化学方程式为2CuSO4+2H2O2Cu+2H2SO4+O2↑。
能力提升练
1.C 2.D 3.C 4.C 6.D 7.D 8.D
1.C 该原电池中,Zn作负极,Cu作正极,负极Zn失电子生成Zn2+,负极反应式为Zn-2e-Zn2+,A正确;该原电池中,Fe作负极,Cu作正极,负极反应式为Fe-2e-Fe2+,B正确;该原电池中,Al作负极,Mg作正极,负极反应式为Al-3e-+4OH-Al+2H2O,C错误;常温下,Al遇浓硝酸发生钝化,所以Cu作负极,Al作正极,负极反应式为Cu-2e-Cu2+,D正确。
2.D 该装置为原电池,能将化学能转变为电能,A错误;Al为活泼金属,作负极,通入CO2的电极作正极,得到电子,C化合价降低,电极反应为 2CO2+2e- C2,B错误;1 mol草酸铝含2 mol Al3+,由2 mol Al单质失去6 mol电子生成,C错误;该装置中CO2最后生成C2,可以捕捉大气中的CO2,减少温室效应,D正确。
3.C 电极A通入NH3,NH3中N元素失电子化合价升高生成氮气,电极A上发生氧化反应,电极A为负极,A正确;电池工作时,A是负极,阴离子向负极移动,OH-透过交换膜从右向左迁移,B正确;没有明确是否为标准状况,不能计算2.24 L NO2被处理时转移电子的物质的量,且电子不能进入溶液中,C错误;电极B是正极,电极B上NO2得电子生成氮气,电极反应式为2NO2+8e-+4H2O N2+8OH-,D正确。
4.C 放电时,a极为负极,Zn失电子,发生氧化反应,A正确;放电时,b极为正极,电流由b极经外电路流向a极,B正确;放电时,b极为正极,CO2在正极得电子发生还原反应,电极反应式为CO2+2H++2e- HCOOH,C错误;多孔钯纳米材料可以增大CO2与电极的接触面积,加快反应速率,D正确。
5.答案 (1)Zn Cu 4.48 L
(2)①负 ②Al-3e-+4OH-Al+2H2O
(3)436
(4)a→b O2+4H++4e-2H2O
解析 (1)甲装置未形成原电池,Zn与稀H2SO4反应生成H2;乙装置形成原电池,Zn作负极,Cu作正极,正极反应式为2H++2e- H2↑。两个装置中反应的关系式为2H+~H2~2e-,则n(H2)=n(e-)=0.4 mol× = 0.2 mol,V(H2)=0.2 mol×22.4 L/mol=4.48 L。
(2)①若溶液为盐酸,镁比铝活泼,镁为负极,铝为正极。②若溶液为氢氧化钠溶液,镁与氢氧化钠溶液不反应,铝能够与氢氧化钠溶液反应,铝为负极,负极反应式为Al-3e-+4OH-Al+2H2O。
(3)氢气完全燃烧生成水蒸气是放热反应,反应放出的热量=新键形成释放的能量-旧键断裂吸收的能量,设氢气中1 mol H—H键断裂时吸收的能量为Q,根据化学方程式2H2(g)+O2(g) 2H2O(g),可知 484 kJ=4×463 kJ-(2Q+496 kJ),解得Q=436 kJ。
(4)该燃料电池中,a电极为负极,b电极为正极,原电池工作时,电子由负极经外电路流向正极;氧气在正极上得电子,发生还原反应,正极反应式为O2+4H++4e-2H2O。
6.D 通入氧气的b电极为正极,O2发生还原反应,A错误;电解质为固体氧化物,可以传递O2-,故正极反应式为O2+4e- 2O2-,B错误;通入辛烷(C8H18)的a电极为负极,电子由a电极经外电路流向b电极,C错误。
7.D 该燃料电池工作时,化学能不只转化为电能,还有热能等,A错误;根据氢离子的移动方向可知,N极为正极,电极反应式为O2+4H++4e- 2H2O,B错误;电池总反应式为N2H4+O2 N2+2H2O,有水生成,溶液体积增大,则电解质溶液中H+的浓度减小,C错误;M极电极反应式为N2H4-4e- N2↑+4H+,则每消耗1 mol N2H4,转移4 mol电子,会有4 mol H+通过质子交换膜,D正确。
8.D 该装置为原电池,由图可知,硫元素价态升高,失电子,故a极为负极,b极为正极。电极b上氧气得电子,发生还原反应,电极反应式为 O2+4H++4e- 2H2O,pH变大,A正确;电极b为正极,溶液中H+由 a极区向b极区迁移,B正确;电极a为负极,SO2失去电子,被氧化为 S,电极反应式为2H2O+SO2-2e- S+4H+,C正确;电池总反应为2H2O+2SO2+O2 2H2SO4,故一段时间后,a极消耗的SO2与b极消耗的O2物质的量之比为2∶1,D错误。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024苏教版高中化学必修第二册同步
第2课时 化学电源
基础过关练
题组一 化学电源的分类
1.(经典题)下列说法中正确的是 ( )
A.镍氢电池、锂离子电池和锌锰干电池都是二次电池
B.氢氧燃料电池是一种高效且不会污染环境的燃料电池
C.铅蓄电池放电的时候正极材料是铅,负极材料是二氧化铅
D.铅蓄电池充电时将化学能转化为电能
2.(经典题)下列说法中正确的是 ( )
①燃料电池的反应物必须储存在电池的内部
②锌锰干电池是一次电池,铅蓄电池是二次电池
③锂离子电池是新一代可充电电池
④燃料电池作为汽车驱动能源已研发成功
A.②③④ B.①②③④
C.①②③ D.①③④
题组二 化学电源
3.(2023辽宁沈阳郊校联考)下面是几种常见的化学电源示意图,有关说法不正确的是( )
A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.铅蓄电池在工作中,负极每消耗1 mol铅,则硫酸溶液中就转移 2 mol电子
D.氢氧燃料电池的电解质溶液可以是稀硫酸或KOH溶液
4.(2023河北邯郸大名第一中学月考)如图为银锌纽扣电池,该电池的总反应为Zn+Ag2O+H2O Zn(OH)2+2Ag,下列说法不正确的是 ( )
A.锌作负极
B.正极发生还原反应
C.负极的电极反应式:Zn-2e- Zn2+
D.电池工作时,电流从Ag2O经导线流向Zn
5.(经典题)(2022江苏常州期中)某种氢氧燃料电池的工作原理如图所示,下列有关说法不正确的是 ( )
A.该电池工作时将化学能转化为电能
B.a极为负极
C.b极的电极反应式为O2-4e-+4H+ 2H2O
D.该电池工作时,电子由a极通过导线流向b极
6.(2022福建福州第四中学月考)汽车的启动电源常用铅蓄电池。其结构如图所示,放电时的电池反应为PbO2+Pb+2H2SO4 2PbSO4+2H2O。根据此反应判断下列说法正确的是 ( )
A.放电时,PbO2是电池的负极
B.放电时,Pb是负极
C.放电时,PbO2得电子,被氧化
D.放电时,溶液酸性增强
7.(2023辽宁六校协作体月考)一种镁氧电池电极材料为金属镁和吸附氧气的活性炭,电解液为KOH浓溶液,如图所示。下列说法错误的是 ( )
A.a极为电池负极,b极为电池正极
B.负极反应式为Mg-2e-+2OH- Mg(OH)2
C.电子的移动方向是由a经外电路到b
D.电池工作过程中,电解液中KOH的浓度减小
8.镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低等特点。研究的镁燃料电池可分为镁—空气燃料电池、镁—海水燃料电池、镁—过氧化氢燃料电池、镁—次氯酸盐燃料电池。镁—次氯酸盐燃料电池的工作原理如图所示,下列说法不正确的是( )
A.放电过程中OH-移向正极
B.电池的总反应为Mg+ClO-+H2O Mg(OH)2+Cl-
C.上述镁燃料电池中镁均为负极,发生氧化反应
D.镁—过氧化氢燃料电池,酸性电解质溶液中正极反应式为H2O2+2H++2e- 2H2O
9.(2023江苏连云港阶段检测)火星大气中含有大量CO2,一种有CO2参加反应的新型全固态电池有望为火星探测器供电。电池以金属钠为负极,碳纳米管为正极。放电时,下列说法正确的是 ( )
A.负极上发生还原反应
B.CO2在正极上失电子
C.工作时电子由碳纳米管经外电路流向金属钠
D.将化学能转化为电能
10.化学电池用途广泛,燃料电池具有能量转化率高、对环境友好等优点。燃料电池在工作时,从负极分别连续通入①H2、②CH4、 ③C2H5OH等,从正极连续通入④O2,在电池内部还有⑤KOH、 ⑥H2SO4等物质的溶液,反应生成⑦H2O、⑧CO2、⑨K2CO3等,同时产生电能。目前已研制成功铝—空气燃料电池,它可以代替汽油为汽车提供动力,也可用作照明电源。
(1)在上述短文标有序号的物质中,属于电解质的是 (填序号,下同);属于非电解质的是 ;和O3互为同素异形体的是 。
(2)写出上文有序号物质中盐的电离方程式: 。
(3)写出少量⑥的稀溶液滴加到⑨的溶液中的离子方程式: 。
写出向⑨的溶液中通入⑧的化学方程式: 。
(4)铝—空气燃料电池反应原理是金属Al在氯化钠溶液中与空气中的O2发生反应生成Al(OH)3,若负极有13.5 g Al参加反应,则正极消耗O2的质量为 g。
题组三 电解原理及其应用
11.(经典题)如图所示是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关判断正确的是( )
A.a为负极,b为正极
B.a为阳极,b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,溶液中氯离子浓度不变
12.通过电解法由CO2制备FeC2O4的原理如图所示,已知FeC2O4难溶于水,电解质不参与反应。下列说法正确的是 ( )
A.电极M所用材料为单质铁,b为负极,M电极发生氧化反应
B.若C2在电解液中的迁移速率大于Fe2+的迁移速率,则应选用阳离子交换膜
C.该装置工作过程的总反应为2CO2+FeFeC2O4
D.若电路中转移0.5 mol电子,则消耗CO2的体积为22.4 L(标准状况下)
13.电动汽车可以锂离子电池提供动力,锂离子电池技术已经成为汽车研究的前沿科技。某锂离子电池的总反应为xLi+Li3-xNiCoMnO6
Li3NiCoMnO6,下列说法正确的是 ( )
A.该电池的充、放电过程互为可逆反应
B.充电时主要为化学能转化为电能
C.放电过程中,Li+向电池的正极移动
D.充电时,电池上标有“-”的电极与外接电源正极相连
14.如下图所示,A、B两个装置的烧杯分别盛有足量的CuSO4溶液。
(1)A、B两个装置中属于原电池的是 (填字母,下同),属于电解池的是 。
(2)A中Zn是 极,发生 (填“氧化”或“还原”)反应,电极反应式为 ;Cu电极的电极反应式为 ;A中总反应的离子方程式为 。
(3)B中左边C是 极,发生 (填“氧化”或“还原”)反应,电极反应式为 ;B中总反应的化学方程式为 。
能力提升练
题组一 原电池正、负极的判断及电极反应式的书写
1.下列说法不正确的是 ( )
A.由Zn、Cu、稀H2SO4组成原电池,其负极反应式为Zn-2e- Zn2+
B.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为Fe-2e- Fe2+
C.由Mg、Al、NaOH溶液组成原电池,其负极反应式为Al-3e- Al3+
D.由Al、Cu、浓硝酸组成原电池,一般认为其负极反应式为Cu-2e- Cu2+
2.(2023江苏南京航空航天大学附属高级中学期中)“碳呼吸电池”是一种新型化学电源,其工作原理如图。
下列说法正确的是 ( )
A.该装置能将电能转变为化学能
B.正极的电极反应为C2+2e- 2CO2↑
C.每得到1 mol草酸铝,电路中转移3 mol电子
D.利用该技术可捕捉大气中的CO2
3.(2023江苏阜宁中学综合测试)利用反应6NO2+8NH3 7N2+ 12H2O设计的电池装置如图所示,该装置既能有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能。下列说法不正确的是 ( )
A.电极A上发生氧化反应,电极A为负极
B.电池工作时,OH-透过交换膜从右向左迁移
C.当有2.24 L NO2被处理时,溶液中通过电子0.4 mol
D.电极B的电极反应式为2NO2+8e-+4H2O N2+8OH-
4.(2022湖北新高考联考协作体期中)中国科学家发明了一种新型Zn-CO2电池,把CO2转化为HCOOH(甲酸)的同时还能对外提供电能,装置如下图所示(双极膜的阴、阳膜复合层间的H2O可解离成H+和 OH-,并可分别通过阳膜和阴膜)。下列说法错误的是( )
A.放电时,a极为负极,发生氧化反应
B.放电时,电流由b极经外电路流向a极
C.放电时,b极的电极反应式为CO2+2H+-2e- HCOOH
D.多孔钯纳米材料可增大CO2与电极的接触面积,加快反应速率
5.任何化学反应都伴随着能量的变化,通过化学反应,化学能可转化为热能、光能、电能等。
(1)用如图所示甲、乙装置进行实验:
甲 乙
甲装置中 (填“Zn”或“Cu”)棒上有氢气产生;乙装置中 (填“Zn”或“Cu”)棒上有氢气产生。若反应过程中有0.4 mol电子转移,生成的氢气在标准状况下的体积为 。
(2)用Mg、Al设计成如图所示原电池装置:
①若溶液为盐酸,Mg为 极。
②若溶液为氢氧化钠溶液,负极的电极反应式为 。
(3)已知2 mol氢气完全燃烧生成水蒸气时放出能量484 kJ,且氧气中1 mol OO键完全断裂时吸收能量496 kJ,水蒸气中1 mol H—O键形成时放出能量463 kJ,则氢气中1 mol H—H键断裂时吸收的能量为 kJ。
(4)氢氧燃料电池工作原理如图所示:
该电池工作时,外电路中电子的流向为
(填“a→b”或“b→a”),正极的电极反应式为 。
题组二 新型燃料电池
6.(2022河南创新发展联盟联考)科学家已开发出一种新型燃料电池——固体氧化物电池,工作原理如图所示。该电池用辛烷(C8H18)作燃料,电池中间部分的固体氧化物可传递O2-,下列说法正确的是 ( )
A.电池工作时,氧气发生氧化反应
B.正极的电极反应式为O2+2H2O+4e- 4OH-
C.电子由b电极经外电路流向a电极
D.电池的总反应为2C8H18+25O2 16CO2+18H2O
7.一种以联氨(N2H4)为燃料的环保电池工作原理如图所示,电解质溶液显酸性,电池工作时产生稳定无污染的物质。下列说法正确的是
( )
A.该燃料电池工作时,化学能只转化为电能
B.N极的电极反应式为O2+2H2O+4e- 4OH-
C.电池总反应式为N2H4+O2 N2+2H2O,电解质溶液中H+的浓度始终不变
D.在M极充入N2H4,每消耗1 mol N2H4,会有4 mol H+通过质子交换膜
8.(2023江苏扬州高邮阶段测试)热电厂尾气经处理得到较纯的SO2,可用于原电池法生产硫酸,其工作原理如图所示。电池工作时,下列说法不正确的是 ( )
A.电极b周围溶液pH变大
B.溶液中H+由a极区向b极区迁移
C.电极a的电极反应式为SO2-2e-+2H2O 4H++S
D.一段时间后,a极消耗的SO2与b极消耗的O2物质的量相等
答案与分层梯度式解析
第2课时 化学电源
基础过关练
1.B 2.A 3.C 4.C 5.C 6.B 7.D 8.A
9.D 11.C 12.C 13.C
1.B 镍氢电池、锂离子电池为可充电电池,为二次电池,锌锰干电池为一次电池,A错误;氢氧燃料电池的产物不污染环境,B正确;铅蓄电池放电时正极材料是PbO2,发生还原反应,负极材料是Pb,发生氧化反应,C错误;铅蓄电池充电时将电能转化为化学能,D错误。
2.A 燃料电池的反应物可不储存在电池的内部,①错误。
3.C 干电池属于一次电池,铅蓄电池属于二次电池,氢氧燃料电池属于燃料电池,A正确;在干电池中,Zn作负极,被氧化,因此长时间使用后,锌筒被破坏,B正确;铅蓄电池工作过程中,负极每消耗1 mol铅,外电路转移2 mol电子,硫酸溶液中不能转移电子,C错误;氢氧燃料电池的电解质溶液可以是酸性或者碱性溶液,故可以是稀硫酸或KOH溶液,D正确。
4.C 在反应中,Zn的化合价升高,发生氧化反应,故Zn作负极,A正确;正极为Ag2O得电子生成Ag,Ag元素化合价降低,发生还原反应,B正确;负极的电极反应式为Zn+2OH--2e- Zn(OH)2,C错误;电流由正极流向负极,Ag2O作正极,故电池工作时,电流从Ag2O经导线流向Zn,D正确。
5.C 该电池属于原电池,工作时将化学能转化成电能,A项正确;H+向b极移动,b极为电池的正极,a极为电池的负极,B项正确;b极为正极, b极的电极反应式为O2+4e-+4H+ 2H2O,C项错误;该电池工作时,电子由负极(a极)通过导线流向正极(b极),D项正确。
6.B 原电池中负极失去电子发生氧化反应,根据电池放电时的反应可知,Pb为负极,PbO2为正极,A错误,B正确;在放电过程中PbO2得到电子被还原,C错误;由于放电过程中消耗硫酸且生成水,电解质溶液中氢离子浓度逐渐减小,所以溶液酸性减弱,D错误。
7.D 该镁氧电池中,镁电极为负极,通入空气的一极为正极,电解液显碱性,所以负极反应式为Mg-2e-+2OH- Mg(OH)2,负极镁被氧化;正极反应式为O2+4e-+2H2O 4OH-,正极上O2被还原;电池总反应为2Mg+O2+2H2O 2Mg(OH)2。a极为电池负极,b极为电池正极,A正确;镁电极为负极,负极反应式为Mg-2e-+2OH- Mg(OH)2,B正确;电子的移动方向是沿外电路由负极到正极,即a到b,C正确;总反应中H2O被消耗,所以该电池在工作过程中,电解液中KOH的浓度增大,D错误。
8.A 题述镁燃料电池中镁均作负极,失去电子,产物由电解质溶液决定,若为酸性溶液生成Mg2+,若为碱性溶液生成Mg(OH)2;ClO-在正极反应,由题图可知有Cl-和OH-生成,OH-向负极移动。
9.D Na为负极,发生氧化反应,A项错误;碳纳米管为正极,CO2得电子发生还原反应,B项错误;电子由负极金属钠经外电路流向正极碳纳米管,C项错误;该电池为原电池,将化学能转化为电能,D项正确。
10.答案 (1)⑤⑥⑦⑨ ②③⑧ ④
(2)K2CO32K++C
(3)H++CHC K2CO3+CO2+H2O2KHCO3
(4)12
解析 (4)13.5 g Al的物质的量为=0.5 mol,则失去电子的物质的量为1.5 mol,根据得失电子守恒,正极上消耗氧气的物质的量为=0.375 mol,消耗O2的质量为0.375 mol×32 g/mol=12 g。
11.C 电流从直流电源的正极流出,因此a为电源正极,b为电源负极,c为阳极,d为阴极;电解CuCl2溶液,阳极(c电极)的电极反应式为2Cl--2e-Cl2↑,阴极(d电极)的电极反应式为Cu2++2e-Cu,故C项正确。
12.C CO2在Pt电极发生还原反应生成C2,则Pt电极为阴极,M电极为阳极,故M与电源的正极相连,M电极需产生Fe2+,所以M应该选用铁作电极,A错误;若C2在电解液中的迁移速率大于Fe2+的迁移速率,则应选用阴离子交换膜,B错误;阴极上CO2被还原生成C2,阳极上Fe被氧化生成Fe2+,故电池总反应为2CO2+FeFeC2O4,C正确;根据电池总反应可知,每转移2 mol电子消耗2 mol CO2,若转移电子的物质的量为0.5 mol,则消耗CO2的物质的量也为0.5 mol,标准状况下体积为11.2 L,D错误。
13.C 对电池充电是在外接电源的条件下,而放电是在没有外接电源的情况下自发进行的,充、放电也不是同时发生的,所以二者不互为可逆反应,A错误;充电时,电能转化为化学能,B错误;放电过程中,电池内部的阳离子向正极移动,阴离子向负极移动,所以Li+向电池的正极移动,C正确;充电时,电池上标有“-”的电极与外接电源负极相连,D错误。
14.答案 (1)A B
(2)负 氧化 Zn-2e-Zn2+ Cu2++2e-Cu Zn+Cu2+Zn2++Cu
(3)阴 还原 Cu2++2e-Cu 2CuSO4+2H2O2Cu+2H2SO4+O2↑
解析 (1)原电池和电解池的明显区别是电解池有外接直流电源,B属于电解池,A属于原电池。
(2)锌比铜活泼,Zn是负极,发生氧化反应,电极反应式为Zn-2e- Zn2+;Cu为正极,电极反应式为Cu2++2e-Cu;A中总反应的离子方程式为Zn+Cu2+Zn2++Cu。
(3)B是电解池,左边C和电源负极相连,是阴极,发生还原反应,电极反应式为Cu2++2e-Cu;B中总反应的化学方程式为2CuSO4+2H2O2Cu+2H2SO4+O2↑。
能力提升练
1.C 2.D 3.C 4.C 6.D 7.D 8.D
1.C 该原电池中,Zn作负极,Cu作正极,负极Zn失电子生成Zn2+,负极反应式为Zn-2e-Zn2+,A正确;该原电池中,Fe作负极,Cu作正极,负极反应式为Fe-2e-Fe2+,B正确;该原电池中,Al作负极,Mg作正极,负极反应式为Al-3e-+4OH-Al+2H2O,C错误;常温下,Al遇浓硝酸发生钝化,所以Cu作负极,Al作正极,负极反应式为Cu-2e-Cu2+,D正确。
2.D 该装置为原电池,能将化学能转变为电能,A错误;Al为活泼金属,作负极,通入CO2的电极作正极,得到电子,C化合价降低,电极反应为 2CO2+2e- C2,B错误;1 mol草酸铝含2 mol Al3+,由2 mol Al单质失去6 mol电子生成,C错误;该装置中CO2最后生成C2,可以捕捉大气中的CO2,减少温室效应,D正确。
3.C 电极A通入NH3,NH3中N元素失电子化合价升高生成氮气,电极A上发生氧化反应,电极A为负极,A正确;电池工作时,A是负极,阴离子向负极移动,OH-透过交换膜从右向左迁移,B正确;没有明确是否为标准状况,不能计算2.24 L NO2被处理时转移电子的物质的量,且电子不能进入溶液中,C错误;电极B是正极,电极B上NO2得电子生成氮气,电极反应式为2NO2+8e-+4H2O N2+8OH-,D正确。
4.C 放电时,a极为负极,Zn失电子,发生氧化反应,A正确;放电时,b极为正极,电流由b极经外电路流向a极,B正确;放电时,b极为正极,CO2在正极得电子发生还原反应,电极反应式为CO2+2H++2e- HCOOH,C错误;多孔钯纳米材料可以增大CO2与电极的接触面积,加快反应速率,D正确。
5.答案 (1)Zn Cu 4.48 L
(2)①负 ②Al-3e-+4OH-Al+2H2O
(3)436
(4)a→b O2+4H++4e-2H2O
解析 (1)甲装置未形成原电池,Zn与稀H2SO4反应生成H2;乙装置形成原电池,Zn作负极,Cu作正极,正极反应式为2H++2e- H2↑。两个装置中反应的关系式为2H+~H2~2e-,则n(H2)=n(e-)=0.4 mol× = 0.2 mol,V(H2)=0.2 mol×22.4 L/mol=4.48 L。
(2)①若溶液为盐酸,镁比铝活泼,镁为负极,铝为正极。②若溶液为氢氧化钠溶液,镁与氢氧化钠溶液不反应,铝能够与氢氧化钠溶液反应,铝为负极,负极反应式为Al-3e-+4OH-Al+2H2O。
(3)氢气完全燃烧生成水蒸气是放热反应,反应放出的热量=新键形成释放的能量-旧键断裂吸收的能量,设氢气中1 mol H—H键断裂时吸收的能量为Q,根据化学方程式2H2(g)+O2(g) 2H2O(g),可知 484 kJ=4×463 kJ-(2Q+496 kJ),解得Q=436 kJ。
(4)该燃料电池中,a电极为负极,b电极为正极,原电池工作时,电子由负极经外电路流向正极;氧气在正极上得电子,发生还原反应,正极反应式为O2+4H++4e-2H2O。
6.D 通入氧气的b电极为正极,O2发生还原反应,A错误;电解质为固体氧化物,可以传递O2-,故正极反应式为O2+4e- 2O2-,B错误;通入辛烷(C8H18)的a电极为负极,电子由a电极经外电路流向b电极,C错误。
7.D 该燃料电池工作时,化学能不只转化为电能,还有热能等,A错误;根据氢离子的移动方向可知,N极为正极,电极反应式为O2+4H++4e- 2H2O,B错误;电池总反应式为N2H4+O2 N2+2H2O,有水生成,溶液体积增大,则电解质溶液中H+的浓度减小,C错误;M极电极反应式为N2H4-4e- N2↑+4H+,则每消耗1 mol N2H4,转移4 mol电子,会有4 mol H+通过质子交换膜,D正确。
8.D 该装置为原电池,由图可知,硫元素价态升高,失电子,故a极为负极,b极为正极。电极b上氧气得电子,发生还原反应,电极反应式为 O2+4H++4e- 2H2O,pH变大,A正确;电极b为正极,溶液中H+由 a极区向b极区迁移,B正确;电极a为负极,SO2失去电子,被氧化为 S,电极反应式为2H2O+SO2-2e- S+4H+,C正确;电池总反应为2H2O+2SO2+O2 2H2SO4,故一段时间后,a极消耗的SO2与b极消耗的O2物质的量之比为2∶1,D错误。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
