2024苏教版高中化学选择性必修2同步练习题--专题强化练4 晶体类型的判断及晶体结构的分析(含解析)
文档属性
| 名称 | 2024苏教版高中化学选择性必修2同步练习题--专题强化练4 晶体类型的判断及晶体结构的分析(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-23 17:25:41 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2024苏教版高中化学选择性必修2同步
专题强化练4 晶体类型的判断及晶体结构的分析
1.(2023河北石家庄第二中学月考)立方氮化硼可作研磨剂,其晶胞结构如图所示。下列说法错误的是( )
A.立方氮化硼的硬度大,属于共价晶体
B.硼原子的配位数是4
C.该物质的化学式是B3N2
D.N和B之间存在配位键
2.元素X的+1价离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶胞结构如图所示。下列说法错误的是( )
A.X元素的原子序数是19
B.X的晶体具有良好的导电性、导热性和延展性
C.X+是图中的灰球
D.该晶体中阳离子与阴离子个数比为3∶1
3.氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如图所示:
下列关于这些晶体结构和性质的叙述不正确的是( )
A.同一主族的不同元素与另一同种元素所形成的化学式相似的物质不一定具有相同的晶体结构
B.在氯化钠晶体中Cl-的配位数为6,在氯化铯晶体中Cl-的配位数为8
C.二氧化碳晶体中一个分子周围有12个紧邻的分子
D.在二氧化硅晶体中,平均每个Si原子形成2个Si—O共价单键
4.(2022河南洛阳孟津一中开学测试)钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,下列有关说法正确的是( )
A.该晶体属于离子晶体,晶体的化学式为BaO
B.该晶体中化学键类型只有离子键
C.该晶体晶胞结构与ZnS相似
D.填入Ba2+堆积产生的八面体空隙
5.(2023河北高考前适应性考试)(CH3NH3)PbI3的晶胞结构如图所示,其中B代表Pb2+,下列说法正确的是( )
A.Pb2+的外围电子排布式为6s26p2
B.A代表I-
C.若原子分数坐标A为(0,0,0),B为(,,),则C的原子分数坐标为(1,,)
D.已知(CH3NH3)PbI3的摩尔质量为M g·mol-1,NA为阿伏加德罗常数的值,则该晶体的密度为 g·cm-3
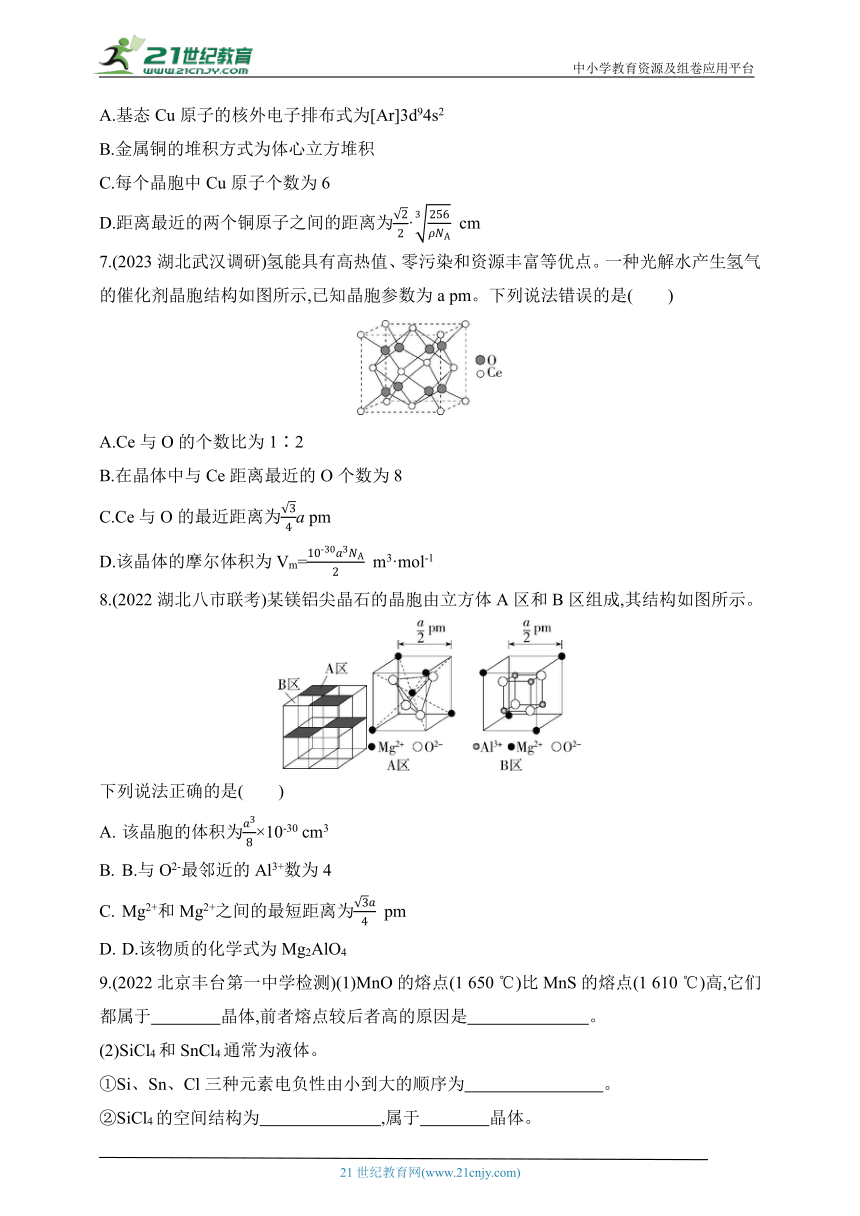
6.(2023河北沧州部分学校开学考试)金属铜的晶胞结构如图所示,已知金属铜的密度为ρ g·cm-3,NA表示阿伏加德罗常数的值。下列说法中正确的是( )
A.基态Cu原子的核外电子排布式为[Ar]3d94s2
B.金属铜的堆积方式为体心立方堆积
C.每个晶胞中Cu原子个数为6
D.距离最近的两个铜原子之间的距离为· cm
7.(2023湖北武汉调研)氢能具有高热值、零污染和资源丰富等优点。一种光解水产生氢气的催化剂晶胞结构如图所示,已知晶胞参数为a pm。下列说法错误的是( )
A.Ce与O的个数比为1∶2
B.在晶体中与Ce距离最近的O个数为8
C.Ce与O的最近距离为a pm
D.该晶体的摩尔体积为Vm= m3·mol-1
8.(2022湖北八市联考)某镁铝尖晶石的晶胞由立方体A区和B区组成,其结构如图所示。
下列说法正确的是( )
该晶胞的体积为×10-30 cm3
B.与O2-最邻近的Al3+数为4
Mg2+和Mg2+之间的最短距离为 pm
D.该物质的化学式为Mg2AlO4
9.(2022北京丰台第一中学检测)(1)MnO的熔点(1 650 ℃)比MnS的熔点(1 610 ℃)高,它们都属于 晶体,前者熔点较后者高的原因是 。
(2)SiCl4和SnCl4通常为液体。
①Si、Sn、Cl三种元素电负性由小到大的顺序为 。
②SiCl4的空间结构为 ,属于 晶体。
③SiCl4的熔点低于SnCl4的原因为
。
(3)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253 K,沸点为376 K,其固体属于 晶体。
(4)O和Na的氢化物所属的晶体类型分别为 和 。
(5)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2 NF3+3NH4F。该化学反应涉及的五种物质所属的晶体类型有 (填字母)。
a.离子晶体 b.分子晶体
c.共价晶体 d.金属晶体
专题强化练4 晶体类型的判断及晶体结构的分析
对应主书P45
1.C 2.A 3.D 4.D 5.C 6.D 7.D 8.C
1.C 立方氮化硼可作研磨剂,硬度很大,属于共价晶体,A正确;硼原子位于晶胞的顶点和面心,离硼原子最近且等距离的氮原子共4个,则硼原子的配位数为4,B正确;立方氮化硼晶胞中N原子个数是4,B原子个数=8×+6×=4,其化学式应为BN,C错误;B原子最外层有3个电子,在立方氮化硼中每个B原子形成了4个B—N键,所以立方氮化硼中B和N之间存在配位键,D正确。
2.A X+中所有电子正好充满K、L、M三个电子层,X+的K、L、M层依次排有2、8、18个电子,X+核外有28个电子,X原子核外有29个电子,X的原子序数为29,A项错误;X为Cu,Cu属于金属晶体,金属晶体具有良好的导电性、导热性和延展性,B项正确;晶胞中白球有8×=1个,灰球有12×=3个,化合物中元素正、负化合价代数和为0,即X+与N3-的个数比为3∶1,X+是图中的灰球,C、D项正确。
3.D CO2为分子晶体,SiO2为共价晶体,故同一主族的不同元素与另一同种元素所形成的化学式相似的物质不一定具有相同的晶体结构,A项正确;在氯化钠晶体中与Cl-紧邻的Na+个数为6,即Cl-的配位数为6,在氯化铯晶体中与Cl-紧邻的Cs+个数为8,即氯离子的配位数为8, B项正确;二氧化碳晶体中一个CO2分子周围有12个紧邻的CO2分子,C项正确;在二氧化硅晶体中,平均每个Si原子形成4个Si—O共价单键,D项错误。
4.D 晶胞中Ba2+位于顶点和面心位置,一个晶胞中含有Ba2+的个数为8×+6×==4,位于晶胞的棱心和体心位置,含有的个数为12×+1=4,该氧化物为BaO2,A错误;中O和O之间为共价键,B错误;其晶胞结构与ZnS不相似,C错误;位于体心和棱心,均处在Ba2+堆积产生的八面体空隙内,D正确。
5.C Pb2+的外围电子排布式为6s2,A错误;由晶胞结构结合该物质化学式得出C代表I-,B错误;根据晶胞中原子的相对位置可知,若原子分数坐标A为(0,0,0),B为(,,),则C的原子分数坐标为(1,,),C正确;1 pm=10-10 cm,故该晶体的密度为 g·cm-3,D错误。
6.D Cu为29号元素,基态Cu原子的核外电子排布式为[Ar]3d104s1,A错误;金属铜的堆积方式为面心立方堆积,B错误;每个晶胞中Cu原子个数为8×+6×=4,C错误;晶胞质量= g,设最近的两个Cu原子之间距离为r cm,则晶胞棱长为r cm,故 g=ρ g·cm-3×(r cm)3,解得r=·,D正确。
7.D 据“均摊法”得,晶胞中Ce的个数为8×+6×=4,O的个数为8,则晶胞中Ce与O的个数比为1∶2,A正确;以底面面心的Ce为例,上、下各有4个氧原子与其距离最近且等距离,故晶体中与Ce距离最近的O个数为8,B正确;Ce与O的最近距离为体对角线长的四分之一,为a pm,C正确;1个晶胞体积为a3×10-36 m3,含有4个Ce和8个O,则该晶体的摩尔体积为×a3×10-36×NA m3·mol-1= m3·mol-1,D错误。
8.C 由图可知A区、B区棱长均为 pm,则晶胞的棱长为a pm=a×10-10 cm,晶胞的体积为a3×10-30 cm3,A错误。与O2-最邻近的Al3+在B区,由图可知,O2-、Al3+构成的立方体中,与O2-最邻近的Al3+有3个,在A区中无铝离子,B错误。Mg2+和Mg2+之间的最短距离为A区体对角线长的一半,故为 pm,C正确。晶胞中紧邻的AB区为晶胞的四分之一部分,镁离子2个位于棱上、4个位于顶点、1个位于体内,所含镁离子数目为2×+4×+1=2;铝离子全部位于内部,数目为4;氧离子全部位于内部,数目为8;则该物质的化学式为MgAl2O4,D错误。
9.答案 (1)离子 O2-半径小于S2-半径,MnO中所含的离子键较MnS强
(2)①Sn②正四面体形 分子
③二者均为分子晶体,组成与结构相似,SiCl4的相对分子质量小于SnCl4,SiCl4的分子间作用力弱于SnCl4
(3)分子
(4)分子晶体 离子晶体
(5)abd
解析 (1)MnO、MnS的熔点都比较高,都属于离子晶体。MnO的熔点较MnS高的原因是O2-半径小于S2-半径,MnO中所含的离子键较MnS强。
(2)①一般,非金属性越强,电负性越大,Si、Sn、Cl三种元素电负性由小到大的顺序为Sn②SiCl4类似于CCl4,SiCl4的空间结构为正四面体形,属于分子晶体。
③SiCl4和SnCl4均为分子晶体,SiCl4的相对分子质量小于SnCl4,SiCl4的分子间作用力弱于SnCl4,熔点低于SnCl4。
(3)Fe(CO)5的熔点为253 K,沸点为376 K,其固体属于分子晶体。
(4)氧的常见氢化物是H2O、H2O2,H2O、H2O2形成的晶体均属于分子晶体;Na的氢化物为NaH,NaH属于离子晶体。
(5)NH3、F2、NF3属于分子晶体;NH4F属于离子晶体;铜属于金属晶体。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024苏教版高中化学选择性必修2同步
专题强化练4 晶体类型的判断及晶体结构的分析
1.(2023河北石家庄第二中学月考)立方氮化硼可作研磨剂,其晶胞结构如图所示。下列说法错误的是( )
A.立方氮化硼的硬度大,属于共价晶体
B.硼原子的配位数是4
C.该物质的化学式是B3N2
D.N和B之间存在配位键
2.元素X的+1价离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶胞结构如图所示。下列说法错误的是( )
A.X元素的原子序数是19
B.X的晶体具有良好的导电性、导热性和延展性
C.X+是图中的灰球
D.该晶体中阳离子与阴离子个数比为3∶1
3.氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如图所示:
下列关于这些晶体结构和性质的叙述不正确的是( )
A.同一主族的不同元素与另一同种元素所形成的化学式相似的物质不一定具有相同的晶体结构
B.在氯化钠晶体中Cl-的配位数为6,在氯化铯晶体中Cl-的配位数为8
C.二氧化碳晶体中一个分子周围有12个紧邻的分子
D.在二氧化硅晶体中,平均每个Si原子形成2个Si—O共价单键
4.(2022河南洛阳孟津一中开学测试)钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,下列有关说法正确的是( )
A.该晶体属于离子晶体,晶体的化学式为BaO
B.该晶体中化学键类型只有离子键
C.该晶体晶胞结构与ZnS相似
D.填入Ba2+堆积产生的八面体空隙
5.(2023河北高考前适应性考试)(CH3NH3)PbI3的晶胞结构如图所示,其中B代表Pb2+,下列说法正确的是( )
A.Pb2+的外围电子排布式为6s26p2
B.A代表I-
C.若原子分数坐标A为(0,0,0),B为(,,),则C的原子分数坐标为(1,,)
D.已知(CH3NH3)PbI3的摩尔质量为M g·mol-1,NA为阿伏加德罗常数的值,则该晶体的密度为 g·cm-3
6.(2023河北沧州部分学校开学考试)金属铜的晶胞结构如图所示,已知金属铜的密度为ρ g·cm-3,NA表示阿伏加德罗常数的值。下列说法中正确的是( )
A.基态Cu原子的核外电子排布式为[Ar]3d94s2
B.金属铜的堆积方式为体心立方堆积
C.每个晶胞中Cu原子个数为6
D.距离最近的两个铜原子之间的距离为· cm
7.(2023湖北武汉调研)氢能具有高热值、零污染和资源丰富等优点。一种光解水产生氢气的催化剂晶胞结构如图所示,已知晶胞参数为a pm。下列说法错误的是( )
A.Ce与O的个数比为1∶2
B.在晶体中与Ce距离最近的O个数为8
C.Ce与O的最近距离为a pm
D.该晶体的摩尔体积为Vm= m3·mol-1
8.(2022湖北八市联考)某镁铝尖晶石的晶胞由立方体A区和B区组成,其结构如图所示。
下列说法正确的是( )
该晶胞的体积为×10-30 cm3
B.与O2-最邻近的Al3+数为4
Mg2+和Mg2+之间的最短距离为 pm
D.该物质的化学式为Mg2AlO4
9.(2022北京丰台第一中学检测)(1)MnO的熔点(1 650 ℃)比MnS的熔点(1 610 ℃)高,它们都属于 晶体,前者熔点较后者高的原因是 。
(2)SiCl4和SnCl4通常为液体。
①Si、Sn、Cl三种元素电负性由小到大的顺序为 。
②SiCl4的空间结构为 ,属于 晶体。
③SiCl4的熔点低于SnCl4的原因为
。
(3)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253 K,沸点为376 K,其固体属于 晶体。
(4)O和Na的氢化物所属的晶体类型分别为 和 。
(5)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2 NF3+3NH4F。该化学反应涉及的五种物质所属的晶体类型有 (填字母)。
a.离子晶体 b.分子晶体
c.共价晶体 d.金属晶体
专题强化练4 晶体类型的判断及晶体结构的分析
对应主书P45
1.C 2.A 3.D 4.D 5.C 6.D 7.D 8.C
1.C 立方氮化硼可作研磨剂,硬度很大,属于共价晶体,A正确;硼原子位于晶胞的顶点和面心,离硼原子最近且等距离的氮原子共4个,则硼原子的配位数为4,B正确;立方氮化硼晶胞中N原子个数是4,B原子个数=8×+6×=4,其化学式应为BN,C错误;B原子最外层有3个电子,在立方氮化硼中每个B原子形成了4个B—N键,所以立方氮化硼中B和N之间存在配位键,D正确。
2.A X+中所有电子正好充满K、L、M三个电子层,X+的K、L、M层依次排有2、8、18个电子,X+核外有28个电子,X原子核外有29个电子,X的原子序数为29,A项错误;X为Cu,Cu属于金属晶体,金属晶体具有良好的导电性、导热性和延展性,B项正确;晶胞中白球有8×=1个,灰球有12×=3个,化合物中元素正、负化合价代数和为0,即X+与N3-的个数比为3∶1,X+是图中的灰球,C、D项正确。
3.D CO2为分子晶体,SiO2为共价晶体,故同一主族的不同元素与另一同种元素所形成的化学式相似的物质不一定具有相同的晶体结构,A项正确;在氯化钠晶体中与Cl-紧邻的Na+个数为6,即Cl-的配位数为6,在氯化铯晶体中与Cl-紧邻的Cs+个数为8,即氯离子的配位数为8, B项正确;二氧化碳晶体中一个CO2分子周围有12个紧邻的CO2分子,C项正确;在二氧化硅晶体中,平均每个Si原子形成4个Si—O共价单键,D项错误。
4.D 晶胞中Ba2+位于顶点和面心位置,一个晶胞中含有Ba2+的个数为8×+6×==4,位于晶胞的棱心和体心位置,含有的个数为12×+1=4,该氧化物为BaO2,A错误;中O和O之间为共价键,B错误;其晶胞结构与ZnS不相似,C错误;位于体心和棱心,均处在Ba2+堆积产生的八面体空隙内,D正确。
5.C Pb2+的外围电子排布式为6s2,A错误;由晶胞结构结合该物质化学式得出C代表I-,B错误;根据晶胞中原子的相对位置可知,若原子分数坐标A为(0,0,0),B为(,,),则C的原子分数坐标为(1,,),C正确;1 pm=10-10 cm,故该晶体的密度为 g·cm-3,D错误。
6.D Cu为29号元素,基态Cu原子的核外电子排布式为[Ar]3d104s1,A错误;金属铜的堆积方式为面心立方堆积,B错误;每个晶胞中Cu原子个数为8×+6×=4,C错误;晶胞质量= g,设最近的两个Cu原子之间距离为r cm,则晶胞棱长为r cm,故 g=ρ g·cm-3×(r cm)3,解得r=·,D正确。
7.D 据“均摊法”得,晶胞中Ce的个数为8×+6×=4,O的个数为8,则晶胞中Ce与O的个数比为1∶2,A正确;以底面面心的Ce为例,上、下各有4个氧原子与其距离最近且等距离,故晶体中与Ce距离最近的O个数为8,B正确;Ce与O的最近距离为体对角线长的四分之一,为a pm,C正确;1个晶胞体积为a3×10-36 m3,含有4个Ce和8个O,则该晶体的摩尔体积为×a3×10-36×NA m3·mol-1= m3·mol-1,D错误。
8.C 由图可知A区、B区棱长均为 pm,则晶胞的棱长为a pm=a×10-10 cm,晶胞的体积为a3×10-30 cm3,A错误。与O2-最邻近的Al3+在B区,由图可知,O2-、Al3+构成的立方体中,与O2-最邻近的Al3+有3个,在A区中无铝离子,B错误。Mg2+和Mg2+之间的最短距离为A区体对角线长的一半,故为 pm,C正确。晶胞中紧邻的AB区为晶胞的四分之一部分,镁离子2个位于棱上、4个位于顶点、1个位于体内,所含镁离子数目为2×+4×+1=2;铝离子全部位于内部,数目为4;氧离子全部位于内部,数目为8;则该物质的化学式为MgAl2O4,D错误。
9.答案 (1)离子 O2-半径小于S2-半径,MnO中所含的离子键较MnS强
(2)①Sn
③二者均为分子晶体,组成与结构相似,SiCl4的相对分子质量小于SnCl4,SiCl4的分子间作用力弱于SnCl4
(3)分子
(4)分子晶体 离子晶体
(5)abd
解析 (1)MnO、MnS的熔点都比较高,都属于离子晶体。MnO的熔点较MnS高的原因是O2-半径小于S2-半径,MnO中所含的离子键较MnS强。
(2)①一般,非金属性越强,电负性越大,Si、Sn、Cl三种元素电负性由小到大的顺序为Sn
③SiCl4和SnCl4均为分子晶体,SiCl4的相对分子质量小于SnCl4,SiCl4的分子间作用力弱于SnCl4,熔点低于SnCl4。
(3)Fe(CO)5的熔点为253 K,沸点为376 K,其固体属于分子晶体。
(4)氧的常见氢化物是H2O、H2O2,H2O、H2O2形成的晶体均属于分子晶体;Na的氢化物为NaH,NaH属于离子晶体。
(5)NH3、F2、NF3属于分子晶体;NH4F属于离子晶体;铜属于金属晶体。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
