2024苏教版高中化学选择性必修2同步练习题--第1课时 范德华力 氢键(含解析)
文档属性
| 名称 | 2024苏教版高中化学选择性必修2同步练习题--第1课时 范德华力 氢键(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-23 17:27:08 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2024苏教版高中化学选择性必修2同步
第四单元 分子间作用力 分子晶体
第1课时 范德华力 氢键
基础过关练
题组一 范德华力
1.下列关于范德华力的叙述正确的是( )
A.是一种较弱的化学键
B.分子间存在强于化学键的相互作用
C.直接影响所有物质的熔、沸点
D.稀有气体的分子间存在范德华力
2.(经典题)下列过程克服了范德华力的是( )
A.氯化钠熔化
B.HCl溶于水
C.碘升华
D.氢氧化钠熔化
3.(2023天津中学期末)下列物质性质的变化规律与范德华力无关的是( )
A.F2、Cl2、Br2、I2的熔、沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.CI4、CBr4、CCl4、CF4的熔、沸点逐渐降低
D.CH3CH3、CH3CH2CH3、CH(CH3)3、CH3CH2CH2CH3的沸点逐渐升高
题组二 氢键
4.(2023湖南师范大学附属中学期末)下列说法正确的是( )
A.乙醇分子和水分子间只存在范德华力
B.氢键通常用X—H…Y表示,其中X、Y代表电负性大而原子半径小的原子
C.H2O比H2S稳定是因为水分子间存在氢键
D.常温下HF呈气态而H2O呈液态,原因是H2O中氢键键能大于HF中氢键键能
5.(2023山东德州第一中学月考)下列事实与氢键无关的有( )
①HF比HCl的熔、沸点高
②相同温度下,冰的密度比水小
③水分子比硫化氢分子稳定
④乙醇可以和水以任意比例互溶
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸低
A.1项 B.2项 C.3项 D.4项
6.下列说法中,错误的是( )
A.卤化氢中,HF的沸点最高,是由于HF分子间存在氢键
B.邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点低
C.H2O的沸点比HF的沸点高,是由于水分子间存在氢键而HF分子间不存在氢键
D.氨气极易溶于水与氨气分子和水分子间形成氢键有关
题组三 化学键、氢键、范德华力的综合考点
7.(2023重庆渝高中学月考)下列各组物质中,升华或熔化时所克服的粒子间作用力类型分别与干冰和氢氧化钠相同的是( )
A.NaCl和CCl4
B.Na2O和SiO2
C.金刚石和金属铝
D.碘和过氧化钠
8.(2023河北邢台第二中学期末)共价键、离子键、范德华力、氢键等都是微观粒子之间的不同作用力,下列物质在升华或熔化时破坏的作用力相同的是( )
A.硼和金刚石 B.NaCl和AlN
C.干冰和冰 D.Fe和S
能力提升练
题组 化学键、范德华力与氢键及其对物质性质的影响
1.氢键是强极性键上的氢原子与电负性很大且含孤电子对的原子之间的静电作用。下列事实与氢键无关的是( )
A.相同压强下H2O的沸点高于HF的沸点
B.一定条件下,NH3与BF3可以形成NH3·BF3
C.羊毛制品水洗再晒干后变形
D.H2O和CH3COCH3的结构和极性并不相似,但二者能完全互溶
2.(2022山东泰安一模,)冰层表面的结构如图所示。下列有关说法错误的是( )
A.冰融化成水的过程中,ΔH>0,ΔS<0
B.第一层固态冰中,水分子间通过氢键形成空间网状结构,密度比液态水小
C.第二层“准液体”中,水分子间形成氢键的数目比固态冰中少
D.当高于一定温度时,“准液体”中的水分子与下层冰中的水分子连接的氢键断裂,产生“流动性水分子”,使冰面变滑
3.(2023北京海淀教师进修学校开学检测)通过原子力显微镜观测铜单晶表面的8-羟基喹啉分子,可清晰观察到分子间存在的氢键作用,这为化学界争论近百年的“氢键的本质”问题提供了新的实验证据。下列说法错误的是( )
A.氢键的本质是一种微粒间的相互作用
B.成像图片中的微粒由4个8-羟基喹啉分子缔合而成
C.8-羟基喹啉分子的取向不同,其间的氢键数目和强弱可能发生改变
D.8-羟基喹啉中存在分子内氢键,因此其熔、沸点相对较高
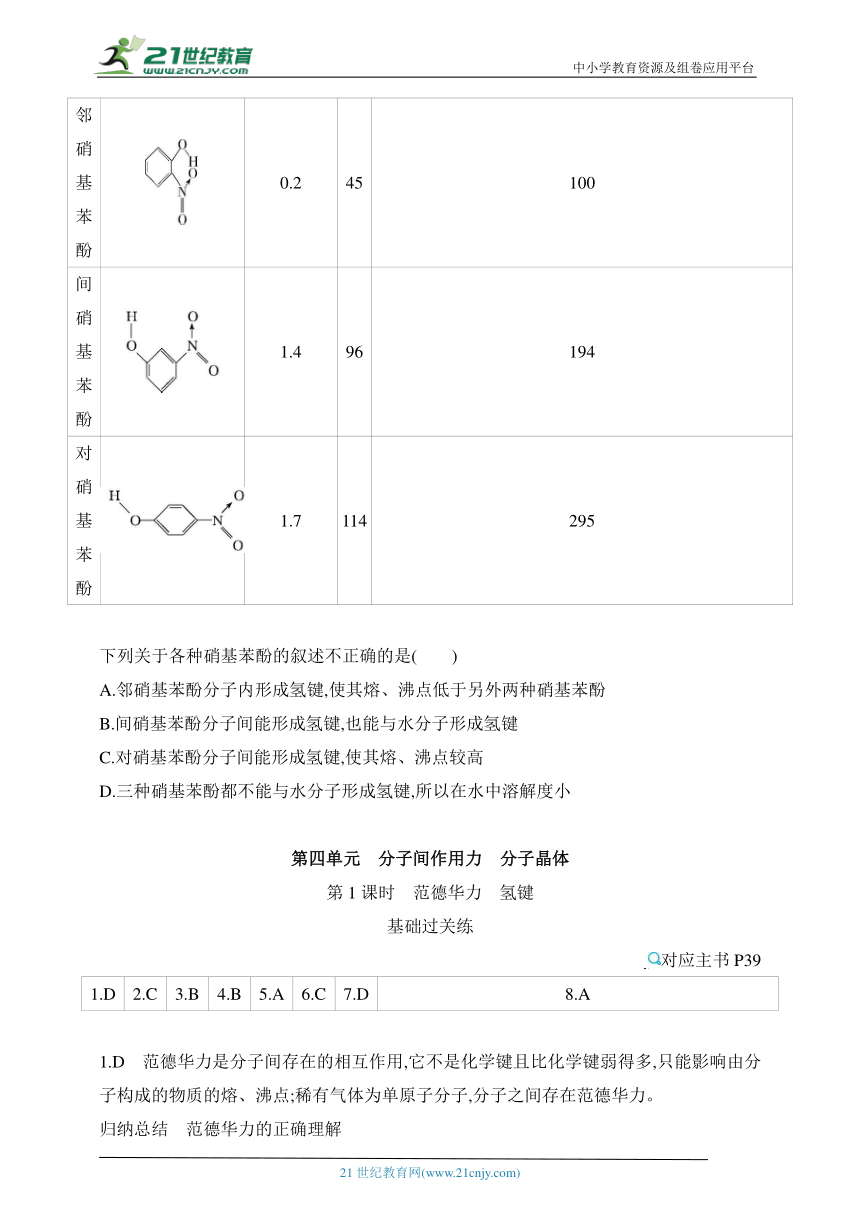
4.已知各种硝基苯酚的性质如表所示:
名称 结构简式 溶解度/(g/ 100 g水,25 ℃) 熔点/ ℃ 沸点/ ℃
邻硝 基苯 酚 0.2 45 100
间硝 基苯 酚 1.4 96 194
对硝 基苯 酚 1.7 114 295
下列关于各种硝基苯酚的叙述不正确的是( )
A.邻硝基苯酚分子内形成氢键,使其熔、沸点低于另外两种硝基苯酚
B.间硝基苯酚分子间能形成氢键,也能与水分子形成氢键
C.对硝基苯酚分子间能形成氢键,使其熔、沸点较高
D.三种硝基苯酚都不能与水分子形成氢键,所以在水中溶解度小
第四单元 分子间作用力 分子晶体
第1课时 范德华力 氢键
基础过关练
对应主书P39
1.D 2.C 3.B 4.B 5.A 6.C 7.D 8.A
1.D 范德华力是分子间存在的相互作用,它不是化学键且比化学键弱得多,只能影响由分子构成的物质的熔、沸点;稀有气体为单原子分子,分子之间存在范德华力。
归纳总结 范德华力的正确理解
范德华力很弱,比化学键弱得多,其主要特征有以下几个方面:
(1)普遍存在于分子之间。
(2)范德华力的作用范围通常为0.3~0.5 nm。
(3)主要影响物质的熔点、沸点等物理性质。
(4)无方向性和饱和性,只要分子周围空间允许,分子总是尽可能多地吸引其他分子。
2.C 氯化钠、氢氧化钠均是离子化合物,熔化时离子键被破坏,A、D项不符合题意;HCl溶于水时破坏的是共价键,B项不符合题意;碘升华时克服的是范德华力,C项符合题意。
3.B F2、Cl2、Br2、I2所形成的晶体均为分子晶体,结构相似,且不存在分子间氢键,相对分子质量越大,范德华力越大,熔、沸点越高,与范德华力有关,A不符合题意;HF、HCl、HBr、HI的热稳定性与其分子中的共价键的强弱有关,而与范德华力无关,B符合题意;CI4、CBr4、CCl4、CF4均为分子晶体,且其结构相似,范德华力随相对分子质量的减小而减小,熔、沸点逐渐降低,与范德华力有关,C不符合题意;乙烷、丙烷、异丁烷、正丁烷分子间的范德华力逐渐增大,沸点逐渐升高,与范德华力有关,D不符合题意。
4.B 乙醇分子和水分子间存在范德华力和氢键,A错误;X—H…Y中X、Y是电负性较大且原子半径较小的原子,B正确;分子间氢键影响物质的熔、沸点等,不影响物质的稳定性,C错误;HF中氢键键能大于H2O中氢键键能,等物质的量的H2O和HF,H2O中的氢键多于HF中的氢键,故常温下水为液态,HF为气态,D错误。
5.A ①HF分子之间能形成氢键,导致其熔、沸点高于HCl;②氢键具有方向性,相同温度、相同质量的水和冰中,冰中氢键数目比液态水中多,使得水分子间隙增大,所以冰的密度比水小;③水分子比硫化氢分子稳定是因为O的非金属性强于S,与氢键无关;④乙醇可以和水分子形成氢键,可以与水互溶;⑤邻羟基苯甲酸易形成分子内氢键使其熔、沸点降低,对羟基苯甲酸易形成分子间氢键使其熔、沸点升高;因此与氢键无关的只有③;选A。
6.C HF分子之间存在氢键,故沸点相对较高,A项正确;能形成分子间氢键的物质沸点较高,邻羟基苯甲醛形成分子内氢键,对羟基苯甲醛形成分子间氢键,所以邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点低,B项正确;HF分子间存在氢键,C项错误;氨气分子和水分子间形成氢键,是氨气极易溶于水的原因之一,D项正确。
7.D 干冰和氢氧化钠分别为分子晶体和离子晶体,升华或熔化时分别克服分子间作用力、离子键。NaCl为离子晶体,熔化时需克服离子键,CCl4为分子晶体,熔化时需克服分子间作用力,A错误。Na2O为离子晶体,熔化时需克服离子键;SiO2为共价晶体,熔化时需克服共价键,B错误。金刚石为共价晶体,熔化时需克服共价键;铝为金属晶体,熔化时需克服金属键,C错误。碘为分子晶体,升华时需克服分子间作用力;过氧化钠为离子晶体,熔化时需克服离子键,D正确。
8.A 金刚石和硼单质都属于共价晶体,共价晶体熔化时破坏共价键,A符合题意。NaCl属于离子晶体,离子晶体熔化时破坏离子键;AlN属于共价晶体,AlN中铝原子与氮原子之间通过共价键结合,共价晶体熔化时破坏共价键,B不符合题意。干冰和冰都属于分子晶体,干冰分子间只存在范德华力,冰中H2O分子间存在范德华力和氢键,干冰升华时破坏范德华力,冰融化时破坏范德华力和氢键,C不符合题意。Fe是金属晶体,熔化时破坏金属键;S单质是分子晶体,熔化时破坏分子间作用力,D不符合题意。
归纳总结
共价晶体熔化共价键
分子晶体熔化范德华力或范德华力和氢键
金属晶体熔化金属键
离子晶体熔化离子键
能力提升练
对应主书P40
1.B 2.A 3.D 4.D
1.B 1个水分子能与周围的水分子形成4个氢键,1个HF分子只能与周围的HF分子形成2个氢键,所以相同压强下H2O的沸点高于HF的沸点,A项不符合题意;NH3与BF3可以形成配位键从而形成NH3·BF3,与氢键无关,B项符合题意;羊毛的主要成分是蛋白质,蛋白质分子与水分子之间形成氢键,所以羊毛制品水洗再晒干后变形,C项不符合题意;CH3COCH3中O原子电负性很大,可与水分子形成氢键,所以二者能完全互溶,D项不符合题意。
2.A 冰融化成水的过程中,需要吸收热量,则ΔH>0,物质由固相变成液相,熵增加,则ΔS>0,A错误;固态冰中,水分子间通过氢键形成空间网状结构,体积变大,则固态冰密度比液态水小,B正确;从图中可以看出,“准液体”中水分子间形成氢键的数目比固态冰中少,C正确;当高于一定温度时“准液体”中的水分子与下层固体冰中的水分子连接的氢键断裂产生“流动性水分子”,使冰面变滑,D正确。
3.D 氢键的本质是一种微粒间的相互作用,A正确;成像图片中的微粒由4个8-羟基喹啉分子缔合而成,B正确;8-羟基喹啉分子的取向不同,其间的氢键数目、形成氢键的原子间的距离不同,即氢键数目和强弱不同,C正确;由题图可知8-羟基喹啉中不存在分子内氢键,D错误。
4.D 邻硝基苯酚能形成分子内氢键,使其熔、沸点降低,间硝基苯酚、对硝基苯酚能形成分子间氢键,使其熔、沸点升高,A项正确;间硝基苯酚分子间能形成氢键,使其熔、沸点升高,间硝基苯酚与水分子可形成氢键,使其在水中的溶解度增大,B项正确;对硝基苯酚分子间能形成氢键,使其熔、沸点升高,C项正确;邻硝基苯酚、间硝基苯酚、对硝基苯酚都可以与水分子形成氢键,使其在水中的溶解度增大,D项错误。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024苏教版高中化学选择性必修2同步
第四单元 分子间作用力 分子晶体
第1课时 范德华力 氢键
基础过关练
题组一 范德华力
1.下列关于范德华力的叙述正确的是( )
A.是一种较弱的化学键
B.分子间存在强于化学键的相互作用
C.直接影响所有物质的熔、沸点
D.稀有气体的分子间存在范德华力
2.(经典题)下列过程克服了范德华力的是( )
A.氯化钠熔化
B.HCl溶于水
C.碘升华
D.氢氧化钠熔化
3.(2023天津中学期末)下列物质性质的变化规律与范德华力无关的是( )
A.F2、Cl2、Br2、I2的熔、沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.CI4、CBr4、CCl4、CF4的熔、沸点逐渐降低
D.CH3CH3、CH3CH2CH3、CH(CH3)3、CH3CH2CH2CH3的沸点逐渐升高
题组二 氢键
4.(2023湖南师范大学附属中学期末)下列说法正确的是( )
A.乙醇分子和水分子间只存在范德华力
B.氢键通常用X—H…Y表示,其中X、Y代表电负性大而原子半径小的原子
C.H2O比H2S稳定是因为水分子间存在氢键
D.常温下HF呈气态而H2O呈液态,原因是H2O中氢键键能大于HF中氢键键能
5.(2023山东德州第一中学月考)下列事实与氢键无关的有( )
①HF比HCl的熔、沸点高
②相同温度下,冰的密度比水小
③水分子比硫化氢分子稳定
④乙醇可以和水以任意比例互溶
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸低
A.1项 B.2项 C.3项 D.4项
6.下列说法中,错误的是( )
A.卤化氢中,HF的沸点最高,是由于HF分子间存在氢键
B.邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点低
C.H2O的沸点比HF的沸点高,是由于水分子间存在氢键而HF分子间不存在氢键
D.氨气极易溶于水与氨气分子和水分子间形成氢键有关
题组三 化学键、氢键、范德华力的综合考点
7.(2023重庆渝高中学月考)下列各组物质中,升华或熔化时所克服的粒子间作用力类型分别与干冰和氢氧化钠相同的是( )
A.NaCl和CCl4
B.Na2O和SiO2
C.金刚石和金属铝
D.碘和过氧化钠
8.(2023河北邢台第二中学期末)共价键、离子键、范德华力、氢键等都是微观粒子之间的不同作用力,下列物质在升华或熔化时破坏的作用力相同的是( )
A.硼和金刚石 B.NaCl和AlN
C.干冰和冰 D.Fe和S
能力提升练
题组 化学键、范德华力与氢键及其对物质性质的影响
1.氢键是强极性键上的氢原子与电负性很大且含孤电子对的原子之间的静电作用。下列事实与氢键无关的是( )
A.相同压强下H2O的沸点高于HF的沸点
B.一定条件下,NH3与BF3可以形成NH3·BF3
C.羊毛制品水洗再晒干后变形
D.H2O和CH3COCH3的结构和极性并不相似,但二者能完全互溶
2.(2022山东泰安一模,)冰层表面的结构如图所示。下列有关说法错误的是( )
A.冰融化成水的过程中,ΔH>0,ΔS<0
B.第一层固态冰中,水分子间通过氢键形成空间网状结构,密度比液态水小
C.第二层“准液体”中,水分子间形成氢键的数目比固态冰中少
D.当高于一定温度时,“准液体”中的水分子与下层冰中的水分子连接的氢键断裂,产生“流动性水分子”,使冰面变滑
3.(2023北京海淀教师进修学校开学检测)通过原子力显微镜观测铜单晶表面的8-羟基喹啉分子,可清晰观察到分子间存在的氢键作用,这为化学界争论近百年的“氢键的本质”问题提供了新的实验证据。下列说法错误的是( )
A.氢键的本质是一种微粒间的相互作用
B.成像图片中的微粒由4个8-羟基喹啉分子缔合而成
C.8-羟基喹啉分子的取向不同,其间的氢键数目和强弱可能发生改变
D.8-羟基喹啉中存在分子内氢键,因此其熔、沸点相对较高
4.已知各种硝基苯酚的性质如表所示:
名称 结构简式 溶解度/(g/ 100 g水,25 ℃) 熔点/ ℃ 沸点/ ℃
邻硝 基苯 酚 0.2 45 100
间硝 基苯 酚 1.4 96 194
对硝 基苯 酚 1.7 114 295
下列关于各种硝基苯酚的叙述不正确的是( )
A.邻硝基苯酚分子内形成氢键,使其熔、沸点低于另外两种硝基苯酚
B.间硝基苯酚分子间能形成氢键,也能与水分子形成氢键
C.对硝基苯酚分子间能形成氢键,使其熔、沸点较高
D.三种硝基苯酚都不能与水分子形成氢键,所以在水中溶解度小
第四单元 分子间作用力 分子晶体
第1课时 范德华力 氢键
基础过关练
对应主书P39
1.D 2.C 3.B 4.B 5.A 6.C 7.D 8.A
1.D 范德华力是分子间存在的相互作用,它不是化学键且比化学键弱得多,只能影响由分子构成的物质的熔、沸点;稀有气体为单原子分子,分子之间存在范德华力。
归纳总结 范德华力的正确理解
范德华力很弱,比化学键弱得多,其主要特征有以下几个方面:
(1)普遍存在于分子之间。
(2)范德华力的作用范围通常为0.3~0.5 nm。
(3)主要影响物质的熔点、沸点等物理性质。
(4)无方向性和饱和性,只要分子周围空间允许,分子总是尽可能多地吸引其他分子。
2.C 氯化钠、氢氧化钠均是离子化合物,熔化时离子键被破坏,A、D项不符合题意;HCl溶于水时破坏的是共价键,B项不符合题意;碘升华时克服的是范德华力,C项符合题意。
3.B F2、Cl2、Br2、I2所形成的晶体均为分子晶体,结构相似,且不存在分子间氢键,相对分子质量越大,范德华力越大,熔、沸点越高,与范德华力有关,A不符合题意;HF、HCl、HBr、HI的热稳定性与其分子中的共价键的强弱有关,而与范德华力无关,B符合题意;CI4、CBr4、CCl4、CF4均为分子晶体,且其结构相似,范德华力随相对分子质量的减小而减小,熔、沸点逐渐降低,与范德华力有关,C不符合题意;乙烷、丙烷、异丁烷、正丁烷分子间的范德华力逐渐增大,沸点逐渐升高,与范德华力有关,D不符合题意。
4.B 乙醇分子和水分子间存在范德华力和氢键,A错误;X—H…Y中X、Y是电负性较大且原子半径较小的原子,B正确;分子间氢键影响物质的熔、沸点等,不影响物质的稳定性,C错误;HF中氢键键能大于H2O中氢键键能,等物质的量的H2O和HF,H2O中的氢键多于HF中的氢键,故常温下水为液态,HF为气态,D错误。
5.A ①HF分子之间能形成氢键,导致其熔、沸点高于HCl;②氢键具有方向性,相同温度、相同质量的水和冰中,冰中氢键数目比液态水中多,使得水分子间隙增大,所以冰的密度比水小;③水分子比硫化氢分子稳定是因为O的非金属性强于S,与氢键无关;④乙醇可以和水分子形成氢键,可以与水互溶;⑤邻羟基苯甲酸易形成分子内氢键使其熔、沸点降低,对羟基苯甲酸易形成分子间氢键使其熔、沸点升高;因此与氢键无关的只有③;选A。
6.C HF分子之间存在氢键,故沸点相对较高,A项正确;能形成分子间氢键的物质沸点较高,邻羟基苯甲醛形成分子内氢键,对羟基苯甲醛形成分子间氢键,所以邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点低,B项正确;HF分子间存在氢键,C项错误;氨气分子和水分子间形成氢键,是氨气极易溶于水的原因之一,D项正确。
7.D 干冰和氢氧化钠分别为分子晶体和离子晶体,升华或熔化时分别克服分子间作用力、离子键。NaCl为离子晶体,熔化时需克服离子键,CCl4为分子晶体,熔化时需克服分子间作用力,A错误。Na2O为离子晶体,熔化时需克服离子键;SiO2为共价晶体,熔化时需克服共价键,B错误。金刚石为共价晶体,熔化时需克服共价键;铝为金属晶体,熔化时需克服金属键,C错误。碘为分子晶体,升华时需克服分子间作用力;过氧化钠为离子晶体,熔化时需克服离子键,D正确。
8.A 金刚石和硼单质都属于共价晶体,共价晶体熔化时破坏共价键,A符合题意。NaCl属于离子晶体,离子晶体熔化时破坏离子键;AlN属于共价晶体,AlN中铝原子与氮原子之间通过共价键结合,共价晶体熔化时破坏共价键,B不符合题意。干冰和冰都属于分子晶体,干冰分子间只存在范德华力,冰中H2O分子间存在范德华力和氢键,干冰升华时破坏范德华力,冰融化时破坏范德华力和氢键,C不符合题意。Fe是金属晶体,熔化时破坏金属键;S单质是分子晶体,熔化时破坏分子间作用力,D不符合题意。
归纳总结
共价晶体熔化共价键
分子晶体熔化范德华力或范德华力和氢键
金属晶体熔化金属键
离子晶体熔化离子键
能力提升练
对应主书P40
1.B 2.A 3.D 4.D
1.B 1个水分子能与周围的水分子形成4个氢键,1个HF分子只能与周围的HF分子形成2个氢键,所以相同压强下H2O的沸点高于HF的沸点,A项不符合题意;NH3与BF3可以形成配位键从而形成NH3·BF3,与氢键无关,B项符合题意;羊毛的主要成分是蛋白质,蛋白质分子与水分子之间形成氢键,所以羊毛制品水洗再晒干后变形,C项不符合题意;CH3COCH3中O原子电负性很大,可与水分子形成氢键,所以二者能完全互溶,D项不符合题意。
2.A 冰融化成水的过程中,需要吸收热量,则ΔH>0,物质由固相变成液相,熵增加,则ΔS>0,A错误;固态冰中,水分子间通过氢键形成空间网状结构,体积变大,则固态冰密度比液态水小,B正确;从图中可以看出,“准液体”中水分子间形成氢键的数目比固态冰中少,C正确;当高于一定温度时“准液体”中的水分子与下层固体冰中的水分子连接的氢键断裂产生“流动性水分子”,使冰面变滑,D正确。
3.D 氢键的本质是一种微粒间的相互作用,A正确;成像图片中的微粒由4个8-羟基喹啉分子缔合而成,B正确;8-羟基喹啉分子的取向不同,其间的氢键数目、形成氢键的原子间的距离不同,即氢键数目和强弱不同,C正确;由题图可知8-羟基喹啉中不存在分子内氢键,D错误。
4.D 邻硝基苯酚能形成分子内氢键,使其熔、沸点降低,间硝基苯酚、对硝基苯酚能形成分子间氢键,使其熔、沸点升高,A项正确;间硝基苯酚分子间能形成氢键,使其熔、沸点升高,间硝基苯酚与水分子可形成氢键,使其在水中的溶解度增大,B项正确;对硝基苯酚分子间能形成氢键,使其熔、沸点升高,C项正确;邻硝基苯酚、间硝基苯酚、对硝基苯酚都可以与水分子形成氢键,使其在水中的溶解度增大,D项错误。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
