2024苏教版高中化学选择性必修2同步练习题--第2课时 分子晶体(含解析)
文档属性
| 名称 | 2024苏教版高中化学选择性必修2同步练习题--第2课时 分子晶体(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-23 17:36:29 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2024苏教版高中化学选择性必修2同步
第2课时 分子晶体
基础过关练
题组一 分子晶体的判断
1.下列晶体由原子直接构成,且属于分子晶体的是 ( )
A.固态氢 B.固态氖 C.磷 D.三氧化硫
2.(2022山西长治二中月考)以下晶体是分子晶体的是( )
①金刚石 ②干冰 ③硫黄 ④金刚砂 ⑤氯化铯 ⑥铁 ⑦固态Ar ⑧苯甲酸
⑨C60 ⑩高锰酸钾
A.②④⑤⑧⑨ B.②③⑦⑧⑨ C.①③⑧⑨⑩ D.③⑦⑧⑨⑩
题组二 分子晶体的结构
3.(经典题)干冰晶胞如图所示,若干冰的晶胞棱长为a,则每个CO2分子周围与其相距a的CO2分子有( )
A.4个 B.8个 C.12个 D.6个
4.下图为冰的结构模型,大球代表O,小球代表H。下列有关说法正确的是( )
A.冰晶体中每个水分子与另外4个水分子形成四面体结构
B.冰晶体具有空间网状结构,是共价晶体
C.水分子间通过H—O键形成冰晶体
D.冰融化后,水分子之间的空隙增大
5.(2022山东潍坊期中)甲烷晶体的晶胞如图所示。下列有关说法中正确的是( )
A.1个CH4晶胞中含有32个H原子
B.晶体中2个碳原子间最近距离为a pm
C.甲烷晶体中碳原子间以共价键相结合
D.甲烷晶体性质稳定,高温条件下也不会与氧气发生反应
6.(2023北京一零一中学3月统练)正硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3通过氢键相连(如图所示)。下列有关说法正确的是( )
A.正硼酸晶体属于离子晶体,熔点很高
B.H3BO3的化学性质主要与氢键有关
C.1 mol H3BO3晶体中有6 mol氢键
D.分子中硼原子最外层不是8电子稳定结构
题组三 分子晶体的性质
7.(2022湖南天壹名校联盟大联考)硅与氢结合能形成一系列的二元化合物SiH4、Si2H6等,与氯、溴结合生成SiCl4、SiBr4,SiH4、Si2H6、SiCl4、SiBr4四种物质的沸点由高到低的顺序为 ( )
A.SiH4、Si2H6、SiCl4、SiBr4 B.SiBr4、SiCl4、SiH4、Si2H6
C.SiBr4、SiCl4、Si2H6、SiH4 D.Si2H6、SiH4、SiCl4、SiBr4
8.(经典题)下列性质可能符合分子晶体特点的是( )
①熔点1 070 ℃,易溶于水,水溶液能导电
②熔点10.31 ℃,液态不导电,水溶液能导电
③能溶于CS2,熔点112.8 ℃,沸点444.6 ℃
④熔点97.81 ℃,质软,固态能导电,密度为0.97 g·cm-3
A.①④ B.②③ C.①② D.②④
9.(2022吉林长春第二实验中学开学考试)下列物质性质的变化与化学键强弱无关的是( )
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.NaF、NaCl、NaBr、NaI的熔点依次降低
C.Li、Na、K、Rb 的熔点逐渐降低
D.F2、Cl2、Br2、I2的熔、沸点逐渐升高
题组四 混合型晶体
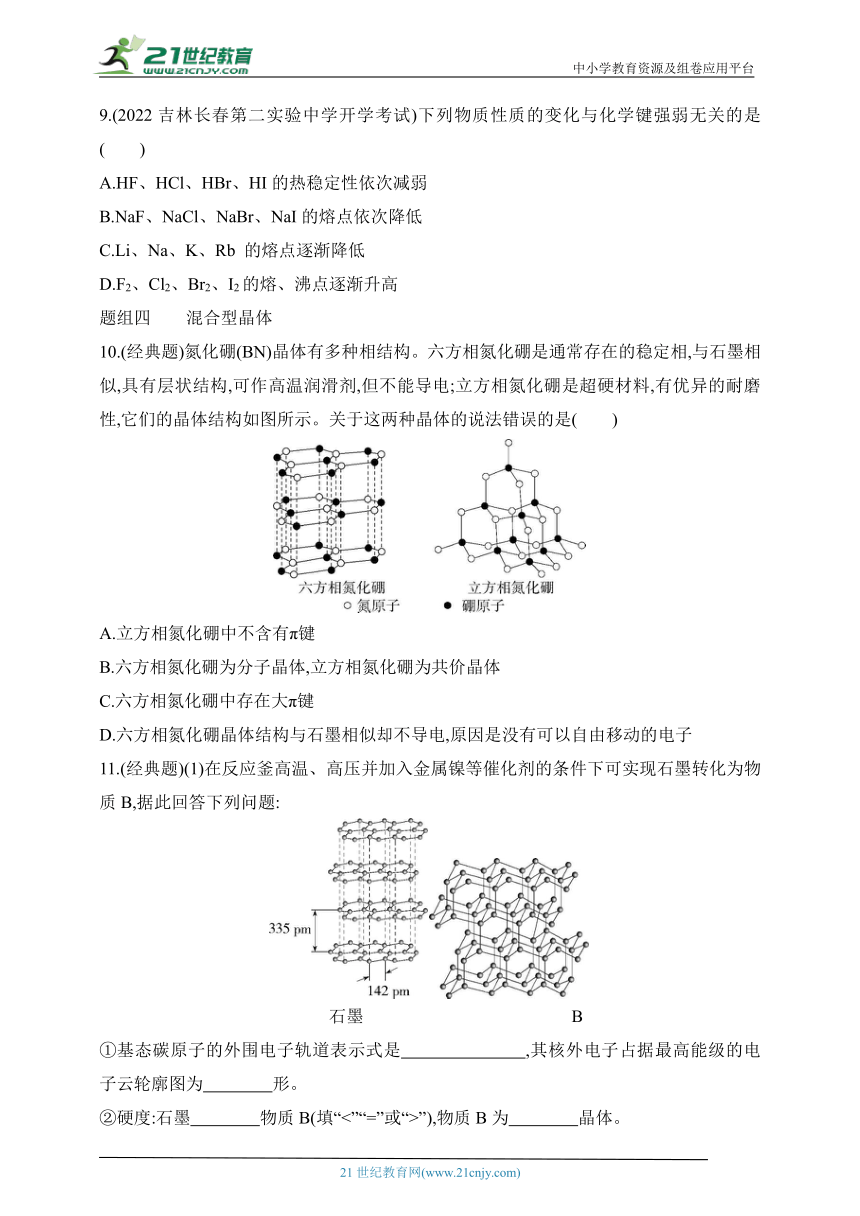
10.(经典题)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂,但不能导电;立方相氮化硼是超硬材料,有优异的耐磨性,它们的晶体结构如图所示。关于这两种晶体的说法错误的是( )
A.立方相氮化硼中不含有π键
B.六方相氮化硼为分子晶体,立方相氮化硼为共价晶体
C.六方相氮化硼中存在大π键
D.六方相氮化硼晶体结构与石墨相似却不导电,原因是没有可以自由移动的电子
11.(经典题)(1)在反应釜高温、高压并加入金属镍等催化剂的条件下可实现石墨转化为物质B,据此回答下列问题:
石墨 B
①基态碳原子的外围电子轨道表示式是 ,其核外电子占据最高能级的电子云轮廓图为 形。
②硬度:石墨 物质B(填“<”“=”或“>”),物质B为 晶体。
(2)石墨烯与金属M可以形成一种插层化合物。其中M层平行于石墨层(晶胞如图甲所示),垂直于石墨层方向的投影如图乙所示,则该插层化合物的化学式为 。
石墨烯晶体
能力提升练
题组 分子晶体的结构与性质
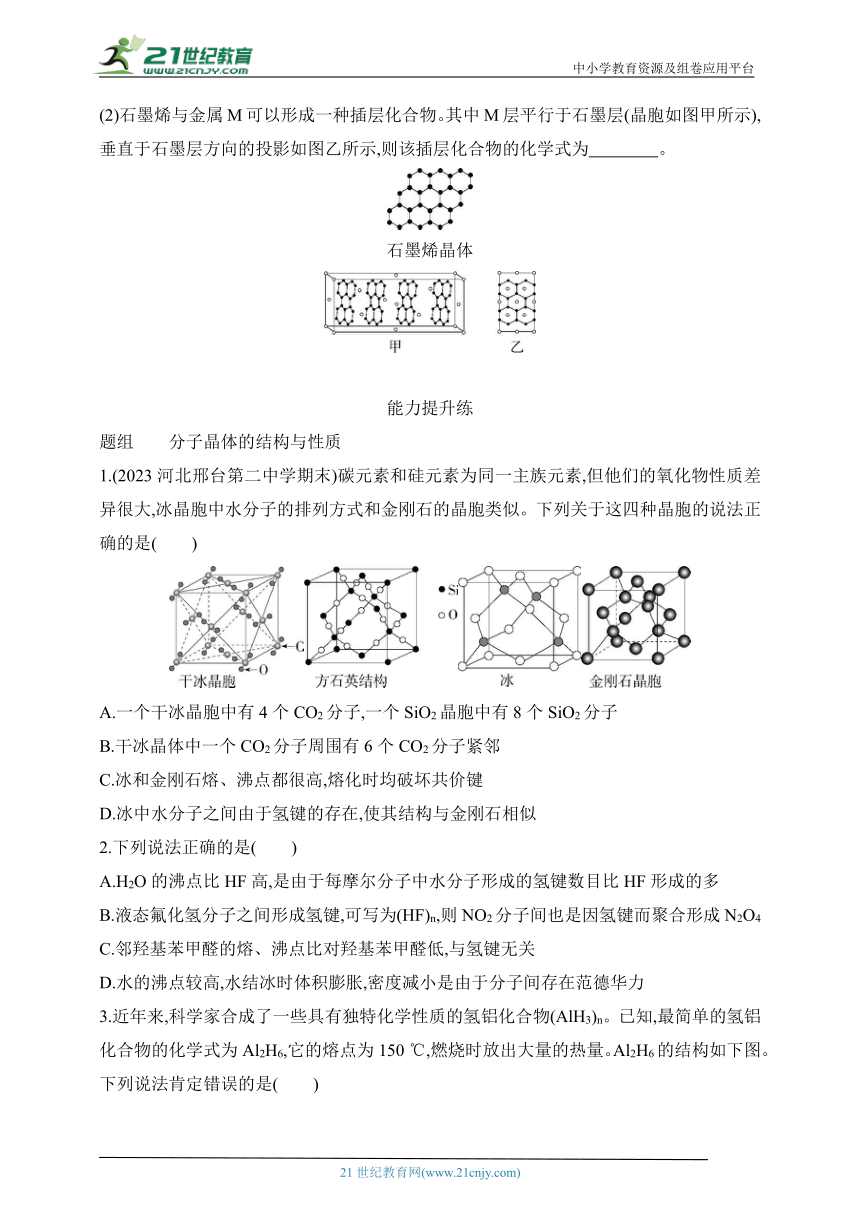
1.(2023河北邢台第二中学期末)碳元素和硅元素为同一主族元素,但他们的氧化物性质差异很大,冰晶胞中水分子的排列方式和金刚石的晶胞类似。下列关于这四种晶胞的说法正确的是( )
A.一个干冰晶胞中有4个CO2分子,一个SiO2晶胞中有8个SiO2分子
B.干冰晶体中一个CO2分子周围有6个CO2分子紧邻
C.冰和金刚石熔、沸点都很高,熔化时均破坏共价键
D.冰中水分子之间由于氢键的存在,使其结构与金刚石相似
2.下列说法正确的是( )
A.H2O的沸点比HF高,是由于每摩尔分子中水分子形成的氢键数目比HF形成的多
B.液态氟化氢分子之间形成氢键,可写为(HF)n,则NO2分子间也是因氢键而聚合形成N2O4
C.邻羟基苯甲醛的熔、沸点比对羟基苯甲醛低,与氢键无关
D.水的沸点较高,水结冰时体积膨胀,密度减小是由于分子间存在范德华力
3.近年来,科学家合成了一些具有独特化学性质的氢铝化合物(AlH3)n。已知,最简单的氢铝化合物的化学式为Al2H6,它的熔点为150 ℃,燃烧时放出大量的热量。Al2H6的结构如下图。下列说法肯定错误的是( )
A.Al2H6在固态时所形成的晶体是分子晶体 B.氢铝化合物可能成为未来的储氢材料和火箭燃料
C.Al2H6在空气中完全燃烧,产物为氧化铝和水 D.Al2H6中含有离子键和极性共价键
4.美国Lawrence Livermore国家实验室成功地在高压下将CO2转化为具有类似SiO2结构的共价晶体,下列说法正确的是( )
A.CO2的共价晶体和分子晶体互为同素异形体
B.在一定条件下,CO2的共价晶体转化为CO2的分子晶体是物理变化
C.CO2的共价晶体和CO2的分子晶体具有相同的物理性质和化学性质
D.在CO2的共价晶体中,每个C原子结合4个O原子,每个O原子跟2个C原子相结合
第2课时 分子晶体
基础过关练
对应主书P41
1.B 2.B 3.C 4.A 5.B 6.D 7.C 8.B
9.D 10.B
1.B 稀有气体分子都属于单原子分子,因此稀有气体分子形成的晶体属于分子晶体,且由原子直接构成。
2.B ①金刚石属于共价晶体;②干冰是固态CO2,是由CO2分子通过分子间作用力形成的分子晶体;③硫黄为分子晶体;④金刚砂中,每个Si原子与相邻4个C原子形成共价键,每个C原子与相邻的4个Si原子形成共价键,金刚砂属于共价晶体;⑤氯化铯由铯离子和氯离子构成,是通过离子键相结合形成的离子晶体;⑥铁属于金属晶体;⑦固态Ar为分子晶体;⑧苯甲酸是由苯甲酸分子通过分子间作用力结合形成的分子晶体;⑨C60是由C60分子通过分子间作用力结合形成的分子晶体;⑩高锰酸钾由钾离子和高锰酸根离子构成,二者通过离子键相结合形成离子晶体;综上所述,②③⑦⑧⑨符合题意,选B。
3.C 以顶点CO2分子为研究对象,若干冰的晶胞棱长为a,该CO2分子周围与其相距a的CO2分子处于共用这个顶点的面的面心,由于顶点CO2分子为8个晶胞共有,则每个CO2分子周围与其相距a的CO2分子有=12个,故选C。
4.A 冰属于分子晶体,冰中的水分子主要是靠氢键结合在一起,氢键不是化学键,而是一种分子间作用力,故B、C两项均错误;每个水分子可以与其他4个水分子形成氢键,从而形成四面体结构,A项正确;冰晶体中形成的氢键具有方向性和饱和性,故水分子间由氢键连接后,分子间空隙变大,因此冰融化成水后,体积减小,水分子之间空隙减小,D项错误。
5.B 由图可知,1个晶胞中含有的CH4分子数目为8×+6×=4,故1个CH4晶胞中含有4×4=16个H原子,A错误;由晶胞图可知,晶体中2个碳原子间最近距离为面对角线长的一半,即a pm,B正确;甲烷晶体中碳原子间不形成共价键,是C和H通过共价键连接形成CH4分子,CH4分子通过分子间作用力形成甲烷晶体,C错误;甲烷晶体可在氧气中燃烧,D错误。
6.D 层内的H3BO3通过氢键相连,可推测正硼酸晶体熔点低,其不为离子晶体,A错误;H3BO3的化学性质主要与分子内共价键有关,与氢键无关,B错误;由均摊法可得1 mol H3BO3晶体中有3 mol氢键,C错误;分子中硼原子最外层只有6个电子,不是8电子稳定结构,D正确。
7.C SiH4、Si2H6、SiCl4、SiBr4的晶体均为分子晶体,相对分子质量越大,分子间作用力越大,分子晶体的沸点越高,所以沸点:SiBr4>SiCl4>Si2H6>SiH4,选C。
8.B 分子晶体中分子之间是以分子间作用力相结合的,分子晶体具有低熔点、易升华、硬度小等性质。①熔点高,不是分子晶体;④固态能导电,不是分子晶体,故选B。
归纳总结 在分子晶体中,相邻分子靠分子间作用力相互吸引。分子晶体熔化时,只需克服分子间作用力,不破坏化学键,所以分子晶体一般具有较低的熔点。此外,分子晶体还具有硬度小、易升华、有较强的挥发性、一般不导电等特点。
9.D 非金属性F>Cl>Br>I,元素的非金属性越强,形成的氢化物共价键的键能越大,对应的氢化物越稳定,与化学键强弱有关,A不符合题意;NaF、NaCl、NaBr、NaI属于离子晶体,影响熔点高低的因素是晶格能,与化学键强弱有关,B不符合题意;金属晶体的熔点与金属键有关,C不符合题意;F2、Cl2、Br2、I2属于分子晶体,它们的相对分子质量逐渐增大,相对分子质量越大,范德华力越大,熔、沸点越高,与化学键强弱无关,D符合题意。
10.B 立方相氮化硼类似于金刚石的结构,只有σ键,没有π键,故A正确;立方相氮化硼为共价晶体,六方相氮化硼为混合型晶体,故B错误;六方相氮化硼结构与石墨相似,六方相氮化硼中存在大π键,故C正确;六方相氮化硼中没有自由移动的电子,故其不导电,故D正确。
11.答案 (1)①
↑↓
↑ ↑
纺锤 ②< 共价 (2)MC8
解析 (1)①碳原子的核外电子数为6,基态碳原子的核外电子排布式为1s22s22p2,外围电子排布式为2s22p2,基态碳原子的外围电子轨道表示式是
↑↓
↑ ↑
,其核外电子占据的最高能级为2p能级,电子云轮廓图为纺锤形。
②由题意可知,石墨经高温、高压、催化剂催化得到的B为金刚石,石墨属于混合型晶体,金刚石属于共价晶体,故硬度:石墨<物质B。
(2)晶胞中M原子数目=8×+6×+4=8;C原子数目=12×4+8×4×=64,M、C原子数目之比为1∶8,则该插层化合物的化学式是MC8。
能力提升练
对应主书P43
1.D 2.A 3.D 4.D
1.D CO2分子位于晶胞的面心和顶点上,一个干冰晶胞中有8×+6×=4个CO2分子,SiO2是共价晶体,SiO2晶胞中不存在分子,A错误;干冰晶体中一个CO2分子周围有12个CO2分子紧邻,B错误;冰是分子晶体,冰融化为水时破坏范德华力和氢键,金刚石是共价晶体,熔化时破坏共价键,C错误;冰中水分子之间由于氢键的存在,使其晶体结构与金刚石相似,D正确。
2.A 1个水分子能与其他4个水分子形成氢键,1个HF分子能与其他2个HF形成氢键,每摩尔分子中水分子形成的氢键数目多于HF,H2O的沸点比HF高,A正确;NO2分子间不存在氢键,NO2分子间因发生反应生成N2O4,B错误;邻羟基苯甲醛能形成分子内氢键,对羟基苯甲醛能形成分子间氢键,当对羟基苯甲醛熔化时,需要消耗较多的能量克服分子间氢键,所以对羟基苯甲醛的熔点高于邻羟基苯甲醛,C错误;水的沸点较高,水结冰时体积膨胀、密度减小与氢键有关,D错误。
3.D Al2H6的熔点为150 ℃,由熔点及题给Al2H6结构可知Al2H6为分子晶体,A正确;该物质燃烧时放出大量的热量,可能成为未来的储氢材料和火箭燃料,B正确;由Al2H6的组成元素可知,其燃烧产物为氧化铝和水,C正确;Al2H6为分子晶体,该化合物中Al和H之间形成共价键,Al2H6中不含离子键,D错误。
4.D 同素异形体的研究对象是单质,CO2是化合物,故A错误;二氧化碳的共价晶体和二氧化碳的分子晶体属于不同物质,所以在一定条件下,CO2的共价晶体转化为CO2的分子晶体是化学变化,故B错误;二氧化碳的分子晶体和二氧化碳的共价晶体的构成微粒不同,空间结构不同,其物理性质不同,故C错误;参照SiO2的晶体结构,知在二氧化碳的共价晶体中,每个C原子结合4个O原子,每个O原子跟2个C原子相结合,故D正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024苏教版高中化学选择性必修2同步
第2课时 分子晶体
基础过关练
题组一 分子晶体的判断
1.下列晶体由原子直接构成,且属于分子晶体的是 ( )
A.固态氢 B.固态氖 C.磷 D.三氧化硫
2.(2022山西长治二中月考)以下晶体是分子晶体的是( )
①金刚石 ②干冰 ③硫黄 ④金刚砂 ⑤氯化铯 ⑥铁 ⑦固态Ar ⑧苯甲酸
⑨C60 ⑩高锰酸钾
A.②④⑤⑧⑨ B.②③⑦⑧⑨ C.①③⑧⑨⑩ D.③⑦⑧⑨⑩
题组二 分子晶体的结构
3.(经典题)干冰晶胞如图所示,若干冰的晶胞棱长为a,则每个CO2分子周围与其相距a的CO2分子有( )
A.4个 B.8个 C.12个 D.6个
4.下图为冰的结构模型,大球代表O,小球代表H。下列有关说法正确的是( )
A.冰晶体中每个水分子与另外4个水分子形成四面体结构
B.冰晶体具有空间网状结构,是共价晶体
C.水分子间通过H—O键形成冰晶体
D.冰融化后,水分子之间的空隙增大
5.(2022山东潍坊期中)甲烷晶体的晶胞如图所示。下列有关说法中正确的是( )
A.1个CH4晶胞中含有32个H原子
B.晶体中2个碳原子间最近距离为a pm
C.甲烷晶体中碳原子间以共价键相结合
D.甲烷晶体性质稳定,高温条件下也不会与氧气发生反应
6.(2023北京一零一中学3月统练)正硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3通过氢键相连(如图所示)。下列有关说法正确的是( )
A.正硼酸晶体属于离子晶体,熔点很高
B.H3BO3的化学性质主要与氢键有关
C.1 mol H3BO3晶体中有6 mol氢键
D.分子中硼原子最外层不是8电子稳定结构
题组三 分子晶体的性质
7.(2022湖南天壹名校联盟大联考)硅与氢结合能形成一系列的二元化合物SiH4、Si2H6等,与氯、溴结合生成SiCl4、SiBr4,SiH4、Si2H6、SiCl4、SiBr4四种物质的沸点由高到低的顺序为 ( )
A.SiH4、Si2H6、SiCl4、SiBr4 B.SiBr4、SiCl4、SiH4、Si2H6
C.SiBr4、SiCl4、Si2H6、SiH4 D.Si2H6、SiH4、SiCl4、SiBr4
8.(经典题)下列性质可能符合分子晶体特点的是( )
①熔点1 070 ℃,易溶于水,水溶液能导电
②熔点10.31 ℃,液态不导电,水溶液能导电
③能溶于CS2,熔点112.8 ℃,沸点444.6 ℃
④熔点97.81 ℃,质软,固态能导电,密度为0.97 g·cm-3
A.①④ B.②③ C.①② D.②④
9.(2022吉林长春第二实验中学开学考试)下列物质性质的变化与化学键强弱无关的是( )
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.NaF、NaCl、NaBr、NaI的熔点依次降低
C.Li、Na、K、Rb 的熔点逐渐降低
D.F2、Cl2、Br2、I2的熔、沸点逐渐升高
题组四 混合型晶体
10.(经典题)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂,但不能导电;立方相氮化硼是超硬材料,有优异的耐磨性,它们的晶体结构如图所示。关于这两种晶体的说法错误的是( )
A.立方相氮化硼中不含有π键
B.六方相氮化硼为分子晶体,立方相氮化硼为共价晶体
C.六方相氮化硼中存在大π键
D.六方相氮化硼晶体结构与石墨相似却不导电,原因是没有可以自由移动的电子
11.(经典题)(1)在反应釜高温、高压并加入金属镍等催化剂的条件下可实现石墨转化为物质B,据此回答下列问题:
石墨 B
①基态碳原子的外围电子轨道表示式是 ,其核外电子占据最高能级的电子云轮廓图为 形。
②硬度:石墨 物质B(填“<”“=”或“>”),物质B为 晶体。
(2)石墨烯与金属M可以形成一种插层化合物。其中M层平行于石墨层(晶胞如图甲所示),垂直于石墨层方向的投影如图乙所示,则该插层化合物的化学式为 。
石墨烯晶体
能力提升练
题组 分子晶体的结构与性质
1.(2023河北邢台第二中学期末)碳元素和硅元素为同一主族元素,但他们的氧化物性质差异很大,冰晶胞中水分子的排列方式和金刚石的晶胞类似。下列关于这四种晶胞的说法正确的是( )
A.一个干冰晶胞中有4个CO2分子,一个SiO2晶胞中有8个SiO2分子
B.干冰晶体中一个CO2分子周围有6个CO2分子紧邻
C.冰和金刚石熔、沸点都很高,熔化时均破坏共价键
D.冰中水分子之间由于氢键的存在,使其结构与金刚石相似
2.下列说法正确的是( )
A.H2O的沸点比HF高,是由于每摩尔分子中水分子形成的氢键数目比HF形成的多
B.液态氟化氢分子之间形成氢键,可写为(HF)n,则NO2分子间也是因氢键而聚合形成N2O4
C.邻羟基苯甲醛的熔、沸点比对羟基苯甲醛低,与氢键无关
D.水的沸点较高,水结冰时体积膨胀,密度减小是由于分子间存在范德华力
3.近年来,科学家合成了一些具有独特化学性质的氢铝化合物(AlH3)n。已知,最简单的氢铝化合物的化学式为Al2H6,它的熔点为150 ℃,燃烧时放出大量的热量。Al2H6的结构如下图。下列说法肯定错误的是( )
A.Al2H6在固态时所形成的晶体是分子晶体 B.氢铝化合物可能成为未来的储氢材料和火箭燃料
C.Al2H6在空气中完全燃烧,产物为氧化铝和水 D.Al2H6中含有离子键和极性共价键
4.美国Lawrence Livermore国家实验室成功地在高压下将CO2转化为具有类似SiO2结构的共价晶体,下列说法正确的是( )
A.CO2的共价晶体和分子晶体互为同素异形体
B.在一定条件下,CO2的共价晶体转化为CO2的分子晶体是物理变化
C.CO2的共价晶体和CO2的分子晶体具有相同的物理性质和化学性质
D.在CO2的共价晶体中,每个C原子结合4个O原子,每个O原子跟2个C原子相结合
第2课时 分子晶体
基础过关练
对应主书P41
1.B 2.B 3.C 4.A 5.B 6.D 7.C 8.B
9.D 10.B
1.B 稀有气体分子都属于单原子分子,因此稀有气体分子形成的晶体属于分子晶体,且由原子直接构成。
2.B ①金刚石属于共价晶体;②干冰是固态CO2,是由CO2分子通过分子间作用力形成的分子晶体;③硫黄为分子晶体;④金刚砂中,每个Si原子与相邻4个C原子形成共价键,每个C原子与相邻的4个Si原子形成共价键,金刚砂属于共价晶体;⑤氯化铯由铯离子和氯离子构成,是通过离子键相结合形成的离子晶体;⑥铁属于金属晶体;⑦固态Ar为分子晶体;⑧苯甲酸是由苯甲酸分子通过分子间作用力结合形成的分子晶体;⑨C60是由C60分子通过分子间作用力结合形成的分子晶体;⑩高锰酸钾由钾离子和高锰酸根离子构成,二者通过离子键相结合形成离子晶体;综上所述,②③⑦⑧⑨符合题意,选B。
3.C 以顶点CO2分子为研究对象,若干冰的晶胞棱长为a,该CO2分子周围与其相距a的CO2分子处于共用这个顶点的面的面心,由于顶点CO2分子为8个晶胞共有,则每个CO2分子周围与其相距a的CO2分子有=12个,故选C。
4.A 冰属于分子晶体,冰中的水分子主要是靠氢键结合在一起,氢键不是化学键,而是一种分子间作用力,故B、C两项均错误;每个水分子可以与其他4个水分子形成氢键,从而形成四面体结构,A项正确;冰晶体中形成的氢键具有方向性和饱和性,故水分子间由氢键连接后,分子间空隙变大,因此冰融化成水后,体积减小,水分子之间空隙减小,D项错误。
5.B 由图可知,1个晶胞中含有的CH4分子数目为8×+6×=4,故1个CH4晶胞中含有4×4=16个H原子,A错误;由晶胞图可知,晶体中2个碳原子间最近距离为面对角线长的一半,即a pm,B正确;甲烷晶体中碳原子间不形成共价键,是C和H通过共价键连接形成CH4分子,CH4分子通过分子间作用力形成甲烷晶体,C错误;甲烷晶体可在氧气中燃烧,D错误。
6.D 层内的H3BO3通过氢键相连,可推测正硼酸晶体熔点低,其不为离子晶体,A错误;H3BO3的化学性质主要与分子内共价键有关,与氢键无关,B错误;由均摊法可得1 mol H3BO3晶体中有3 mol氢键,C错误;分子中硼原子最外层只有6个电子,不是8电子稳定结构,D正确。
7.C SiH4、Si2H6、SiCl4、SiBr4的晶体均为分子晶体,相对分子质量越大,分子间作用力越大,分子晶体的沸点越高,所以沸点:SiBr4>SiCl4>Si2H6>SiH4,选C。
8.B 分子晶体中分子之间是以分子间作用力相结合的,分子晶体具有低熔点、易升华、硬度小等性质。①熔点高,不是分子晶体;④固态能导电,不是分子晶体,故选B。
归纳总结 在分子晶体中,相邻分子靠分子间作用力相互吸引。分子晶体熔化时,只需克服分子间作用力,不破坏化学键,所以分子晶体一般具有较低的熔点。此外,分子晶体还具有硬度小、易升华、有较强的挥发性、一般不导电等特点。
9.D 非金属性F>Cl>Br>I,元素的非金属性越强,形成的氢化物共价键的键能越大,对应的氢化物越稳定,与化学键强弱有关,A不符合题意;NaF、NaCl、NaBr、NaI属于离子晶体,影响熔点高低的因素是晶格能,与化学键强弱有关,B不符合题意;金属晶体的熔点与金属键有关,C不符合题意;F2、Cl2、Br2、I2属于分子晶体,它们的相对分子质量逐渐增大,相对分子质量越大,范德华力越大,熔、沸点越高,与化学键强弱无关,D符合题意。
10.B 立方相氮化硼类似于金刚石的结构,只有σ键,没有π键,故A正确;立方相氮化硼为共价晶体,六方相氮化硼为混合型晶体,故B错误;六方相氮化硼结构与石墨相似,六方相氮化硼中存在大π键,故C正确;六方相氮化硼中没有自由移动的电子,故其不导电,故D正确。
11.答案 (1)①
↑↓
↑ ↑
纺锤 ②< 共价 (2)MC8
解析 (1)①碳原子的核外电子数为6,基态碳原子的核外电子排布式为1s22s22p2,外围电子排布式为2s22p2,基态碳原子的外围电子轨道表示式是
↑↓
↑ ↑
,其核外电子占据的最高能级为2p能级,电子云轮廓图为纺锤形。
②由题意可知,石墨经高温、高压、催化剂催化得到的B为金刚石,石墨属于混合型晶体,金刚石属于共价晶体,故硬度:石墨<物质B。
(2)晶胞中M原子数目=8×+6×+4=8;C原子数目=12×4+8×4×=64,M、C原子数目之比为1∶8,则该插层化合物的化学式是MC8。
能力提升练
对应主书P43
1.D 2.A 3.D 4.D
1.D CO2分子位于晶胞的面心和顶点上,一个干冰晶胞中有8×+6×=4个CO2分子,SiO2是共价晶体,SiO2晶胞中不存在分子,A错误;干冰晶体中一个CO2分子周围有12个CO2分子紧邻,B错误;冰是分子晶体,冰融化为水时破坏范德华力和氢键,金刚石是共价晶体,熔化时破坏共价键,C错误;冰中水分子之间由于氢键的存在,使其晶体结构与金刚石相似,D正确。
2.A 1个水分子能与其他4个水分子形成氢键,1个HF分子能与其他2个HF形成氢键,每摩尔分子中水分子形成的氢键数目多于HF,H2O的沸点比HF高,A正确;NO2分子间不存在氢键,NO2分子间因发生反应生成N2O4,B错误;邻羟基苯甲醛能形成分子内氢键,对羟基苯甲醛能形成分子间氢键,当对羟基苯甲醛熔化时,需要消耗较多的能量克服分子间氢键,所以对羟基苯甲醛的熔点高于邻羟基苯甲醛,C错误;水的沸点较高,水结冰时体积膨胀、密度减小与氢键有关,D错误。
3.D Al2H6的熔点为150 ℃,由熔点及题给Al2H6结构可知Al2H6为分子晶体,A正确;该物质燃烧时放出大量的热量,可能成为未来的储氢材料和火箭燃料,B正确;由Al2H6的组成元素可知,其燃烧产物为氧化铝和水,C正确;Al2H6为分子晶体,该化合物中Al和H之间形成共价键,Al2H6中不含离子键,D错误。
4.D 同素异形体的研究对象是单质,CO2是化合物,故A错误;二氧化碳的共价晶体和二氧化碳的分子晶体属于不同物质,所以在一定条件下,CO2的共价晶体转化为CO2的分子晶体是化学变化,故B错误;二氧化碳的分子晶体和二氧化碳的共价晶体的构成微粒不同,空间结构不同,其物理性质不同,故C错误;参照SiO2的晶体结构,知在二氧化碳的共价晶体中,每个C原子结合4个O原子,每个O原子跟2个C原子相结合,故D正确。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
