2024苏教版高中化学选择性必修2同步练习题(含解析)--专题3 微粒间作用力与物质性质
文档属性
| 名称 | 2024苏教版高中化学选择性必修2同步练习题(含解析)--专题3 微粒间作用力与物质性质 |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-23 11:05:02 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2024苏教版高中化学选择性必修2同步
专题3 微粒间作用力与物质性质
1.全卷满分100分 考试用时90分钟。
2.可能用到的相对原子质量:H 1 C 12 N 14 O 16 F 19 Na 23
Mg 24 Cl 35.5 Ca 40 I 127 Cs 133 Pb 207
一、选择题(本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.科研人员发现在-50 ℃环境中,用水可制得直径在0.8~10 μm的光纤,其性能与石英光纤相似。下列说法正确的是( )
A.石英光纤的主要成分是硅
B.等质量的冰和水中,冰中含有更多的氢键
C.冰光纤是一种胶体,具有丁达尔现象
D.冰光纤和石英光纤都是分子晶体
2.下表给出了几种物质的熔点,对此有下列一些说法:①CaCl2属于离子晶体;②SiCl4是分子晶体;③一个SiO2分子由1个Si原子和2个O原子构成;④MgCl2在熔融状态下不能导电。上述说法中正确的有( )
物质 SiO2 MgCl2 CaCl2 SiCl4
熔点/℃ 1 723 712 782 -68
A.①② B.①③ C.②④ D.①②③
3.将氢氧化钠加热至熔融后进行电解,可得到金属钠、氧气和水,此过程中不存在( )
A.离子键破坏 B.共价键断裂 C.离子键形成 D.共价键形成
4.据美国《科学》杂志报道:在40 GPa高压下,用激光器加热到1 800 K可制得具有高熔点、高硬度的二氧化碳晶体。下列关于该晶体的说法正确的是( )
A.该晶体属于分子晶体
B.该晶体易升华,可用作制冷材料
C.该晶体的熔、沸点低于二氧化硅晶体
D.一定条件下,该晶体可跟氢氧化钠溶液反应
5.下列说法正确的是( )
A.铁元素位于元素周期表的ds区
B.石墨能导电,石墨沿层的平行方向的导电性强
C.中σ键和π键的数目比为6∶1
D.HNO3所含元素中第一电离能最大的是O
6.下列关于共价晶体、分子晶体的叙述中,正确的是( )
A.在SiO2晶体中,1个硅原子和2个氧原子形成2个共价键
B.分子晶体中一定存在共价键
C.HI的相对分子质量大于HF,但是HF的沸点高于HI
D.金刚石为共价键三维骨架结构,晶体中的最小环上有6个碳原子,且6个碳原子共面
7.W、X、Y、Z是原子序数依次增大的短周期元素,可“组合”成一种具有高效催化性能的超分子,其结构如图(注:实线代表共价键,其他Y原子之间的重复单元中的W、X未展开标注),W、X、Z分别位于不同周期,Z是同周期中金属性最强的元素。下列说法不正确的是( )
A.Y位于第二周期第ⅥA 族
B.XY2形成的晶体中一个XY2周围紧邻的XY2有12个
C.X单质存在能导电的混合型晶体
D.Y与Z可组成阴、阳离子数之比为1∶1的离子晶体
8.CaC2晶体的晶胞结构(如图所示)与NaCl晶体的相似,但CaC2晶体中由于哑铃形的存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是( )
A.CaC2晶体属于离子晶体
B.1个Ca2+周围距离最近且等距离的有6个
C.6.4 g CaC2晶体中含阴离子0.2 mol
D.与每个Ca2+距离相等且最近的Ca2+共有12个
9.下列有关图示,能直观形象地展示化学知识。关于下列图示的说法正确的是( )
A.①可表示石墨的空间结构 B.②可表示2s电子云轮廓图
C.③可表示C60晶体的晶胞 D.④可表示NaCl晶体的晶胞结构图
10.下列关于晶体的说法中,正确的是( )
A.共价键的强弱可决定分子晶体的熔、沸点
B.含有金属阳离子的晶体一定是离子晶体
C.晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性
D.CsCl和NaCl晶体中阴、阳离子的配位数都为6
11.有关晶体或晶胞的结构如图所示,下列说法正确的是( )
A.冰中的每个水分子均摊4个氢键
B.每个硅原子被4个最小环所共有
C.如图所示的金刚石晶胞中有6个碳原子
D.在CO2晶胞中,1个分子周围有12个紧邻分子
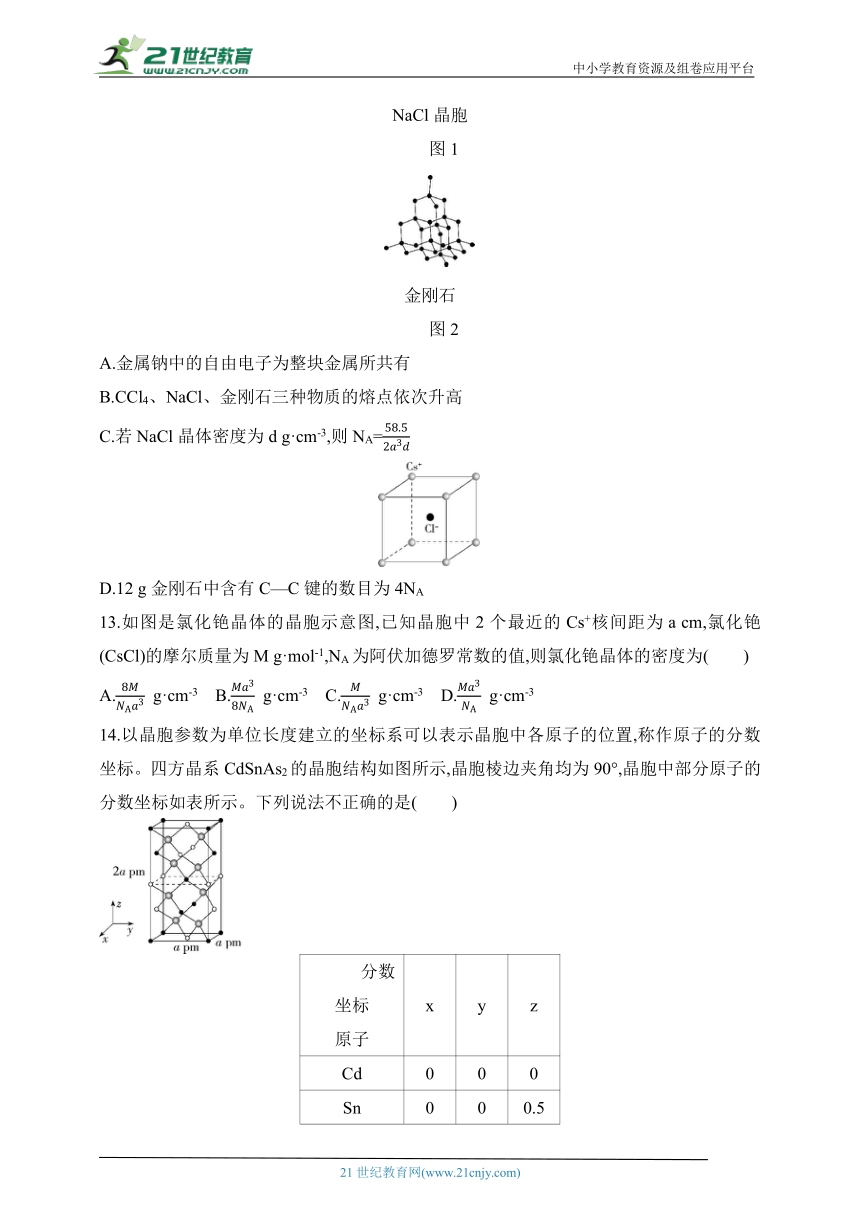
12.金刚石硬度大,熔点高,用途非常广泛。工业上利用反应CCl4+4Na C(金刚石)+4NaCl人工合成金刚石。已知:氯化钠晶胞结构如图1所示,相邻的Na+与Cl-的距离为a cm,设NA为阿伏加德罗常数的值,下列说法错误的是( )
NaCl晶胞
图1
金刚石
图2
A.金属钠中的自由电子为整块金属所共有
B.CCl4、NaCl、金刚石三种物质的熔点依次升高
C.若NaCl晶体密度为d g·cm-3,则NA=
D.12 g金刚石中含有C—C键的数目为4NA
13.如图是氯化铯晶体的晶胞示意图,已知晶胞中2个最近的Cs+核间距为a cm,氯化铯(CsCl)的摩尔质量为M g·mol-1,NA为阿伏加德罗常数的值,则氯化铯晶体的密度为( )
A. g·cm-3 B. g·cm-3 C. g·cm-3 D. g·cm-3
14.以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如表所示。下列说法不正确的是( )
分数坐标 原子 x y z
Cd 0 0 0
Sn 0 0 0.5
As 0.25 0.25 0.125
A.灰色大球代表As
B.一个晶胞中有4个Sn
C.CdSnAs2晶体中与单个Sn键合的As有2个
D.距离Cd(0,0,0)最近的Sn的分数坐标是(0.5,0,0.25)和(0.5,0.5,0)
15.F2和Xe在一定条件下可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂,都极易与水发生反应,其中:6XeF4+12H2O2XeO3+4Xe↑+24HF+3O2↑。下列推测正确的是( )
A.XeF2分子中各原子最外层均达到8电子结构
B.某种氟化氙的晶体结构单元如图,可推知其化学式为XeF6
C.XeF4按题中方程式与水反应时,每生成4 mol Xe,转移16 mol e-
D.XeF2加入水中,在水分子作用下将生成Xe和F2
二、非选择题(本题共5小题,共55分)
16.(12分)Al和Si在元素周期表金属和非金属分界线附近,其单质和化合物在建筑业、电子工业和石油化工等方面应用广泛。请回答下列问题:
(1)AlCl3是化工生产中常用的催化剂,熔点为192.6 ℃,熔融状态以二聚体Al2Cl6形式存在,其中铝原子与氯原子形成的化学键类型是 。
(2)纳米氮化铝(AlN)在绝缘材料中的应用广泛,AlN晶体与金刚石类似,每个Al原子与 个N原子相连,与同一个Al原子相连的N原子构成的空间结构为 。AlN属于 晶体。
(3)Si和C同主族,Si、C和O成键情况如下:
化学键 C—O CO Si—O
键能/kJ·mol-1 360 803 464 640
C和O之间可以通过双键形成CO2分子,而Si和O却不能像碳那样形成稳定分子的原因是 。
(4)下列数据是对应物质的熔点,有关的判断错误的是 。
Na2O Na AlF3 AlCl3
920 ℃ 97.8 ℃ 1 291 ℃ 190 ℃
Al2O3 BCl3 CO2 SiO2
2 073 ℃ -107 ℃ -57 ℃ 1 723 ℃
A.Na2O、AlF3是离子晶体;AlCl3、BCl3是分子晶体
B.同族元素的氧化物可形成不同类型的晶体
C.SiO2是共价晶体
D.在表中涉及的共价化合物分子中各原子都形成8电子稳定结构
17.(12分)超分子化学已逐渐扩展到化学的各个分支,还扩展到生命科学和物理学等领域。由Mo将2个C60分子、2个p-甲酸丁酯吡啶及2个CO分子利用配位键自组装的超分子结构如图所示。
(1)Mo处于元素周期表第五周期第ⅥB族,核外电子排布与Cr相似,它的基态原子外围电子排布式是 ;核外未成对电子数是 。
(2)该超分子中存在的化学键类型有 。
A.σ键 B.π键 C.离子键 D.氢键
(3)从电负性角度解释CF3COOH的酸性强于CH3COOH的原因:
。
(4)C60与金刚石互为同素异形体,从结构与性质之间的关系解释C60的熔点远低于金刚石的原因是 。
18.(10分)党的十八大以来,我国在科技创新和重大工程建设方面取得了丰硕成果,在新时代更需要新科技。2018年3月5日,《自然》连刊两文报道石墨烯超导重大发现,第一作者均为中国科大2010级少年班的曹原。曹原团队在双层石墨烯中发现新的电子态,可以简单实现绝缘体到超导体的转变。石墨烯是一种由碳原子组成六角形呈蜂巢晶格的二维碳纳米材料(如图甲),石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙)。
(1)图乙中1号C与相邻C有无形成π键 (填“有”或“无”)。
(2)图甲中1号C与相邻C形成的键之间的夹角 (填“>”“<”或“=”)120°。
(3)我国制墨工艺将50 nm左右的石墨烯或氧化石墨烯溶于水,在相同条件下所得到的分散系后者沸点更高,其原因是 。
(4)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
参数 分子 分子直径/nm 分子与H2O的结合 能E/kJ· mol-1
CH4 0.436 16.40
CO2 0.512 29.91
①“可燃冰”中分子间存在的2种作用力是 。
②有科学家提出用CO2置换CH4的设想。已知图中笼状结构的空腔直径为0.586 nm,结合表中内容从物质结构及性质的角度分析,该设想能否实现 (填“能”或“否”)。
19.(8分)2019年诺贝尔化学奖授予三位开发锂离子电池的科学家。TiS2、LiCoO2和LiMnO2等都是他们研究锂离子电池的载体。回答下列问题:
(1)基态Co原子的外围电子轨道表示式为 。
(2)已知第三电离能数据:I3(Mn)=3 246 kJ·mol-1,I3(Fe)=2 957 kJ·mol-1。锰的第三电离能大于铁的第三电离能,其主要原因是 。
(3)工业上,采用电解熔融氯化锂制备锂,钠还原TiCl4(g)制备钛。已知:LiCl、TiCl4的熔点分别为605 ℃、-24 ℃,它们的熔点相差很大,其主要原因是 。
20.(13分)氨硼烷是一种特殊的化合物,分子式为NH3BH3。氨硼烷在催化剂作用下水解释放氢气:3NH3BH3+6H2O3N+B3+9H2↑。B3的结构如图甲,回答下列问题:
图甲
图乙
(1)写出O原子的外围电子轨道表示式: 。
(2)写出NH3BH3分子的电子式: ;NH3BH3晶体中含有的微粒间作用力有 (填字母)。
a.非极性共价键 b.配位键 c.氢键 d.范德华力 e.金属键
(3)有机碱离子CH3N是NH3BH3的等电子体,该离子与Pb2+、I-组成的光电材料的晶胞如图乙所示。
该晶体中CH3N与I-间的作用力为 ,CH3N的配位数是 。若晶胞参数为a nm,该晶体密度为ρ g·cm-3,阿伏加德罗常数NA可表示为 mol-1(列出计算式)。
专题3 微粒间作用力与物质性质
1.B 2.A 3.C 4.D 5.B 6.C 7.D 8.A
9.D 10.C 11.D 12.D 13.C 14.C 15.C
1.B 石英光纤的主要成分是二氧化硅,A错误;冰中水分子有序排列,分子间更容易形成氢键,相同质量的水和冰中,冰中含有更多的氢键,B正确;冰光纤不是胶体,C错误;冰光纤是分子晶体,石英光纤是共价晶体,D错误。
2.A 氯化钙熔点高,属于离子晶体,①正确;四氯化硅熔点很低,属于分子晶体,②正确;二氧化硅为共价晶体,在SiO2晶体中无SiO2分子,③错误;氯化镁是离子晶体,其在熔融状态下能导电,④错误;A符合题意。
3.C 将氢氧化钠加热至熔融后进行电解,可得到金属钠、氧气和水,该反应的化学方程式为4NaOH 4Na+2H2O+O2↑,在这个过程中有离子键、共价键的破坏,同时在生成水、氧气的过程中有共价键的形成,金属钠中存在金属键,该过程不涉及离子键的形成,选C。
4.D 该二氧化碳晶体具有高熔点、高硬度,属于共价晶体,A错误;该二氧化碳晶体具有高熔点,说明该晶体不易升华,不能作制冷材料,B错误;共价晶体的熔、沸点取决于共价键的强弱,该二氧化碳晶体的熔、沸点高于二氧化硅,C错误;一定条件下该晶体能与氢氧化钠溶液反应,D正确。
5.B 铁元素位于元素周期表的d区,A错误;单键是σ键,一个双键中含一个σ键和一个π键,因此中σ键和π键的数目比为7∶1,C错误;一般第ⅡA族和第ⅤA族元素的第一电离能高于同一周期与之相邻的主族元素,故HNO3所含元素中第一电离能最大的是N,D错误。
6.C 在SiO2晶体中,1个硅原子和4个氧原子形成4个共价键,A错误;部分分子晶体(如稀有气体形成的晶体)中不含有共价键,B错误;金刚石为共价键三维骨架结构,晶体中的最小碳环上有6个碳原子,6个碳原子不共面,D错误。
7.D W、X、Y、Z是原子序数依次增大的短周期元素,W、X、Z分别位于不同周期,W只形成1个共价键,W为H元素,由超分子的结构可知,X能形成4个共价键,则X为C元素;Y能形成2个共价键,则Y为O元素;Z是同周期中金属性最强的元素,则Z为Na元素。Y为氧元素,位于第二周期第ⅥA族,A项正确;XY2形成的晶体干冰中一个二氧化碳分子周围紧邻的二氧化碳分子有12个,B项正确;由碳元素形成的单质中,石墨是能导电的混合型晶体,C项正确;Y与Z可形成氧化钠、过氧化钠,阴、阳离子数之比均为1∶2,D项错误。
8.A CaC2是由Ca2+和组成的离子化合物,A正确;CaC2晶胞不为正六面体形,1个Ca2+周围距离最近的有4个,而不是6个,B错误;CaC2是由Ca2+和组成的,6.4 g CaC2的物质的量为=0.1 mol,则6.4 g CaC2中含阴离子0.1 mol,C错误;CaC2晶胞不为正六面体形,与每个Ca2+距离相等且最近的Ca2+有4个,D错误。
9.D 石墨是层状结构,①可以表示金刚石的空间结构,A错误;s电子云是球形的,②不能表示2s电子云轮廓图,B错误;③表示C60分子的球棍模型,不为C60的晶胞,C错误;氯化钠是离子晶体,④可以表示NaCl晶体的晶胞结构图,D正确。
10.C 分子晶体熔化时破坏分子间作用力,不破坏共价键,分子间作用力决定分子晶体的熔、沸点,A错误;含有金属阳离子的晶体不一定是离子晶体,如金属晶体中含有金属阳离子,但不属于离子晶体,B错误;NaCl晶体中,阴、阳离子的配位数都为6,CsCl晶体中,阴、阳离子的配位数都为8,D错误。
11.D 根据图中信息冰中每个水分子与周围四个水分子形成分子间氢键,每个氢键都为两个水分子所共有,因而每个水分子均摊氢键数为4×=2,A错误;在SiO2晶体结构中每个Si原子被12个最小环所共有,B错误;如图所示的金刚石晶胞中碳原子有8个在顶点,6个在面心,4个在体内,因此含有8×+6×+4=8个碳原子,C错误。
12.D 金属晶体中的自由电子为整块金属共有,A正确;四氯化碳是分子晶体、氯化钠是离子晶体、金刚石是共价晶体,这三种物质的熔点依次升高,B正确;晶胞中位于顶点和面心的氯离子个数为8×+6×=4,位于棱上和体心的钠离子数为12×+1=4,则=(2a)3d,解得NA=,故C正确;金刚石中每个碳原子形成4个碳碳键,每个碳碳键为2个碳原子所共有,所以每个碳原子形成的碳碳键数目为4×=2,则12 g金刚石中含有碳碳键的数目为×2×NAmol-1=2NA,D错误。
13.C ρ== g·cm-3= g·cm-3。
14.C 由晶胞结构图可知,CdSnAs2晶体中与单个Sn键合的As有4个,C项错误。
15.C Xe原子本身最外层就是8电子结构,再与F原子结合,肯定就不再是8电子结构了,A错误;一个该晶体结构单元中Xe原子个数为8×+1=2,F原子个数为8×+2=4,故Xe与F的原子个数比为1∶2,其化学式为XeF2,B错误;由题中化学方程式可知,每生成4 mol Xe转移电子总物质的量为16 mol,C正确;F2与水会剧烈反应,所以在溶液中不可能生成F2,D错误。
16.答案 (每空2分)(1)共价键(或σ键) (2)4 正四面体 共价 (3)键的键能大于2倍的C—O键的键能,键的键能小于2倍的键的键能,所以Si和O不能以双键结合形成稳定分子 (4)D
解析 (1)AlCl3熔点为192.6 ℃,熔融状态以二聚体Al2Cl6形式存在,可以推出其分子为共价化合物,因此原子间形成的化学键为共价键。(2)AlN晶体与金刚石类似,可以知道AlN为共价晶体,因此每个Al原子周围有4个N原子,且与同1个Al原子相连的4个N原子构成正四面体结构。(4)Na2O、AlF3的熔点较高,是活泼的金属元素与活泼的非金属元素形成的离子晶体;AlCl3、BCl3的熔点较低,且两种物质的组成元素的电负性相差都小于1.7,所以AlCl3、BCl3是分子晶体,A项正确。C、Si都是第ⅣA族的元素,它们形成的氧化物中,CO2是分子晶体,而SiO2是共价晶体,B项正确,C项正确。BCl3分子中B原子最外层只有6个电子,没有形成8电子稳定结构,D项错误。
17.答案 (除注明外,每空2分)(1)4d55s1 6 (2)AB (3)F的电负性强于H,对电子的吸引能力强,共用电子对偏向F,使羧基中氧氢键较易断裂(3分) (4)C60是分子晶体,金刚石是共价晶体,共价晶体熔化时破坏共价键所需的能量远高于分子晶体熔化时克服分子间作用力所需的能量(3分)
解析 (1)Cr的基态原子外围电子排布式为3d54s1,而Mo与Cr同族,但在Cr的下一周期,Mo的基态原子外围电子排布式为4d55s1,其核外未成对电子数为6。(2)观察题图可知,该超分子中含有双键,说明有σ键和π键,分子中不存在离子键,根据题给信息知Mo形成配位键,因而答案为AB。
18.答案 (每空2分)(1)无 (2)= (3)氧化石墨烯可与水形成分子间氢键 (4)①氢键、范德华力 ②能
解析 (1)图乙中,1号碳原子形成4个共价单键,与相邻C没有形成π键。(2)图甲中1号C与相邻C形成的键之间的夹角为120°。(3)氧化石墨烯可与水分子形成氢键,而石墨烯不能。(4)①“可燃冰”中分子间存在范德华力和氢键。②由表中数据可知:二氧化碳的分子直径小于笼状结构的空腔直径,能顺利进入笼状空腔内,且二氧化碳分子与水分子的结合能大于甲烷分子与H2O分子的结合能。
19.答案 (1)(2分) (2)Mn2+的外围电子排布式为3d5,达半满稳定状态,不易再失去电子形成Mn3+,Fe2+的外围电子排布式为3d6,易再失去1个电子3d轨道达半满稳定状态(3分) (3)氯化锂属于离子晶体,氯化钛属于分子晶体,离子晶体里的离子键要比分子晶体里的分子间作用力强(3分)
解析 (1)Co原子的外围电子轨道表示式为
。(3)采用电解熔融氯化锂制备锂,可知LiCl为离子晶体,TiCl4的熔点为-24 ℃,说明TiCl4为分子晶体
20.答案 (除注明外,每空2分)(1)
(2) bcd (3)离子键 12 ×1021(3分)
解析 (1) O原子的外围电子排布式为2s22p4,其外围电子轨道表示式为
。(2)NH3BH3属于分子晶体,分子间存在范德华力,NH3BH3分子中N和H原子间、B和H原子间都形成的是极性共价键,N和B原子间形成的是配位键,其分子间还可以形成氢键。(3)该晶体中CH3N与I-之间的作用力为离子键;由题图可知CH3N在立方体的顶点,其配位数为12。1个晶胞中含有I-的个数为6×=3,CH3N的个数为8×=1,Pb2+的个数为1,化学式为PbCH3NH3I3,其摩尔质量为620 g·mol-1,一个晶胞的体积为(a×10-7)3 cm3,则晶体密度ρ g·cm-3=×1021,所以阿伏加德罗常数NA=×1021mol-1。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024苏教版高中化学选择性必修2同步
专题3 微粒间作用力与物质性质
1.全卷满分100分 考试用时90分钟。
2.可能用到的相对原子质量:H 1 C 12 N 14 O 16 F 19 Na 23
Mg 24 Cl 35.5 Ca 40 I 127 Cs 133 Pb 207
一、选择题(本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.科研人员发现在-50 ℃环境中,用水可制得直径在0.8~10 μm的光纤,其性能与石英光纤相似。下列说法正确的是( )
A.石英光纤的主要成分是硅
B.等质量的冰和水中,冰中含有更多的氢键
C.冰光纤是一种胶体,具有丁达尔现象
D.冰光纤和石英光纤都是分子晶体
2.下表给出了几种物质的熔点,对此有下列一些说法:①CaCl2属于离子晶体;②SiCl4是分子晶体;③一个SiO2分子由1个Si原子和2个O原子构成;④MgCl2在熔融状态下不能导电。上述说法中正确的有( )
物质 SiO2 MgCl2 CaCl2 SiCl4
熔点/℃ 1 723 712 782 -68
A.①② B.①③ C.②④ D.①②③
3.将氢氧化钠加热至熔融后进行电解,可得到金属钠、氧气和水,此过程中不存在( )
A.离子键破坏 B.共价键断裂 C.离子键形成 D.共价键形成
4.据美国《科学》杂志报道:在40 GPa高压下,用激光器加热到1 800 K可制得具有高熔点、高硬度的二氧化碳晶体。下列关于该晶体的说法正确的是( )
A.该晶体属于分子晶体
B.该晶体易升华,可用作制冷材料
C.该晶体的熔、沸点低于二氧化硅晶体
D.一定条件下,该晶体可跟氢氧化钠溶液反应
5.下列说法正确的是( )
A.铁元素位于元素周期表的ds区
B.石墨能导电,石墨沿层的平行方向的导电性强
C.中σ键和π键的数目比为6∶1
D.HNO3所含元素中第一电离能最大的是O
6.下列关于共价晶体、分子晶体的叙述中,正确的是( )
A.在SiO2晶体中,1个硅原子和2个氧原子形成2个共价键
B.分子晶体中一定存在共价键
C.HI的相对分子质量大于HF,但是HF的沸点高于HI
D.金刚石为共价键三维骨架结构,晶体中的最小环上有6个碳原子,且6个碳原子共面
7.W、X、Y、Z是原子序数依次增大的短周期元素,可“组合”成一种具有高效催化性能的超分子,其结构如图(注:实线代表共价键,其他Y原子之间的重复单元中的W、X未展开标注),W、X、Z分别位于不同周期,Z是同周期中金属性最强的元素。下列说法不正确的是( )
A.Y位于第二周期第ⅥA 族
B.XY2形成的晶体中一个XY2周围紧邻的XY2有12个
C.X单质存在能导电的混合型晶体
D.Y与Z可组成阴、阳离子数之比为1∶1的离子晶体
8.CaC2晶体的晶胞结构(如图所示)与NaCl晶体的相似,但CaC2晶体中由于哑铃形的存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是( )
A.CaC2晶体属于离子晶体
B.1个Ca2+周围距离最近且等距离的有6个
C.6.4 g CaC2晶体中含阴离子0.2 mol
D.与每个Ca2+距离相等且最近的Ca2+共有12个
9.下列有关图示,能直观形象地展示化学知识。关于下列图示的说法正确的是( )
A.①可表示石墨的空间结构 B.②可表示2s电子云轮廓图
C.③可表示C60晶体的晶胞 D.④可表示NaCl晶体的晶胞结构图
10.下列关于晶体的说法中,正确的是( )
A.共价键的强弱可决定分子晶体的熔、沸点
B.含有金属阳离子的晶体一定是离子晶体
C.晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性
D.CsCl和NaCl晶体中阴、阳离子的配位数都为6
11.有关晶体或晶胞的结构如图所示,下列说法正确的是( )
A.冰中的每个水分子均摊4个氢键
B.每个硅原子被4个最小环所共有
C.如图所示的金刚石晶胞中有6个碳原子
D.在CO2晶胞中,1个分子周围有12个紧邻分子
12.金刚石硬度大,熔点高,用途非常广泛。工业上利用反应CCl4+4Na C(金刚石)+4NaCl人工合成金刚石。已知:氯化钠晶胞结构如图1所示,相邻的Na+与Cl-的距离为a cm,设NA为阿伏加德罗常数的值,下列说法错误的是( )
NaCl晶胞
图1
金刚石
图2
A.金属钠中的自由电子为整块金属所共有
B.CCl4、NaCl、金刚石三种物质的熔点依次升高
C.若NaCl晶体密度为d g·cm-3,则NA=
D.12 g金刚石中含有C—C键的数目为4NA
13.如图是氯化铯晶体的晶胞示意图,已知晶胞中2个最近的Cs+核间距为a cm,氯化铯(CsCl)的摩尔质量为M g·mol-1,NA为阿伏加德罗常数的值,则氯化铯晶体的密度为( )
A. g·cm-3 B. g·cm-3 C. g·cm-3 D. g·cm-3
14.以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系CdSnAs2的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如表所示。下列说法不正确的是( )
分数坐标 原子 x y z
Cd 0 0 0
Sn 0 0 0.5
As 0.25 0.25 0.125
A.灰色大球代表As
B.一个晶胞中有4个Sn
C.CdSnAs2晶体中与单个Sn键合的As有2个
D.距离Cd(0,0,0)最近的Sn的分数坐标是(0.5,0,0.25)和(0.5,0.5,0)
15.F2和Xe在一定条件下可生成XeF2、XeF4和XeF6三种氟化氙,它们都是极强的氧化剂,都极易与水发生反应,其中:6XeF4+12H2O2XeO3+4Xe↑+24HF+3O2↑。下列推测正确的是( )
A.XeF2分子中各原子最外层均达到8电子结构
B.某种氟化氙的晶体结构单元如图,可推知其化学式为XeF6
C.XeF4按题中方程式与水反应时,每生成4 mol Xe,转移16 mol e-
D.XeF2加入水中,在水分子作用下将生成Xe和F2
二、非选择题(本题共5小题,共55分)
16.(12分)Al和Si在元素周期表金属和非金属分界线附近,其单质和化合物在建筑业、电子工业和石油化工等方面应用广泛。请回答下列问题:
(1)AlCl3是化工生产中常用的催化剂,熔点为192.6 ℃,熔融状态以二聚体Al2Cl6形式存在,其中铝原子与氯原子形成的化学键类型是 。
(2)纳米氮化铝(AlN)在绝缘材料中的应用广泛,AlN晶体与金刚石类似,每个Al原子与 个N原子相连,与同一个Al原子相连的N原子构成的空间结构为 。AlN属于 晶体。
(3)Si和C同主族,Si、C和O成键情况如下:
化学键 C—O CO Si—O
键能/kJ·mol-1 360 803 464 640
C和O之间可以通过双键形成CO2分子,而Si和O却不能像碳那样形成稳定分子的原因是 。
(4)下列数据是对应物质的熔点,有关的判断错误的是 。
Na2O Na AlF3 AlCl3
920 ℃ 97.8 ℃ 1 291 ℃ 190 ℃
Al2O3 BCl3 CO2 SiO2
2 073 ℃ -107 ℃ -57 ℃ 1 723 ℃
A.Na2O、AlF3是离子晶体;AlCl3、BCl3是分子晶体
B.同族元素的氧化物可形成不同类型的晶体
C.SiO2是共价晶体
D.在表中涉及的共价化合物分子中各原子都形成8电子稳定结构
17.(12分)超分子化学已逐渐扩展到化学的各个分支,还扩展到生命科学和物理学等领域。由Mo将2个C60分子、2个p-甲酸丁酯吡啶及2个CO分子利用配位键自组装的超分子结构如图所示。
(1)Mo处于元素周期表第五周期第ⅥB族,核外电子排布与Cr相似,它的基态原子外围电子排布式是 ;核外未成对电子数是 。
(2)该超分子中存在的化学键类型有 。
A.σ键 B.π键 C.离子键 D.氢键
(3)从电负性角度解释CF3COOH的酸性强于CH3COOH的原因:
。
(4)C60与金刚石互为同素异形体,从结构与性质之间的关系解释C60的熔点远低于金刚石的原因是 。
18.(10分)党的十八大以来,我国在科技创新和重大工程建设方面取得了丰硕成果,在新时代更需要新科技。2018年3月5日,《自然》连刊两文报道石墨烯超导重大发现,第一作者均为中国科大2010级少年班的曹原。曹原团队在双层石墨烯中发现新的电子态,可以简单实现绝缘体到超导体的转变。石墨烯是一种由碳原子组成六角形呈蜂巢晶格的二维碳纳米材料(如图甲),石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙)。
(1)图乙中1号C与相邻C有无形成π键 (填“有”或“无”)。
(2)图甲中1号C与相邻C形成的键之间的夹角 (填“>”“<”或“=”)120°。
(3)我国制墨工艺将50 nm左右的石墨烯或氧化石墨烯溶于水,在相同条件下所得到的分散系后者沸点更高,其原因是 。
(4)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
参数 分子 分子直径/nm 分子与H2O的结合 能E/kJ· mol-1
CH4 0.436 16.40
CO2 0.512 29.91
①“可燃冰”中分子间存在的2种作用力是 。
②有科学家提出用CO2置换CH4的设想。已知图中笼状结构的空腔直径为0.586 nm,结合表中内容从物质结构及性质的角度分析,该设想能否实现 (填“能”或“否”)。
19.(8分)2019年诺贝尔化学奖授予三位开发锂离子电池的科学家。TiS2、LiCoO2和LiMnO2等都是他们研究锂离子电池的载体。回答下列问题:
(1)基态Co原子的外围电子轨道表示式为 。
(2)已知第三电离能数据:I3(Mn)=3 246 kJ·mol-1,I3(Fe)=2 957 kJ·mol-1。锰的第三电离能大于铁的第三电离能,其主要原因是 。
(3)工业上,采用电解熔融氯化锂制备锂,钠还原TiCl4(g)制备钛。已知:LiCl、TiCl4的熔点分别为605 ℃、-24 ℃,它们的熔点相差很大,其主要原因是 。
20.(13分)氨硼烷是一种特殊的化合物,分子式为NH3BH3。氨硼烷在催化剂作用下水解释放氢气:3NH3BH3+6H2O3N+B3+9H2↑。B3的结构如图甲,回答下列问题:
图甲
图乙
(1)写出O原子的外围电子轨道表示式: 。
(2)写出NH3BH3分子的电子式: ;NH3BH3晶体中含有的微粒间作用力有 (填字母)。
a.非极性共价键 b.配位键 c.氢键 d.范德华力 e.金属键
(3)有机碱离子CH3N是NH3BH3的等电子体,该离子与Pb2+、I-组成的光电材料的晶胞如图乙所示。
该晶体中CH3N与I-间的作用力为 ,CH3N的配位数是 。若晶胞参数为a nm,该晶体密度为ρ g·cm-3,阿伏加德罗常数NA可表示为 mol-1(列出计算式)。
专题3 微粒间作用力与物质性质
1.B 2.A 3.C 4.D 5.B 6.C 7.D 8.A
9.D 10.C 11.D 12.D 13.C 14.C 15.C
1.B 石英光纤的主要成分是二氧化硅,A错误;冰中水分子有序排列,分子间更容易形成氢键,相同质量的水和冰中,冰中含有更多的氢键,B正确;冰光纤不是胶体,C错误;冰光纤是分子晶体,石英光纤是共价晶体,D错误。
2.A 氯化钙熔点高,属于离子晶体,①正确;四氯化硅熔点很低,属于分子晶体,②正确;二氧化硅为共价晶体,在SiO2晶体中无SiO2分子,③错误;氯化镁是离子晶体,其在熔融状态下能导电,④错误;A符合题意。
3.C 将氢氧化钠加热至熔融后进行电解,可得到金属钠、氧气和水,该反应的化学方程式为4NaOH 4Na+2H2O+O2↑,在这个过程中有离子键、共价键的破坏,同时在生成水、氧气的过程中有共价键的形成,金属钠中存在金属键,该过程不涉及离子键的形成,选C。
4.D 该二氧化碳晶体具有高熔点、高硬度,属于共价晶体,A错误;该二氧化碳晶体具有高熔点,说明该晶体不易升华,不能作制冷材料,B错误;共价晶体的熔、沸点取决于共价键的强弱,该二氧化碳晶体的熔、沸点高于二氧化硅,C错误;一定条件下该晶体能与氢氧化钠溶液反应,D正确。
5.B 铁元素位于元素周期表的d区,A错误;单键是σ键,一个双键中含一个σ键和一个π键,因此中σ键和π键的数目比为7∶1,C错误;一般第ⅡA族和第ⅤA族元素的第一电离能高于同一周期与之相邻的主族元素,故HNO3所含元素中第一电离能最大的是N,D错误。
6.C 在SiO2晶体中,1个硅原子和4个氧原子形成4个共价键,A错误;部分分子晶体(如稀有气体形成的晶体)中不含有共价键,B错误;金刚石为共价键三维骨架结构,晶体中的最小碳环上有6个碳原子,6个碳原子不共面,D错误。
7.D W、X、Y、Z是原子序数依次增大的短周期元素,W、X、Z分别位于不同周期,W只形成1个共价键,W为H元素,由超分子的结构可知,X能形成4个共价键,则X为C元素;Y能形成2个共价键,则Y为O元素;Z是同周期中金属性最强的元素,则Z为Na元素。Y为氧元素,位于第二周期第ⅥA族,A项正确;XY2形成的晶体干冰中一个二氧化碳分子周围紧邻的二氧化碳分子有12个,B项正确;由碳元素形成的单质中,石墨是能导电的混合型晶体,C项正确;Y与Z可形成氧化钠、过氧化钠,阴、阳离子数之比均为1∶2,D项错误。
8.A CaC2是由Ca2+和组成的离子化合物,A正确;CaC2晶胞不为正六面体形,1个Ca2+周围距离最近的有4个,而不是6个,B错误;CaC2是由Ca2+和组成的,6.4 g CaC2的物质的量为=0.1 mol,则6.4 g CaC2中含阴离子0.1 mol,C错误;CaC2晶胞不为正六面体形,与每个Ca2+距离相等且最近的Ca2+有4个,D错误。
9.D 石墨是层状结构,①可以表示金刚石的空间结构,A错误;s电子云是球形的,②不能表示2s电子云轮廓图,B错误;③表示C60分子的球棍模型,不为C60的晶胞,C错误;氯化钠是离子晶体,④可以表示NaCl晶体的晶胞结构图,D正确。
10.C 分子晶体熔化时破坏分子间作用力,不破坏共价键,分子间作用力决定分子晶体的熔、沸点,A错误;含有金属阳离子的晶体不一定是离子晶体,如金属晶体中含有金属阳离子,但不属于离子晶体,B错误;NaCl晶体中,阴、阳离子的配位数都为6,CsCl晶体中,阴、阳离子的配位数都为8,D错误。
11.D 根据图中信息冰中每个水分子与周围四个水分子形成分子间氢键,每个氢键都为两个水分子所共有,因而每个水分子均摊氢键数为4×=2,A错误;在SiO2晶体结构中每个Si原子被12个最小环所共有,B错误;如图所示的金刚石晶胞中碳原子有8个在顶点,6个在面心,4个在体内,因此含有8×+6×+4=8个碳原子,C错误。
12.D 金属晶体中的自由电子为整块金属共有,A正确;四氯化碳是分子晶体、氯化钠是离子晶体、金刚石是共价晶体,这三种物质的熔点依次升高,B正确;晶胞中位于顶点和面心的氯离子个数为8×+6×=4,位于棱上和体心的钠离子数为12×+1=4,则=(2a)3d,解得NA=,故C正确;金刚石中每个碳原子形成4个碳碳键,每个碳碳键为2个碳原子所共有,所以每个碳原子形成的碳碳键数目为4×=2,则12 g金刚石中含有碳碳键的数目为×2×NAmol-1=2NA,D错误。
13.C ρ== g·cm-3= g·cm-3。
14.C 由晶胞结构图可知,CdSnAs2晶体中与单个Sn键合的As有4个,C项错误。
15.C Xe原子本身最外层就是8电子结构,再与F原子结合,肯定就不再是8电子结构了,A错误;一个该晶体结构单元中Xe原子个数为8×+1=2,F原子个数为8×+2=4,故Xe与F的原子个数比为1∶2,其化学式为XeF2,B错误;由题中化学方程式可知,每生成4 mol Xe转移电子总物质的量为16 mol,C正确;F2与水会剧烈反应,所以在溶液中不可能生成F2,D错误。
16.答案 (每空2分)(1)共价键(或σ键) (2)4 正四面体 共价 (3)键的键能大于2倍的C—O键的键能,键的键能小于2倍的键的键能,所以Si和O不能以双键结合形成稳定分子 (4)D
解析 (1)AlCl3熔点为192.6 ℃,熔融状态以二聚体Al2Cl6形式存在,可以推出其分子为共价化合物,因此原子间形成的化学键为共价键。(2)AlN晶体与金刚石类似,可以知道AlN为共价晶体,因此每个Al原子周围有4个N原子,且与同1个Al原子相连的4个N原子构成正四面体结构。(4)Na2O、AlF3的熔点较高,是活泼的金属元素与活泼的非金属元素形成的离子晶体;AlCl3、BCl3的熔点较低,且两种物质的组成元素的电负性相差都小于1.7,所以AlCl3、BCl3是分子晶体,A项正确。C、Si都是第ⅣA族的元素,它们形成的氧化物中,CO2是分子晶体,而SiO2是共价晶体,B项正确,C项正确。BCl3分子中B原子最外层只有6个电子,没有形成8电子稳定结构,D项错误。
17.答案 (除注明外,每空2分)(1)4d55s1 6 (2)AB (3)F的电负性强于H,对电子的吸引能力强,共用电子对偏向F,使羧基中氧氢键较易断裂(3分) (4)C60是分子晶体,金刚石是共价晶体,共价晶体熔化时破坏共价键所需的能量远高于分子晶体熔化时克服分子间作用力所需的能量(3分)
解析 (1)Cr的基态原子外围电子排布式为3d54s1,而Mo与Cr同族,但在Cr的下一周期,Mo的基态原子外围电子排布式为4d55s1,其核外未成对电子数为6。(2)观察题图可知,该超分子中含有双键,说明有σ键和π键,分子中不存在离子键,根据题给信息知Mo形成配位键,因而答案为AB。
18.答案 (每空2分)(1)无 (2)= (3)氧化石墨烯可与水形成分子间氢键 (4)①氢键、范德华力 ②能
解析 (1)图乙中,1号碳原子形成4个共价单键,与相邻C没有形成π键。(2)图甲中1号C与相邻C形成的键之间的夹角为120°。(3)氧化石墨烯可与水分子形成氢键,而石墨烯不能。(4)①“可燃冰”中分子间存在范德华力和氢键。②由表中数据可知:二氧化碳的分子直径小于笼状结构的空腔直径,能顺利进入笼状空腔内,且二氧化碳分子与水分子的结合能大于甲烷分子与H2O分子的结合能。
19.答案 (1)(2分) (2)Mn2+的外围电子排布式为3d5,达半满稳定状态,不易再失去电子形成Mn3+,Fe2+的外围电子排布式为3d6,易再失去1个电子3d轨道达半满稳定状态(3分) (3)氯化锂属于离子晶体,氯化钛属于分子晶体,离子晶体里的离子键要比分子晶体里的分子间作用力强(3分)
解析 (1)Co原子的外围电子轨道表示式为
。(3)采用电解熔融氯化锂制备锂,可知LiCl为离子晶体,TiCl4的熔点为-24 ℃,说明TiCl4为分子晶体
20.答案 (除注明外,每空2分)(1)
(2) bcd (3)离子键 12 ×1021(3分)
解析 (1) O原子的外围电子排布式为2s22p4,其外围电子轨道表示式为
。(2)NH3BH3属于分子晶体,分子间存在范德华力,NH3BH3分子中N和H原子间、B和H原子间都形成的是极性共价键,N和B原子间形成的是配位键,其分子间还可以形成氢键。(3)该晶体中CH3N与I-之间的作用力为离子键;由题图可知CH3N在立方体的顶点,其配位数为12。1个晶胞中含有I-的个数为6×=3,CH3N的个数为8×=1,Pb2+的个数为1,化学式为PbCH3NH3I3,其摩尔质量为620 g·mol-1,一个晶胞的体积为(a×10-7)3 cm3,则晶体密度ρ g·cm-3=×1021,所以阿伏加德罗常数NA=×1021mol-1。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
