化学人教版(2019)选择性必修1 3.1难溶电解质的沉淀溶解平衡与溶度积(共25张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.1难溶电解质的沉淀溶解平衡与溶度积(共25张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 9.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-11-23 08:14:12 | ||
图片预览






文档简介
(共25张PPT)
第三章 第四节 沉淀溶解平衡
第1课时 难溶电解质的沉淀溶解平衡
学习重难点
理解难溶电解质的沉淀溶解平衡常数——溶度积Ksp,学会通过比较Q与Ksp,的大小判断难溶电解质的沉淀与溶解情况。
根据化学平衡理论,分析影响沉淀溶解平衡的因素。
理解溶度积Ksp及溶度积规则,并能进行Ksp简单的计算。
学习目标
能描述沉淀溶解平衡,知道溶解平衡的特征。
学习目标
阅读教材
1:如何建立难溶电解质的沉淀溶解平衡?
2:可以根据什么来判断难溶电解质的沉淀或溶解情况?
3:影响难溶电解质沉淀溶解平衡的因素有哪些?
情境引入
情境引入
1. 肾结石的主要成分是什么?
2. 肾结石是如何出现在人的身体里的?
3. 肾结石病有什么防治方法?
问题一: 结石的成分是什么?
CaC2O4 80% 难溶于水
Ca3(PO4)2 9% 难溶于水
HUr (尿酸) 5% 微溶于水
10
易溶
可溶
1
微溶
0.01
难溶
S /g
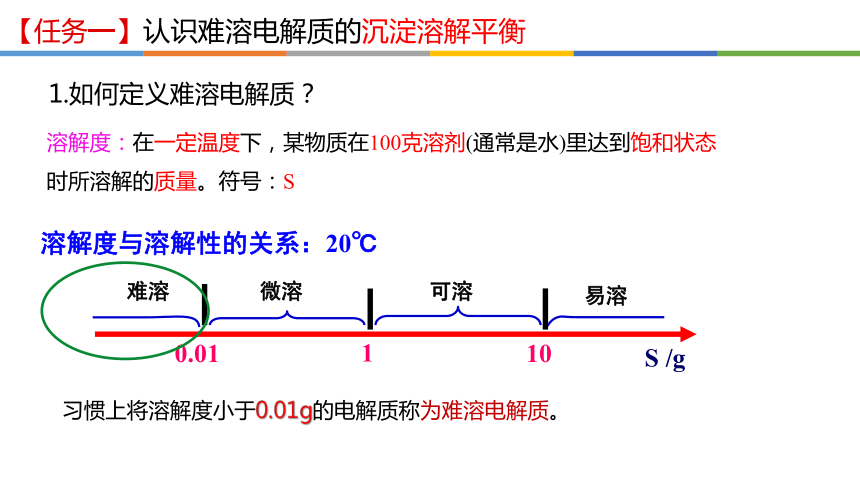
溶解度与溶解性的关系:20℃
溶解度:在一定温度下,某物质在100克溶剂(通常是水)里达到饱和状态 时所溶解的质量。符号:S
习惯上将溶解度小于0.01g的电解质称为难溶电解质。
1.如何定义难溶电解质?
【任务一】认识难溶电解质的沉淀溶解平衡
难溶 绝对不溶
【任务一】认识难溶电解质的沉淀溶解平衡
2. 通常我们所说的难溶物在水中是否完全不能溶解?
几种电解质的溶解度(20 ℃)
化学式 AgCl AgNO3 AgBr Ag2SO4 Ag2S BaCl2
溶解度/g 1.5×10-4 211 8.4×10-6 0.796 1.3×10-16 35.7
化学式 Ba(OH)2 BaSO4 Ca(OH)2 CaSO4 Mg(OH)2 Fe(OH)3
溶解度/g 3.89 3.1×10-4 0.160 0.202 6.9×10-4 3×10-9
难溶物的溶解性探究
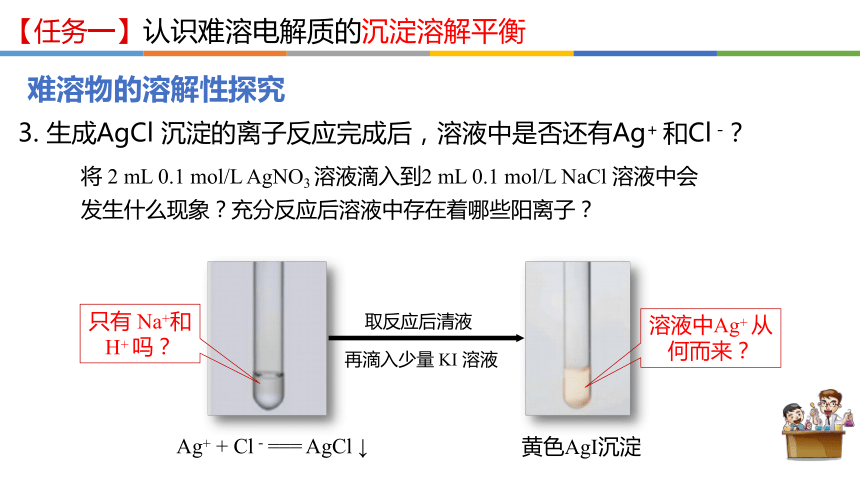
3. 生成AgCl 沉淀的离子反应完成后,溶液中是否还有Ag+ 和Cl -?
【任务一】认识难溶电解质的沉淀溶解平衡
将 2 mL 0.1 mol/L AgNO3 溶液滴入到2 mL 0.1 mol/L NaCl 溶液中会发生什么现象?充分反应后溶液中存在着哪些阳离子?
Ag+ + Cl-=== AgCl ↓
只有 Na+和 H+ 吗?
溶液中Ag+ 从何而来?
再滴入少量 KI 溶液
取反应后清液
黄色AgI沉淀
沉淀溶解平衡的建立
【任务一】认识难溶电解质的沉淀溶解平衡
溶解过程:在水分子作用下,少量Ag+和 Cl-脱离AgCl的表面进入水中。
沉淀过程:溶液中的Ag+和 Cl-受AgCl表面阴、阳离子的吸引,回到AgCl的表面析出。
υ(沉淀) = υ(溶解)
沉淀不再增多
达到沉淀溶解平衡
充分反应
AgCl饱和溶液
【任务一】认识难溶电解质的沉淀溶解平衡
v(溶解)=v(沉淀)
v
v(溶解)
v(沉淀)
t
沉淀溶解平衡方程式:AgCl(s) Ag+ (aq) + Cl-(aq)
沉淀
溶解
沉淀溶解平衡的建立(v-t图像)
1. 概念:在一定温度下,当难溶电解质溶解和沉淀的速率相等时,形成电解质的饱和溶液,达到平衡状态,溶液中各离子的浓度保持不变,这种平衡称为沉淀溶解平衡。
2. 特征:逆、等、动、定、变
3. 沉淀溶解平衡表达式
AgCl(s) Ag+(aq) + Cl-(aq)
溶解
沉淀
一、难溶电解质的沉淀溶解平衡
书写时注意表明各物质的状态“s/aq”并用“ ”连接
【注意】
【任务一】认识难溶电解质的沉淀溶解平衡
4.沉淀完全的判断
化学上通常认为,当溶液中剩余离子的浓度小于1×10-5 mol·L-1时,已沉淀完全。
Ca2+与C2O42-的浓度要具体达到多少,才会在人体内形成沉淀
我们需要获得什么样的数据才能进行计算
问题二:结石是如何出现在人的身体里面的
平衡中的定量计算依据—平衡常数 ( Ka Kb Kw Kh )
难溶电解质的沉淀溶解平衡常数—K
二、溶度积常数—Ksp
Ksp = c(Ag+)·c(Cl-)
Ksp = c2(Ag+)·c(S2- )
AgCl(s) Ag+(aq) + Cl-(aq)
Ag2S(s) 2Ag+(aq) + S2-(aq)
【思考】根据你学过的化学平衡常数,观察氯化银,硫化银Ksp的表达式总结溶度积的概念。
【任务二】定量描述难溶电解质溶解程度
固体纯物质不列入平衡常数
Ksp =[c(Mn+)]m · [c(Am-)]n
2、表达式:
对于反应 MmAn(s) mMn+(aq)+nAm-(aq)
3、影响因素:
溶度积Ksp只与难溶电解质的性质和温度有关。
【任务二】定量描述难溶电解质溶解程度
1、定义:一定温度下,难溶电解质达到沉淀溶解平衡时,溶液中各离子浓度幂之积为常数,叫做溶度积常数(简称溶度积)。
(1)对于同类型(阴、阳离子个数比相同)的难溶电解质来说,Ksp越小,其溶解度越小。
溶度积:Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI)
溶解度:S(AgCl)>S(AgBr)>S(AgI)
(2)不同类型的难溶电解质不能直接通过Ksp的大小判断溶解度大小,要通过Ksp计算出离子浓度来比较。
【任务二】定量描述难溶电解质溶解程度
难溶物 Ksp(25 oC) 溶解度 难溶物 Ksp(25 oC) 溶解度
AgCl 1.8×10-10 1.5×10-4 BaSO4 1.1×10-10 2.4×10-4
AgBr 5.4×10-13 8.4×10-6 Mg(OH)2 5.6×10-12 6.9×10-4
AgI 8.5×10-17 2.1×10-7 Fe(OH)3 2.6×10-39 3.0×10-9
4、Ksp的意义:
溶液过饱和,有沉淀析出,直到溶液饱和达到平衡。
Qc >Ksp
溶液饱和,沉淀与溶解处于平衡状态
Qc = Ksp
溶液不饱和,无沉淀析出,还可继续溶解直到平衡。
Qc<Ksp
②溶度积规则
Qc称为离子积,表达式中c是任意时刻的浓度,是溶液中的瞬间实际浓度
Qc= c(Am+)n · c(Bn-)m
AnBm(s) nAm+(aq) + mBn-(aq)
①离子积
5、应用
任意时刻浓度
【任务二】定量描述难溶电解质溶解程度
(1)已知Ksp(CaC2O4) =4.0×10-9,尿钙含量 2.50 mmol/L,人体中浓度达到多少就会产生结石?
c(Ca2+) = 2.50 mmol/L = 2.50×10-3 mol/L
Ksp(CaC2O4) = c(Ca2+).c() = 4.0×10-9
c() = 1.60×10-6 mol/L
(2)若使Ca2+完全沉淀,那么此时的浓度是多少
当Ca2+完全沉淀时,c(Ca2+) < 1×10-5 mol/L
Ksp(CaC2O4) = c(Ca2+).c() = 4.0×10-9
c() > 4.0×10-4 mol/L
【任务二】定量描述难溶电解质溶解程度
学以致用
学以致用:在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示
①溶度积曲线上的点表示该条件下,达到溶解与沉淀平衡状态;
②在曲线下方的点表示该点下未达到平衡;在曲线上方的点表示过饱和状态,此时有沉淀析出。
【任务二】定量描述难溶电解质溶解程度
问题三:肾结石病有什么防治方法?
HUr (s) H+(aq) + Ur -(aq)
平衡移动的角度分析
CaC2O4 (s) Ca2+(aq) + C2O42-(aq)
三、沉淀溶解平衡的影响因素
1、内因:电解质本身的性质
在电解质的溶液中,不管是易溶(如NaCl)的,微溶的,难溶的电解质都存在着溶解平衡。只要是饱和溶液都存在溶解平衡。
【任务三】影响难溶电解质沉淀溶解平衡的因素
思考:预测影响难溶物的溶解平衡的外因有哪些?
条件改变 移动方向 C(Mg2+) C(OH-)
升温 加水(有固体剩余) 加Mg(OH)2(s) 加MgCl2(s) 加NaOH(s) 加盐酸 正向 增大 增大
正向 不 变 不变
不移动 不变 不变
逆向 增大 减小
逆向 减小 增大
正向 增大 减小
已知沉淀溶解平衡:Mg(OH)2(s)??Mg2+(aq)+2OH-(aq),请分析当改变下列条件时,对该沉淀溶解平衡的影响,填写下表
——化学平衡移动的规律符合勒夏特列原理
【任务三】影响难溶电解质沉淀溶解平衡的因素
2、外因
Mg(OH)2 (s) Mg2+ (aq) + 2OH-(aq)
【任务三】影响难溶电解质沉淀溶解平衡的因素
①温度:一般来说,温度越高,固体物质的溶解度越大;
极少数固体物质的溶解度随温度的升高而减小,如Ca(OH)2。
③外加其他物质(与电解质电离的离子反应),平衡向沉淀溶解的方向移动,溶解度增大。
②同离子效应:加入与电解质电离的离子相同的可溶性盐,平衡向生成沉淀的方向移动,溶解度减小。
——符合“勒夏特列原理”
课堂检测
1、氯化银在水中存在溶解平衡:AgCl(s) Ag+(aq) + Cl-(aq)。在相同温度下,将足量氯化银分别放人相同体积的下列溶液中,Ag+的浓度最小的是( )
A. 0.1 mol/L盐酸 B. 蒸馏水
C. 0.1 mol/L AlCl3溶液 D. 0.1 mol/LMgCl2 溶液
C
2、在一定温度下,Mg(OH)2固体在水溶液中达到沉淀溶解平衡Mg(OH)2(s) Mg2+(aq) +2OH-(aq) ,要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是( )
A. 加MgSO4固体 B. 加盐酸
C. 加NaOH固体 D. 加水
D
沉淀溶解平衡
知识地图
眼中有微粒,心中有平衡
第三章 第四节 沉淀溶解平衡
第1课时 难溶电解质的沉淀溶解平衡
学习重难点
理解难溶电解质的沉淀溶解平衡常数——溶度积Ksp,学会通过比较Q与Ksp,的大小判断难溶电解质的沉淀与溶解情况。
根据化学平衡理论,分析影响沉淀溶解平衡的因素。
理解溶度积Ksp及溶度积规则,并能进行Ksp简单的计算。
学习目标
能描述沉淀溶解平衡,知道溶解平衡的特征。
学习目标
阅读教材
1:如何建立难溶电解质的沉淀溶解平衡?
2:可以根据什么来判断难溶电解质的沉淀或溶解情况?
3:影响难溶电解质沉淀溶解平衡的因素有哪些?
情境引入
情境引入
1. 肾结石的主要成分是什么?
2. 肾结石是如何出现在人的身体里的?
3. 肾结石病有什么防治方法?
问题一: 结石的成分是什么?
CaC2O4 80% 难溶于水
Ca3(PO4)2 9% 难溶于水
HUr (尿酸) 5% 微溶于水
10
易溶
可溶
1
微溶
0.01
难溶
S /g
溶解度与溶解性的关系:20℃
溶解度:在一定温度下,某物质在100克溶剂(通常是水)里达到饱和状态 时所溶解的质量。符号:S
习惯上将溶解度小于0.01g的电解质称为难溶电解质。
1.如何定义难溶电解质?
【任务一】认识难溶电解质的沉淀溶解平衡
难溶 绝对不溶
【任务一】认识难溶电解质的沉淀溶解平衡
2. 通常我们所说的难溶物在水中是否完全不能溶解?
几种电解质的溶解度(20 ℃)
化学式 AgCl AgNO3 AgBr Ag2SO4 Ag2S BaCl2
溶解度/g 1.5×10-4 211 8.4×10-6 0.796 1.3×10-16 35.7
化学式 Ba(OH)2 BaSO4 Ca(OH)2 CaSO4 Mg(OH)2 Fe(OH)3
溶解度/g 3.89 3.1×10-4 0.160 0.202 6.9×10-4 3×10-9
难溶物的溶解性探究
3. 生成AgCl 沉淀的离子反应完成后,溶液中是否还有Ag+ 和Cl -?
【任务一】认识难溶电解质的沉淀溶解平衡
将 2 mL 0.1 mol/L AgNO3 溶液滴入到2 mL 0.1 mol/L NaCl 溶液中会发生什么现象?充分反应后溶液中存在着哪些阳离子?
Ag+ + Cl-=== AgCl ↓
只有 Na+和 H+ 吗?
溶液中Ag+ 从何而来?
再滴入少量 KI 溶液
取反应后清液
黄色AgI沉淀
沉淀溶解平衡的建立
【任务一】认识难溶电解质的沉淀溶解平衡
溶解过程:在水分子作用下,少量Ag+和 Cl-脱离AgCl的表面进入水中。
沉淀过程:溶液中的Ag+和 Cl-受AgCl表面阴、阳离子的吸引,回到AgCl的表面析出。
υ(沉淀) = υ(溶解)
沉淀不再增多
达到沉淀溶解平衡
充分反应
AgCl饱和溶液
【任务一】认识难溶电解质的沉淀溶解平衡
v(溶解)=v(沉淀)
v
v(溶解)
v(沉淀)
t
沉淀溶解平衡方程式:AgCl(s) Ag+ (aq) + Cl-(aq)
沉淀
溶解
沉淀溶解平衡的建立(v-t图像)
1. 概念:在一定温度下,当难溶电解质溶解和沉淀的速率相等时,形成电解质的饱和溶液,达到平衡状态,溶液中各离子的浓度保持不变,这种平衡称为沉淀溶解平衡。
2. 特征:逆、等、动、定、变
3. 沉淀溶解平衡表达式
AgCl(s) Ag+(aq) + Cl-(aq)
溶解
沉淀
一、难溶电解质的沉淀溶解平衡
书写时注意表明各物质的状态“s/aq”并用“ ”连接
【注意】
【任务一】认识难溶电解质的沉淀溶解平衡
4.沉淀完全的判断
化学上通常认为,当溶液中剩余离子的浓度小于1×10-5 mol·L-1时,已沉淀完全。
Ca2+与C2O42-的浓度要具体达到多少,才会在人体内形成沉淀
我们需要获得什么样的数据才能进行计算
问题二:结石是如何出现在人的身体里面的
平衡中的定量计算依据—平衡常数 ( Ka Kb Kw Kh )
难溶电解质的沉淀溶解平衡常数—K
二、溶度积常数—Ksp
Ksp = c(Ag+)·c(Cl-)
Ksp = c2(Ag+)·c(S2- )
AgCl(s) Ag+(aq) + Cl-(aq)
Ag2S(s) 2Ag+(aq) + S2-(aq)
【思考】根据你学过的化学平衡常数,观察氯化银,硫化银Ksp的表达式总结溶度积的概念。
【任务二】定量描述难溶电解质溶解程度
固体纯物质不列入平衡常数
Ksp =[c(Mn+)]m · [c(Am-)]n
2、表达式:
对于反应 MmAn(s) mMn+(aq)+nAm-(aq)
3、影响因素:
溶度积Ksp只与难溶电解质的性质和温度有关。
【任务二】定量描述难溶电解质溶解程度
1、定义:一定温度下,难溶电解质达到沉淀溶解平衡时,溶液中各离子浓度幂之积为常数,叫做溶度积常数(简称溶度积)。
(1)对于同类型(阴、阳离子个数比相同)的难溶电解质来说,Ksp越小,其溶解度越小。
溶度积:Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI)
溶解度:S(AgCl)>S(AgBr)>S(AgI)
(2)不同类型的难溶电解质不能直接通过Ksp的大小判断溶解度大小,要通过Ksp计算出离子浓度来比较。
【任务二】定量描述难溶电解质溶解程度
难溶物 Ksp(25 oC) 溶解度 难溶物 Ksp(25 oC) 溶解度
AgCl 1.8×10-10 1.5×10-4 BaSO4 1.1×10-10 2.4×10-4
AgBr 5.4×10-13 8.4×10-6 Mg(OH)2 5.6×10-12 6.9×10-4
AgI 8.5×10-17 2.1×10-7 Fe(OH)3 2.6×10-39 3.0×10-9
4、Ksp的意义:
溶液过饱和,有沉淀析出,直到溶液饱和达到平衡。
Qc >Ksp
溶液饱和,沉淀与溶解处于平衡状态
Qc = Ksp
溶液不饱和,无沉淀析出,还可继续溶解直到平衡。
Qc<Ksp
②溶度积规则
Qc称为离子积,表达式中c是任意时刻的浓度,是溶液中的瞬间实际浓度
Qc= c(Am+)n · c(Bn-)m
AnBm(s) nAm+(aq) + mBn-(aq)
①离子积
5、应用
任意时刻浓度
【任务二】定量描述难溶电解质溶解程度
(1)已知Ksp(CaC2O4) =4.0×10-9,尿钙含量 2.50 mmol/L,人体中浓度达到多少就会产生结石?
c(Ca2+) = 2.50 mmol/L = 2.50×10-3 mol/L
Ksp(CaC2O4) = c(Ca2+).c() = 4.0×10-9
c() = 1.60×10-6 mol/L
(2)若使Ca2+完全沉淀,那么此时的浓度是多少
当Ca2+完全沉淀时,c(Ca2+) < 1×10-5 mol/L
Ksp(CaC2O4) = c(Ca2+).c() = 4.0×10-9
c() > 4.0×10-4 mol/L
【任务二】定量描述难溶电解质溶解程度
学以致用
学以致用:在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示
①溶度积曲线上的点表示该条件下,达到溶解与沉淀平衡状态;
②在曲线下方的点表示该点下未达到平衡;在曲线上方的点表示过饱和状态,此时有沉淀析出。
【任务二】定量描述难溶电解质溶解程度
问题三:肾结石病有什么防治方法?
HUr (s) H+(aq) + Ur -(aq)
平衡移动的角度分析
CaC2O4 (s) Ca2+(aq) + C2O42-(aq)
三、沉淀溶解平衡的影响因素
1、内因:电解质本身的性质
在电解质的溶液中,不管是易溶(如NaCl)的,微溶的,难溶的电解质都存在着溶解平衡。只要是饱和溶液都存在溶解平衡。
【任务三】影响难溶电解质沉淀溶解平衡的因素
思考:预测影响难溶物的溶解平衡的外因有哪些?
条件改变 移动方向 C(Mg2+) C(OH-)
升温 加水(有固体剩余) 加Mg(OH)2(s) 加MgCl2(s) 加NaOH(s) 加盐酸 正向 增大 增大
正向 不 变 不变
不移动 不变 不变
逆向 增大 减小
逆向 减小 增大
正向 增大 减小
已知沉淀溶解平衡:Mg(OH)2(s)??Mg2+(aq)+2OH-(aq),请分析当改变下列条件时,对该沉淀溶解平衡的影响,填写下表
——化学平衡移动的规律符合勒夏特列原理
【任务三】影响难溶电解质沉淀溶解平衡的因素
2、外因
Mg(OH)2 (s) Mg2+ (aq) + 2OH-(aq)
【任务三】影响难溶电解质沉淀溶解平衡的因素
①温度:一般来说,温度越高,固体物质的溶解度越大;
极少数固体物质的溶解度随温度的升高而减小,如Ca(OH)2。
③外加其他物质(与电解质电离的离子反应),平衡向沉淀溶解的方向移动,溶解度增大。
②同离子效应:加入与电解质电离的离子相同的可溶性盐,平衡向生成沉淀的方向移动,溶解度减小。
——符合“勒夏特列原理”
课堂检测
1、氯化银在水中存在溶解平衡:AgCl(s) Ag+(aq) + Cl-(aq)。在相同温度下,将足量氯化银分别放人相同体积的下列溶液中,Ag+的浓度最小的是( )
A. 0.1 mol/L盐酸 B. 蒸馏水
C. 0.1 mol/L AlCl3溶液 D. 0.1 mol/LMgCl2 溶液
C
2、在一定温度下,Mg(OH)2固体在水溶液中达到沉淀溶解平衡Mg(OH)2(s) Mg2+(aq) +2OH-(aq) ,要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是( )
A. 加MgSO4固体 B. 加盐酸
C. 加NaOH固体 D. 加水
D
沉淀溶解平衡
知识地图
眼中有微粒,心中有平衡
